Summary
Het protocol beschrijft intubating volwassen zebrafish met een biologische; dan ontleden en cytometry, confocal microscopie en qPCR in de darm voorbereiden. Met deze methode kunt beheer van biologische actieve stoffen ten aanzien van intestinale opname en de lokale immuun stimulus opgeroepen. Het is relevant voor het testen van de intestinale dynamiek van mondelinge mondhygiëne.
Abstract
De meeste ziekteverwekkers binnenvallen organismen via hun mucosa. Dit geldt met name in vis zoals ze worden voortdurend blootgesteld aan een omgeving van het microbiële-rijke water. De ontwikkeling van doelmatige methoden voor de mondelinge aflevering van immunostimulants en vaccins, die het immuunsysteem tegen besmettelijke ziekten activeren, is zeer wenselijk. Bij het uitwerken van profylactische tools, zijn goede experimentele modellen nodig voor het testen van hun prestaties. Hier, laten we een methode voor mondelinge intubatie van volwassen zebravis en een reeks procedures om te ontleden en de darm voorbereiden van cytometry, confocal microscopie en kwantitatieve polymerase kettingreactie (qPCR) analyse. Met dit protocol, kunnen we precies beheren volumes tot 50 µL vissen weegt ongeveer 1 g eenvoudig en snel, zonder nadelige gevolgen voor de dieren. Deze methode kan wij de directe in-vivo -opname van fluorescently geëtiketteerde verbindingen met de intestinale mucosa en de immunomodulerende capaciteit van dergelijke biologics in de lokale site na intubatie kunt verkennen. Door het combineren van downstream methoden zoals stroom cytometry, histologie, qPCR en confocale microscopie van de intestinale weefsel, kunnen we begrijpen hoe immunostimulants of vaccins steken de intestinale mucosa barrières kunnen, passeren de lamina propria, en het bereiken van de spier, een effect op de intestinale mucosale immuunsysteem uit te oefenen. Het model kan worden gebruikt om de kandidaat-mondelinge mondhygiëne en levering systemen of het plaatselijke effect van een oraal toegediende bioactieve verbinding testen.
Introduction
Het doel van dit artikel is om te beschrijven in detail een eenvoudige methode voor mondelinge intubatie van zebrafish, samen met nuttige bijbehorende downstream procedures. Mondelinge intubatie met behulp van de zebravis is uitgegroeid tot een praktisch model in de studie van infectieziekten dynamiek, orale vaccin/immunostimulant drug/nanoparticle opname en werkzaamheid en intestinale mucosale immuniteit. Bijvoorbeeld, is zebravis mondelinge intubatie gebruikt in de studie van Mycobacterium marinum en Mycobacterium peregrinum infectie1. Lovmo et al. ook met succes gebruikt dit model nanodeeltjes en M. marinum te leveren aan het maag-darmkanaal van volwassen zebrafish2. Bovendien, Chen et al. zebrafish mondelinge intubatie gebruikt om te tonen dat drugs ingekapseld door nanodeeltjes, wanneer door de overheid gereguleerde via het maag-darmkanaal, werden vervoerd over de bloed hersenen barrière3. Deze auteurs uitgevoerd volgens de methode van de gauvage beschreven door Collymore et al. intubatie 4 met enkele wijzigingen. Echter, deed ze niet het leveren van een zeer gedetailleerd protocol met een beschrijving van de procedure mondeling intubatie. Hier presenteren we een methode voor mondelinge intubatie van volwassen zebrafish Collymore et al. kapitaliseren 4 verder ook de voorbereiding van de darm voor relevante stroomafwaartse analyse door cytometry, confocal microscopie en qPCR.
De darm en met name de mucosa is de eerste lijn van verdediging tegen infectie en de primaire site voor opname van voedingsstoffen5. Wanneer de epitheliale cellen en cellen antigeen-presenteren binnen de mucosal belemmeringen gevaar signalen waarnemen, wordt een onmiddellijke ingeboren immune reactie geactiveerd. De zeer specifieke adaptieve immuunrespons wordt vervolgens vastgesteld door T en B lymfocyten6,7. Ontwikkeling van mondelinge vaccins is een huidige aandachtspunt in vaccintechnologie. Dergelijke vaccins zou een effectief instrument ter bescherming van het organisme op blootgestelde plaatsen als gevolg van de specifieke reactie van immuuncellen in de mucosa-geassocieerde lymfoïde weefsels (mout)8,9. In de aquacultuur hebben mucosal vaccins duidelijke voordelen ten opzichte van injecteerbare vaccins. Ze zijn praktisch voor massale vaccinatie, minder arbeidsintensief, zijn minder belastend voor de vis, en aan jonge vis kunnen worden toegediend. Toch moeten de mucosal vaccin kandidaten het tweede segment van de darm zonder wordt gedenatureerd in de mondelinge omgeving bereiken. Zij moeten ook Kruis mucosal belemmeringen om toegang aan antigeen presentatie van cellen (APCs) voor het opwekken van de lokale en/of systemische reacties10te krijgen. Vandaar, testen van de mucosal opname bereikt door kandidaat-mondelinge antigenen en hun levering systemen, evenals de immune reactie opgeroepen, is essentieel bij de ontwikkeling van mondelinge vaccins.
In een biomedisch kader, ontwikkeling van een model om te testen van de biologische effecten van verbindingen na orale intubatie van groeiende belangstelling is. Veel van de anatomische en fysiologische functies van de darm worden bewaard tussen bilaterian geslachten, met zoogdieren en beenvissen11. Dit model van de mondelinge intubatie verbonden met stroomafwaartse analyse kan een hulpmiddel om inzicht in de menselijke biologie, evenals een proefterrein voor biologics of andere verbindingen in vivo.
Het mondelinge intubatie protocol kan worden uitgevoerd door een exploitant, bijvoorbeeldsuccesvol beheer van maximaal 50 µL van het eiwit nanoparticle schorsing wegende 1 g, met een hoog overlevingspercentage te vissen. De procedure is eenvoudig op te zetten en snel; 30 vis kan worden intubated in 1 h. Het protocol voor de voorbereiding van de darm is de sleutel tot het verstrekken van kwaliteit cel- en weefseltransplantaties monsters voor latere analyse. Voorbeelden van downstream resultaten worden gegeven waaruit blijkt dat het protocol van nut bij het verkrijgen van gegevens met betrekking tot intestinale opname en in het isoleren van kwaliteit RNA voor qPCR. Het protocol zou van groot nut zijn voor degenen die een geschikt model voor het testen van de dynamiek van mondelinge mondhygiëne of andere verbindingen in de darm.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle experimentele procedures met zebravissen (Danio rerio) werden goedgekeurd door de ethische commissie van de Universitat Autònoma de Barcelona (CEEH nummer 1582) in overleg met de internationale leidende beginselen voor onderzoek waarbij dieren ( EU 2010/63). Alle experimenten met live zebravissen werden uitgevoerd bij 26-28 ° C.
1. voorbereiding van de apparatuur van mondelinge intubatie
- Plaats ongeveer 1 cm van een fijne siliconen slang op een 31 G Luer lock naald ter dekking van de naald-tip.
- Knip een 10 µL steriel filter pipet uiteinde (ongeveer 2 cm), het fijnere einde nemen en plaats deze over de Siliconen slang als een omhulsel. Zorg ervoor dat de pipet verder reikt dan het puntje van de naald te voorkomen verwonden het dier.
- Bevestig de naald aan een 100 µL Luer lock spuit.
Opmerking: Spoel altijd na met ethanol en vervolgens fosfaatgebufferde zoutoplossing (PBS, Zie materialen) grondig tussen behandelingen.
2. vereiste oplossingen
- Voorbereiden van 150 mg/L (voor narcose) of 300 mg/L (voor euthanasie) ethyl 3-aminobenzoaat methanesulfonate (MS-222) oplossing met water uit het aquarium waar de zebravis worden gehandhaafd. Een kleine tank vullen met 1 liter verdoving oplossing en bewaar deze belucht.
- Een andere kleine tank vullen met 1 liter aquariumwater zonder MS-222 voor herstel van de vis en houd het belucht.
- Breng 50 mL 1 x PBS van een 10 x steriele stamoplossing.
- Voor cytometry analyse/intestinale cel isolatie, voorbereiden genoeg verse 0,15% collagenase Type IV oplossing 1 mL per vis uit een stamoplossing of poeder in de Dulbecco gemodificeerde eagle medium (DMEM) met 1% (v/v): penicilline en streptomycine (Zie materiaal). Maak aliquots (1 per vis) van 1 mL in 2 mL centrifuge buizen. Bewaren bij 4 ° C tot 30 minuten vóór de dissectie stap.
- Voor de fixatie van de confocal microscopie/monster, voorbereiden van 50 mL vers 4% paraformaldehyde (PFA) oplossing in PBS of ontdooien van een stamoplossing van-20 ° C vriezer in een zuurkast.
Let op: PFA is giftig. Lees het veiligheidsinformatieblad voordat u gaat werken met het. Handschoenen en veiligheidsbril moet gedragen worden en altijd laat oplossingen in een zuurkast.
3. voorbereiding van de fluorescerende Nanoparticle schorsing
- Label van de eiwit-nanoparticle met Atto-488 NHS ester (Zie Tabel van materialen) of een passende fluorescente kleurstof volgens de instructies van de fabrikant.
- Resuspendeer de nanodeeltjes in 0,1 M natriumbicarbonaat buffer op de concentratie van 2 mg/mL.
- Los de Atto 488 NHS ester in amine-vrije dimethylsulfoxide (DMSO) 2 mg/ml. Houd een aliquoot deel van 10 µL om labeling efficiëntie (stap 3.7-3.8) te controleren.
- Meng de nanodeeltjes en de Atto 488 NHS ester bij een molaire verhouding van 1:2 (eiwit: kleurstof) door roeren in het donker.
- Spin down de gelabelde nanodeeltjes door centrifugeren bij 8.000 x g gedurende 10 minuten bij kamertemperatuur, verwijder het supernatant en houd het Controleer labeling efficiëntie (stap 3.7-3.8).
- De gelabelde nanodeeltjes wassen door resuspending in 1 mL 0,1 M natriumbicarbonaat buffer door vortexing en pipetteren omhoog en omlaag. Verwijder het supernatant vervolgens door centrifugeren bij 8.000 x g gedurende 10 minuten bij kamertemperatuur. Herhaal stap 3.6 voor 5 keer.
- Resuspendeer de pellet in 5 mL 0,1 M natriumbicarbonaat buffer in een centrifugebuis 15 mL en maak aliquots van het fluorescerende nanoparticle in 1,5 mL centrifuge buizen (30 aliquots). Spin down bij 8.000 x g gedurende 10 minuten bij kamertemperatuur, verwijder het supernatant en opslaan bij-80 ° C beschermd tegen het licht.
-
De labeling efficiëntie met behulp van een microvolume spectrofotometer meten.
- Neem 1 µL van de oorspronkelijke Atto 488 oplossing stap 3.3 behoed en verder verdunnen het in DMSO (bijvoorbeeld1:20 volgens de volumeverhouding). Dit is het volume dat wordt gebruikt om de molaire verhouding van het eiwit nanoparticle en Atto 488 mix bij stap 3.4.
- Neem 1 µL van het supernatans dat uit de etikettering reactie opgeslagen in stap 3.5. Meten van de absorptie (abs) at = 501 nm. Het percentage van de etikettering is:
(
- Voordat het experiment, stelt u de opschorting van de nanoparticle op de gewenste concentratie met 1 x PBS oplossing.
4. de zebravis afstomping en mondelinge intubatie
- Snel de vis (> 0,5 g) ten minste 48 uur vóór het experiment voor het leegmaken van de darm.
- Verplaats de vis (12 vis) naar de experimentele tanks (6 L) één nacht voordat het experiment dat acclimatisatie12.
- Vortex de goed nanoparticle-oplossing (bijvoorbeeld 2500 rpm en 30 s) en de gewenste hoeveelheid nanoparticle schorsing (bijvoorbeeld 20 – 50 µL) in te stellen in de spuit gekoppeld aan de beschermde naald.
- Plaats de vis in de belucht 150 mg/L MS-222 oplossing (zie punt 2) totdat ze naar de bodem van de tank zinken en niet op een snuifje staartvin reageren; Dit proces duurt minder dan 5 min.
- Snel de narcose vissen met een net overbrengen in een natte kunststof dienblad, het dier horizontaal om de naald worden geconfronteerd en meteen beginnen met de mondelinge intubatie oriënteren.
- Zorgvuldig ondersteunen de vis met de ene hand en het openen van de mond met de andere hand met behulp van de beschermde naald. Zachtjes invoegen de naald van de slokdarm tot ongeveer 1 cm uit de mond openen.
Opmerking: De operator kan een lichte weerstand voelen wanneer het einde van het uiteinde van de pipet het gill is verstreken. Wees voorzichtig niet te hoek van de naald-post te veel die de gill perforate kan. - Langzaam injecteren de opschorting van de nanoparticle voor de vis. Zorg ervoor dat de schorsing stromen niet naar buiten door de kieuwen of mond.
- Zachtjes verwijderen van de naald en leg de vis in de herstel tank (zie punt 2). Herstel duurt meestal binnen 1 min.
- Controleer de vissen zorgvuldig voor eventuele afwijking (bvbloeden op de kieuwen is een teken van perforatie).
- Zodra de vis zijn hersteld, terugsturen naar de experimentele tanks.
5. Zebrafish darm dissectie
- Na een bepaalde periode van tijd post intubatie (bijvoorbeeld 5 h en/of 24 h), plaats de vis met behulp van een net in 300 mg/L MS-222 oplossing voor euthanasie (zie punt 2). Zorg ervoor dat de operculum niet meer beweegt en er is geen staart snuifje reflex. Vijf minuten is doorgaans voldoende.
- Pak het euthanized dier met een net en plaats deze op een filtreerpapier.
Opmerking: Het koffiefilter is handig voor het verwijderen van de lijm weefsel langs de darm. - Maak scherpe dissectie schaar met een halfronde insnijding van de anus naar de operculum en open insnijding met fijne pincet. Knippen van beide uiteinden van de darm, nemen alle van de inwendige organen en leg ze op het filtreerpapier.
Let op: Werk snel te verminderen celmetabolisme en de dood.
Opmerking: Als alternatief, verwijdert de zelfklevende weefsel in PBS en op ijs. - Het scheiden van de darm van inwendige organen, ervoor zorgend om houden haar geaardheid (anterior to achterste intestinale segment) en het strekken. Meestal is het anterieure segment van de darm breder dan de achterste segment. Zorg dat alle van de darm kunnen wanneer ontleden.
Opmerking: Het achterste einde is heel fijn en kwetsbaar in kleine vissen en kan afbreken, met name bij dieren < 0.7 g. - Rol de darm op het filtreerpapier met een pincet om het loskoppelen van de zelfklevende weefsel van de darm.
- Ga verder met het bereiden van de darm voor verschillende downstream analyses (artikelen 6, 7 en 8).
6. voorbereiding intestinale cellen van Cytometry
- Bereiden aliquots van 0,15% collagenase-oplossing (zie punt 2.4).
Opmerking: Aliquots moet bij kamertemperatuur voordat u verdergaat. - Optioneel: Voortzetting van stap 5.5, spleet open de darm lengterichting en wassen met 1 x PBS.
- Plaats de darm met pincet in de centrifugebuis van 2 mL gevuld met 0,15% collagenase oplossing.
- Plaats de buizen op een verticale laboratorium rotator gedurende 1 uur bij kamertemperatuur in het donker.
- Plaats de darm op een 100 µm cel zeef ondersteund via een centrifuge tube van 50 mL. Breken van de darm met een 5 mL spuit zuiger, 3 keer wassen met PBS in 1 x, het verzamelen van de stroom door het monster in de centrifugebuis 50 mL.
- Centrifugeer de centrifugebuis 50 mL bij 400 x g gedurende 10 minuten, bij 4 ° C.
- Pipetteer zorgvuldig uit de meeste van het supernatans dat terwijl niet verliezen de cellen, waarvan sommige gekoppeld aan het slijm worden kunnen.
- Resuspendeer de intestinale cellen bij de bodem van de centrifugebuis met 500 µL van 1 x PBS en houden op ijs totdat cytometry analyse
- Filter monsters door een 30 µm cel filter in 5 mL ronde onderkant buizen voor cytometry.
- Instellen van de parameters (bijvoorbeeld het aantal cellen voor analyse, de regio van belang, spanning en compensatie, selectie van detectoren) inzake de uitrusting van een cytometer (Zie materiaal).
- Onmiddellijk analyseren de cellen op een cytometer, volgens de instructies van gebruik13.
7. voorbereiding van de darm cryosecties van de Confocal Microscopie
- Vul de plastic mal (Zie Tabel van materialen) aan de helft van de volume met optimale snijden temperatuur (O.C.T.) samengestelde.
- Voortzetting van stap 5.5 en onmiddellijk na de dissectie, zorgvuldig plaats de darm in de plastic mal. Zorg ervoor dat de darm is volledig ingebed in de O.C.T. compound. Indien nodig, voeg meer O.C.T. samengestelde aan de plastic mal.
Opmerking: Het wordt aanbevolen om de darm met een "Z" shape in O.C.T. samengestelde gemakkelijk volgen de natuurlijke oriëntatie. - Plaats de plastic mal op droog ijs totdat het gaat dekkend (minder dan een minuut).
- Bewaar de plastic mal bij-80 ° C voor langdurig gebruik of proces onmiddellijk met de volgende procedure.
Opmerking: Het protocol kan hier worden gepauzeerd. - Snijd het bevroren darm in 10 µm secties of de juiste dikte met behulp van een cryostaat bij-20 ° C.
- De darm sectie met een fijne penseel op een dia te verzamelen.
- Onderdompelen van de dia in 4% PFA gedurende 15 minuten bij kamertemperatuur te lossen van het monster.
Let op: PFA is giftig. Lees het veiligheidsinformatieblad voordat u gaat werken met het. Handschoenen en veiligheidsbril moet gedragen worden en altijd laat oplossingen in een zuurkast. - Wassen van de dia 3 keer met 1 x PBS, elke 10 min.
- Voeg een druppel van montage medium en plaats een dekglaasje aan over het model.
Opmerking: Het protocol kan hier worden gepauzeerd. - Observeer het monster onder een confocal microscoop op passende vergroting.
8. voorbereiding van de darm voor qPCR van real-time (RT-qPCR)
- Verder vanaf stap 5.5, zet de darm in een cryogene flesje en snel bevriezen de darm in vloeibare stikstof en winkel bij-80 ° C tot gebruik.
Opmerking: Het protocol kan hier worden gepauzeerd. - Voor homogenisering, voeg 200 µL van 2% (v/v) gekoeld 1-Thioglycerol/homogenisering oplossing (Zie Tabel van materialen) of alternatieve homogenisering oplossing aan de darm monster.
- Snel werken, meng het darm monster op ijs met een laboratorium homogenizer op hoge snelheid (vastgesteld op 25 tot 30.000 rpm) tot geen zichtbare weefsel fragmenten blijven. 3 keer voor 5 s is meestal voldoende.
- Isoleren van RNA met behulp van een commerciële kit (Zie Tabel van materialen) volgens de fabrikant instructies14 of een geschikte alternatieve methode. Zo nodig, slaan de RNA-80 ° c voor langdurig gebruik.
Opmerking: Het protocol kan hier worden gepauzeerd. - Kwantificeren van de RNA-concentratie met behulp van een spectrofotometer15 en evalueren van de kwaliteit met behulp van een RNA analyzer16.
- Bereiden 1 µg of een passend bedrag van cDNA met behulp van een cDNA synthese kit volgens de instructies van de fabrikant.
Opmerking: Het protocol kan hier worden gepauzeerd. Voor de analyse van de qPCR, volg de MIQE richtsnoeren17. - Het ontwerp van passende primerparen voor de gene/s van belang.
- Selecteer een geschikte referentiemiddelen gen en analyseren van de expressie van elk gen door een RT-qPCR detectie systeem met behulp van een commerciële kit (Zie materiaal).
Opmerking: Voeg bijvoorbeeld 5 µL van SYBR groene supermix, 0,5 µM inleidingen, 2.5 µL van verdunde cDNA en 1,5 µL van water in een eindvolume van 10 µL voor elk putje van de plaat van de qPCR.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Zebrafish (gemiddeld gewicht: 1,03 ± 0.16 g) van gemengde geslacht werden met succes intubated met verschillende recombinant eiwit nanodeeltjes (bacteriële opneming lichamen) met behulp van onze huisgemaakte mondelinge intubatie apparaat (Figuur 1). We hebben met succes uitgevoerd de mondelinge intubatie en bereikt een lage gemiddelde percentage mortaliteit (6,8%) (Tabel 1). Zebravis waren ofwel intubated met 30 µL of 50 µL van nanoparticle schorsingen en de sterfte binnen 24u post intubatie was berekend. De experimenten werden uitgevoerd door twee operators, R had minder ervaring in het werken met de mondelinge intubatie zebrafish dan J. De resultaten toonden dat zelfs een nieuwe exploitant de mondelinge intubatie zelfstandig kan uitvoeren experimenteren en een hoog overlevingspercentage gemakkelijk te bereiken door dit protocol. Uit onze ervaring, de optimale vis grootte is 1 g, maar we hebben met succes intubated vis zo klein als 0,5 g.
Om beter te begrijpen dat of de fluorescerende nanodeeltjes IBsTNFα (een recombinant cytokine eiwit nanostructured als integratie organen) werden geleverd aan zebrafish door onze methode en in beslag genomen door de zebravis darm of niet, we uitgevoerd cytometry analyse. De nanodeeltjes (100 µg/vis, 50 µL) en PBS (control) werden oraal toegediend (door intubatie) aan zebravis en de darm na 5 uur en 24 h post intubatie werd ontleed. Totaal aantal intestinale cellen werden voorbereid door stap 6 en geanalyseerd door het detecteren van de fluorescentie emissie signaal. De representatieve histogrammen van de intensiteit van de fluorescentie en de stip percelen van fluorescerende cel percentage zijn afgebeeld in Figuur 2. De dichtheid van fluorescerende cellen is duidelijk hoger in nanoparticle intubated groep in vergelijking met de controlegroep in zowel 5 h en 24 h(Figuur 2). De percentages van fluorescerende cellen zijn aanzienlijk hoger in zowel 5 h (46,3%) en 24 h (43.0%) van nanoparticle intubated groepen (Figuur 2B).
Voor verdere studie welk deel van de intestinale laag is betrokken bij de opname van de nanoparticle, we confocale microscopie analyse uitgevoerd. De nanodeeltjes (20 µg/vis, 50 µL) en PBS (control) waren mondeling intubated aan de zebravis en de darm was ontleed aan 5 h post intubatie. De darm secties werden voorbereid door een bevroren weefsel methode volgens stap 7 (Figuur 3A). De confocal beelden van fluorescerende nanodeeltjes in de darm worden weergegeven in Figuur 3B. De fluorescerende nanodeeltjes werden gevonden in zebrafish darm. We hebben vastgesteld dat de fluorescentie in de epitheliale cellen, lamina propria en spiercellen.
Om te controleren of we hoge kwaliteit RNA door ons protocol halen kan, geanalyseerd wij het RNA geëxtraheerd uit de darm met een bioanalyzer (ook RNA analyzer hier genoemd). Zebravis mondeling werden intubated met PBS (50 µL) of de nanodeeltjes (20 µg/vis, 50 µL). De darmen waren voor RNA extractie op 24u post intubatie ontleed. We kozen de zeven RNA monsters om te testen met de analyzer. We vonden dat alle geteste RNA monsters hebben hoge RNA integriteit nummers variërend van 7,9 tot 8,9 (Figuur 4).
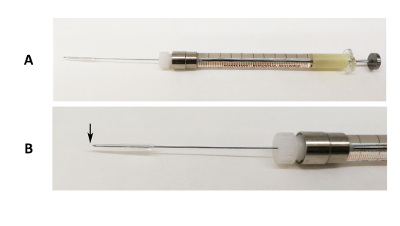
Figuur 1 : Mondeling intubatie apparaat. (A) afbeelding van een 31 G Luer lock naald gefixeerd op een 100 µL spuit met het silicium buis en Pipetteer tip einde die betrekking hebben op het puntje van de naald. (B) een vergrote beeld van het deel van de naald. De zwarte pijl geeft aan waar het einde pipette uiteinde groter is dan het puntje van de naald. Klik hier voor een grotere versie van dit cijfer.

Figuur 2 : Stroom cytometry analyse van fluorescerende nanodeeltjes in zebrafish darm via mondeling intubatie. Zebravis werden behandeld met PBS of fluorescerende IBsTNFα (100 µg) voor 5 h en 24 h, respectievelijk. (A) representatieve histogrammen van de intensiteit van de fluorescentie. (B) Dot percelen grafiek van fluorescerende cellen percentage. Elke groene stip geeft het percentage van fluorescerende cellen in één afzonderlijke, n ≥4. Gegevens vertegenwoordigen gemiddelde ± standaardafwijking van het gemiddelde (SEM). Verschillen zijn geanalyseerd met behulp van one-way ANOVA. Significante verschillen met betrekking tot controle (**, p < 0.01) Klik hier voor een grotere versie van dit cijfer.

Figuur 3 : Foto's van de analyse van de confocal microscopie. Vis waren mondeling intubated met PBS of 20 µg/vis fluorescerende nanodeeltjes. De darm was ontleed aan 5 h post intubatie. (A) Zebrafish darm ingebed in OCT verbindingen. De darm is geplaatst met de natuurlijke geaardheid van een 'Z'-vorm (a: anterior einde; p: posterieure einde). (B) de beelden van de Confocal Microscopie van zebravis darm. De witte pijlen geven aan dat de fluorescerende nanodeeltjes worden overgenomen in de intestinale mucosa. Klik hier voor een grotere versie van dit cijfer.

Figuur 4 : RNA analyzer virtuele gel afbeelding toont RNA geëxtraheerd uit 7 zebrafish darmen bemonsterd post intubatie. Monster nummer 1 en 2 zijn PBS intubated groepen en monster nummer 3 tot en met 7 zijn nanoparticle intubated groepen. RNA integrity nummers (RIN) zijn vermeld onderaan variërend van 7,9 tot 8,9. Klik hier voor een grotere versie van dit cijfer.
| Operator | Volume | # vis intubated | Gemiddelde gewicht (g ± SD) |
# doden | Mortaliteit (%) |
| R | 30 ΜL | 22 | 0.88 ± 0.14 | 3 | 13,6 |
| R | 30 ΜL | 17 | 0.93 ± 0,19 | 0 | 0 |
| J | 50 ΜL | 19 | 1.23 ± 0.31 | 1 | 5.2 |
| J | 50 ΜL | 30 | 1,08 ± 0.40 | 2 | 6.6 |
| Totaal | 88 | 1,03 ± 0,16 | 6 | 6,8 | |
| SD: standaarddeviatie van het gemiddelde | |||||
Tabel 1: Vergelijking van zebravis sterfte veroorzaakt door twee ondernemers met behulp van het protocol. De identificatiecode van de exploitant, het intubated volume, het aantal vissen en het gemiddelde gewicht van vissen in gram (g) worden weergegeven.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dit protocol is een verbetering ten opzichte van de eerder beschreven techniek voor mondelinge intubatie door Collymore et al. 4 ons protocol beschrijft in detail de mondelinge intubatie methode en omvat de voorbereiding van de darm voor downstream analyses. Onze methode verbetert vis manipulatie snelheid waardoor één persoon uit te voeren van het hele protocol snel, zonder veel variatie tussen exploitanten. Een belangrijkste verschil van onze protocol met het vorige voorbeeld is dat we het succes van een mondelinge intubatie experiment niet alleen door observatie van het dier voor welzijn evalueren (bijvoorbeeld geen bloeden) en geen lekkage van de vloeistof toegediend, maar ook door te controleren de opname van een bioactieve nanoparticle in de darm met behulp van downstream analyse (cytometry, confocal microscopie en qPCR). We laten zien dat intubated fluorescently geëtiketteerde nanodeeltjes in de darm bleken.
Aan de praktische kant, de intubatie apparatuur is goedkoop, precieze en herbruikbare: het basisapparaat is gemaakt van een herbruikbare 100 µL glas (bijvoorbeeldHamilton) spuit gekoppeld aan een 31 G naald met een stukje silicium op de top. Een gesneden steriele tip over de silicium-buis wordt geplaatst en voor elke afzonderlijke administratie kan worden gewijzigd. De spuit is herbruikbaar en de dunne naald kunt intubating kleine vis met een hoge kans van slagen. Bovendien kon de gesneden steriele tip direct boven de naald zonder het silicium buis waarmee de intubatie apparatuur gemakkelijker worden gemaakt in een laboratorium worden geplaatst. De door de overheid gereguleerde bioactieve compound is duidelijk zichtbaar, en een kloppende administratie kan gemakkelijk worden gecontroleerd. Een kritieke stap tijdens de intubatie procedure is de naald. Het is belangrijk dat de naald niet gekanteld of teveel geplaatst om te voorkomen dat de kieuwen perforeren. De sterfte bij deze methode is zeer laag (ongeveer 7%) en hangt af van de grootte van de vis. Gill perforatie is de meest voorkomende oorzaak van de dood van de vis, en wanneer het vissen sterven binnen het eerste uur gebeurt. Hoewel vis van 0,5 g kan gemakkelijk worden intubated is de optimale vis grootte ongeveer 1 g. Een ander verschil met de methode ontwikkeld door Collymore et al. is dat de vis zijn gevast voor 48 uur om er zeker van te zijn dat maag-darmkanaal is leeg. De hele intubatie procedure kan zeer snel worden gedaan (30 dieren/h) door één exploitant en belangrijker, de methode is in overeenstemming tussen de verschillende exploitanten4. De intubatie methode is eenvoudig te leren en vereist niet veel praktijk te beheersen.
De darm dissectie procedure moet naar behoren worden uitgevoerd om het verkrijgen van goede kwaliteit monsters voor cytometry, confocal en qPCR analyses. De kritieke stap is op dit punt de dissectie van de hele darm; het achterste gedeelte is kwetsbaar en gemakkelijk te verliezen. Zodra de darm is ontleed, kan het verder worden verwerkt voor cytometry (2 h protocol), qPCR analyse (2 h protocol tot totale isolatie van RNA) of confocale microscopie (1 h om monsters klaar voor cryosection). Het is zeer belangrijk om de oriëntatie van de darm, vooral voor confocale microscopie bij te houden. Cytometry analyse snelle verwerking vereist, en de procedure vóór afronding niet worden gestopt. Overwegende dat, met het RNA isolatie en monsters opgesteld voor cryosection kan correct worden opgeslagen en op elk gewenst moment verwerkt. Voor cytometry, goede kwaliteit monsters zonder puin samendoen van de machine kunnen worden geïsoleerd met deze methode en snelle analyse voor de aanwezigheid van fluorescerende cellen kan gemakkelijk worden uitgevoerd op individuen. RNA kwaliteitsbewaking toonde aan dat RNA van hoge kwaliteit geïsoleerd uit darm waardoor analyse van afzonderlijke vissen door qPCR worden kan. Tot slot, de voorbereiding van de cryosection van de confocal microscopie biedt belangrijke structurele informatie over de opname van proteïne nanoparticle. Onze methoden bieden dus een model om te testen van de dynamiek van mondelinge mondhygiëne of andere verbindingen in de darm.
De beperkingen van onze studie zijn de grootte van de vis, aangezien wij niet administratie in vissen kleiner dan 0,5 g en het gebruik van een chemische verdoving testen te verdoven van dieren. Sommige auteurs gebruiken koud water (0-4 ° C) tot anesthetize van de zebravis18 maar in het kader van het dierenwelzijn en de Europese juridische beperkingen hebben we besloten dat MS-222 de methode van keuze was.
De zebravis biedt vele voordelen ten opzichte van andere modelsystemen met inbegrip van een volledige set van genetische gegevens en de beschikbare transgene lijnen. De transgene regels (bijvoorbeeld Tg mpx:GFP en GS mpeg1:GFP) stel voor immunologen, een scène voor de waarneming in vivo van immune cellen zoals macrofagen en neutrofielen19,20. Onze mondelinge intubatie en downstream analyses combineren met transgene lijnen, zou ideaal zijn voor het identificeren van de celtypes waarbij de opname, transport en verwerking van orale vaccins, nanodeeltjes en ziektekiemen in de vis.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs verklaren dat geen tegenstrijdige belangen bestaan.
Acknowledgments
Dit werk werd gesteund door subsidies van het Spaanse ministerie van wetenschap, de Europese Commissie en AGAUR fondsen NR (AGL2015-65129-R MINECO/FEDER en 2014SGR-345-AGAUR). RT houdt een-gepromoveerde beurs van AGAUR (Spanje), JJ werd ondersteund door een PhD fellowship van de China Scholarship Raad (China) en NR wordt ondersteund door het programma Ramón y Cajal (RYC-2010-06210, 2010, MINECO). Wij danken Dr. Torrealba voor deskundig advies bij de productie van eiwitten, N. Barba uit de "Servei de Microscopia" en Dr. M. Costa uit de "Servei de Citometria" van de Universitat Autònoma de Barcelona voor nuttige technische bijstand.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




