Summary
O protocolo descreve intubação zebrafish adulto com um biológico; em seguida, dissecando e preparar o intestino para citometria, microscopia confocal e qPCR. Este método permite a administração de compostos bioativos para monitorar a absorção intestinal e o estímulo imune local evocado. É relevante para a dinâmica intestinal da profilaxia oral de teste.
Abstract
A maioria dos patógenos invadem organismos por meio de sua mucosa. Isto é particularmente verdadeiro em peixe como eles estão continuamente expostos a um ambiente de água rica em microbiana. Desenvolver métodos eficazes para entrega oral de Imunoestimuladores ou vacinas, que ativam o sistema imunológico contra doenças infecciosas, é altamente desejável. Na concepção de ferramentas profiláticas, bons modelos experimentais são necessários para testar seu desempenho. Aqui, nós mostramos um método para intubação oral de zebrafish adulto e um conjunto de procedimentos para dissecar e preparar o intestino para citometria, microscopia confocal e análise (qPCR) reação em cadeia de polimerase quantitativa. Com este protocolo, estamos precisamente pode administrar volumes até 50 µ l de pescar pesando cerca de 1 g simplesmente e rapidamente, sem prejudicar os animais. Este método nos permite explorar a absorção direta na vivo de compostos fluorescente rotulados pela mucosa intestinal e a capacidade de imunomoduladores de tais produtos biológicos no local após a intubação. Combinando métodos a jusante como citometria de fluxo, histologia, qPCR e microscopia confocal do tecido intestinal, podemos entender como Imunoestimuladores ou vacinas são capazes de atravessar as barreiras da mucosa intestinais, passar a lâmina própria, e atingir o músculo, exercendo um efeito sobre o sistema imunológico da mucosa intestinal. O modelo pode ser usado para testar a profilaxia oral candidato e sistemas de entrega ou o efeito local de qualquer composto Bioativo administrado por via oral.
Introduction
O objetivo deste artigo é descrever em profundidade um método simples para intubação oral de zebrafish, juntamente com procedimentos de jusante associados útil. Intubação oral usando zebrafish tornou-se um modelo prático no estudo da dinâmica de doenças infecciosas, vacina oral/imuno-estimulantes, drogas/nanopartículas absorção e eficácia e imunidade da mucosa intestinal. Por exemplo, zebrafish intubação oral tem sido usada no estudo de Mycobacterium marinum e Mycobacterium peregrinum infecção1. Lovmo et al . também utilizado com sucesso este modelo para entregar o trato gastro-intestinal de adultos do zebrafish2-nanopartículas e M. marinum . Além disso, Chen et al costumava intubação oral zebrafish para mostrar que drogas encapsuladas por nanopartículas, quando administrada através do trato gastro-intestinal, foram transportados através do sangue cérebro barreira3. Estes autores realizaram intubação baseada no método descrito por Collymore et al gauvage 4 , com algumas modificações. No entanto, eles não forneceu um protocolo altamente detalhado, descrevendo o procedimento de intubação oral. Aqui, apresentamos um método para intubação oral de adultos do zebrafish baseando Collymore et al 4 outras incluem a preparação do intestino para análise pertinente a jusante por citometria, microscopia confocal e qPCR.
O intestino e particularmente sua mucosa é a primeira linha de defesa contra a infecção e o local principal de absorção de nutrientes5. Quando as células epiteliais e células apresentadoras de antígeno dentro da mucosa barreiras percebem sinais de perigo, uma imediata resposta imune inata é acionada. Em seguida, a resposta imune adaptativa altamente específica é estabelecida por de6,de linfócitos T e B7. Desenvolvimento de vacinas orais é uma área de foco atual em Vacinologia. Essas vacinas seria uma ferramenta eficaz para proteger o organismo em locais expostos devido à resposta específica de células do sistema imunológico em tecidos linfoides associados a mucosa (MALT)8,9. Na aquicultura, vacinas da mucosa tem vantagens óbvias em comparação com as vacinas injetáveis. Eles são práticos para vacinação em massa, menos trabalhosa, são menos estressantes para os peixes e podem ser administrados para peixes jovens. No entanto, candidatos vacinais da mucosa devem chegar o segundo segmento de intestino sem ser desnaturada no meio oral. Eles também devem transpor as barreiras da mucosa para obter acesso a apresentadoras de antígenos (APCs) para induzir respostas locais e/ou sistêmica10de células. Portanto, testes de captação da mucosa alcançada pelo candidato oral antígenos e seus sistemas de entrega, bem como a resposta imune evocada, é essencial no desenvolvimento de vacinas orais.
Em um contexto biomédico, desenvolvendo um modelo para testar os efeitos biológicos de compostos após intubação oral é de interesse crescente. Muitas das características anatômicas e fisiológicas do intestino são conservadas entre linhagens é formado por, com mamíferos e peixes ósseos11. Este modelo de entubação oral ligado à análise a jusante pode ser uma ferramenta para fornecer insights sobre a biologia humana, bem como um campo de testes para produtos biológicos ou outros compostos na vivo.
O protocolo de intubação oral pode ser realizado por um operador, por exemplo, administrar com sucesso até 50 µ l de suspensão de nanopartículas de proteína para peixes pesando 1 g, com uma taxa de sobrevivência de alta. O procedimento é simples de configurar e rápido; 30 peixes podem ser intubados em 1h. O protocolo para a preparação do intestino é a chave para fornecer amostras de células e tecidos de qualidade para posterior análise. Exemplos de resultados a jusante são dados que mostram a utilidade do protocolo na obtenção de dados relacionados à absorção intestinal e no isolamento do RNA de qualidade para qPCR. O protocolo seria de grande utilidade para aqueles que necessitam de um modelo adequado para testar a dinâmica da profilaxia oral ou outros compostos no intestino.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Todos os procedimentos experimentais envolvendo peixe-zebra (Danio rerio) foram autorizados pelo Comitê de ética da Universitat Autònoma de Barcelona (número CEEH 1582) de acordo com os princípios orientadores do Internacional para pesquisa envolvendo animais ( EU 2010/63). Todos os experimentos com zebrafish ao vivo foram realizados em 26 e 28 ° C.
1. preparar o equipamento para intubação Oral
- Coloque aproximadamente 1 cm de um tubo de silicone fino sobre uma agulha de bloqueio de Luer de 31 mil para cobrir a ponta da agulha.
- Corte uma pipeta de filtro estéril 10 µ l de ponta (cerca de 2 cm), pegue a ponta mais fina e coloque-o sobre o tubo de silicone como uma bainha. Certifique-se que a pipeta se estende para além da ponta da agulha para evitar ferir o animal.
- Conecte a agulha de uma seringa de fecho Luer µ l 100.
Nota: Lave sempre com etanol, e em seguida tampão fosfato salino (PBS, ver materiais) completamente entre os tratamentos.
2. soluções necessárias
- Prepare a 150 mg/L (anestesia) ou 300 mg/L (eutanásia) da solução de Metanossulfonato (MS-222) etil 3-aminobenzoato com água do aquário onde o peixe-zebra são mantidas. Encher um tanque pequeno com 1 L de solução anestésica e mantê-lo arejado.
- Preencher outro tanque pequeno com 1 L de água do aquário sem MS-222 para recuperação do peixe e mantê-lo arejado.
- Fazer 50 mL de 1X PBS de uma solução estéril de 10x.
- Para o isolamento de célula intestinal/análise cytometry, prepare bastante fresco colagenase 0,15% solução tipo IV para 1ml por peixes de uma solução de reserva ou de pó num meio de águia modificados de Dulbecco (DMEM) com 1% v/v penicilina e estreptomicina (ver materiais). Faça (1 por peixe) de alíquotas de 1 mL em tubos de centrífuga de 2 mL. Manter a 4 ° C até 30 min antes da etapa de dissecação.
- Para fixação de microscopia confocal/amostra, preparar 50 mL de solução de paraformaldeído (PFA) fresca de 4% em PBS ou descongelar uma solução stock de congelador-20 ° C em uma coifa.
Atenção: O PFA é tóxico. Por favor, leia a folha de dados material de segurança antes de trabalhar com ele. Luvas e óculos de segurança devem ser usados e deixar sempre soluções dentro de uma coifa.
3. preparar a suspensão de nanopartículas fluorescentes
- Rotular as nanopartículas de proteína com éster Atto-488 NHS (ver Tabela de materiais) ou uma tintura fluorescente apropriada de acordo com as instruções do fabricante.
- Resuspenda as nanopartículas em tampão de bicarbonato de sódio 0,1 M na concentração de 2 mg/mL.
- Dissolva o éster Atto 488 NHS em amina livre dimetilsulfóxido (DMSO) 2 mg/ml. Manter uma alíquota de 10 µ l para verificar a eficiência de rotulagem (etapa 3.7 – 3.8).
- Misture as nanopartículas e o éster Atto 488 NHS em uma relação molar de 1:2 (proteína: tintura) por agitação no escuro.
- Spin para baixo as nanopartículas rotuladas por centrifugação a 8.000 x g durante 10 minutos à temperatura ambiente, remover o sobrenadante e mantê-lo para verificar a eficiência de rotulagem (etapa 3.7 – 3.8).
- Lave as nanopartículas rotuladas por resuspending em 1 mL de tampão de bicarbonato de sódio 0,1 M num Vortex e pipetagem para cima e para baixo. Em seguida, descarte o sobrenadante por centrifugação a 8.000 x g durante 10 minutos à temperatura ambiente. Repita a etapa 3.6 por 5 vezes.
- Resuspenda o pellet em 5 mL de tampão de bicarbonato de sódio 0,1 M em um tubo de centrífuga de 15 mL e faça alíquotas das nanopartículas fluorescentes em tubos de centrífuga de 1,5 mL (30 alíquotas). Spin para baixo a 8.000 x g durante 10 minutos à temperatura ambiente, desprezar o sobrenadante e armazenar a-80 ° C, protegido da luz.
-
Medir a eficiência de rotulagem usando um spectrophotometer microvolume.
- Tomar 1 µ l da solução de Atto 488 original mantida da etapa 3.3 e diluí-lo ainda mais em DMSO (por exemplo, 01:20 de acordo com a relação de volume). Este é o volume usado para obter a relação molar de nanopartículas de proteína e Atto 488 misture no passo 3.4.
- Tome 1 µ l do sobrenadante da reação da rotulagem salvo na etapa 3.5. Medir a absorção (abs) no = 501 nm. É a porcentagem de rotulagem:
(
- Antes do experimento, prepare a suspensão de nanopartículas na concentração desejada usando 1 x solução de PBS.
4. Zebrafish Anesthetization e intubação Oral
- Rápido o peixe (> 0,5 g) pelo menos 48 h antes do experimento para esvaziar o intestino.
- Mova o peixe (12 peixe) para os tanques experimentais (6L) uma noite antes do experimento para permitir que a aclimatação12.
- Vórtice a solução de nanopartículas bem (por exemplo, 2.500 rpm e 30 s) e elaborar o volume desejado de nanopartículas suspensão (por exemplo, 20 – 50 µ l) para a seringa anexada para a agulha protegida.
- Coloque o peixe no aerado 150mg/L MS-222 solução (ver secção 2) até que eles descem para o fundo do tanque e não respondem a uma pitada de barbatana de cauda; Este processo leva menos de 5 min.
- Rapidamente o peixe anestesiado com uma rede de transferência para uma bandeja de plástico molhada, orientar o animal horizontalmente para enfrentar a agulha e começar imediatamente a intubação oral.
- Cuidadosamente, apoiar o peixe com uma mão e abrir a boca com a outra mão usando a agulha protegida. Insira cuidadosamente a agulha até ao esófago para cerca de 1 cm da boca abrindo.
Nota: O operador pode sentir uma ligeira resistência ao final da ponta da pipeta passou o gill. Tome cuidado para não o ângulo da entrada de agulha demais que possam perfurar o gill. - Injete lentamente a suspensão de nanopartículas para os peixes. Certifique-se que a suspensão não flui para fora através de brânquias ou da boca.
- Delicadamente, retire a agulha e coloque o peixe no tanque de recuperação (ver secção 2). Recuperação leva geralmente dentro de 1 min.
- Verifique o peixe cuidadosamente para qualquer anormalidade (por exemplo, sangramento em brânquias é um sinal de perfuração).
- Uma vez que os peixes se recuperaram, devolvê-los para os tanques experimentais.
5. Zebrafish intestino dissecação
- Após um período especificado de tempo pós intubação (por exemplo, 5 h e/ou 24 h), coloque o peixe usando uma rede em 300 mg/L de MS-222 solução para eutanásia (ver secção 2). Certifique-se o opérculo para de se mover e não há nenhum reflexo de pitada de cauda. Cinco minutos é normalmente suficiente.
- Pegar o animal euthanized com uma rede e colocá-lo em um papel de filtro.
Nota: O papel de filtro é muito útil para remover o tecido adesivo ao longo do intestino. - Usando uma tesoura afiada dissecação, fazer uma incisão semicircular do ânus para o opérculo e incisão aberta, usando uma pinça fina. Corte as duas extremidades do intestino, tirar todos os órgãos internos e coloque-os sobre o papel de filtro.
Cuidado: Trabalho rapidamente para reduzir a morte e o metabolismo celular.
Nota: Como alternativa, remova o tecido adesivo em PBS e no gelo. - Separe o intestino dos órgãos internos, certificando-se de manter sua orientação (anterior posterior segmento intestinal) e esticá-la. Geralmente, o segmento anterior do intestino é mais largo do que o segmento posterior. Tome cuidado para obter todos do intestino quando dissecando.
Nota: A extremidade posterior é muito fina e frágil em peixes pequenos e podem romper, particularmente em animais < 0,7 g. - Role o intestino no filtro de papel com uma pinça para desanexar o tecido adesivo no intestino.
- Proceda para preparar o intestino para várias análises a jusante (seções 6, 7 e 8).
6. preparar células intestinais por citometria
- Prepare com antecedência alíquotas da solução de colagenase de 0,15% (ver secção 2.4).
Nota: Alíquotas devem estar à temperatura ambiente antes de prosseguir. - Opcional: Continuação da etapa 5.5, cortar aberto o intestino longitudinalmente e lave com PBS 1x.
- Usando uma pinça, coloca o intestino no tubo de centrífuga de 2ml, preenchido com solução de colagenase de 0,15%.
- Coloque os tubos em rotacao laboratório vertical por 1h à temperatura ambiente no escuro.
- Coloque o intestino em um coador de célula de 100 µm apoiado sobre um tubo de centrífuga de 50 mL. Romper o intestino com um êmbolo da seringa de 5 mL, lavar 3 vezes com PBS 1x, coletando o fluxo através da amostra no tubo de centrífuga de 50 mL.
- Centrifugar o tubo de centrífuga de 50 mL a 400 x g durante 10 minutos, a 4 ° C.
- Pipete cuidadosamente durante a maior parte do líquido sobrenadante enquanto não perder as células, alguns dos quais podem ser associados com o muco.
- Ressuspender as células intestinais na parte inferior do tubo de centrífuga com 500 µ l de PBS 1x e manter no gelo até análise cytometry
- Amostras de filtro através de um filtro de célula 30 µm em 5 mL redonda tubos para citometria.
- Definir os parâmetros (por exemplo, o número de células para análise, a região de interesse, a tensão e a compensação, seleção de detectores) em um equipamento de citômetro (ver materiais).
- Imediatamente analise as células em um citômetro, seguindo as instruções de uso13.
7. preparação de Cryosections intestino para microscopia Confocal
- Encher o molde de plástico (ver Tabela de materiais) para metade do volume com a temperatura de corte ideal (O.C.T.) composta.
- Continuando da etapa 5.5 e imediatamente após a dissecação, coloque cuidadosamente o intestino no molde plástico. Certifique-se que o intestino é totalmente incorporado no composto O.C.T.. Se necessário, adicione mais O.C.T. composto para o molde plástico.
Nota: É recomendável colocar o intestino com uma forma de "Z" no O.C.T. compostos facilmente seguir sua orientação natural. - Coloque o molde de plástico em gelo seco até ficar opaco (menos de um minuto).
- Armazene o molde plástico a-80 ° C para uso a longo prazo ou processo imediatamente usando o procedimento a seguir.
Nota: O protocolo pode ser pausado aqui. - Fatie o intestino congelado em 10 seções µm ou espessura apropriada usando um criostato a-20 ° C.
- Recolha a seção de intestino com um pincel fino para um slide.
- Mergulhe o slide em 4% PFA durante 15 minutos à temperatura ambiente para fixar a amostra.
Atenção: O PFA é tóxico. Por favor, leia a folha de dados material de segurança antes de trabalhar com ele. Luvas e óculos de segurança devem ser usados e deixar sempre soluções dentro de uma coifa. - Lave o slide 3 vezes com 1X PBS, 10 min cada.
- Adicionar uma gota de meio de montagem e coloque uma lamela sobre o espécime.
Nota: O protocolo pode ser pausado aqui. - Observe a amostra sob um microscópio confocal na ampliação adequada.
8. preparar o intestino para qPCR em tempo Real (RT-qPCR)
- Continuando da etapa 5.5, colocar o intestino em um frasco criogênico e congelar rapidamente o intestino em nitrogênio líquido e loja a-80 ° C até o uso.
Nota: O protocolo pode ser pausado aqui. - Para homogeneização, adicionar solução de 1-Thioglycerol/homogeneização 200 µ l de 2% (v/v) refrigerados (ver Tabela de materiais) ou solução alternativa de homogeneização para a amostra de intestino.
- Trabalhar rapidamente, homogeneizar a amostra de intestino no gelo com um homogeneizador de laboratório em alta velocidade (fixado em 25-30.000 rpm) até nenhum tecido visível fragmentos permanecem. 3 vezes por 5 s é geralmente suficiente.
- Isolar o RNA usando um comercial kit (veja a Tabela de materiais) de acordo com instruções14 as indicações do fabricante ou um método alternativo adequado. Conforme necessário, armazene o RNA a-80 ° C para uso a longo prazo.
Nota: O protocolo pode ser pausado aqui. - Quantificar a concentração de RNA usando um espectrofotômetro15 e avaliar a qualidade usando um analisador de RNA16.
- Prepare-se 1 µ g ou uma quantidade adequada de cDNA usando um kit de síntese do cDNA de acordo com as instruções do fabricante.
Nota: O protocolo pode ser pausado aqui. Para análise de qPCR, por favor, siga as orientações MIQE17. - Desenha pares de primer adequado para o gene/s de interesse.
- Selecione um gene de referência adequada e analisar a expressão de cada gene por uma detecção de RT-qPCR kit de sistema usando um comercial (ver materiais).
Nota: por exemplo, adicione 5 µ l de supermix SYBR green, as primeiras demão de 0,5 µM, 2,5 µ l de cDNA diluído e 1,5 µ l de água em um volume final de 10 µ l de cada poço da placa de qPCR.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Zebrafish (peso médio: 1.03 ± 0,16 g) de sexo misturado com êxito foram intubados com nanopartículas de diferentes proteínas recombinantes (corpos de inclusão bacterianas) usando nosso dispositivo de intubação oral caseiro (Figura 1). Nós temos com sucesso realizada a intubação oral e alcançado uma percentagem média baixa mortalidade (6,8%) (Tabela 1). Zebrafish foram também intubado com 30 µ l ou 50 µ l de suspensões de nanopartículas e a mortalidade foi calculada dentro de intubação do post de 24 h. Os experimentos foram realizados por dois operadores, R tinha menos experiência trabalhando com zebrafish intubação oral do que J. Os resultados mostraram que mesmo um novo operador independente poderia executar a intubação oral experimentar e facilmente atingir uma taxa de sobrevivência de alta pelo presente protocolo. De nossa experiência, o tamanho ideal do peixe é de 1 g, mas nós com sucesso ter entubado tão pequenas quanto 0,5 g de peixe.
Para entender melhor que se as nanopartículas fluorescentes IBsTNFa (uma proteína nanoestruturados de citocinas recombinantes como corpos de inclusão) foram entregues pelo nosso método zebrafish e retomadas pelo intestino zebrafish, ou não, realizamos citometria análise. As nanopartículas (100 µ g/peixe, 50 µ l) e PBS (controle) foram administrados por via oral (por intubação) de zebrafish e o intestino foi dissecado em 5 h e 24 h pós intubação. Células intestinais totais foram elaboradas por etapa 6 e analisadas através da detecção do sinal de emissão de fluorescência. Os histogramas representativos da intensidade de fluorescência e os lotes do ponto da porcentagem de células fluorescentes são mostrados na Figura 2. A densidade de células fluorescentes é claramente superior em nanopartículas intubado grupo comparado ao grupo controle em 5 h e 24 h(Figura 2). As porcentagens de células fluorescentes são significativamente mais elevadas em 5h (46,3%) e 24 h (43,0%) dos grupos de nanopartículas intubado (Figura 2B).
Para um estudo mais aprofundado que parte da camada intestinal está envolvido na captação de nanopartículas, realizamos análise de microscopia confocal. As nanopartículas (20 µ g/peixe, 50 µ l) e PBS (controle) foram intubados por via oral de zebrafish e o intestino foi dissecado na intubação do post de 5h. As seções de intestino foram preparadas por um método de tecido congelado, de acordo com a etapa 7(Figura 3). As imagens confocal de nanopartículas fluorescentes no intestino são mostradas na Figura 3B. As nanopartículas fluorescentes foram encontradas no intestino de zebrafish. Observamos a fluorescência no propria do lamina, células epiteliais e células musculares.
Para verificar se pode extrair da alta qualidade do RNA pelo nosso protocolo, analisamos o RNA extraído do intestino com um bioanalyzer (também referida como analisador de RNA aqui). Zebrafish foram intubados oralmente com PBS (50 µ l) ou as nanopartículas (20 µ g/peixe, 50 µ l). Os intestinos foram dissecados para extração de RNA na intubação do post de 24 h. Nós selecionamos sete amostras de RNA para testar com o analisador. Descobrimos que todas as amostras testadas de RNA têm números elevados de integridade do RNA que variam de 7,9 a 8,9 (Figura 4).
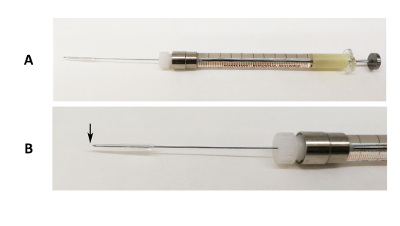
Figura 1 : Dispositivo de intubação oral. Imagem do (A) de uma agulha de bloqueio Luer G 31 corrigida em uma seringa de 100 µ l com silicone tubo e pipeta ponta final cobrindo a ponta da agulha. (B) uma imagem ampliada da parte de agulha. A seta preta indica onde a ponta da pipeta excede a ponta da agulha. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Flow cytometry análise de nanopartículas fluorescentes no intestino de zebrafish através intubação oral. Zebrafish foram tratados com PBS ou fluorescentes IBsTNFa (100 µ g) por 5 h e 24 h, respectivamente. (A) representante histogramas de intensidade de fluorescência. (B) Dot plota o gráfico da percentagem de células fluorescentes. Cada ponto verde representa a porcentagem de células fluorescentes em um ≥4 individual, n. Dados representam média ± erro padrão da média (SEM). As diferenças foram analisadas usando ANOVA One-Way. Diferenças significativas em relação ao controle (* *, p < 0,01) clique aqui para ver uma versão maior desta figura.

Figura 3 : Imagens de análise de microscopia confocal. Peixes foram intubados oralmente com PBS ou nanopartículas fluorescentes de 20 µ g/peixe. O intestino foi dissecado na intubação do post de 5h. (A) intestino Zebrafish incorporado em compostos de OCT. O intestino foi colocado com a orientação natural de uma forma de "Z" (r: final anterior; p: extremidade posterior). (B) imagens de microscopia Confocal do intestino zebrafish. As setas brancas mostram que as nanopartículas fluorescentes são retomadas na mucosa intestinal. Clique aqui para ver uma versão maior desta figura.

Figura 4 : Imagem de gel de virtual de analisador de RNA mostrando RNA extraído 7 zebrafish intestinos amostrados intubação post. Número da amostra 1 e 2 são grupos de PBS intubado e número de amostra 3 a 7 são grupos de nanopartículas entubado. Números de integridade do RNA (RIN) são dadas na parte inferior, que varia de 7,9 a 8,9. Clique aqui para ver uma versão maior desta figura.
| Operador | Volume de | peixe de # intubado | Peso médio (g ± SD) |
mortes de # | Mortalidade (%) |
| R | 30 Μ l | 22 | 0,88 ± 0,14 | 3 | 13,6 |
| R | 30 Μ l | 17 | 0,93 ± 0,19 | 0 | 0 |
| J | 50 Μ l | 19 | 1,23 ± 0,31 | 1 | 5.2 |
| J | 50 Μ l | 30 | 1.08 ± 0,40 | 2 | 6.6 |
| Total | 88 | 1.03 ± 0,16 | 6 | 6.8 | |
| SD: desvio padrão da média | |||||
Tabela 1: Comparação de zebrafish mortalidade causada por dois operadores usando o protocolo. O código de identificação do operador, o volume de intubação, o número de peixes e o peso médio de peixes em gramas (g) são mostrados.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Este protocolo é um aperfeiçoamento da técnica descrita anteriormente para intubação oral por Collymore et al 4 nosso protocolo descreve em detalhes o método de intubação oral e inclui a preparação do intestino para análises a jusante. Nosso método melhora a velocidade de manipulação de peixes permitindo que uma pessoa para executar o protocolo rapidamente, sem muita variação entre os operadores. A principal diferença do nosso protocolo com a anterior é que avaliamos o sucesso de um experimento de intubação oral não apenas pela observação do animal para o bem-estar (por exemplo, sem sangramento) e por nenhum escapamento do fluido administrado, mas também, verificando a absorção de uma nanopartícula Bioativo no intestino usando análise a jusante (citometria, microscopia confocal e qPCR). Nós mostramos que intubado fluorescente etiquetadas nanopartículas foram encontradas no intestino.
No lado prático, o equipamento de intubação é mais barato, preciso e reutilizável: o dispositivo básico é feito de um vidro de 100 µ l reutilizáveis (por exemplo, Hamilton) seringa acoplada a uma agulha de 31 G com um pedaço de silício na parte superior. Uma dica de corte estéril é colocada sobre o tubo de silicone e pode ser alterada para cada administração individual. A seringa é reutilizável, e a agulha fina permite que pequenos peixes com uma grande possibilidade de sucesso de intubação. Além disso, a ponta de corte estéril pode ser colocada diretamente sobre a agulha sem o tubo de silicone, que permite que o equipamento de intubação mais fácil de ser feita em um laboratório. O composto Bioativo administrado é claramente visível, e uma administração correta pode ser controlada facilmente. Um passo crítico durante o procedimento de intubação é a entrada da agulha. É importante que a agulha não está inclinada ou inserida demais para evitar perfurar as brânquias. A mortalidade observada com este método é muito baixo (aproximadamente 7%) e depende do tamanho do peixe. Perfuração de brânquia é a causa mais comum de morte de peixes, e quando isso acontece o peixe morrer dentro da primeira hora. Embora os peixes de 0,5 g podem facilmente ser intubados o tamanho ideal do peixe é cerca de 1 g. Outra diferença com o método desenvolvido por Collymore et al é que os peixes são jejuou durante 48 h para certifique-se de que o trato gastrointestinal está vazio. O procedimento de intubação inteiro pode ser feito muito rapidamente (30 animais/h) por um operador e importante, o método é consistente entre os diferentes operadores4. O método de intubação é fácil de aprender e não requer muita prática para dominar.
O procedimento de dissecação intestino deve ser realizado adequadamente para obter amostras de boa qualidade para análises de qPCR e citometria, confocal. O passo fundamental neste momento é a dissecação do intestino inteiro; a seção posterior é frágil e fácil de perder. Uma vez que o intestino é dissecado, pode ser processado ainda mais para citometria (protocolo de 2 h), análise de qPCR (protocolo de 2h até isolamento de RNA total) ou microscopia confocal (1 h para ter pronto para cryosection de amostras). É muito importante controlar a orientação do intestino, especialmente para a microscopia confocal. Análise cytometry requer processamento rápido, e o procedimento não pode ser interrompido antes da conclusão. Considerando que, as amostras e isolamento de RNA prepararam para cryosection pode corretamente ser armazenadas e processadas em qualquer momento. Para citometria, amostras de boa qualidade sem detritos aglutinação da máquina podem ser isoladas com este método e análise rápida da presença de células fluorescentes pode ser executada facilmente em indivíduos. Monitoramento de qualidade de RNA mostrou que o RNA de alta qualidade pode ser isolada do intestino permitindo análise de peixe individual por qPCR. Finalmente, a preparação de cryosection para a microscopia confocal fornece importantes informações estruturais sobre a absorção de nanopartículas de proteína. Nossos métodos, assim, fornecem um modelo para testar a dinâmica da profilaxia oral ou outros compostos no intestino.
As limitações de nosso estudo são o tamanho do peixe, desde que não Testámos a administração em peixe menor do que 0,5 g e o uso de um anestésico químico para sedar os animais. Alguns autores usam água fria (0 – 4 ° C) para anestesiar o zebrafish18 , mas no contexto do bem-estar animal e limitações jurídicas europeias, decidimos que o MS-222 foi o método de escolha.
O zebrafish oferece muitas vantagens sobre outros sistemas modelo, incluindo um conjunto completo de dados de gene e as linhas transgênicas disponíveis. Para imunologistas, as linhas transgénicas (por exemplo, Tg mpx:GFP e mpeg1:GFP Tg) definem uma cena para a observação na vivo de células do sistema imunológico tais como os macrófagos e os neutrófilos19,20. Combinando a nossa análise a jusante e intubação oral com linhas transgénicas, poderia ser ideal para identificar os tipos de células que envolve a absorção, transporte e processamento de vacinas orais, nanopartículas e patógenos em peixes.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores declaram que não há interesses concorrentes existem.
Acknowledgments
Este trabalho foi apoiado por concessões do Ministério da ciência, espanhol AGAUR fundos para NR (AGL2015-65129-R MINECO/FEDER e 2014SGR-345 AGAUR) e Comissão Europeia. RT detém uma bolsa doutorandos de AGAUR (Espanha), JJ foi apoiada por uma bolsa de doutorado do Conselho da bolsa de China (China) e NR é suportado pelo programa de Ramón y Cajal (RYC-2010-06210, 2010, MINECO). Agradecemos o Dr. Torrealba por consultoria especializada na produção de proteína, s. Botelho da "Servei de Microscopia" e Dr. M. Costa desde o "Servei de Citometria" da Universitat Autònoma de Barcelona, para assistência técnica útil.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




