Summary
Протокол описывает интубирование взрослых данио рерио с биологическими; затем рассечения и подготовка кишечника цитометрии, конфокальная микроскопия и ПЦР. Этот метод позволяет администрации биоактивных соединений для мониторинга кишечного поглощения и местной иммунной стимул вызывали. Это актуально для тестирования кишечных динамика устных профилактики.
Abstract
Большинство возбудителей вторгнуться организмов через их слизистой оболочки. Это особенно верно в рыбе, как они постоянно подвергаются воздействию микробной богатые водной среды. Разработка эффективных методов для перорального Иммуностимуляторы или вакцин, которые активируют иммунную систему против инфекционных заболеваний, является весьма желательным. В разработке профилактических средств, хорошие экспериментальные модели необходимо проверить их эффективность. Здесь мы показываем, метод для устного интубации взрослых рыбок данио и набор процедур для вскрыть и подготовки кишечника цитометрии, confocal микроскопии и анализа количественных полимеразной цепной реакции (ПЦР). Этот протокол мы точно можно администрировать тома до 50 мкл рыбы весом примерно 1 g просто и быстро, без ущерба для животных. Этот метод позволяет нам исследовать поглощения прямых в vivo дневно помечены соединений на слизистой оболочке кишечника и иммуномодулирующим потенциала таких биопрепаратов на локальном сайте после интубации. Объединив течению методы, такие как проточной цитометрии, гистология, ПЦР и confocal микроскопии кишечника ткани, мы можем понять, как возможность пересечь кишечной слизистой барьеров, проходят через lamina propria, иммуностимуляторы или вакцины и достичь мышцы, оказывая влияние на кишечной слизистой иммунной системы. Модель может использоваться для проверки кандидата устные профилактики и систем доставки или местное действие любого перорального биоактивных соединений.
Introduction
Цель этой статьи заключается в подробно описать простой метод для устного интубации данио рерио, наряду с полезной связанные течению процедур. Устные интубации, используя данио рерио стала практической моделью в изучении динамики инфекционного заболевания, устные вакцины/иммуностимулирующим, потребление наркотиков/наночастиц и эффективность и кишечной слизистой иммунитета. Например в исследовании Mycobacterium marinum и peregrinum микобактерий инфекции1был использован данио рерио устные интубации. Lovmo и др. также успешно используется эта модель для доставки наночастиц и м. marinum желудочно кишечного тракта у взрослых рыбок данио2. Кроме того, Чэнь et al. используется данио рерио устные интубации чтобы показать, что наркотики инкапсулируется наночастиц, когда управляемые через желудочно кишечного тракта, были перевезены через барьер мозга крови3. Эти авторы провели интубации, основанную на методе gauvage, характеризуется Коллимор et al. 4 с некоторыми изменениями. Однако они не обеспечивают весьма подробный протокол описания процедуры устного интубации. Здесь мы представляем метод для устного интубации взрослых рыбок данио, опираясь на Коллимор et al. 4 далее мы включают подготовку intestine для соответствующих течению анализа цитометрии, конфокальная микроскопия и ПЦР.
Кишечника и особенно ее слизистой оболочки является первой линией обороны против инфекции и основной сайт питательных5. Когда клетки эпителия и антиген представляющих клеток в слизистой барьеры воспринимают сигналы опасности, запускается немедленно врожденный иммунный ответ. Далее,6,лимфоцитов T и B7устанавливается весьма специфический адаптивного иммунного ответа. Развитие устной вакцин является текущее направление в вакцинологии. Такие вакцины будет эффективным инструментом для защиты организма на открытых участках из-за конкретный ответ иммунных клеток в слизистой оболочки связанных лимфоидной ткани (MALT)8,9. В аквакультуре слизистой вакцины имеют очевидные преимущества, по сравнению с инъекционные вакцины. Они практичны для массовой вакцинации, менее трудоемкой, менее стрессовым для рыб и может назначаться молоди рыб. Тем не менее слизистой вакцин-кандидатов должны достичь второго сегмента кишки без денатурировано в устной окружающей среды. Они также должны пересекать слизистой барьеров для того, чтобы получить доступ к антиген представляющих клеток (БТР), чтобы побудить местных или системных ответов10. Таким образом тестирование слизистой поглощения, достигнутые устные антигены кандидат и систем их доставки, а также иммунный ответ вызвал, имеет важное значение в развитии устных вакцин.
В рамках биомедицинских разработка модели для тестирования биологических эффектов соединений после интубации в Оральный растущий интерес. Многие анатомические и физиологические функции кишечника консервируют между bilaterian линий, с11млекопитающих и костистых рыб. Эта модель устные интубации, подключенных к течению анализа может быть инструментом обеспечить понимание биологии человека, а также полигоном для biologics или других соединений в естественных условиях.
Протокол устное интубации могут выполняться одним оператором, например, успешно администрирование до 50 мкл суспензии наночастиц белок рыбы весом 1 g, с высокой выживаемости. Процедура проста в настройке и быстро; 30 рыб может быть интубированных в 1 час. Протокол для кишечника подготовки является ключом к обеспечению качества образцов клеток и тканей для последующего анализа. Приведены примеры течению результаты, которые показывают полезность протокола в получении данных, относящиеся к кишечного поглощения и изолировать РНК качества для ПЦР. Протокол будет весьма полезным для тех, кто нуждается подходящую модель для проверки динамика устных профилактики или других соединений в кишечнике.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Все экспериментальные процедуры с участием данио рерио (Danio рерио) были утверждены Комитетом по этике близлежащем автономном Университат де Барселона (CEEH номер 1582) по согласованию с международные руководящие принципы для исследований с участием животных ( EU 2010/63). Все эксперименты с живой данио рерио были исполнены на 26-28 ° C.
1. Подготовка оборудования для устного интубации
- Место примерно 1 см тонкой силиконовые трубки на 31 G Luer иглы блокировки для покрытия кончик иглы.
- Вырезать 10 мкл стерильного фильтра пипетки наконечник (около 2 см), тонкой конец и поместите его силиконовые трубки в ножнах. Убедитесь, что дозатор выходит за пределы кончика иглы во избежание ранения животного.
- Прикрепите иглы к 100 мкл Luer lock шприца.
Примечание: Всегда полоскать с этанолом и затем фосфат буфер солевой раствор (PBS, смотрите материалы) тщательно между процедурами.
2. решения
- Подготовка 150 мг/Л (для анестезии) или 300 мг/Л (для euthanasia) 3-аминобензоат этиловый метансульфонат (MS-222) раствора с воды из аквариума, где сохраняются у рыбок данио. Заполните небольшой резервуар с 1 Л раствора анестетика и держать его газированные.
- Заполнить еще один небольшой резервуар с 1 Л аквариумной воды без MS-222 для восстановления рыбы и держать его газированные.
- Сделайте 50 мл 10 x стерильный раствор ПБС.
- Для cytometry анализ/кишечные изоляция клетки Подготовьте достаточно свежие 0,15% коллагеназы типа IV решение по 1 мл на рыбу от Стоковый раствор или порошка в среде Дульбекко изменение орла (DMEM) с 1% v/v пенициллина и стрептомицина (см. материалы). Сделайте аликвоты (1 за рыбы) 1 мл 2 мл пробирок. Храните при 4 ° C до 30 мин перед шагом рассечение.
- Для фиксации конфокальная микроскопия/образца подготовить 50 мл свежего параформальдегида (PFA) 4% раствора в PBS или разморозить Стоковый раствор от-20 ° C Морозильник в зонта.
Предупреждение: PFA является токсичным. Пожалуйста, прочитайте паспорт безопасности материала перед началом работы с ним. Перчатки и защитные очки нужно носить и всегда оставить решения внутри зонта.
3. Подготовка флуоресцентные подвеска наночастиц
- Ярлык белка наночастиц с Эстер NHS Атто-488 (см. Таблицу материалов) или соответствующий Люминесцентную краску согласно инструкциям производителя.
- Ресуспензируйте наночастиц в буфере бикарбоната натрия 0,1 М на концентрация 2 мг/мл.
- Растворите Эстер NHS 488 Атто в Амин бесплатно диметилсульфоксида (ДМСО) на 2 мг/мл. Держите Алиготе 10 мкл для проверки эффективности маркировки (шаг 3,7-3,8).
- Смесь наночастиц и Эстер NHS 488 Атто в молярное соотношение 1:2 (белок: краска) при перемешивании в темноте.
- Спин вниз помечены наночастиц центрифугированием в 8000 x g 10 мин при комнатной температуре, удалить супернатант и сохранить его для проверки эффективности маркировки (шаг 3,7-3,8).
- Вымойте помечены наночастиц, resuspending в 1 мл 0,1 М буфера бикарбонат натрия, vortexing и закупорить вверх и вниз. Затем удалить супернатант центрифугированием в 8000 x g 10 мин при комнатной температуре. Повторите шаг 3,6 в 5 раз.
- Ресуспензируйте гранулы в 5 мл 0,1 М бикарбоната натрия буфера в 15 мл пластиковых пробирок и сделать аликвоты флуоресцентные наночастиц в 1,5 мл пробирок (30 аликвоты). Спин вниз на 8000 x g 10 мин при комнатной температуре, удалить супернатант и хранить при температуре-80 ° C защищенный от света.
-
Измерьте маркировки эффективности, с использованием microvolume спектрофотометром.
- Возьмите 1 мкл оригинальное решение Атто 488 от шагу 3.3 и далее развести его в ДМСО (например, 1:20 согласно соотношение объема). Это объем, используется для получения молярное соотношение белка наночастиц и 488 Атто микс на шаге 3.4.
- Взять 1 мкл сохраненных супернатант от маркировки реакции на шаге 3.5. Измерение поглощения (abs) = 501 Нм. Процент маркировки является:
(
- До эксперимента Подготовьте наночастиц подвеска на желаемой концентрации с помощью 1 x PBS решения.
4. данио рерио анестезии и устные интубации
- Быстрая рыба (> 0,5 г) по крайней мере за 48 часов до эксперимента, чтобы опорожнить кишечник.
- Переместите рыбы (12 рыбы) Экспериментальные танки (6 Л) одну ночь перед эксперимент, чтобы позволить акклиматизации12.
- Вихревой наночастиц раствор хорошо (например, 2500 об/мин и 30 s) и составить желаемый объем наночастиц подвеска (например, 20-50 мкл) в шприц, придает охраняемых иглы.
- Место рыбы в пористый 150 мг/Л MS-222 решение (см. раздел 2) до тех пор, пока они опускаться на дно бака и не реагировать щепотку хвостовой плавник; Этот процесс занимает менее 5 минут.
- Быстро передавать наркотизированных рыбы с чистой влажной пластиковый лоток, ориентироваться животное горизонтально к лицу иглы и сразу же начать устное интубации.
- Тщательно поддерживают рыба с одной стороны и открыть рот с другой стороны, используя защищенный иглы. Аккуратно вставьте иглу вниз пищевода до около 1 см от устья открытия.
Примечание: Оператор могут чувствовать незначительное сопротивление, когда в конце кончика пипетки прошло Гилл. Будьте осторожны, не угол записи иглы, слишком много которые могут перфорировать Гилл. - Медленно вводить наночастиц подвеска с рыбой. Убедитесь, что приостановление не течет наружу через жабры или рот.
- Аккуратно удалите иглу и место рыбы в резервуар восстановления (см. раздел 2). Восстановление обычно занимает в течение 1 мин.
- Проверьте рыбу тщательно для любого отклонения от нормы (например, кровотечение в жабры является признаком перфорации).
- Как только рыба выздоровели, вернуть их в экспериментальные танки.
5. данио рерио кишечника рассечение
- После определенного периода времени должность интубации (например, 5 ч или 24 ч), поместите рыбу с помощью сети в 300 мг/Л MS-222 решение для эвтаназии (см. раздел 2). Убедитесь, что крышечки перестает двигаться, и нет не рефлекс щепотку хвост. Пять минут обычно достаточно.
- Подобрать Усыпленных животных с чистой и поместите его на фильтровальной бумаге.
Примечание: Фильтровальная бумага очень полезен для удаления клея ткани вдоль кишечника. - Используя острые Рассечение ножницами, сделайте полу-круговой разрез от ануса до крышечки и открытого разреза с помощью тонкой пинцета. Вырезать обоих концах кишечника, вывезти всех внутренних органов и разместить их на фильтровальной бумаге.
Предупреждение: Работайте быстро, чтобы уменьшить клеточный метаболизм и смерти.
Примечание: в качестве альтернативы, удалите клейкие ткани в PBS и на льду. - Отделите кишечника от внутренних органов, убедившись в том сохранить свою ориентацию (предшествовавшие заднего сегмента кишечника) и растянуть его. Как правило шире, чем заднего сегмента переднего отрезка кишечника. Позаботьтесь, чтобы получить все кишки, когда вскрывали.
Примечание: Задний конец довольно тонкой и хрупкой в мелких рыб и могут разорвать, особенно в животных < 0,7 г. - Ролл кишечника на фильтровальной бумаге с помощью пинцета, чтобы отсоединить адгезивные ткани из кишечника.
- Перейти к подготовки кишечника для анализа различных течению (разделы 6, 7 и 8).
6. подготовка кишечника клетки для цитометрии
- Заранее подготовьте аликвоты коллагеназы 0,15% раствора (см. раздел 2.4).
Примечание: При комнатной температуре перед продолжением следует аликвоты. - Дополнительно: Продолжите с шага 5.5, щели открытым кишечника продольно и мыть с ПБС.
- С помощью пинцета, место intestine в 2-мл пробирку центрифуги, заполненные раствором коллагеназы 0,15%.
- Место труб на вертикальной Лаборатория ротатор за 1 ч при комнатной температуре в темноте.
- Место кишечника на стрейнер ячейки 100 мкм, поддерживает более 50 мл пластиковых пробирок. Разбейте intestine с плунжером шприц 5 мл, стирка 3 раза с ПБС, собирая поток через образец в центрифуге Тюбик 50 мл.
- Центрифуга для пластиковых пробирок 50 мл на 400 x g за 10 мин., на 4 ° C.
- Тщательно пипеткой покинуть большую часть супернатант при этом не теряя клетки, некоторые из которых могут быть связаны в слизи.
- Ресуспензируйте кишечных клетки в нижней части пластиковых пробирок с 500 мкл ПБС и держать на льду до cytometry анализ
- Фильтр образцы через 30 мкм фильтром клеток в 5 мл вокруг нижней трубы для цитометрии.
- Задать параметры (например, количество ячеек для анализа, региона интерес, напряжения и компенсации, выбор детекторов) на оборудовании цитометр (см. материалы).
- Сразу же анализируйте клетки на цитометр, следуя указаниям использования13.
7. подготовка кишечника Cryosections конфокальная микроскопия
- Заполните пластиковые формы (см. Таблицу материалы) до половины объема с оптимальной резки температуры (O.C.T.) соединение.
- Продолжая из шага 5.5 и сразу после вскрытия, тщательно место intestine в пластиковые плесень. Убедитесь, что кишечник полностью встроенный в O.C.T. комплексе. Если необходимо, добавьте еще O.C.T. составные прессформа.
Примечание: Рекомендуется разместить в кишечнике с формы «Z» в O.C.T. соединения легко следовать его естественной ориентации. - Место Прессформа на сухого льда до тех пор, пока она идет непрозрачный (меньше чем за минуту).
- Храните Прессформа на-80 ° C для длительного использования или процесса, непосредственно, используя следующую процедуру.
Примечание: Протокол может быть приостановлена здесь. - Ломтик замороженные кишке в 10 мкм секций или соответствующей толщины, с помощью криостата при-20 ° C.
- Собирайте кишки раздел с тонкой кистью на слайд.
- Погрузите слайд в 4% PFA для 15 мин при комнатной температуре исправить образца.
Предупреждение: PFA является токсичным. Пожалуйста, прочитайте паспорт безопасности материала перед началом работы с ним. Перчатки и защитные очки нужно носить и всегда оставить решения внутри зонта. - Вымойте слайд 3 раза с ПБС, 10 мин.
- Добавить каплю монтажа средних и поместите coverslip образца.
Примечание: Протокол может быть приостановлена здесь. - Наблюдать за образец под микроскопом конфокальный с соответствующим увеличением.
8. подготовка кишечника для ПЦР в реальном времени (RT-ПЦР)
- Продолжите с шага 5.5, поставьте intestine в криогенных пузырек и быстро заморозить intestine в жидком азоте и хранить при температуре-80 ° C до использования.
Примечание: Протокол может быть приостановлена здесь. - Для гомогенизации, добавить 200 мкл 2% (v/v) охлажденные 1-Thioglycerol/гомогенизации решение (см. Таблицу материалов) или альтернативных гомогенизации решение кишечника образца.
- Работать быстро, гомогенизировать кишечника образца на льду с лаборатории гомогенизатор на высокой скорости (устанавливается на 25 – 30 000 об/мин) до без видимых ткани остаются фрагменты. 3 раза за 5 s обычно достаточно.
- Изолировать РНК с помощью коммерческих комплект (см. Таблицу материалы) согласно инструкциям производителя14 или подходящий альтернативный метод. При необходимости Храните РНК в-80 ° C для долгосрочного использования.
Примечание: Протокол может быть приостановлена здесь. - Количественную оценку концентрации РНК с помощью спектрофотометра15 и оценить качество, с использованием РНК анализатор16.
- Подготовка 1 мкг или соответствующее количество cDNA, используя набор для синтеза cDNA согласно инструкциям производителя.
Примечание: Протокол может быть приостановлена здесь. Для ПЦР-анализа пожалуйста, следуйте руководящих MIQE17. - Дизайн пар соответствующие грунтовка для гена/s интерес.
- Выберите подходящую ссылку генов и проанализировать выражение каждого гена, RT-ПЦР обнаружение системы с использованием коммерческих комплект (см. материалы).
Примечание: например, добавьте 5 мкл SYBR зеленый Супермикс, 0,5 мкм грунты, 2.5 мкл разбавленного cDNA и 1,5 мкл воды в окончательный объем 10 мкл для каждой скважины ПЦР пластины.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Данио рерио (средний вес: 1,03 ± 0,16 g) смешанного пола были успешно интубированных с различными рекомбинантных белков наночастиц (бактериальный включение органы) с помощью нашего дома сделал устные интубации устройства (рис. 1). Мы успешно выполнять устные интубации и добились низкий средний процент смертности (6,8%) (Таблица 1). Данио рерио были либо интубированных с 30 мкл или 50 мкл суспензии наночастиц и смертность была рассчитана в течение 24 ч пост интубации. Эксперименты были проведены двумя операторами, R был меньше опыта работы с устные интубации данио рерио чем Дж. Результаты показали, что даже новый оператор может самостоятельно выполнять устные интубации экспериментировать и легко достичь более высокую выживаемость настоящим Протоколом. Из нашего опыта размер оптимальный рыбы 1 g, но мы успешно интубированных рыбы, как малые, как 0,5 г.
Чтобы лучше понять ли флуоресцентные наночастиц IBsTNFα (рекомбинантный цитокина белка наноструктурированных как включение тела) были доставлены данио рерио нашим методом и рассмотрен данио рерио кишечника или нет, мы провели цитометрии анализ. Наночастицы (50 мкл, 100 мкг/рыбы) PBS (управления) были перорально (путем интубации) данио рерио и кишечника был расчлененный в 5 ч. и 24 ч пост интубации. Всего кишечника клетки были подготовлены шаг 6 и проанализированы обнаружения сигнала выбросов флуоресценции. Представитель гистограмм флуоресцирования интенсивности и точка земельные доли люминесцентные клеток показаны на рисунке 2. Плотность люминесцентные клеток значительно выше в наночастиц интубированных группу, по сравнению с контрольной группой в 5 ч. и 24 ч (рисA). Проценты люминесцентные клеток значительно выше в 5 h (46,3%) и 24 ч (43,0%) наночастиц интубированных групп (рис. 2B).
Для дальнейшего изучения, какая часть кишечника слоя участвует в освоении наночастиц мы провели анализ confocal микроскопии. Наночастицы (20 мкг/рыба, 50 мкл) PBS (управления) были устно интубированных для данио рерио и кишечника был расчлененный в 5 h пост интубации. Кишечник разделы были подготовлены замороженные ткани методом по шаг 7 (рис. 3А). Конфокальный изображения флуоресцентных наночастиц в кишечнике показаны на рисунке 3B. Флуоресцентный наночастиц были найдены в кишечнике у рыбок данио. Мы наблюдали флуоресценции в эпителиальных клеток, lamina propria и мышечные клетки.
Чтобы проверить ли мы смогли извлечь высокое качество РНК нашего протокола, мы проанализировали РНК, извлеченные из кишечника с bioanalyzer (также упоминаемый как РНК анализатор здесь). Данио рерио были устно интубированных с PBS (50 мкл) или наночастиц (20 мкг/рыба, 50 мкл). Для извлечения РНК в интубации пост 24 h были расчленены кишечника. Мы выбрали семь образцов РНК для тестирования с помощью анализатора. Мы обнаружили, что всех испытанных образцов РНК имеют высокие РНК целостности чисел от 7,9 до 8,9 (рис. 4).
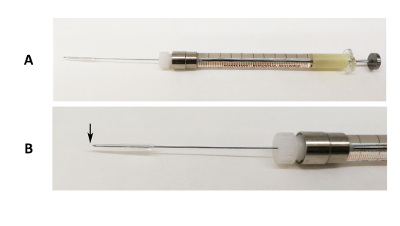
Рисунок 1 : Устройство устные интубации. (A) изображение 31 G Luer иглы блокировки зафиксировано на 100 мкл шприц с кремния трубки и пипетки наконечник конца охватывающих кончик иглы. (B) увеличенное изображение части иглы. Черная стрелка указывает, где конец наконечник пипетки превышает кончик иглы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Cytometry анализ флуоресцентные наночастиц в кишечнике данио рерио потока через устные интубации. Данио рерио относились с PBS или флуоресцентные IBsTNFα (100 мкг) для 5 h и 24 h, соответственно. (A) представитель гистограмм флуоресцирования интенсивности. (B) точка участков граф процент люминесцентные клеток. Каждый Зеленая точка представляет процент люминесцентные клеток в одной личности, n ≥4. Данные представляют собой среднее ± Среднеквадратичная ошибка среднего значения (SEM). Различия были проанализированы с помощью односторонней ANOVA. Существенные различия в отношении управления (**, p < 0.01) пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : Изображения анализа конфокальная микроскопия. Рыбы были устно интубированных с PBS или 20 мкг/рыба флуоресцентные наночастиц. Кишечника был расчлененный в 5 h пост интубации. (A) кишечника данио рерио, встроенные в OCT соединений. Кишечника был сделан с естественной ориентации фигуры «Z» (передний конец a:; p: заднего конца). (B) Confocal микроскопии изображений данио рерио кишечника. Белые стрелки показывают, что флуоресцентные наночастицы будут взяты в слизистой оболочке кишечника. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Анализатор РНК виртуальный гель изображением РНК, извлеченные из 7 данио рерио кишечника пробы пост интубации. Пример номер 1 и 2 групп PBS интубированных и образца номер 3-7 наночастиц интубированных групп. РНК целостности чисел (Рин) приведены в нижней части от 7,9 до 8,9. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Оператор | Объем | # рыбы интубированных | Средний вес (g ± SD) |
# Смертей | Смертность (%) |
| R | 30 МКЛ | 22 | 0,88 ± 0,14 | 3 | 13.6 |
| R | 30 МКЛ | 17 | 0.93 ± 0,19 | 0 | 0 |
| J | 50 МКЛ | 19 | 1.23 ± 0.31 | 1 | 5.2 |
| J | 50 МКЛ | 30 | 1,08 ± 0.40 | 2 | 6.6 |
| Итого | 88 | 1,03 ± 0,16 | 6 | 6.8 | |
| SD: стандартное отклонение от среднего значения | |||||
Таблица 1: Сравнение данио рерио смертности, вызванной двумя операторами, используя протокол. Код идентификации оператора, интубированных объем, количество рыбы и рыбы средний вес в граммах (г) показано.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Этот протокол является улучшение ранее описанные методики для устного интубации на Коллимор et al. 4 наши протокол подробно описывает метод устные интубации и включает в себя подготовку intestine вниз по течению анализа. Наш метод улучшает скорость манипуляции рыбы, позволяя один человек для выполнения весь протокол быстро, без много различий между операторами. Главное отличие нашего протокола с предыдущим является, что мы оцениваем успех эксперимента устные интубации не только путем наблюдения животного благосостояния (например, нет кровотечения) и для утечки жидкости осуществляется, но и путем проверки поглощение биоактивные наночастиц в кишечнике, используя течению анализа (цитометрии, конфокальная микроскопия и ПЦР). Мы покажем, что интубированных дневно обозначенные наночастиц были найдены в кишечнике.
С практической стороны, интубации оборудование дешево, точные и многоразовые: основной прибор изготовлен из многоразовые 100 мкл стекла (например, Гамильтон) шприца в сочетании с иглой 31 G с куском кремния на вершине. Вырежьте стерильные наконечник помещается над силиконовой трубки и может быть изменено для каждого индивидуального управления. Шприц для повторного использования, и тонкой иглой позволяет интубирование рыбки с высокая вероятность успеха. Кроме того кончик отрезока стерильные могут быть размещены непосредственно через иглу без силиконовой трубки, который позволяет легче быть сделаны в лаборатории оборудования интубации. Ведении биоактивные соединения хорошо видна, и правильное управление может контролироваться легко. Важнейшим шагом во время процедуры интубации является запись иглы. Важно, что игла не наклонен или вставлен слишком много, чтобы избежать перфорации жабры. Смертности с помощью этого метода является очень низким (около 7%) и зависит от размера рыбы. Гилл перфорация является наиболее распространенной причиной гибели рыбы, и когда это произойдет рыбы умирают в течение первого часа. Хотя рыбы 0,5 g может быть легко интубированных размер оптимальный рыбы составляет около 1 g. Еще одно различие с метод, разработанный Коллимор и др. Это, что рыба постились в течение 48 часов, чтобы убедиться, что желудочно-кишечного тракта является пустым. Весь интубации процедура может быть сделано очень быстро (30 животных/ч) одним оператором и, главное, метод согласуется между различными операторами4. Интубация метод прост в освоении и не требует много практики, чтобы мастер.
Кишечник рассечение процедура должна выполняться должным образом для получения хорошего качества образцов цитометрии, конфокальных и ПЦР анализа. Важнейшим шагом на данный момент является рассечение всего кишечника; Задняя секция является хрупкой и легко потерять. После рассекается кишечника, он может быть дополнительно обработаны цитометрии (2Н Протокола), ПЦР-анализ (2Н Протокола до полной изоляции RNA) или confocal микроскопии (1 h иметь образцы готовы к cryosection). Это очень важно отслеживать ориентации кишечника, особенно для confocal микроскопии. Cytometry анализ требует быстрой обработки, и процедура не может быть остановлена до завершения. В то время как РНК изоляции и образцы подготовлены для cryosection может быть должным образом хранятся и обрабатываются в любое время. Для цитометрии хорошее качество образцов без мусора, нанося удар машины могут быть изолированы с помощью этого метода и быстрый анализ на наличие люминесцентные клеток могут быть выполнены легко на отдельных лиц. Мониторинг качества РНК показали, что высокое качество РНК может быть изолирована от кишечника позволяет анализа отдельных рыб ПЦР. Наконец cryosection подготовку для confocal микроскопии предоставляет важную структурных информацию о наночастиц усвоение белков. Таким образом, наши методы обеспечивают модель для проверки динамика устных профилактики или других соединений в кишечнике.
Ограничения нашего исследования являются размер рыбы, поскольку мы не тест администрации в рыбу меньше, чем 0,5 г и использование химического анестетика для степенный животных. Некоторые авторы используют холодной воды (0-4 ° C) чтобы анестезировать данио рерио18 но в контексте благополучия животных и европейских юридических ограничений мы решили, что MS-222 является методом выбора.
Данио рерио предлагает много преимуществ над другими системами модели, включая полный набор данных генов и доступных трансгенных линий. Для иммунологов трансгенных линий (например, mpx:GFP ТГ и ТГ mpeg1:GFP) установить сцену для наблюдений в естественных условиях иммунных клеток, такие как макрофаги и нейтрофилы19,20. Объединяя наши устные интубации и ниже по течению анализа с трансгенными линиями, может быть идеальным для выявления типов клеток, включая поглощение, транспортировка и обработка устных вакцин, наночастиц и патогенов в рыбе.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы заявляют, что существуют не конкурирующие интересы.
Acknowledgments
Эта работа была поддержана грантов от испанского министерства науки, Европейской Комиссии и AGAUR средства для NR (AGL2015-65129-R МИНЕКО/ФЕДЕР и 2014SGR-345 AGAUR). RT имеет предварительно докторской стипендии от AGAUR (Испания), JJ было поддержано PhD стипендии от Совета стипендию Китай (Китай) и NR поддерживается программой Ramón y Cajal (Исправительные-2010-06210, МИНЕКО, 2010). Мы благодарим д-р Торреальба для консультации экспертов в производстве белка, н. «Барба» от «Обслуживание де Microscopia» и д-р м. Коста от «Обслуживание de Citometria» на близлежащем автономном Университат де Барселона полезной технической помощи.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




