Summary
MALT1 регулирует врожденного иммунитета, но как это происходит, остается нечетко. Мы использовали селективный ингибитор paracaspase MALT1 MLT-827 разгадать MALT1 вклад врожденной сигнализации вниз по течению от Толл подобные или C-типа Лектин подобные рецепторы, демонстрируя, что MALT1 регулирует производство миелоидного цитокинов и вниз по течению C-типа Лектин подобных рецепторов выборочно.
Abstract
Помимо своей функции в лимфоидных клетках, который рассматривался на многочисленные исследования, paracaspase MALT1 также играет важную роль в врожденной клеток по течению шаблон признание рецепторов. Лучше всего изучены являются Dectin-1 и Dectin-2 члены семьи Лектин подобный рецептор C-типа которые индуцируют SYK - и CARD9-зависимый сигнальный Каскад, ведущие к активации NF-κB, в зависимости от MALT1. С другой стороны, Толл подобные рецепторы (TLR), например TLR-4, распространять активацию NF-κB но сигнал через каскад MYD88/Ирак зависимых. Тем не менее ли MALT1 могли бы способствовать TLR-4 сигнализации остается неясным. Последние данные с MLT-827, мощным и селективный ингибитор MALT1 paracaspase деятельности, показывает, что TNF-производство по течению TLR-4 в миелоидных клеток человека независимо от MALT1, в отличие от TNF-производства Dectin-1, который является MALT1 зависимые. Здесь мы рассматривали избирательное участие MALT1 в распознавание зондирования дальше, используя разнообразные человека и мыши клеточных препаратов и стимуляции Dectin-1, MINCLE или TLR-4 дорожки. Мы также предоставили дополнительные идеи, исследуя цитокины ФНО-за и путем сравнения MLT-827 ингибитор SYK (Cpd11) и ингибитор IKK (AFN700). Коллективно, предоставленных данных дополнительных доказательств для MALT1-зависимость C-типа Лектин подобный рецептор — в отличие от сигнализации для TLR-сигнализации.
Introduction
Paracaspase активность MALT1 (слизистой оболочки связанных лимфоидной ткани лимфомы транслокации белка 1) было выявлено в 20081,2. С тех пор ряд исследований сообщали свой критический вклад антигена рецепторов ответы в лимфоцитах. Генетической модели в мышь также, как фармакология данных поддерживает ключевую роль в Т-клеток, Т-клеток зависит от аутоиммунных заболеваний и B-клеточной лимфомы параметры3,4. В лимфоцитах, MALT1 paracaspase Активация происходит после Ассамблеи CARD11-BCL10-MALT1 комплекс5, который инициируется антиген рецепторный проксимальной сигнализации вниз по течению от Т - и B-клеточный рецептор. Также имеется достаточно доказательств того, что подобный CARD9-BCL10-MALT1 комплекс имеет важное значение для распространения сигналов по течению C-типа Лектин подобные рецепторы (CLLR), например, Dectin-1, Dectin-2 и MINCLE в миелоидных клеток,6,7. Dectin-1 был изучен особенно хорошо, потому что этот путь имеет решающее значение для узла обороны против грибковых инфекций8,9. Последствия MALT1 в пути Толл подобный рецептор (TLR), однако, остается спорным10. Последние данные в миелоидных клеток человека исключил непосредственную роль для MALT1 paracaspase деятельность в сфере регулирования TNF-производства по течению TLR-411.
В настоящей работе мы использовали различные экспериментальные параметры и стимулирующие условия в человека и мыши миелоидных клеток зонд врожденной сигнальных путей, опираясь на конкретные фармакологические средства ингибиторы и измерение цитокиновой продукции.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Эксперименты были проведены согласно руководящих принципов и стандартов человека Комитета по этике исследований Новартис.
1. Подготовка мононуклеаров периферической крови (получения) от человека Баффи пальто
Примечание: Мы получили Баффи пальто от здоровых добровольцев через один день после сбора, в мешках по 50 мл. Они были предусмотренных осознанного согласия и собранные Interregionale Blutspende Schweizeriches Rotes Kreuz. Мы обрабатывать их с помощью процедуры ниже, при комнатной температуре, если не указано иное.
- Подготовьте стерильных и чистого пара ножницы и стакан емкостью 1 Л с пластиковый пакет (под пластинки потока).
- Передача Баффи пальто в стакан и тщательно открыть его с помощью ножниц.
- С помощью пипетки 25 мл, добавить 100 мл фосфат амортизированное saline буфера/Этилендиаминтетрауксусная кислота (PBS/ЭДТА: PBS 1 x рН 7,4, содержащие не CaCl2 и не MgCl2, дополненные 2 мм ЭДТА рН 8,0).
Примечание: Используя тот же Пипетка и после медленно вверх и вниз дозирование раствора, обойтись 25 мл разбавленной Баффи пальто в 6 конических пробирок по 50 мл, предварительно заполнены 15 мл на основе полисахаридов плотность градиента. - Центрифуга 20 мин на 800 x g с умеренной ускорение (устанавливается в 4 из 9) и без тормозов для разделения клеток, основанные на их плотность.
Примечание: После центрифугирования три слоя будет видна; гранулы, содержащие красных кровяных клеток и гранулоцитов, верхний слой из плазмы, и между белыми кольцо, содержащие мононуклеаров периферической крови (получения). - Урожай КСДОР кольцо, с помощью пипетки 10 мл и передачи новых 50 мл трубки.
Примечание: Два-три 50 мл трубки обычно требуются в Баффи пальто. На этом этапе некоторые плазмы скорее всего загрязняет собранных репликацию, которые должны иметь никакого влияния на последующие обогащения шаги. - Топ 50 мл каждая трубка с помощью PBS/ЭДТА и провести три последовательных автомойки с уменьшением время центрифугирования и скорость (15 мин на 520 x g, 10 мин на 330 x g, 8 минут при 150 x g).
Примечание: На каждом шаге, супернатанта заливается покинуть в контейнере жидких отходов и Пелле клетки высокомобильна в 50 мл PBS/ЭДТА (гранулы могут объединяться после первой стирки). - После окончательной стирки, Ресуспензируйте гранулы в 25 мл ледяной литического буфера (см. Таблицу материалы) лизируют красные кровяные клетки осмотическим давлением.
- Инкубировать до тех пор, пока решение становится ясно (≤5 мин при комнатной температуре).
- Остановите реакции, добавив 25 мл разделения буфера (PBS 1 x рН 7,4, содержащие не CaCl2 и не MgCl2, с 2% тепло инактивированная плода бычьим сывороточным (ФБС) и 1 мм ЭДТА рН 8,0).
- Промойте еще раз на 150 x g 8 мин.
Примечание: На этом этапе получения может использоваться как основная населения (см. шаг 3: процедуры получения и моноцитов и стимулирующие условия) или обработаны Моноцит обогащения (см. шаг 2: подготовка моноцитов от получения), или замороженных вниз для последующего использования (см. шаг 5: Моноциты и получения процедуры замораживания/оттаивания).
2. Подготовка моноциты от получения
- Ресуспензируйте репликацию, полученные на шаге 1.10 в буфере разделения и считать их достичь 5 x 10-7кл/мл.
- Перенесите суспензию клеток в 14 мл конические пластиковых пробирок с крышкой.
- Добавьте 50 мкл антител обогащения Моноцит коктейль на мл суспензии клеток, вихрь и инкубировать 10 мин при 4 ° C.
- Добавьте 50 мкл Моноцит обогащения шариков / мл клеток.
Примечание: Бисер должен быть тщательно vortexed для обеспечения однородности подвески. - После добавления бусы, вскоре вихревой суспензию клеток и инкубировать 5 мин при 4 ° C.
- Промывайте в верхней части трубки с разделения буфера до тех пор, пока трубка заполняется до 10 мл.
- Медленно mix решение, закупорить вверх и вниз.
- Место труб без крышки в магнит разделения.
- Инкубируйте 2,5 мин при комнатной температуре.
- Медленно Налейте 15 мл конические пластиковых пробирок.
- На данном этапе, напрямую использовать моноцитов (см. шаг 3: процедуры получения и моноцитов и стимулирующие условия) или их дифференцироваться в яmmature Monocyte производные Dendritic Cells (iMoDCs) (см. шаг 4), или заморозить их вниз для последующего использования (см. шаг 5).
3. репликацию и моноциты лечения и стимулирующие условия
- Подсчитать ячейки и развести их в питательную среду (Розвелл парк Мемориальный институт среднего (RPMI) 10% FBS 1 мм пируват натрия + 100 ед/мл пенициллин стрептомицина (Pen/Strep) + 5 мкм β-меркаптоэтанол), вплоть до 1,25 х 104 клетки/хорошо.
- Распространите 30 мкл суспензии клеток за хорошо 384-ну плиты.
- 15 мкл 4 x концентрированной составные решения и предварительно инкубировать 1 час при 37 ° C, 5% CO2.
- Добавить липополисахарида (LPS) до конечной концентрации 10 нг/мл, или обедненного zymosan (DZ) до конечной концентрации 100 мкг/мл или держать в простой среде.
- Инкубируйте на ночь при 37 ° C, 5% CO2.
- Возьмите 10 мкл супернатант для измерения уровней выделяется ФНО a (см. шаг 7: измерение Cytokines и жизнеспособности).
4. моноциты дифференцировку в iMoDCs и стимулирующие условия
- Граф (обогащенный на шаге 2) моноциты и центрифуги суспензию клеток в 520 x g за 5 мин.
- Пипетка с супернатант и добавить питательной среды (RPMI + 10% FBS для получения окончательного клеток подвеска 0,4 х 106 клеток/мл.
- Добавьте 80 нг/мл рекомбинантный человеческий Ил-4 + 100 нг/мл ГМ-КСФ.
- Отказаться от 5 мл суспензии клеток в колодец в пластине 6-хорошо.
- Инкубируйте 7 дней при 37 ° C, 5% CO2.
- На 7 день урожай клетки, закупорить осторожно, чтобы избежать их активации.
- Центрифуга на 520 x g за 5 мин.
- Вакуумные аспирата и Ресуспензируйте в 50 мл питательной среды без факторов роста.
- Центрифуга на 520 x g 5 мин и Ресуспензируйте на 1 х 106 клеток/мл в культурной среде.
- Отказаться от 100 мкл суспензии клеток (105 клеток) за хорошо 96-луночных плоское дно плиты.
- Предварительно incubate, за 1 ч при 37 ° C после добавления 50 мкл 4 x сосредоточены составные решения, подготовленные, как описано на шаге 8: соединений подготовки.
- 50 мкл раздражителей (4 x сосредоточены), подготовленный, как описано на шаге 9.
- Инкубировать 24 ч при 37 ° C.
- Смешайте каждой скважины и передачи клетки и супернатант (SN) в 96-луночных V-днище.
- Спин вниз на 475 x g за 5 мин.
- Передача супернатант в новую плиту 96-луночных плоское дно, уплотнение и заморозить при температуре-20 ° C до дальнейшего использования.
5. моноциты и получения процедуры замораживания/оттаивания
-
Замораживание
- Спин вниз КСДОР или Моноцит подготовки клетки на 520 x g за 5 мин.
- Вакуум аспирацию супернатант и Ресуспензируйте клетки в замораживания среднего в 1 x 10-7 кл/мл.
- Отказаться от 1 мл суспензии клеток в cryotubes, передать определенное устройство охлаждения трубы (см. таблицу материалов) и поместите его на-80 ° C.
-
Оттаивания
- Размораживание cryotube и быстро перевести его содержание в 15 мл конические пластиковых пробирок, содержащих 9 мл питательной среды.
- Центрифуга на 520 x g за 5 мин.
- Вакуумные аспирата супернатант и Ресуспензируйте Пелле клеток в 5 мл питательной среды. Клетки теперь готовы для дальнейшей обработки экспериментальных.
6. мыши селезенки клеток подготовка и лечение
Примечание: Мы провели жертвоприношения животных согласно руководящих принципов и стандартов Организации благосостояния животных Новартис. Исследования были утверждены Комитетом по этике региональной государственной власти (высоким судом kantonales будет Veterinäramt der Stadt Базель). Мы приносили в жертву животных, изофлюрановая чрезмерное воздействие, с все усилия, чтобы свести к минимуму страдания.
- Урожай селезенки и отделить ткани с помощью трубки оснащены устройством Мясорубки механические ткани и заполнены с 5 мл холодного RPMI среды.
- Используйте программу селезенки диссоциации машины для измельчения органов.
- Фильтр клетки через стрейнер клеток Нейлон 100 мм.
- Перенесите подвеска в 50 мл трубки и центрифуги на 4 ° C на 10 мин на 320 x g.
- Вакуумные аспирата супернатанта, Ресуспензируйте Пелле клеток в 3 мл ледяной литического буфера и проинкубируйте ≤2 мин на льду.
- Остановите лизиса, добавляя 7 мл RPMI среды.
- Фильтр снова через стрейнер клеток Нейлон 100 мкм.
- Спин вниз суспензию клеток на 330 x g 10 мин при 4 ° C.
- Вакуумные аспирата супернатант и Ресуспензируйте клетки на 11 x 106 клеток/мл в полной средней (RPMI дополнена 10% FBS, 100 ед/мл перо/шаг и β-меркаптоэтанол 5 мкм).
- Пластина 1 х 106 клеток/колодец (90 мкл) в 96-луночных пластине (плоское дно).
- Добавить 5 мкл 20 x сосредоточены составные решения, предварительно разводят в среде RPMI, как описано в шаге 8.3: последовательный разрежения для мышиных селезенки клеток.
- Инкубируйте 30 минут при 37 ° C, 5% CO2.
- Добавьте 5 мкл 20 x сосредоточены DZ (конечная концентрация 30 мкг/мл) или 20 x сосредоточены LPS + ИФН g (TLR-4) (конечная концентрация 1 мкм ПЛАСТИНОК и ИФН g 10 нг/мл).
- Инкубируйте на ночь при 37 ° C, 5% CO2.
- Центрифуга на 330 x g за 10 мин.
- Передача supernatants в новой пластинки, уплотнение и заморозить при температуре-20 ° C до дальнейшего использования.
7. цитокинов и измерения жизнеспособности
-
Измерение человеческого ФНО a HTRF (однородных время решена флуоресценции)
Примечание: Протокол следовали рекомендациям поставщика, кратко излагаются ниже.- Смешайте 1 объем восстановленный реагента (анти-ФНО a-cryptate и анти ФНО a-XL665) с 19 томов, восстановление буфера (50 мм фосфатного буфера рН 7,0, 0,8 М калия фторид (КФ), 0,2% бычьим сывороточным альбумином (БСА)).
- Смешайте два решения для готовых антител 1:1 до дозирования реагентов.
- Лунки 10 мкл supernatants из шага 3.6 белый 384-ну плиты.
- Лунки 10 мкл антител смеси.
- Крышка с герметик и Инкубируйте на 4 ° C на ночь.
- Читать пластины на Считыватель микропланшетов (50 – 200 flash).
- Человеческого измерения Ил-23 по HTRF (однородных время решена флуоресценции)
Примечание: Протокол следовали рекомендациям поставщика, кратко излагаются ниже.- Смешайте один объем восстановленный реагента (анти-IL-23-cryptate антитела и анти IL-23 D2-антитела) с 19 томов обнаружения буфера #3.
- Смешайте два решения для готовых антител 1:1 до дозирования реагентов.
- Лунки 10 мкл supernatants из шага 3.6 белый 384-ну плиты.
- Лунки 10 мкл антител смеси.
- Крышка с герметик и Инкубируйте на 4 ° C на ночь.
- Читать пластины на Считыватель микропланшетов (50 – 200 Нм flash).
-
Человеческий ИЛ-6, IL-8, ИЛ 1β и ФНО α измерения electrochemiluminescence
Примечание: Все образцы были разбавлять на 1/150 в разбавителя 2 (первый Разбавление: 10 мкл в 150 мкл, то 20 мкл в 180 мкл). Протокол следовали рекомендациям поставщика:- Развести образцы и стандартные разбавителя 2.
- Перейти к размыванию стандарта в разбавителя 2 с помощью разрежения серийный сложить 1/4.
- Мыть тарелки три раза с буфером мыть.
- Лунки 50 мкл образцов или стандарт в колодец.
- Проинкубируйте втечение 2 ч при комнатной температуре под агитации.
- Вымойте тарелку в четыре раза с PBS + 0,05% Полисорбат 20.
- 25 мкл обнаружения антител (60 мкл каждого антитела для 3 мл окончательный), в 3 разбавителя.
- Проинкубируйте втечение 2 ч при комнатной температуре под агитации.
- Вымойте тарелку в четыре раза с PBS + 0,05% Полисорбат 20.
- Избежать пузырей, 150 мкл на хорошо буфера чтения (на основе трис буфер, содержащий tripropylamine, разбавленный 2 x в ddH20) как сопредседатель реагент для света поколения в electrochemiluminescence иммуноанализа.
- Читайте пластину (без задержки) на мультиплексной пластины читателя.
-
Мышь ФНО a измерение с помощью ИФА после поставщика протокол
- Разбавьте супернатант 1:1 в Пробирной разбавителя (готов к использованию-белковые буфера).
- Подготовьте реагентов, образцов и стандартных растворов, как описано в комплекте. Добавьте 50 мкл пробирного разбавителя в каждой скважине.
- Добавьте 50 мкл стандарт, управления или образец в колодец.
- Смесь осторожно нажав кадра пластину за 1 мин.
- Обложка с предоставленного клейкой лентой и проинкубируйте втечение 2 ч при комнатной температуре.
- Аспирационная каждый хорошо и мыть с 400 мкл/хорошо (повторить этот шаг пять раз в общей сложности).
- После окончательного вымыть удалите любые оставшиеся буфера мытья, аспирационных.
- Инвертировать пластину и промокните против чистого бумажные полотенца.
- Добавьте 100 мкл конъюгата мыши ФНО α в каждой скважине. Крышка с новой клейкой лентой.
- Проинкубируйте втечение 2 ч при комнатной температуре.
- Повторите стремление/мыть как шаг 7.4.4.
- Добавить 100 мкл раствора субстрата в каждой скважине и Инкубируйте 30 мин при комнатной температуре в защищенном от света.
- Добавьте 100 мкл раствора разбавленной соляной кислотой (остановка раствор) в каждой скважине. Аккуратно нажмите пластину для обеспечения тщательного перемешивания.
- Измеряют оптическую плотность на 450 Нм (с длиной волны коррекции на 560 Нм) с использованием Считыватель микропланшетов (чтобы быть сделано в течение 30 мин).
- Разбавьте супернатант 1:1 в Пробирной разбавителя (готов к использованию-белковые буфера).
-
Жизнеспособность клеток
- После удаления supernatants из КСДОР или Моноцит препаратов, оцените жизнеспособность клеток, используя готовые для использования резазурина решения (показатель кислотно) добавлены непосредственно в суспензию клеток до конечной концентрации 10%.
- Инкубируйте 1-2 ч при 37 ° C, 5% CO2.
- Читайте флуоресценции в 590 Нм (возбуждения 540 Нм) с помощью Считыватель микропланшетов.
8. сложные подготовка
-
Серийный разрежения для iMoDCs
- Разбавить MLT-827 Стоковый раствор (10 мм диметилсульфоксида (ДМСО) в среду до 8 мкм на одном дыхании (4 x концентрированный).
- Выполнение шести шаг 1:5 последовательных разрежения, используя средний + 0,08% ДМСО. Используйте же средний + 0,08% ДМСО решение для состояния автомобиля (нет соединения).
-
Разовая доза, тестирование на iMoDCs
- Разбавить MLT-827, AFN700 и Cpd11 акций решений в среду до 4 мкм в один идти (4 x концентрированный).
-
Серийный разрежения для мышиных селезенки клетки
- Разбавляют раствором MLT-827 10 мкм (полученные от 10 мм раствор после одной идти разрежения в среде) до 0,01 мкм, с 0,1% концентрации ДМСО конец.
- Для разбавления шаги принимать 2 мкл каждого разведения, добавить мкл 38 RPMI и пипетки 5 мкл в колодец.
Примечание: Все процедуры выполняются в трех экземплярах.
9. стимулы подготовка
-
Обедненного zymosan (DZ)
- Добавить 2 мл стерильной воды свободной эндотоксина в 10 мг DZ.
- Вортекс для гомогенизации Стоковый раствор, вихрь также до каждого использования.
- Аликвота аликвоты решения и хранить при температуре-20 ° C.
-
Трегалоза-6,6-dibehenate (БТ)
- Добавьте 100 мкл ДМСО в 1 мг БТ, тепла при 60 ° C в водяной бане для 15-30 s.
- Вортекс и немедленно 900 мкл стерильных PBS, вихрь снова.
- Тепла на 10-15 мин при 60 ° C и гомогенизации vortexing перед каждым использованием.
- Держите решение при 4 ° C.
- Выполняйте серийных разведений и разовая доза подготовки для MLT-827 соединения.
Примечание: Потому что БТ должен быть подготовлен в ДМСО, конечная концентрация ДМСО 1% присутствует во время стимуляции клеток.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
В миелоидных клеток MALT1 реле сигналов по течению активации нескольких C-типа Лектин подобные рецепторы, такие как Dectin-1, Dectin-2 и MINCLE6. Эти пути полагаются на мотив содержащих рецепторов (Подол) ИТПМ (например, Dectin-1) или ИТПМ мотив содержащих Сопредседатель рецепторов (например, FcRγ, Dectin-2 и MINCLE), набирать и активировать SYK киназы (рис. 1). Это приводит к активации протеин киназы C изоформы, а именно PKCδ, которая фосфорилирует CARD9, тем самым вызывая комплекс формирования CARD9/BCL10/MALT1 и набор TRAF6 для активации течению NF-κB12. Напротив путь TLR-4 новобранцев TRAF6 в MALT1-независимые, но MYD88/Ирак-обнаруживавшие для NF-κB активации (рис. 1). Доказательств для этого дифференциального участия MALT1 был получен с помощью генетических модели MALT1 дефицита, а также медикаментозное лечение с пептидные активного сайта ингибитор z-VRPR-fmk11,,1314.
Мы использовали недавно сообщили мощным и селективный ингибитор MALT1 MLT-82715 и спросил, если это соединение будет регулировать TNF-производство по течению C тип Лектин как и Толл подобные рецепторы, соответственно. Человека репликацию и клеток селезенки мыши были стимулируется с обедненного zymosan (DZ, известный агониста Dectin-1) или липополисахарида (LPS, известный агонист TLR-4) и мы измерить TNF-релиз в культуре супернатанта после 20 h. Как человека, так и мышь анализы MLT-827 выборочно блокируются TNF-производство управляемый путь Dectin-1, но не путь TLR-4 (рис. 2). Мы получили аналогичные данные по инкубации с z-VRPR-fmk соединения (дополнительный рис. 1).
Чтобы получить путь идеи, мы провели дальнейшие эксперименты в человека моноцитов и незрелых моноцитов производные дендритных клеток (iMoDCs), сравнивая влияние MLT-827, ингибитор Cpd11 SYK16 и что IKK ингибитора AFN70015 . В моноциты стимулируется с ПЛАСТИНОК, производство ФНО α почти полностью был отменен, AFN700, но не был чувствителен к Cpd11 (Рисунок 3А), которая согласуется с зависимостей/независимость TLR-4 пути на NF-κB/SYK активность, соответственно () Смотрите Рисунок 1). Напротив, производство ФНО α, движимый Dectin-1 в iMoDCs отображается чувствительность к Cpd11 помимо чувствительность MLT-827 и AFN700 (рисунок 3B, дополнительный Рисунок 2), предоставление дополнительных доказательств для участия SYK/CBM сигнализации Каскад в пути Dectin-1 (рис. 1). Примечательно, производство IL-1, Ил-6 и IL-23 после стимуляции Dectin-1 был также чувствителен к трем ингибиторы, изъявив тем самым регулирующих механизмов, аналогичных TNF-. Однако ограниченное воздействие трех соединений на Ил-8 производство предлагает собственный регулирующий механизм для этого цитокина (рисунок 3B, дополняющий Рисунок 2).
В дополнение к Dectin-1, другие CLLRs, как Dectin-2 и MINCLE, функция через стимулирование CARD9 signalosome7. Поэтому мы тестировали MLT-827 в iMoDCs с MINCLE агонист Трегалоза-6,6-dibehenate (TBD). Повышение концентрации TBD выше 50 мкг/мл привело к производству TNF-, Ил-6 и IL-1, который опирался на MALT1 paracaspase деятельности, как видно из блокирующий эффект MLT-827 (рис. 4A). Согласованные результаты были получены при сложной iMoDCs с увеличением концентрации DZ стимулировать Dectin-1 (Рисунок 4B).
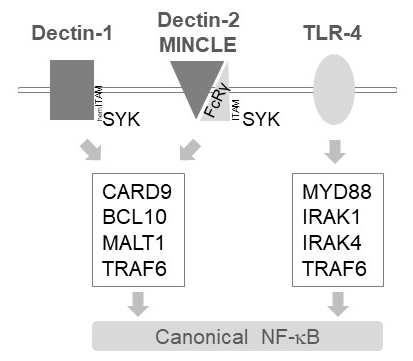
Рисунок 1: NF-κB сигнализации вниз по течению от Dectin-1, MINCLE и TLR-4. Карикатура изображает ключевых особенностей канонических NF-κB активации пути вниз по течению Dectin-1, Dectin-2, MINCLE или TLR-4 в миелоидных клеток. HemITAM содержащих Dectin-1 рецепторов17 непосредственно могут заниматься SYK стимулировать комплекс формирования CBM (CARD9/BCL10/MALT1), приводит к TRAF6-зависимых активацию NF-κB. Лектин подобные рецепторы других C-тип Dectin-2 или MINCLE нужно набирать ИТПМ содержащих FcRγ цепь CBM и активировать NF-κB. Рецепторы TLR-4 использовать другой механизм для активации NF-κB, опираясь на MYD88 и IRAK1/IRAK4 киназы, вверх по течению от TRAF6.

Рисунок 2: Dectin-1 сигналы через MALT1 для производства ФНО α в человека и клетки мыши. (A) человека репликацию данных как Унтеррайнер et al., 2017 (рисунок 2A)11. С 1 нг/мл ПЛАСТИНОК (TLR-4 агонист) или 100 мкг/мл DZ (агонист Dectin-1) для 20 h присутствии градуированных концентрации MLT-827 были стимулировали человека репликацию. TNF-выпущена в надосадке была количественно оценена по HTRF. (B) мыши клеток селезенки относились с концентрацией диапазон от MLT-827 30 мин и впоследствии стимулировало с 30 мкг/мл, DZ или 1 мкг/мл LPS + 10 нг/мл ИФН - для 18 h. ФНО α в клеточной культуре супернатанта измерялась ELISA. Один из двух экспериментов с аналогичными результатами показано, как средства ± SEM трех измерений.

Рисунок 3: IKK - или SYK-зависимость цитокиновой продукции по течению TLR-4 и Dectin-1. (A) человека моноциты были предварительно обработаны за 1 час с MLT-827 (1 мкм), Cpd11 (1 мкм), или AFN700 (3 мкм) или транспортного средства (ДМСО). Клетки были стимулировали с 10 нг/мл ПЛАСТИНОК для 20 h и TNF-в надосадке была количественно оценена по HTRF. (B) ФНО α, ИЛ-1β, IL-6, производства Ил-23 и ИЛ-8 человека моноцитов производные дендритных клеток (iMoDCs) стимулируется за 24 ч с DZ (100 мкг/мл) после предварительной инкубации 1 ч с MLT-827, Cpd11, AFN700 (все в 1 мкм) или ДМСО. Уровни цитокина в ДМСО лечение образцы были установлены на 100%. Данные средства ± SD трех измерений и представитель трех независимых экспериментов. * P < 0,05; ** P < 0,01; P < 0,001, непарные двух Стьюдента t-тест.

Рисунок 4: C тип Лектин как зависимой цитокина производство, iMoDCs. ФНО α, ИЛ-1β и IL-6 производства iMoDCs стимулируется за 24 ч с MINCLE агонист Трегалоза-6,6-dibehenate (БТ, 100 мкг/мл) (A) или с Dectin-1 агонист DZ (100 мкг/мл) (B) после предварительной инкубации 1 ч с MLT-827 (1 мкм) или ДМСО. Данные средства ± SD трех измерений и представитель трех независимых экспериментов.
Дополнительный файл 1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительного файла 3. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
В этой работе мы использовали простой экспериментальной установки для изучения сигнальных путей в человека и врожденной клетки мыши и допрашивать их зависимость MALT1 протеолитической функции. Расширение на предыдущей работе11, наши исследования показали, что MALT1 paracaspase деятельности контролирует тип C Лектин подобный рецептор индуцированной цитокина производства, включая ФНО α. В противоположность этому индуцированных TLR-4 ФНО α независима от MALT1 в обоих видов. Вместе эти данные подтверждены ключа и селективного вклад МУП/MALT1 signalosome вниз по течению C-типа Лектин подобных рецепторов, который был открыт ранее исследования6,12,18.
Ли ясно независимость сигналов на MALT1 в миелоидных клеток TLR-4 применяется к другой ячейке типы предстоит изучить. К примеру в-лимфоцитов, TLR сигнализации был ранее виден вносить B-клетки активации по течению B-клетки антигена рецепторов19. В самом деле мы неопубликованные доказательства того, что TLR-4 стимулировали человека и чувствительность клеток мыши B вывести MLT-827. Таким образом дальнейшее механистический идеи по течению B-клеточный рецептор будет ценным. В этом контексте недавнее исследование в B-клеточной лимфомы представила доказательства для кластеризации сигнальных путей по течению B-клеточный рецептор и рецептора TLR920. TRAF6, который выступает в качестве посредника для NF-κB активации в B-клеточный рецептор и TLR пути, может быть точкой перекрестных помех, которые могли бы объяснить чувствительность обоих путей MALT1 протеазы ингибирование. И наоборот TRAF6 является также общим течению игрок CLLRs и TLRs для индукции NF-κB, но эти два пути не представляется перекрестных образом зависящих от paracaspase MALT1 в миелоидных клеток.
Эта работа сосредоточена на производство цитокинов, которая обеспечивает легко индикация для сигнальных путей и могут быть легко реализованы для составных профилирования. Она подчеркнула важное значение избирательного и мощным ингибиторов MALT1 распутыванию MALT1 биологии. Получения дополнительной идеи механистического потребует дополнительной работы и развития более проксимальном анализов, например, характеризовать субстратов MALT1 участвующих в врожденной сигнализации регулирования.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не имеют ничего сообщать.
Acknowledgments
Мы благодарим Elsevier для их разрешения (номер лицензии 4334770630127) воспроизвести здесь рисунок 2A от Унтеррайнер и др. (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



