Summary
MALT1 ينظم الحصانة الفطرية ولكن كيف يحدث هذا وتظل غير محددة. كنا مثبط باراكاسباسي MALT1 انتقائية MLT-827 لكشف مساهمة MALT1 الفطرية مما يشير إلى المتلقين للمعلومات من مستقبلات يكتين مثل مثل عدد القتلى أو نوع ج، مما يدل على أن MALT1 وينظم إنتاج السيتوكينات النقوي، والمتلقين للمعلومات ج-نوع يكتين مثل مستقبلات، بشكل انتقائي.
Abstract
وإلى جانب وظيفته في الخلايا اللمفاوية، وقد عالج العديد من الدراسات، باراكاسباسي MALT1 أيضا دوراً هاما في الخلايا الفطرية المصب مستقبلات التعرف على نمط. أفضل درس من أعضاء الأسرة يكتين مثل مستقبلات ج من نوع ديكتين-1 وديكتين-2 التي تحفز SYK و CARD9-تعتمد على إشارات تتالي مما يؤدي إلى تنشيط NF-κB، بطريقة تعتمد على MALT1. على النقيض من ذلك، مثل عدد القتلى مستقبلات (TLR)، مثل TLR-4، نشر التنشيط NF-κB لكن الإشارات عبر تتالي MYD88/IRAK-تعتمد على. ومع ذلك، ظلت عما إذا كان MALT1 قد تسهم في TLR-4 إشارات غير واضحة. تشير الأدلة الأخيرة مع MLT-827، مثبط قوية والانتقائي للنشاط باراكاسباسي MALT1، إلى أن إنتاج تنف المصب TLR-4 في الخلايا البشرية النقوي مستقلة عن MALT1، بدلاً من إنتاج تنف المصب ديكتين-1، وهو MALT1 يعتمد. هنا، نحن معالجة انتقائية مشاركة MALT1 في التعرف على نمط الاستشعار كذلك، باستخدام مجموعة متنوعة من الإنسان والاستعدادات الخلوية الماوس، والحث على مسارات ديكتين-1، مينكلي أو TLR-4. كما قدمنا أفكاراً إضافية باستكشاف السيتوكينات بعدها تنف-، وعن طريق مقارنة MLT 827 مثبط SYK (Cpd11) ومثبط لايك (AFN700). جماعياً، البيانات المقدمة كذلك الأدلة على MALT1-تبعية مستقبلات يكتين مثل نوع ج – يشير في المقابل إلى إشارات TLR.
Introduction
نشاط باراكاسباسي MALT1 (المرتبطة بالغشاء المخاطي الأنسجة اللمفاوية سرطان الغدد الليمفاوية إزفاء بروتين 1) قد كشف في 20081،2. ومنذ ذلك الحين، سجلت عددا من الدراسات مساهمتها الحاسمة في مستضد مستقبلات الردود في الخلايا الليمفاوية. نماذج الوراثية في الماوس، فضلا عن دعم بيانات الصيدلة دوراً رئيسيا في خلايا تي تي خلية تعتمد المناعة الذاتية وفي ب-الخلية اللمفاوية إعدادات3،4. في الخلايا الليمفاوية، يحدث التنشيط باراكاسباسي MALT1 لدى الجمعية من CARD11-BCL10-MALT1 مجمع5، التي يتم تشغيلها بواسطة إشارات مستقبلات مستضد الدانية المتلقين للمعلومات من مستقبلات خلية تي أو ب. وهناك أيضا أدلة كثيرة على أن مجمع CARD9-BCL10-MALT1 مماثلة أمر مهم لنشر إشارات المصب ج-نوع يكتين مثل مستقبلات (لشانون)، مثل، ديكتين-1 وديكتين-2 مينكلي في النقوي الخلايا6،7. ديكتين-1 درست جيدا لأن هذا المسار أمر حاسم للمضيف الدفاع ضد الأمراض الفطرية8،9. بيد أن الآثار المترتبة MALT1 في الممرات الشبيهة بحصيلة مستقبلات (TLR)، ظلت مثيرة للجدل10. واستبعد الأدلة الأخيرة في الخلايا البشرية النقوي دوراً مباشرا للنشاط باراكاسباسي MALT1 في تنظيم الإنتاج تنف المصب TLR-411.
في هذا العمل، استخدمنا مختلف إعدادات التجريبية وظروف محفزة في الإنسان وخلايا النقوي الماوس لسبر مسارات الإشارات الفطرية، الاعتماد على مثبطات أداة معينة الدوائي وقياس إنتاج سيتوكين.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
وقد أجريت التجارب وفقا لمبادئ توجيهية ومعايير "لجنة أخلاقيات البحوث البشرية نوفارتيس".
1-إعداد خلايا الدم المحيطية وحيدات النوى (ببمكس) من المعاطف بافي البشرية
ملاحظة: تلقينا المعاطف بافي من المتطوعين صحية في يوم واحد بعد جمع، في أكياس 50 مل. كانت المقدمة بموجب الموافقة المستنيرة والتي تم جمعها من خلال إينتيريجيونالي بلوتسبيندي شويزيريتشيس Rotes Kreuz. علينا التعامل مع منهم في درجة حرارة الغرفة باستخدام الإجراء أدناه، ما لم يحدد خلاف ذلك.
- إعداد زوج معقمة ونظيفة من المقص وكوب 1 لتر مع كيس من بلاستيك (تحت الصفيحة تدفق).
- نقل معطف بافي في الكأس وفتحه بعناية مع المقص.
- استخدام ماصة 25 مل، إضافة 100 مل حامض الفوسفات مخزنة المالحة المخزن المؤقت/الإيثيلين (برنامج تلفزيوني/يدتا: برنامج تلفزيوني 1 x درجة الحموضة 7.4 تتضمن لا كاكل2 ولا مجكل2، وتستكمل مع 2 مم يدتا pH 8.0).
ملاحظة: استخدام نفس "الماصة؛" وبعد ببطء بيبيتينج الحل صعودا وهبوطاً، الاستغناء عن 25 مل معطف بافي المخفف إلى 6 أنابيب مخروطية الشكل للطرد المركزي من 50 مل المملوء مسبقاً مع 15 مل تدرج على أساس السكاريد الكثافة. - الطرد المركزي 20 دقيقة في 800 x ز مع تسارع معتدلة (تعيين في 4 من أصل 9) وبدون فرامل للسماح لفصل الخلايا استناداً إلى هذه الكثافة.
ملاحظة: بعد الطرد المركزي، ستكون ثلاث طبقات مرئية؛ بيليه الذي يحتوي على خلايا الدم الحمراء والمحببة، طبقة العليا من البلازما، والفترات الفاصلة بين عصابة بيضاء تحتوي على خلايا الدم المحيطية وحيدات النوى (ببمكس). - حصاد الحلبة ببمك باستخدام الماصة 10 مل ونقل إلى أنابيب 50 مل جديدة.
ملاحظة: اثنين إلى ثلاثة أنابيب 50 مل مطلوبة عادة كل معطف بافي قاتلة. في هذه المرحلة، يلوث بعض البلازما المحتمل ببمكس التي تم جمعها، الذي ينبغي أن يكون له تأثير على الخطوات اللاحقة في تخصيب اليورانيوم. - أعلى يصل إلى 50 مل كل أنبوب باستخدام برنامج تلفزيوني/يدتا والمضي قدما ليغسل المتعاقبة الثلاث مع تناقص وقت الطرد المركزي والسرعة (15 دقيقة في 520 x g, 10 دقيقة في 330 x ز, 8 دقيقة في 150 س ز).
ملاحظة: في كل خطوة، سكب المادة طافية قبالة في حاوية نفايات سائلة وهو حراكه بيليه الخلية في 50 مل من برنامج تلفزيوني/يدتا (قد يكون تجميع الكريات بعد الغسيل الأولى). - بعد الغسيل النهائي، ريسوسبيند بيليه في 25 مل مخزن مؤقت لتحلل المثلج (انظر الجدول للمواد) خلايا الدم الحمراء بالضغط الاسموزي.
- احتضان حتى يصبح الحل واضح (دي فايف دقيقة في درجة حرارة الغرفة).
- وقف رد الفعل بإضافة 25 مل من فصل المخزن المؤقت (PBS 1 x درجة الحموضة 7.4 تتضمن لا كاكل2 ولا مجكل2، وتستكمل مع 2% غير نشط الحرارة الجنين البقري المصل (FBS) و 1 مم يدتا pH 8.0).
- أغسل مرة أخرى في 150 x ز لمدة 8 دقائق.
ملاحظة: في هذه المرحلة يمكن استخدام ببمكس كعدد سكان الأكبر (راجع الخطوة 3: العلاج ببمكس ووحيدات وظروف تنشيطية) أو تجهيزها لإثراء الوحيدات (راجع الخطوة 2: إعداد وحيدات من ببمكس)، أو المجمدة إلى أسفل للاستخدام اللاحق (راجع الخطوة 5: وحيدات وإجراءات تجميد/ذوبان ببمكس).
2-إعداد وحيدات من ببمكس
- ريسوسبيند ببمكس التي تم الحصول عليها في الخطوة 1، 10 في المخزن المؤقت للانفصال والاعتماد عليها تصل إلى 5 × 107خلايا/مل.
- نقل تعليق خلية في أنبوب الطرد مركزي مخروطية مل 14 مع غطاء.
- إضافة 50 ميليلتر من الوحيدات تخصيب جسم كوكتيل كل مل تعليق خلية، الدوامة، واحتضان 10 دقيقة في 4 درجات مئوية.
- إضافة 50 ميليلتر من الوحيدات تخصيب حبات الواحد مل خلايا.
ملاحظة: يجب أن يكون الخرز جيدا فورتيكسيد لضمان التجانس للتعليق. - بعد إضافة الخرز، قريبا من دوامة تعليق خلية واحتضان 5 دقيقة في 4 درجات مئوية.
- شطف الجزء العلوي من الأنبوب مع فصل المخزن المؤقت حتى يتم ملء الأنبوب تصل إلى 10 مل.
- مزيج الحل ببطء من بيبيتينج صعودا وهبوطاً.
- ضع الأنبوب دون سقف في فصل مغناطيس.
- احتضانها ل 2.5 دقيقة في درجة حرارة الغرفة.
- صب ببطء في أنبوب الطرد مركزي مخروطية 15 مل.
- في هذه المرحلة، استخدم وحيدات مباشرة (راجع الخطوة 3: العلاج ببمكس ووحيدات وظروف تنشيطية) أو تمييزها في أناماتور موالمستمدة من نوسيتي داندريتيك جخبرنيs (إيمودكس) (راجع الخطوة 4)، أو تجميدها لأسفل للاستخدام اللاحق (راجع الخطوة 5).
3-ببمكس وعلاجات وحيدات وظروف تنشيطية
- عد الخلايا وتمييع لهم في الثقافة المتوسطة (روزويل بارك التذكاري المعهد المتوسط (ربمي) 10% FBS 1 مم بيروفات صوديوم + + + U/mL 100 البنسلين والستربتوميسين (القلم/بكتيريا) β-mercaptoethanol 5 ميكرومتر)، وصولاً إلى 1.25 × 104 خلايا/جيدا.
- توزيع 30 ميليلتر من تعليق الخلية الواحدة من صفيحة 384-جيدا جيدا.
- إضافة 15 ميليلتر من 4 × حلول مجمع مركزة واحتضان مسبقاً ح 1 في 37 درجة مئوية، وأول أكسيد الكربون 5%2.
- إضافة lipopolysaccharide (LPS) بتركيز نهائي 10 نانوغرام/مل، أو المنضب زيموسان (DZ) بتركيز نهائي من 100 ميكروغرام/مل، أو تبقى في المتوسط العادي.
- تبني بين عشية وضحاها في 37 درجة مئوية، وأول أكسيد الكربون 5%2.
- تأخذ 10 ميليلتر من المادة طافية لقياس مستويات يفرز تنف-أ (راجع الخطوة 7: قياسات السيتوكينات وقابليتها للبقاء).
4-وحيدات التمايز في إيمودكس و "ظروف تنشيطية"
- عد وحيدات (التخصيب في الخطوة 2) والطرد المركزي من تعليق خلية في 520 x ز لمدة 5 دقائق.
- "الماصة؛" إيقاف المادة طافية وإضافة الثقافة المتوسطة (ربمي + 10% FBS للحصول على تعليق خلية نهائي 0.4 × 106 خلايا/مل.
- إضافة 80 نانوغرام/مليلتر الماشوب البشري إيل-4 + 100 نانوغرام/مليلتر GM-CSF.
- الاستغناء عن 5 مل تعليق الخلية الواحدة وكذلك في لوحة 6-جيدا.
- احتضان لمدة 7 أيام في 37 درجة مئوية، وأول أكسيد الكربون 5%2.
- في يوم 7، حصاد الخلايا التي بيبيتينج برفق لتجنب من التفعيل.
- أجهزة الطرد المركزي في 520 x ز لمدة 5 دقائق.
- فراغ أسبيراتي وريسوسبيند في 50 مل من الثقافة المتوسطة دون عوامل النمو.
- الطرد المركزي في 520 x ز لمدة 5 دقائق وريسوسبيند في 1 × 106 خلايا/مل في الثقافة المتوسطة.
- الاستغناء عن 100 ميليلتر من تعليق خلية (خلايا5 10) كل من لوحة مسطحة 96-بئر القاع جيدا.
- إينكوباتي مسبقاً ح 1 في 37 درجة مئوية بعد إضافة 50 ميليلتر 4 x تتركز الحلول المركبة، إعداد كما هو موضح في الخطوة 8: إعداد المركبات.
- إضافة 50 ميليلتر من المحفزات (4 x تتركز)، إعداد كما هو موضح في الخطوة رقم 9.
- احتضان 24 ساعة عند 37 درجة مئوية.
- مزيج كل بئر ونقل الخلايا والمادة طافية (SN) في لوحة الخامس-أسفل 96-جيدا.
- زيادة ونقصان لأسفل في 475 x ز لمدة 5 دقائق.
- نقل المادة طافية في لوحة أسفل شقة 96-بئر جديدة وختم وتجميد في-20 درجة مئوية إلى استخدامها مرة أخرى.
5-وحيدات وإجراءات تجميد/ذوبان الجليد ببمكس
-
تجميد
- تدور أسفل ببمك أو الوحيدات الخلية الأعمال التحضيرية على 520 x ز لمدة 5 دقائق.
- الفراغ نضح المادة طافية وريسوسبيند الخلايا في تجميد المتوسطة في 1 × 107 خلايا/مل.
- الاستغناء عن 1 مل تعليق خلية في كريوتوبيس، ونقل الأنابيب إلى جهاز تبريد محددة (انظر الجدول المواد) ووضعه في-80 درجة مئوية.
-
ذوبان الجليد
- ذوبان الجليد في كريوتوبي وسرعة نقل محتواه في أنبوب الطرد مركزي مخروطية 15 مل تحتوي على 9 مل من الثقافة المتوسطة.
- أجهزة الطرد المركزي في 520 x ز لمدة 5 دقائق.
- أسبيراتي فراغ طافية وبيليه الخلية ريسوسبيند في 5 مل من الثقافة المتوسطة. خلايا جاهزة الآن لمواصلة معالجة تجريبية.
6-خلايا الطحال الماوس الإعداد والمعالجة
ملاحظة: وقد أجرينا التضحيات الحيوانية وفقا للمبادئ التوجيهية والمعايير "منظمة رعاية الحيوان نوفارتيس". الدراسات كانت وافقت لجنة الأخلاقيات التابعة للهيئة الحكومية الدولية الإقليمية (بازل شتات der Veterinäramt كانتوناليس). نحن التضحية الحيوانات isoflurane التعرض المفرط، مع جميع الجهود المبذولة للتقليل من المعاناة.
- حصاد الطحال وننأى بالانسجة باستخدام أنبوب مزودة بجهاز طاحونة أنسجة ميكانيكية وشغلها مع 5 مل من البرد ربمي المتوسطة.
- استخدام برنامج الطحال الجهاز تفكك لطحن الأجهزة.
- تصفية الخلايا عن طريق مصفاة خلية نايلون 100 مم.
- نقل التعليق في أنابيب 50 مل والطرد المركزي عند 4 درجة مئوية لمدة 10 دقيقة في 320 x ز.
- أسبيراتي فراغ المادة طافية، ريسوسبيند بيليه الخلية في 3 مل من المخزن المؤقت لتحلل المثلج، واحتضان لمدة دقيقة دي تو على الجليد.
- إيقاف تحلل بإضافة 7 مل متوسطة ربمي.
- تصفية مرة أخرى من خلال مصفاة خلية نايلون 100 ميكرومتر.
- تدور أسفل تعليق خلية في 330 x ز لمدة 10 دقائق في 4 درجات مئوية.
- فراغ أسبيراتي المادة طافية وريسوسبيند الخلايا في 11 × 106 خلايا/مل في المتوسط كاملة (RPMI تستكمل مع 10% FBS والقلم يو/مليلتر 100/الخطوة 5 ميكرومتر β-ميركابتوثانول).
- لوحة 1 × 106 خلايا/بئر (90 ميليلتر) في لوحة 96-جيدا (مسطحة القاع).
- إضافة 5 ميليلتر من 20 x تتركز حل مركب تمييع سابقا في المتوسط ربمي كما هو موضح في الخطوة 8.3: تمييع المسلسل لخلايا الطحال مورين.
- احتضان لمدة 30 دقيقة عند 37 درجة مئوية، 5% CO2.
- إضافة 5 ميليلتر من 20 x تتركز DZ (التركيز النهائي 30 ميكروغرام/مل) أو 20 x تتركز لبس + IFN-ز (TLR-4) (تركيز النهائي 1 ميكرومتر لبس و 10 نانوغرام/مل IFN-ز).
- تبني بين عشية وضحاها في 37 درجة مئوية، وأول أكسيد الكربون 5%2.
- أجهزة الطرد المركزي في 330 x ز لمدة 10 دقائق.
- نقل سوبيرناتانتس في اللوحات الجديدة، وختم وتجميد في-20 درجة مئوية حتى استخدامها مرة أخرى.
7-السيتوكينات ومقاييس السلامة
-
البشرية تنف القياس هترف (Fluorescence حل الوقت متجانسة)
ملاحظة: البروتوكول يتبع توصيات المورد، بإيجاز أدناه.- 1 ميكس حجم الكاشف المعاد تشكيلها (مكافحة تنف كريبتاتي ومكافحة تنف في XL665) مع 19 حجم المخزن المؤقت لإعادة تشكيل (50 مم الفوسفات المخزن المؤقت pH 7.0، فلوريد البوتاسيوم 0.8 متر (KF)، 0.2% ألبومين المصل البقري (BSA)).
- مزيج من الحلين الأجسام المضادة جاهزة للاستخدام 1:1 قبل صرفها الكواشف.
- الاستغناء عن 10 ميليلتر من سوبيرناتانتس من الخطوة 3.6 إلى الأبيض 384-جيدا لوحات.
- الاستغناء عن 10 ميليلتر لمزيج الأجسام المضادة.
- تغطية اللوحة مع السدادة واحتضان في 4 درجات مئوية بين عشية وضحاها.
- قراءة لوحة على قارئ ميكروسكوبية (فلاش 50 – 200).
- قياس إيل-23 البشرية قبل هترف (Fluorescence حل الوقت متجانسة)
ملاحظة: البروتوكول يتبع توصيات المورد، بإيجاز أدناه.- مزيج واحد حجم الكاشف المعاد تشكيلها (مكافحة إيل-23-كريبتاتي-الأجسام المضادة ومكافحة--إيل-23 الضد D2) مع وحدات التخزين 19 من الكشف عن المخزن المؤقت #3.
- مزيج من الحلين الأجسام المضادة جاهزة للاستخدام 1:1 قبل صرفها الكواشف.
- الاستغناء عن 10 ميليلتر من سوبيرناتانتس من الخطوة 3.6 إلى الأبيض 384-جيدا لوحات.
- الاستغناء عن 10 ميليلتر لمزيج الأجسام المضادة.
- تغطية اللوحة مع السدادة واحتضان في 4 درجات مئوية بين عشية وضحاها.
- قراءة لوحة على قارئ ميكروسكوبية (50-200 نانومتر فلاش).
-
البشرية إيل-6، 8 إيل وايل-1β وقياسات تنف-α بواسطة اليكتروتشيميلومينيسسينسي
ملاحظة: جميع العينات كانت مخففة في 1/150 في مادة 2 (تمييع الأولى: 10 ميليلتر في 150 ميليلتر، ثم 20 ميليلتر في ميليلتر 180). البروتوكول يتبع توصيات المورد:- تضعف من عينات والموحدة في مادة 2.
- المضي قدما إلى إضعاف المعيار في مادة 2 استخدام إضعاف إضعاف مسلسل 1/4.
- غسل الأطباق ثلاث مرات مع المخزن المؤقت للمياه والصرف الصحي.
- الاستغناء عن 50 ميليلتر من عينات أو معيار كل بئر.
- احتضانها ح 2 في درجة حرارة الغرفة تحت التحريض.
- أغسل لوحة أربع مرات مع برنامج تلفزيوني + 0.05% بوليسوربيت 20.
- إضافة 25 ميليلتر للكشف عن الأجسام المضادة (60 ميليلتر من كل جسم للنهائي 3 مل) في مادة 3.
- احتضانها ح 2 في درجة حرارة الغرفة تحت التحريض.
- أغسل لوحة أربع مرات مع برنامج تلفزيوني + 0.05% بوليسوربيت 20.
- تجنب فقاعات، إضافة 150 ميليلتر كل بئر من المخزن المؤقت للقراءة (على أساس تريس المخزن المؤقت الذي يحتوي على تريبروبيلاميني، تضعف x 2 في ddH20) مادة التفاعل المشترك لتوليد الضوء في تحديدكم اليكتروتشيميلومينيسسينسي.
- قراءة اللوحة (بدون تأخير) على قارئ لوحة متعدد.
-
ماوس تنف القياس بإليزا بعد البروتوكول المورد
- تمييع المادة طافية 1:1 في مقايسة مخفف (جاهزة للاستخدام تحتوي على البروتين المخزن المؤقت).
- إعداد الكواشف وعينات، وتخفيف القياسية كما هو موضح في هذه المجموعة. إضافة 50 ميكروليتر من تحليل مادة لكل بئر.
- إضافة 50 ميكروليتر من المعيار، أو السيطرة، أو العينة الواحدة وكذلك.
- المزيج بلطف التنصت على الإطار لوحة لمدة 1 دقيقة.
- تغطية قطاع لاصقة المقدمة واحتضانها ح 2 في درجة حرارة الغرفة.
- نضح كل جيدا ويغسل مع 400 ميكروليتر/البئر (كرر هذه الخطوة خمس مرات في المجموع).
- بعد الغسيل النهائي، إزالة أي العازلة غسيل المتبقية بواسطة يسفط.
- عكس اللوحة ولطخة ضد مناشف ورقية نظيفة.
- إضافة 100 ميكروليتر من الماوس تنف-α المتقارن لكل بئر. وتغطي بشريط لاصق جديد.
- احتضانها ح 2 في درجة حرارة الغرفة.
- كرر التطلع/الغسيل كما هو الحال في الخطوة 7.4.4.
- إضافة 100 ميكروليتر من الركازة الحل لكل بئر واحتضان لمدة 30 دقيقة في درجة حرارة الغرفة محمية من الضوء.
- إضافة 100 ميكروليتر من حمض الهيدروكلوريك المخفف (إيقاف الحل) لكل بئر. اضغط برفق لوحة لضمان خلط دقيق.
- قياس الكثافة الضوئية في 450 نانومتر (مع الطول الموجي تصحيح مبلغ 560 نانومتر) باستخدام قارئ ميكروسكوبية (إلى القيام بذلك في 30 دقيقة).
- تمييع المادة طافية 1:1 في مقايسة مخفف (جاهزة للاستخدام تحتوي على البروتين المخزن المؤقت).
-
بقاء الخلية
- بعد إزالة سوبيرناتانتس من الاستعدادات PBMC أو الوحيدات، تقييم إمكانية بقاء الخلية استخدام جهاز على استعداد لاستخدام ريسازورين الحل (مؤشر الأكسدة والاختزال) أضيف مباشرة إلى تعليق الخلية بتركيز نهائي 10%.
- احتضانها ح 1 إلى 2 في 37 درجة مئوية، وأول أكسيد الكربون 5%2.
- قراءة الأسفار في 590 نانومتر (540 الإثارة nm) باستخدام قارئ ميكروسكوبية.
8-مجمع إعداد
-
تمييع المسلسل إيمودكس
- تمييع الحل MLT 827 الأسهم (10 ملم في ثنائي ميثيل سلفوكسيد ([دمس]) في المتوسط تصل إلى 8 ميكرومتر في دفعة واحدة (4 x مركزة).
- إجراء ستة-الخطوة 1:5 إضعاف مسلسل، باستخدام متوسط + 0.08 في المائة [دمس]. استخدام نفس المتوسطة + 0.08 في المائة [دمس] حل لحالة مركبة (لا مركب).
-
جرعة وحيدة اختبار إيمودكس
- تمييع الحلول الأسهم MLT-827، و AFN700، و Cpd11 في المتوسط للوصول إلى 4 ميكرومتر في دفعة واحدة (4 x مركزة).
-
تمييع المسلسل لخلايا الطحال مورين
- تمييع حل MLT 827 10 ميكرون (التي تم الحصول عليها من حل أسهم 10 ملم بعد إضعاف الذهاب واحد في المتوسط) إلى 0.01 ميكرومتر، مع تركيز 0.1% نهاية [دمس].
- خطوات تمييع، تأخذ 2 ميليلتر من كل تمييع، إضافة 38 ميليلتر ربمي، وبيبيت 5 ميليلتر في البئر.
ملاحظة: وتجري جميع العلاجات في ثلاث نسخ.
9-محفزات إعداد
-
زيموسان المستنفد (DZ)
- إضافة 2 مل الماء المعقم خالية من الذيفان إلى 10 مغ من dz.
- دوامة مجانسة الحل الأسهم، دوامة المسبقة أيضا كل استعمال.
- الكوة مختبرين الحل ومخزن في-20 درجة مئوية.
-
تريهالوسي--6.6-ديبيهيناتي (مجلس التجارة والتنمية)
- إضافة 100 ميليلتر من [دمس] إلى 1 مغ مجلس التجارة والتنمية، الحرارة عند 60 درجة مئوية في حمام مائي ل 15 – 30 ثانية.
- دوامة وإضافة 900 ميليلتر من برنامج تلفزيوني العقيمة، دوامة مرة أخرى فورا.
- الحرارة لمدة 10 – 15 دقيقة في 60 درجة مئوية ومجانسة فورتيكسينج قبل كل استعمال.
- يبقى الحل في 4 درجات مئوية.
- إجراء تخفيف المسلسل وإعداد جرعة واحدة أما بالنسبة للمجمع MLT-827.
ملاحظة: لمجلس التجارة والتنمية يحتاج إلى أن يكون أعدت في [دمس]، تركيز [دمس] 1% نهائي حاضرا أثناء تنشيط الخلية.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
في الخلايا النقوي، التبديلات MALT1 إشارات التنشيط المصب عدة مستقبلات يكتين مثل ج-نوع، مثل ديكتين-1 وديكتين-2 مينكلي6. هذه المسارات تعتمد على المستقبلات المحتوية على عزر (هيم) أيتام (مثل، ديكتين-1) أو أيتام المحتوية على فكرة مستقبلات المشارك (مثل، FcRγ، ديكتين-2 ومينكلي) أن تجنيد وتفعيل كيناز SYK (الشكل 1). وهذا يؤدي إلى تنشيط البروتين كيناز ج isoform، إلا وهي PKCδ، الذي فوسفوريلاتيس CARD9، مما تسبب في تشكيل معقدة CARD9/BCL10/MALT1 وتعيين TRAF6 ل التنشيط NF-κB المصب12. وفي المقابل، المجندين مسار TLR-4 TRAF6 في MALT1 مستقلة لكن MYD88/IRAK-تعتمد على طريقة لتنشيط NF-κB (الشكل 1). تم الحصول على الأدلة لهذه المشاركة التفضيلية من MALT1 استخدام النماذج الوراثية MALT1 عوز، فضلا عن العلاج الدوائي مع13،،z-فربر-مارك فنلندي11السمات موقع نشط المانع14.
ونحن المستخدمة تم الإبلاغ عنها مؤخرا قوية وانتقائية MALT1 المانع MLT 82715 وسألت إذا كان هذا المركب من شأنه أن ينظم إنتاج تنف المصب ج نوع مثل يكتين وعدد القتلى مثل مستقبلات، على التوالي. حفز ببمكس البشرية وخلايا الطحال الماوس مع زيموسان المستنفد (DZ، مؤثر معروفة ديكتين-1) أو lipopolysaccharide (لبس، ومؤثر معروفة TLR-4) ونحن قياس تنف-الإفراج في ثقافة طافية بعد ح 20. في كل من الإنسان وفحوصات الماوس حظر MLT 827 انتقائية تنف-إنتاج مدفوعة بالطريق ديكتين-1، ولكن ليس في مسار TLR-4 (الشكل 2). ونحن الحصول على بيانات مشابهة عند الاحتضان مع المجمع z-فربر-مارك فنلندي (تكميلية الشكل 1).
للحصول على معلومات المسار، أجرينا تجارب أخرى في وحيدات البشرية وغير ناضجة المستمدة من وحيدات الخلايا الجذعية (إيمودكس)، مقارنة تأثير MLT-827 ل المانع Cpd11 SYK16 ومثبط إيك AFN70015 . في حفز مع لبس وحيدات، إنتاج تنف-α ألغى تماما تقريبا من AFN700 ولكن لم تكن حساسة إلى Cpd11 (الشكل 3 ألف)، وهو ما يتسق مع التبعية/الاستقلالية المسار TLR-4 النشاط NF-κB/SYK، على التوالي ( انظر الشكل 1). على النقيض من ذلك، عرض إنتاج تنف-α يقودها ديكتين-1 في إيمودكس حساسية ل Cpd11 بالإضافة إلى حساسية MLT-827 و AFN700 (الشكل 3B، الإضافي رقم 2)، توفير المزيد من الأدلة عن تورط SYK/تدابير بناء الثقة مما يشير إلى تتالي في المسار ديكتين-1 (الشكل 1). الجدير بالذكر، إنتاج IL-1، إيل-6، وايل-23 على التحفيز ديكتين-1 كان أيضا حساسة لمثبطات الثلاث، مما يشير إلى آليات تنظيمية مماثلة إلى تنف-. ومع ذلك، أثر محدود من المركبات الثلاثة على إنتاج إيل-8 اقترح إليه تنظيمية متميزة لهذا سيتوكين (الشكل 3B، الملحق رقم 2).
بالإضافة إلى ديكتين-1، كلرس الأخرى، مثل ديكتين-2 ومينكلي، وظيفة عن طريق تحفيز سيجنالوسومي CARD97. ولذلك نحن اختبار MLT 827 في إيمودكس وتحدي مع مؤثر مينكلي تريهالوسي-6.6-ديبيهيناتي (يحدد لاحقاً). زيادة تركيزات الراتب أعلاه 50 ميكروغرام/مل أدت إلى إنتاج تنف-، إيل-6 و IL-1، التي كانت تعتمد على نشاط باراكاسباسي MALT1 كما يتضح من أثر حظر MLT-827 (الشكل 4 أ). تم الحصول على نتائج متسقة عند الطعن في إيمودكس مع زيادة تركيزات DZ لتحفيز ديكتين-1 (الشكل 4 باء).
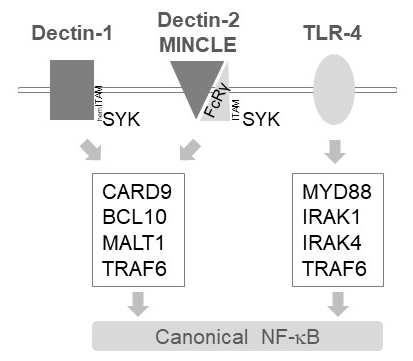
رقم 1: NF-κB إشارات المتلقين للمعلومات من ديكتين-1 ومينكلي و TLR-4- الكرتون يصور الملامح الرئيسية للمتعارف عليه NF κB تنشيط مسارات المصب مينكلي، ديكتين-2، ديكتين-1 أو 4 TLR في الخلايا النقوي. يمكن الدخول التي تحتوي على هيميتام ديكتين-1 مستقبلات17 مباشرة SYK لحفز تشكيل مجمع تدابير بناء الثقة (CARD9/BCL10/MALT1)، مما يؤدي إلى تنشيط NF-κB التابعة TRAF6. مستقبلات يكتين مثل ج-نوع الأخرى مثل ديكتين-2 أو مينكلي تحتاج إلى تعيين سلسلة FcRγ المحتوية على أيتام للقيام تدابير بناء الثقة وتفعيل NF-κB. مستقبلات TLR-4 استخدام إليه أخرى للتنشيط NF-κB، الاعتماد على مؤنزم MYD88 و IRAK1/IRAK4 المنبع من TRAF6.

رقم 2: ديكتين-1 إشارات عن طريق MALT1 لإنتاج خلايا الفأر وتنف-α في الإنسان- (أ) البيانات "ببمكس البشرية" كما هو الحال في أونتيرينير et al., 2017 (الشكل 2A)11. حفز ببمكس البشرية مع 1 نانوغرام/مليلتر من لبس (مؤثر TLR-4) أو 100 ميكروغرام/مل DZ (مؤثر ديكتين-1) ح 20 حضور تركيزات متدرجة من MLT-827. أفرج عنه في المادة طافية تنف-كان كمياً هترف. الماوس (ب) خلايا الطحال تعامل مع تركيز مجموعة من MLT-827 لمدة 30 دقيقة ومن ثم حفز مع 30 ميكروغرام/مل DZ أو لبس 1 ميكروغرام/مل + 10 نانوغرام/مليلتر IFN-بالنسبة h. 18 تنف-α في ثقافة الخلية طافية تم قياسه بواسطة أليسا. ويرد واحد من تجربتين مع نتائج مماثلة، كما يعني ± ووزارة شؤون المرأة من ثلاثة مقاييس.

الشكل 3: إيك--و/أو SYK-التبعية لإنتاج سيتوكين المصب TLR-4 وديكتين-1- (A) وحيدات البشرية كانت ما قبل المعالجة ح 1 مع MLT-827 (1 ميكرومتر)، Cpd11 (1 ميكرومتر)، أو AFN700 (3 ميكرومتر) أو مركبة ([دمس]). حفز الخلايا مع 10 نانوغرام/مل لبس ح 20 وتنف-في المادة طافية وكان كمياً هترف. (ب) تنف-α، إيل-1β، إيل-6، 23 إيل وايل-8 إنتاج البشرية المستمدة من وحيدات الخلايا الجذعية (إيمودكس) حفز على 24 ساعة مع DZ (100 ميكروغرام/مل) بعد الحضانة قبل ح 1 مع MLT-827، Cpd11، AFN700 (كلها في 1 ميكرومتر) أو [دمس]. تم تعيين مستويات سيتوكين في عينات يعامل [دمس] في 100%. البيانات يعني ± SD من قياسات ثلاثة، وهي الممثل لثلاث تجارب مستقلة. * ف < 0.05؛ * * ف < 0.01؛ ف مزاوج < 0.001، اختبار t-التائي.

الشكل 4: ج إنتاج سيتوكين يكتين مثل-تعتمد على نوع من إيمودكس- تنف-α، إيل-1β، وايل-6 إنتاج إيمودكس وحفز على 24 ساعة مع مؤثر مينكلي تريهالوسي-6.6-ديبيهيناتي (مجلس التجارة والتنمية، 100 ميكروغرام/مل) (A) أو مع مؤثر ديكتين-1 DZ (100 ميكروغرام/مل) (ب) بعد الحضانة قبل ح 1 مع MLT-827 (1 ميكرومتر) أو [دمس]. البيانات يعني ± التنمية المستدامة من ثلاثة مقاييس وهي الممثل لثلاث تجارب مستقلة.
الملف الإضافي 1- اضغط هنا لتحميل هذا الملف.
ملف إضافي 2- اضغط هنا لتحميل هذا الملف.
ملف إضافي 3- اضغط هنا لتحميل هذا الملف.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
في هذا العمل، استخدمنا إعدادات تجريبي بسيط لدراسة مسارات إشارات في الإنسان والماوس الخلايا الفطرية، واستجواب الاعتماد على وظيفة بروتيوليتيك MALT1. التوسع في العمل السابق11، أظهرت الدراسة أن يتحكم MALT1 باراكاسباسي نشاط إنتاج سيتوكين مستقبلات يكتين مثل التي يسببها ج-نوع، بما في ذلك تنف-α. في المقابل، كان 4 المستحثة TLR تنف-α مستقلة عن MALT1 في كل الأنواع. مجتمعة، هذه البيانات إثبات مساهمة أساسية وانتقائية MALT1/بناء الثقة سيجنالوسومي المصب مستقبلات يكتين مثل نوع ج، التي تم كشف النقاب عن سابق الدراسات6،12،18.
سواء الاستقلالية واضحة TLR-4 إشارات على MALT1 في خلايا النقوي ينطبق على سائر أنواع الخلايا ما زال يتعين استكشافها. على سبيل المثال، في ب-الخلايا الليمفاوية، مما يشير إلى TLR سابقا تبين للمساهمة في تنشيط الخلية ب المصب مستقبلات مستضد خلايا ب19. وفي الواقع، أننا قد غير منشورة الأدلة أن TLR-4 تحفز الإنسان وتعرض الخلايا الماوس ب حساسية إلى MLT 827. ولذلك، سوف تكون كذلك آليا إلى رؤى المصب مستقبلات الخلية ب قيمة. وفي هذا السياق، قدمت دراسة أجريت مؤخرا في سرطان الغدد الليمفاوية الخلية بأدلة لتجميع المسارات مما يشير إلى المصب مستقبلات خلايا ب و مستقبلات TLR920. TRAF6، الذي يعمل كوسيط للتنشيط NF-κB في مستقبلات خلايا ب ومسارات TLR، ربما يكون نقطة من الحديث المتبادل، الأمر الذي يمكن أن يفسر حساسية كل المسارات إلى تثبيط البروتياز MALT1. على العكس من ذلك، TRAF6 أيضا لاعب المصب مشترك كلرس و TLRs لتحريض NF-κB ولكن لا تظهر هذه المسارات اثنين للحديث المتبادل بطريقة تعتمد على باراكاسباسي MALT1 في خلايا النقوي.
ركز هذا العمل على إنتاج سيتوكين، الذي ينص قراءات سهلة مسارات الإشارات ويمكن تنفيذها سهولة التنميط المركب. وشدد على قيمة مثبطات انتقائية وفعالة من MALT1 لضياع MALT1 البيولوجيا. الحصول على المزيد من الأفكار الميكانيكية سيتطلب المزيد من العمل والتنمية لفحوصات أكثر الدانية، مثلاً، تميز ركائز MALT1 المتورطين في الفطرية مما يشير إلى التنظيم.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgments
ونحن نشكر السفير على تصريح (ترخيص رقم 4334770630127) استنساخ هنا الشكل 2 ألف من أونتيرينير et al. (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



