Summary
MALT1 regelt die angeborene Immunität, aber wie in diesem Fall bleibt unklar. Wir verwendet die selektive MALT1 Paracaspase Inhibitor MLT-827 um zu entwirren den Beitrag von MALT1 zur angeborenen Signalisierung von Toll-Like oder C-Art Lectin-Like-Rezeptoren, zeigen, dass MALT1 die Produktion der myeloischen Zytokine reguliert, vor- und nachgelagerten der C-Art Lectin-Like-Rezeptoren selektiv.
Abstract
Neben seiner Funktion in lymphoiden Zellen, die durch zahlreiche Studien behandelt wurden, Rolle die Paracaspase MALT1 auch eine wichtige in angeborene Zellen unterhalb der Muster-Erkennung-Rezeptoren. Am besten untersucht sind die Dectin-1 und Dectin-2 Mitglieder der C-Typ-Lektin-Like-Rezeptor-Familie, die eine SYK - und CARD9-abhängige Signalkaskade zu NF-κB Aktivierung in einem MALT1-abhängigen Weise zu induzieren. Propagieren Sie durch Kontrast, Toll-Like-Rezeptoren (TLR), z. B. TLR-4 NF-κB Aktivierung aber Signal über eine Kaskade von MYD88/IRAK-abhängige. Dennoch, ob MALT1 TLR-4 Signalisierung beitragen kann ist unklar geblieben. Den letzten deutet mit MLT-827, ein potenter und selektiver Inhibitor von MALT1 Paracaspase Aktivität, darauf hin, dass TNF-Produktion flussabwärts von TLR-4 in menschlichen myeloische Zellen unabhängig von MALT1, im Gegensatz zu TNF-Produktion flussabwärts von Dectin-1, das ist MALT1 angewiesen. Hier haben wir die selektive Einbeziehung von MALT1 in Mustererkennung Fernerkundung weiter, unter Verwendung einer Vielzahl von Mensch und Maus zellulären Präparate und Stimulation der Dectin-1, MINCLE oder TLR-4 Bahnen. Wir lieferten auch zusätzliche Erkenntnisse durch die Zytokine TNF-Erforschung und durch den Vergleich von MLT-827 ein SYK-Inhibitor (Cpd11) und ein IKK-Inhibitor (AFN700). Gemeinsam zur Verfügung gestellten Daten weitere Beweise für die MALT1-Abhängigkeit der C-Art Lectin-Like Rezeptor-Signalisierung im Gegensatz zu TLR-Signalisierung.
Introduction
Die Paracaspase Aktivität von MALT1 (Mucosa-assoziierte Lymphgewebe Lymphom Translokation Protein 1) zeigte sich in 20081,2. Seit dieser Zeit haben eine Reihe von Studien ihren kritischen Beitrag zur Antigen-Rezeptor-Antworten in Lymphozyten berichtet. Genetische Modelle in der Maus sowie Pharmakologie Daten eine wichtige Rolle in T-Zellen, T-Zell-abhängigen Autoimmunität und B-Zell-Lymphom Einstellungen3,4unterstützen. In Lymphozyten, MALT1 Paracaspase Ansteuerung erfolgt bei der Montage eines CARD11-BCL10-MALT1 Komplex5, ausgelöst durch Antigen-Rezeptor proximalen signalisieren stromabwärts des T - oder B-Zell-Rezeptors. Es gibt auch genügend Beweise, dass ein ähnlicher CARD9-BCL10-MALT1-Komplex wichtig ist für die Vermehrung Signale unterhalb der C-Art Lectin-Like-Rezeptoren (CLLR), z. B., Dectin-1, Dectin-2 und MINCLE in myeloische Zellen6,7. Dectin-1 ist besonders gut untersucht worden, weil dieser Weg für Host Verteidigung gegen Pilzinfektionen8,9entscheidend. Auswirkung von MALT1 in Toll-Like-Rezeptor (TLR) Wege, ist jedoch umstritten10geblieben. Den letzten Beweis in menschlichen myeloische Zellen ausgeschlossen, eine direkte Rolle für MALT1 Paracaspase Aktivität in die Regulierung der TNF-Produktion flussabwärts von TLR-4-11.
In der vorliegenden Arbeit verwendeten wir verschiedene experimentelle Einstellungen und stimulierende Bedingungen in Mensch und Maus myeloische Zellen um angeborene Signalwege Sonde unter Berufung auf spezifische pharmakologische Werkzeug-Inhibitoren und Messung der Produktion von Zytokinen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Gemäß den Richtlinien und Normen der menschlichen Ethik-Forschungskommission Novartis wurden Experimente durchgeführt.
1. Vorbereitung des peripheren mononukleären Blutzellen (PBMCs) von menschlichen Buffy Coats
Hinweis: Wir erhielten buffy Coats von gesunden Probanden einen Tag nach der Entnahme in 50 mL Beuteln. Sie waren Einverständniserklärung zur Verfügung gestellt und durch das Interregionale Blutspende Schweizeriches Rotes Kreuzgesammelt. Wir behandelt sie mit dem Verfahren unter, bei Raumtemperatur, wenn nicht anders angegeben.
- Bereiten Sie ein steril und sauber Paar Scheren und 1 L Becher mit einer Plastiktüte (unter einer Lamina-Flow).
- Transfer der buffy Coat in das Becherglas und öffnen Sie es vorsichtig mit der Schere.
- Mit einem 25-mL-Pipette, 100 mL von Phosphat-gepufferte Kochsalzlösung Puffer/Ethylenediaminetetraacetic Säure hinzufügen (PBS/EDTA: PBS 1 X pH 7.4 enthält keine CaCl2 und kein MgCl2, ergänzt mit 2 mM EDTA pH 8,0).
Hinweis: Mit dem gleichen pipette und nach dem Pipettieren der Lösung langsam rauf und runter, Spenden 25 mL der verdünnten buffy Mantel in 6 konische Zentrifuge Rohre von 50 mL vorausgefüllt mit 15 mL Polysaccharid-basierte Dichtegradient. - Zentrifugieren Sie 20 min. bei 800 X g mit mäßiger Beschleunigung (auf 4 von 9 gesetzt) und ohne Bremse, um Trennung von Zellen anhand ihrer Dichte zu ermöglichen.
Hinweis: Nach Zentrifugation werden drei Schichten sichtbar sein; ein Pellet, Erythrozyten und Granulozyten, eine obere Schicht besteht aus Plasma, und dazwischen einen weißen Ring mit peripheren mononukleären Zellen (PBMCs) enthalten. - Ernten Sie die PBMC-Ring mit einem 10 mL-Pipette und Übertragung auf neue 50 mL-Tuben.
Hinweis: Zwei bis drei 50 mL Röhrchen sind normalerweise pro buffy Mantel benötigt. In diesem Stadium verschmutzt einige Plasma wahrscheinlich die gesammelten PBMCs, die keine Auswirkungen auf die anschließende Anreicherung Schritte haben sollte. - Top-bis zu 50 mL jedes Rohr mit PBS/EDTA und fahren Sie mit drei aufeinander folgenden Waschungen mit abnehmender Zentrifugation Zeit und Geschwindigkeit (15 min bei 520 x g, 10 min bei 330 X g, 8 min. bei 150 X g).
Hinweis: Bei jedem Schritt wird der Überstand in einem flüssigen Abfallbehälter abgegossen und die Zelle Pellet wird in 50 mL PBS/EDTA Nukleinsäuretablette (Pellets können nach der ersten Wäsche gepoolt). - Nach der letzten Wäsche Aufschwemmen der Pellets in 25 mL einen eiskalten Lyse-Puffer (siehe Tabelle der Materialien), die roten Blutkörperchen durch osmotischen Druck zu lösen.
- Inkubieren, bis die Lösung klar wird (≤5 min bei Raumtemperatur).
- Stoppen Sie die Reaktion durch Zugabe von 25 mL Trennung Puffer (PBS 1 x pH 7.4 enthält keine CaCl2 und kein MgCl2, ergänzt um 2 % Hitze-inaktivierten fetalen bovine Serum (FBS) und 1 mM EDTA pH 8,0).
- Waschen Sie ein weiteres Mal bei 150 X g für 8 min.
Hinweis: In diesem Stadium PBMCs einsetzbar als größte Population (siehe Schritt 3: PBMCs und Monozyten Behandlungen und stimulierende Bedingungen) oder für Monocyte Bereicherung verarbeitet (siehe Schritt 2: Vorbereitung der Monozyten von PBMCs), oder gefroren nach unten für eine spätere Verwendung (siehe Schritt 5: Monozyten und PBMCs Einfrieren/Auftauen-Verfahren).
2. Vorbereitung von Monozyten aus PBMCs
- Aufschwemmen Sie der PBMCs am Schritt 1.10 Trennung Puffer erhalten und zählen sie 5 x 107Zellen/mL erreichen.
- Übertragen Sie die Zellsuspension in einer 14 mL konische Zentrifugenröhrchen mit Kappe.
- Fügen Sie 50 µL Monocyte Bereicherung Antikörper cocktail pro mL Zellsuspension, Wirbel, und 10 min bei 4 ° c inkubieren
- Fügen Sie 50 µL Monocyte Bereicherung Perlen pro mL von Zellen.
Hinweis: Die Perlen müssen gründlich verwirbelt, Homogenität der Suspension zu gewährleisten. - Nach dem Hinzufügen von Perlen, kurz die Zellsuspension Wirbel und 5 min bei 4 ° c inkubieren
- Spülen Sie den oberen Teil des Rohres mit Trennung Puffer, bis das Rohr bis zu 10 mL gefüllt ist.
- Mischen Sie die Lösung langsam durch Pipettieren rauf und runter.
- Legen Sie das Rohr ohne Kappe in eine Trennung-Magnet.
- 2,5 min bei Raumtemperatur inkubieren.
- Gießen Sie langsam in eine konische Zentrifugenröhrchen 15 mL.
- In diesem Stadium Monozyten direkt verwenden (siehe Schritt 3: PBMCs und Monozyten Behandlungen und stimulierende Bedingungen) oder in ichMmature MoNocyte abgeleitet Dendritic CElls (iMoDCs) zu unterscheiden (siehe Schritt 4), oder frieren sie Sie zur späteren Verwendung (siehe Schritt 5).
(3) PBMCs und Monozyten Behandlungen und stimulierende Bedingungen
- Zellen zu zählen und in Kulturmedium zu verdünnen (Roswell Park Memorial Institute Medium (RPMI) 10 % FBS + 1 mM Natrium Pyruvat + 100 U/mL Penicillin Streptomycin (Pen/Strep) + 5 µM β-Mercaptoethanol), bis zu 1,25 x 104 Zellen/gut.
- Verteilen Sie 30 µL Zellsuspension pro Bohrloch von 384-Well-Platte.
- Fügen Sie 15 µL 4 x konzentrierten zusammengesetzte Lösungen und Pre-Inkubation für 1 h bei 37 ° C, 5 % CO2.
- Hinzufügen von Lipopolysaccharid (LPS), eine Endkonzentration von 10 ng/mL, erschöpft Zymosan (DZ), eine Endkonzentration von 100 µg/mL oder in plain Medium halten.
- Inkubation über Nacht bei 37 ° C, 5 % CO2.
- Nehmen Sie 10 µL des Überstands sekretierten TNF-a-Niveau messen (siehe Schritt 7: Zytokine und Lebensfähigkeit Messungen).
(4) Monozyten Unterscheidung in iMoDCs und stimulierende Bedingungen
- Zentrifugieren Sie die Zellsuspension bei 520 X g für 5 min und zählen Sie Monozyten (angereichert mit Schritt 2).
- Pipette aus der Überstand und fügen Kulturmedium (RPMI + 10 % FBS, eine endgültige Zellsuspension von 0,4 x 106 Zellen/mL zu erhalten.
- Fügen Sie 80 ng/mL rekombinanten menschlichen IL-4 + 100 ng/mL GM-CSF.
- 5 mL Zellsuspension pro Bohrloch in einer 6-Well-Platte zu verzichten.
- 7 Tage bei 37 ° C, 5 % CO2inkubieren.
- Am 7.Tag ernten Sie Zellen durch Pipettieren sanft um die Aktivierung zu vermeiden.
- Zentrifuge bei 520 X g für 5 Minuten.
- Vakuum-Aspirat und in 50 mL Kulturmedium ohne Wachstumsfaktoren aufzuwirbeln.
- 520 X g für 5 min Zentrifugieren und 1 x 106 Zellen/ml in Kulturmedium aufzuwirbeln.
- 100 µL Zellsuspension (105 Zellen) pro Bohrloch einer 96-Well Flachboden-Platte zu verzichten.
- Pre-incubate für 1 h bei 37 ° C nach Zugabe von 50 µL 4 X konzentriert zusammengesetzte Lösungen, wie in Schritt 8 beschrieben: Vorbereitung Verbindungen.
- Fügen Sie 50 µL Reize (4 X konzentriert), wie in Schritt 9 beschrieben.
- 24 h bei 37 ° c inkubieren
- Mischen Sie jeden Brunnen und Transfer Zellen und überstand (SN) in eine 96-Well-V-Boden-Platte.
- Spin-down bei 475 X g für 5 Minuten.
- Überstand in eine neue Flachboden 96-Well-Platte zu übertragen, zu versiegeln und Einfrieren bei-20 ° C bis zur weiteren Verwendung.
(5) Monozyten und PBMCs Einfrieren/Auftauen Verfahren
-
Einfrieren
- Spin-down PBMC oder Monocyte Zelle Vorbereitungen bei 520 X g für 5 Minuten.
- Vakuum anzusaugen überstand und Aufschwemmen Zellen im eiskalten Medium 1 x 107 Zellen/ml.
- 1 mL Zellsuspension in Cryoröhrchen zu verzichten, die Röhren auf eine spezifische Kühlvorrichtung übertragen (siehe Materialtabelle) und legen Sie sie bei-80 ° C.
-
Auftauen
- Die Cryotube Auftauen und schnell seine Inhalte in eine 15 mL konische Zentrifugenröhrchen mit 9 mL Kulturmedium übertragen.
- Zentrifuge bei 520 X g für 5 Minuten.
- Vakuum-Aspirat überstand und Zelle Pellet in 5 mL Kulturmedium aufzuwirbeln. Zellen sind nun bereit für weitere experimentelle Verarbeitung.
(6) Maus Milz Zellen Vorbereitung und Behandlung
Hinweis: Wir führten Tieropfer gemäß den Richtlinien und Normen von Novartis Animal Welfare Organization. Studien wurden von der Ethikkommission der regionalen staatlichen Behörde genehmigt (Kantonales Veterinäramt der Stadt Basel). Bei allen Anstrengungen unternommen, um Leiden zu minimieren haben wir Tiere von Isofluran Überbelichtung, geopfert.
- Die Milz zu ernten und Gewebe mit einem Schlauch mit einer mechanischen Gewebe Mahlwerk ausgestattet und mit 5 mL kaltes RPMI Medium gefüllt zu distanzieren.
- Verwenden Sie das Milz-Programm der Dissoziation Maschine um Organe zu mahlen.
- Filtern Sie die Zellen durch ein 100 mm Nylon Zelle Sieb.
- Übertragen Sie die Aufhängung in 50 mL-Tuben und Zentrifuge bei 4 ° C für 10 min bei 320 X g.
- Vakuum-Aspirat überstand, Aufschwemmen der Zelle Pellet in 3 mL eiskaltes Lyse Puffer und inkubieren ≤2 min auf Eis.
- Lyse durch Zugabe von 7 mL RPMI Medium zu stoppen.
- Erneut durch ein 100 µm Nylon Zelle Sieb filtern.
- Spin-down Zellsuspension bei 330 X g für 10 min bei 4 ° C.
- Vakuum-Aspirat überstand und Aufschwemmen Zellen 11 x 106 Zellen/ml in kompletten Medium (RPMI ergänzt mit 10 % FBS, 100 U/mL Pen/Schritt und 5 µM β-Mercaptoethanol).
- Platte 1 x 106 Zellen/Well (90 µL) in eine 96-Well-Platte (Flachboden).
- Hinzufügen von 20 X 5 µL konzentriert zusammengesetzte Lösung zuvor in RPMI Medium verdünnt, wie unter Punkt 8.3 beschrieben: serielle Verdünnung für murine Milzzellen.
- 30 min bei 37 ° C, 5 % CO2inkubieren.
- Fügen Sie 5 µL 20-fach konzentrierter DZ (Endkonzentration 30 µg/mL) oder 20-fach konzentrierter LPS + IFN-g (TLR-4) (Endkonzentration 1 µM LPS und 10 ng/mL IFN-g).
- Inkubation über Nacht bei 37 ° C, 5 % CO2.
- Zentrifuge bei 330 X g für 10 Minuten.
- Überstände in neue Platten zu übertragen, zu versiegeln und Einfrieren bei-20 ° C bis zur weiteren Verwendung.
(7) Zytokine und Lebensfähigkeit Messungen
-
Menschlichen TNF-a Messung von HTRF (homogene Zeit gelöst Fluoreszenz)
Hinweis: Das Protokoll hielt sich der Lieferant Empfehlungen, im folgenden kurz zusammengefasst.- Mix 1-Volume wiederhergestellten Reagenzes (anti-TNF-a-Cryptate und Anti-TNF-a-XL665) mit 19 Bände der Rekonstitution Puffer (50 mM Phosphat-Puffer pH 7,0, 0.8 M Kalium Fluorid (KF), 0,2 % Rinderserumalbumin (BSA)).
- Mischen Sie die beiden Lösungen der Ready-to-Use Antikörper 1:1 kurz vor Abgabe der Reagenzien.
- 10 µL Überstände von 3.6 betreten weiß 384-Well-Platten zu verzichten.
- 10 µL des Antikörper-Mix zu verzichten.
- Die Platte mit einer Versiegelung abdecken und über Nacht bei 4 ° C inkubieren.
- Platte auf einer Mikrotestplatte Reader (50 – 200 Flash) zu lesen.
- Menschlichen IL-23-Messung von HTRF (homogene Zeit gelöst Fluoreszenz)
Hinweis: Das Protokoll hielt sich der Lieferant Empfehlungen, im folgenden kurz zusammengefasst.- Mischen Sie 1 Volumenteil wiederhergestellten Reagenz (anti-IL-23-Cryptate-Antikörper und Anti-IL-23 D2-Antikörper) mit 19 Bände der Detektionspuffer #3.
- Mischen Sie die beiden Lösungen der Ready-to-Use Antikörper 1:1 kurz vor Abgabe der Reagenzien.
- 10 µL Überstände von 3.6 betreten weiß 384-Well-Platten zu verzichten.
- 10 µL des Antikörper-Mix zu verzichten.
- Die Platte mit einer Versiegelung abdecken und über Nacht bei 4 ° C inkubieren.
- Lesen Sie die Platte auf einer Mikrotestplatte Reader (50 – 200 nm Flash).
-
Menschlichen IL-6, IL-1β, IL-8 und TNF-α-Messungen von electrochemiluminescence
Hinweis: Alle Proben wurden bei 1/150 diluent 2 verdünnt (ersten Verdünnung: 10 µL in 150 µL, dann 20 µL in 180 µL). Das Protokoll des Lieferers Empfehlungen gefolgt:- Verdünnte Proben und Standard im Verdünnungsmittel 2.
- Fahren Sie mit Verdünnung des Standards in diluent 2 mit einer 1/4 serielle Falte Verdünnung.
- Waschen Sie Platten drei Mal mit Waschpuffer.
- 50 µL von Proben oder Standard pro Bohrloch zu verzichten.
- 2 h bei Raumtemperatur unter Rühren inkubieren.
- Waschen Sie die Platte viermal mit PBS + 0,05 % Polysorbat 20.
- 25 µL Detektionsantikörper (60 µL jeder Antikörper für die letzten 3 mL) in Verdünnungsmittel 3 hinzufügen.
- 2 h bei Raumtemperatur unter Rühren inkubieren.
- Waschen Sie die Platte viermal mit PBS + 0,05 % Polysorbat 20.
- Vermeidung von Luftblasen, 150 µL pro Bohrloch lesen Sie Puffer hinzufügen (Tris-Puffer mit Tripropylamine, verdünnt 2 X im DdH20) als Co Reaktionspartner für die Lichterzeugung in Electrochemiluminescence Immunoassays.
- Lesen Sie die Platte (ohne Verzögerung) auf ein Lesegerät, Multiplex-Platte.
-
Maus TNF-a Messung mittels ELISA nach dem Lieferanten-Protokolls
- Verdünnen Sie überstand 1:1 im Assay Verdünnungsmittel (gebrauchsfertig Protein-haltigen Puffer).
- Bereiten Sie standard Verdünnungen, Reagenzien und Proben, wie im Lieferumfang beschrieben. Jede Vertiefung 50 μl Assays Verdünnungsmittel hinzufügen.
- Fügen Sie 50 μL Standard, Kontrolle oder Probe pro Bohrloch.
- Durch leichtes Klopfen Kennzeichenrahmen für 1 min mischen.
- Mit den mitgelieferten Klebestreifen abdecken und 2 h bei Raumtemperatur inkubieren.
- Aspirieren Sie jeweils gut und waschen mit 400 μl/Well (wiederholen Sie diesen Schritt fünf Mal insgesamt).
- Entfernen Sie nach dem letzten Waschen alle verbleibenden Waschpuffer durch Absaugen.
- Invertieren der Plattenrandes und tupfen Sie gegen saubere Papiertücher.
- Fügen Sie 100 μL der Maus TNF-α-Konjugat in jede Vertiefung. Mit einem neuen Klebestreifen abdecken.
- 2 h bei Raumtemperatur inkubieren.
- Wiederholen Sie die Aspiration/Waschgang wie in Schritt 7.4.4.
- Jedes gut fügen Sie 100 μl Substratlösung hinzu und inkubieren Sie für 30 min bei Raumtemperatur vor Licht geschützt werden.
- Jedes gut 100 μl verdünnter Salzsäure-Lösung (Hand) hinzufügen. Klopfen Sie leicht die Platte, um eine gute Durchmischung zu gewährleisten.
- Messung der Extinktion bei 450 nm (mit der Korrektur-Wellenlänge eingestellt auf 560 nm) mit einer Mikrotestplatte Leser (innerhalb von 30 Minuten erfolgen).
- Verdünnen Sie überstand 1:1 im Assay Verdünnungsmittel (gebrauchsfertig Protein-haltigen Puffer).
-
Zellviabilität
- Nach dem Entfernen Überstände von PBMC oder Monocyte Zubereitungen, bewerten Sie Zellviabilität mit ein fertiges Resazurin Lösung (Oxidations-Reduktions-Indikator) direkt an die Zellsuspension auf 10 % Endkonzentration hinzugefügt.
- 1 bis 2 h bei 37 ° C, 5 % CO2inkubieren.
- Lesen Fluoreszenz bei 590 nm (Anregung 540 nm) mit einer Mikrotestplatte Reader.
8. zusammengesetzte Vorbereitung
-
Serielle Verdünnung für iMoDCs
- Verdünnen Sie die MLT-827-Stammlösung (10 mM in Dimethyl Sulfoxid (DMSO) in Medium, 8 µM in einem Rutsch (4 X konzentriert) zu erreichen.
- Führen Sie eine sechs-Schritt 1:5 serielle Verdünnung, mit Medium + 0,08 % DMSO. Verwenden Sie das gleiche Medium + 0,08 % DMSO-Lösung für den Zustand des Fahrzeugs (keine Verbindung).
-
Einzeldosis Tests für iMoDCs
- Verdünnen Sie die MLT-827, AFN700 und Cpd11 auf Lagerlösungen in Mittel-bis 4 µM in einem Rutsch (4 X konzentriert) zu erreichen.
-
Serielle Verdünnung für murine Milzzellen
- Verdünnen Sie eine 10 µM MLT-827-Lösung (gewonnen aus einer 10 mM Vorratslösung nach einer ein gehen Verdünnung im Medium) bis 0,01 µM mit einer DMSO-Ende-Konzentration von 0,1 %.
- Nehmen Sie für die Verdünnung Schritte 2 µL jeder Verdünnung, 38 µL RPMI, und Pipettieren 5 µL in den Brunnen.
Hinweis: Alle Behandlungen sind in dreifacher Ausfertigung.
9. Reize Vorbereitung
-
Abgereichertem Zymosan (DZ)
- 10 mg DZ. 2 mL sterilem Endotoxin-freies Wasser hinzufügen
- Wirbel um Vorratslösung Wirbel auch vor jedem Gebrauch homogenisieren.
- Aliquoten Lösung und Store Aliquote bei-20 ° C.
-
Trehalose-6,6-Dibehenate (TDB)
- 1 mg TDB, Hitze bei 60 ° C in einem Wasserbad für 15-30 s 100 µL von DMSO hinzufügen.
- Wirbel und 900 µL steriler PBS, Wirbel wieder sofort hinzufügen.
- 10 – 15 min. bei 60 ° C erhitzen und Homogenisieren von vortexen vor jedem Gebrauch.
- Halten Sie die Lösung bei 4 ° C.
- Durchführen Sie Verdünnungsreihen und Einzeldosis Vorbereitung für die MLT-827-Verbindung.
Hinweis: Weil TDB in DMSO vorbereitet werden muss, ist eine 1 % DMSO Endkonzentration Zellstimulation anwesend.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
In myeloische Zellen Relais MALT1 Aktivierung Signale unterhalb der mehrere C-Art Lectin-Like-Rezeptoren, wie z. B. Dectin-1, Dectin-2 und MINCLE6. Diese Wege verlassen sich auf (Saum) ITAM Motiv-haltigen Rezeptoren (z. B., Dectin-1) oder ITAM Motiv-haltigen Co-Rezeptoren (z. B., FcRγ für Dectin-2 und MINCLE), das rekrutieren und aktivieren die Kinase SYK (Abbildung 1). Dies führt zu einer Aktivierung von einem Protein Kinase C Isoform, nämlich PKCδ, die CARD9, und lösen so CARD9/BCL10/MALT1 Komplexbildung und Rekrutierung von TRAF6 für nachgeschalteten NF-κB Aktivierung12phosphorylates. Im Gegensatz dazu rekrutiert die TLR-4-Weg TRAF6 in einem MALT1 selbstständig, aber MYD88/IRAK-abhängigen Weise für die NF-κB Aktivierung (Abbildung 1). Beweise für diese differenzierte Beteiligung von MALT1 wurde mittels genetischer Modelle von MALT1 Mangel sowie pharmakologische Behandlung mit dem peptidischer aktiv-Website-Hemmer Z-VRPR-Fmk11,13,14erhalten.
Wir benutzten kürzlich berichtete potente und selektive MALT1 Inhibitor MLT-82715 und fragte, ob diese Verbindung TNF-flussabwärts C Typ Lektin-Like und Toll-Like Rezeptoren, bzw. regulieren würden. Menschlichen PBMCs und Maus Milzzellen wurden mit abgereichertem Zymosan (DZ, einen bekannten Agonisten Dectin-1) stimuliert oder Lipopolysaccharid (LPS, einen bekannten Agonisten des TLR-4) und wir gemessen TNF-Release in der Kultur überstand nach 20 h. In der Mensch und die Maus-Assays blockiert MLT-827 selektiv TNF-Produktion angetrieben durch den Dectin-1-Weg, aber nicht von der TLR-4-Weg (Abbildung 2). Wir erhalten ähnliche Daten nach Inkubation mit der Z-VRPR-Fmk-Verbindung (ergänzende Abbildung 1).
Um Weg Erkenntnisse zu gewinnen, führten wir weitere Experimente in menschlichen Monozyten und unreife Monozyten-abgeleitete dendritische Zellen (iMoDCs), vergleicht man die Wirkung von MLT-827 SYK-Inhibitor Cpd1116 und derjenigen der IKK-Inhibitor AFN70015 . In Monozyten mit LPS stimuliert, Produktion von TNF-α wurde fast vollständig aufgehoben durch AFN700 aber war nicht empfindlich auf Cpd11 (Abbildung 3A), das steht im Einklang mit der Abhängigkeit/Unabhängigkeit des TLR-4-Signalwegs auf NF-κB/SYK Aktivität, bzw. () (siehe Abbildung 1). Im Gegensatz dazu, TNF-α Produktion angetrieben Dectin-1 in iMoDCs Empfindlichkeit zu Cpd11 zusätzlich angezeigt Empfindlichkeit gegenüber MLT-827 und AFN700 (Abb. 3 b, ergänzende Abbildung 2), weitere Beweise für eine Beteiligung von SYK/CBM-Signalisierung Kaskade in den Dectin-1 Weg (Abbildung 1). Bemerkenswert, Herstellung von IL-1, IL-6 und IL-23 nach Dectin-1 Stimulation war auch empfindlich auf die drei Inhibitoren damit angibt Regulationsmechanismen ähnlich wie TNF-. Jedoch schlug eine begrenzte Wirkung der drei Verbindungen auf die Produktion von IL-8 verschiedene Regelmechanismus für dieses Zytokin (Abb. 3 b, ergänzende Abbildung 2).
Neben Dectin-1, andere CLLRs, wie Dectin-2 und MINCLE, Funktion über Stimulation der CARD9 Signalosome7. Wir haben daher MLT-827 in iMoDCs vor der Herausforderung, des MINCLE-Agonist Trehalose-6,6-Dibehenate (TBD) getestet. TBD-Konzentrationen über 50 µg/mL Anhebung führte zur Produktion von TNF-IL-6 und IL-1, die auf MALT1 Paracaspase Aktivität zu verlassen, wie aus der Sperrwirkung des MLT-827 (Abb. 4A). Konsistente Ergebnisse wurden erzielt, wenn anspruchsvolle iMoDCs mit steigenden Konzentrationen von DZ, Dectin-1 (Abbildung 4 b) zu stimulieren.
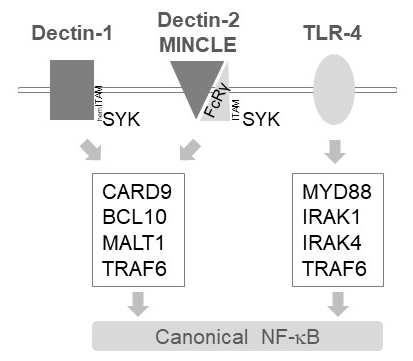
Abbildung 1: NF-κB-Signalisierung nachgelagerten Dectin-1, MINCLE und TLR-4. Die Karikatur zeigt die wichtigsten Funktionen des kanonischen NF-κB Aktivierung Bahnen stromabwärts von Dectin-1, Dectin-2, MINCLE oder TLR-4 in myeloid Zellen. HemITAM-haltigen Dectin-1 Rezeptor17 können SYK Komplexbildung CBM (CARD9/BCL10/MALT1), führt zu TRAF6 von NF-κB Aktivierung stimulieren direkt engagieren. Anderen C-Art Lectin-Like-Rezeptoren wie Dectin-2 oder MINCLE müssen eine ITAM-haltigen FcRγ Kette zu engagieren einen CBM und Aktivierung von NF-κB zu rekrutieren. TLR-4 Rezeptoren verwenden einen anderen Mechanismus für die NF-κB Aktivierung, unter Berufung auf MYD88 und IRAK1/IRAK4 Kinasen stromaufwärts von TRAF6.

Abbildung 2: Dectin-1 Signale über MALT1 zur Produktion von TNF-α in der Human- und Mauszellen. (A) menschliche PBMCs Daten wie Unterreiner Et Al., 2017 (Abbildung 2A)11. Menschlichen PBMCs wurden mit 1 ng/mL von LPS (TLR-4-Agonist) oder 100 µg/mL DZ (Dectin-1 Agonist) für 20 h in Anwesenheit von abgestuften Konzentrationen von MLT-827 stimuliert. TNF-veröffentlicht im Überstand wurde durch HTRF quantifiziert. (B) Maus Milzzellen, mit einer Konzentration Palette von MLT-827 für 30 min und anschließend behandelt wurden mit 30 µg/mL stimuliert, DZ oder 1 µg/mL LPS + 10 ng/mL IFN - 18 h. TNF-α in der Zellkultur Überstand wurde durch ELISA gemessen. Einer der zwei Experimente mit ähnlichen Ergebnissen wird gezeigt, wie ± SEM von drei Messungen bedeutet.

Abbildung 3: IKK - und/oder SYK-Abhängigkeit der Produktion von Zytokinen stromabwärts des TLR-4 und Dectin-1. (A) menschlichen Monozyten waren vorbehandelt für 1 h mit MLT-827 (1 µM), Cpd11 (1 µM) oder AFN700 (3 µM) oder Fahrzeug (DMSO). Zellen wurden mit 10 ng/mL LPS für 20 h angeregt und TNF-im Überstand wurde durch HTRF quantifiziert. (B) TNF-α, IL-1β, IL-6, IL-23 und IL-8 Produktion von menschlichen Monozyten-abgeleitete dendritische Zellen (iMoDCs) für 24 h mit DZ stimuliert (100 µg/mL) nach 1 h Vorinkubation mit MLT-827, Cpd11, AFN700 (alle auf 1 µM) oder DMSO. Zytokin Ebenen in DMSO-behandelten Proben wurden auf 100 % gesetzt. Daten sind Mittel ± SD von drei Messungen, und Vertreter der drei unabhängigen Experimenten. * P < 0,05; ** P < 0,01; P < 0,001, ungepaarten zweiseitigen Student t-Test.

Abbildung 4: C Typ Lektin-ähnlichen-abhängigen Zytokin-Produktion von iMoDCs. TNF-α, IL-1β und IL-6 Produktion durch iMoDCs angeregt für 24 h mit MINCLE-Agonist Trehalose-6,6-Dibehenate (TDB, 100 µg/mL) (A) oder mit den Dectin-1 Agonist DZ (100 µg/mL) (B) nach 1 h Vorinkubation mit MLT-827 (1 µM) oder DMSO. Daten sind Mittel ± SD von drei Messungen und Vertreter der drei unabhängigen Experimenten.
Ergänzende Datei 1. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Datei 2. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Datei 3. Bitte klicken Sie hier, um diese Datei herunterladen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In dieser Arbeit verwendeten wir einfache experimentelle Einstellungen um Signalwege in der Human- und angeborene Mauszellen zu studieren und ihre Abhängigkeit von MALT1 proteolytischen Funktion zu verhören. Aufbauend auf früheren Arbeiten11, zeigte unsere Studie, dass MALT1 Paracaspase Aktivität C-Type Lektin-ähnlichen Rezeptoren induzierte Produktion von Zytokinen, einschließlich TNF-α steuert. Im Gegensatz dazu war TLR-4-induzierte TNF-α unabhängig von MALT1 in beiden Arten. Kollektiv, bestätigt diese Daten den Schlüssel und selektive Beitrag der MALT1/CBM Signalosome flussabwärts von C-Art Lectin-Like-Rezeptoren, die von früheren Studien6,12,18vorgestellt wurde.
Ob die klare Unabhängigkeit von TLR-4 Signalisierung auf MALT1 in myeloische Zellen zueinander gilt Typen Zelle bleibt, erkundet zu werden. Beispielsweise wurde in B-Lymphozyten, TLR-Signalisierung zuvor gezeigt, zur B-Zell-Aktivierung stromabwärts von der B-Zell-Antigen-Rezeptor19beitragen. In der Tat haben wir unveröffentlichte Beweise, dass TLR-4 Mensch angeregt und Maus B-Zellen Sensibilität zu MLT-827 zeigen. Daher werden weitere mechanistische Einblicke stromabwärts des B-Zell-Rezeptors wertvoll sein. In diesem Zusammenhang stellte eine aktuelle Studie in B-Zell-Lymphom Beweis für das clustering der Signalwege stromabwärts von der B-Zell-Rezeptor und TLR9 Rezeptor20. TRAF6, fungiert als Vermittler für die NF-κB Aktivierung in der B-Zell-Rezeptor und der TLR-Wege, möglicherweise ein Punkt von Crosstalk, die die Empfindlichkeit der beiden Wege MALT1 Protease Inhibition erklären könnte. Umgekehrt TRAF6 ist auch ein gemeinsames nachgelagerten Spieler CLLRs und TLR für die Induktion von NF-κB aber diese zwei Wege scheinen nicht zu Übersprechen auf MALT1 Paracaspase-abhängigen Weise in myeloid Zellen.
Diese Arbeit konzentrierte sich auf die Produktion von Zytokinen, ein leicht auslesen Signalwege und leicht umsetzbar für zusammengesetzte Profilierung. Er betonte den Wert der selektiven und potente Hemmstoffe von MALT1 für unravelling MALT1 Biologie. Weitere mechanistische Einblicke zu erhalten erfordert zusätzliche Arbeit und Entwicklung von mehr proximalen Assays, z. B. die Substrate von MALT1 beteiligt bei angeborenen Signalisierung Verordnung zu charakterisieren.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Wir danken für ihre Berechtigung (Lizenz-Nummer 4334770630127), hier zu reproduzieren Figur 2A von Unterreiner Et Al. Elsevier (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



