Summary
Doğuştan gelen bağışıklık MALT1 düzenleyen ama nasıl oluşur kötü tanımlanmış kalır. Biz doğuştan gelen sinyal MALT1 myeloid sitokinler, üretimini düzenler gösteren Toll benzeri veya C tipi lektin-benzeri reseptörler aşağı ve aşağı akım için MALT1 katkısını çözülmeye selektif MALT1 paracaspase inhibitörü MLT-827 kullanılan C tipi lektin benzeri reseptörlerinin seçerek.
Abstract
Çok sayıda çalışma tarafından ele onun fonksiyonu yanında lenfoid hücrelerde paracaspase MALT1 da doğuştan gelen hücrelerin aşağı desen tanıma reseptörleri önemli bir rol oynar. En iyi okudu bir SYK ve CARD9 art arda sıralı bir MALT1 bağlı şekilde NF-κB harekete geçirmek için önde gelen sinyal bağımlı neden Dectin-1 ve Dectin 2 C tipi lektin benzeri reseptör aile üyesidir. Buna karşılık, Toll benzeri reseptörler (TLR), TLR-4 gibi NF-κB harekete geçirmek ama bir MYD88/Irak-bağımlı cascade üzerinden sinyal yaymak. Yine de, ister MALT1 TLR-4 sinyal için katkıda belirsiz kalmıştır. Son kanıtlar ile MIT-827, güçlü ve selektif inhibitörü olan MALT1 paracaspase etkinlik, MALT1 olan TNF-üretim aşağı TLR-4 insan myeloid hücrelerin Dectin-1, bağımsız olarak MALT1, TNF-üretim akıntıya karşı olduğunu gösterir bağımlı. Burada, biz MALT1 seçici katılımı daha da algılama, insan ve fare hücresel ürünleri ve Dectin-1, MINCLE veya TLR-4 yolları uyarılması çeşitli kullanarak örüntü tanıma içinde ele. Biz de sitokinler ötesinde TNF-keşfetmek ve MIT-827 SYK inhibitörü (Cpd11) ve bir IKK inhibitörü (AFN700) karşılaştırma ek anlayışlar sağladı. Topluca, sağlanan verileri C tipi lektin benzeri reseptör MALT1-bağımlılık için daha fazla kanıt — buna karşılık TLR sinyalli için sinyal.
Introduction
MALT1 paracaspase etkinliği (mukoza ilişkili lenfoid doku Lenfoma translocation protein 1) 20081,2' ortaya koydu. O zamandan beri çalışmalar bir dizi kritik katkısının antijen reseptör yanıtları lenfositler bildirdin. Genetik modelleri T hücreleri, T-hücre bağımlı otoimmünite ve B hücreli lenfoma ayarları3,4önemli bir rol Farmakoloji veri desteği yanı sıra Mouse. Lenfosit, derleme antijen reseptör proksimal sinyal tarafından tetiklenen bir CARD11-BCL10-MALT1 karmaşık5' in üzerine MALT1 paracaspase etkinleştirme oluşuyor T veya B hücre reseptörü aşağı. Ayrıca benzer bir CARD9-BCL10-MALT1 kompleksi örneğin C tipi lektin-benzeri reseptörler (CLLR), akıntı yönünde sinyaller yayma için önemlidir yeterli kanıt olduğunu, Dectin-1, Dectin-2 ve MINCLE içinde myeloid hücrelerin6,7. Dectin-1, özellikle de bu yolu mantar enfeksiyonları8,9karşı ana savunma için önemli olduğundan çalışılmıştır. MALT1 dolaylı olarak Toll benzeri reseptör (TLR) yollar, ancak, tartışmalı10kalmıştır. Son kanıtlar insan myeloid hücrelerin TNF-üretim aşağı TLR-411tür ile MALT1 paracaspase etkinliği için doğrudan bir rol dışarı karar verdi.
Mevcut çalışma, biz çeşitli deneysel ayarları ve uyarıcı koşullarda insan ve fare myeloid hücrelerin belirli farmakolojik aracı inhibitörleri ve ölçüm sitokin üretiminin güvenerek doğuştan gelen sinyal yolları, soruşturma için kullandık.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Deneyler kuralları ve standartları Novartis insan araştırma etik kurulu göre yapılmıştır.
1. hazırlık periferik kan mononükleer hücre (PBMCs) insan Buffy kat
Not: Bir gün sonra 50 mL çanta koleksiyonunda sağlıklı gönüllü buffy kat aldık. Onlar onam altında sağlanan ve Interregionale Blutspende Schweizeriches Rotes Kreuztoplanan. Aksi belirtilmediği sürece oda sıcaklığında, aşağıdaki yordamı kullanarak idare ettik.
- Makas ve bir 1 L ölçek (altında lamina akışı) plastik bir torba ile steril ve temiz bir çifti hazırlayın.
- Buffy kat kabı aktarmak ve dikkatle makas ile açın.
- 25 mL pipet kullanarak eklemek 100 mL fosfat tamponlu tuz arabellek/ethylenediaminetetraacetic asit (PBS/EDTA: PBS 1 x pH 7.4 hiçbir CaCl2 ve hiçbir MgCl2, içeren takviye ile 2 mM EDTA pH 8.0).
Not: İstimal ayni pipet ve yavaş yavaş çözüm yukarı ve aşağı pipetting sonra seyreltilmiş buffy kat 25 mL 50 mL polisakkarit tabanlı yoğunluk gradient 15 mL ile önceden dolu 6 konik santrifüj tüpler içine dağıtmak. - Orta ivmesi (4 dışarı-in 9'ayarla) vasıl 800 x g 20 dk santrifüj kapasitesi ve onların yoğunlukları dayalı hücreleri ayrılması için izin vermek için fren olmadan.
Not: Santrifüjü sonra üç katmanı görünür hale gelir; kırmızı kan hücreleri ve granülosit, plazma ve periferik kan mononükleer hücreler (PBMCs) içeren bir beyaz yüzük arasında yapılan bir üst katman içeren bir pelet. - Bir 10 mL pipet ve yeni 50 mL tüpler için transfer kullanarak PBMC yüzük hasat.
Not: 2-3 50 mL tüpler normalde buffy kat gereklidir. Bu aşamada, bazı plazma büyük olasılıkla herhangi bir etkisi sonraki zenginleştirme merdivenlerinde olmalıdır toplanan PBMCs kirlenmektedir. - İlâ 50 mL her tüp PBS/EDTA kullanarak üst ve azalan Santrifüjü zaman ve hız (520 x g, 330 x g, 10 min, 150 x gde 8 dk, 15 dk) ile üç ardışık yıkar geçin.
Not: Her adımda, süpernatant kapalı bir sıvı atık kap içinde dökülür ve hücre Pelet PBS/EDTA 50 mL resuspended (Granül havuza alınmış sonra ilk yıkama). - Son yıkama sonra Pelet buz gibi lizis arabelleği 25 mL resuspend (kırmızı kan hücrelerinin ozmotik basıncı parçalayıcı için Malzemeler tablobkz:).
- Çözüm açık hale gelinceye kadar kuluçkaya (Oda sıcaklığında ≤5 dk).
- Reaksiyon ayrılık arabelleği (PBS 1 x pH 7.4 hiçbir CaCl2 ve % 2 ısı inaktive fetal Sığır serum ile (FBS) takıma hiçbir MgCl2, içeren ve 1 mM EDTA pH 8.0) 25 mL ekleyerek durdurmak.
- Bir kez daha vasıl 150 x g 8 dakika yıkayın.
Not: Bu aşamada PBMCs toplu nüfus kullanılabilir (bkz. Adım 3: PBMCs ve monosit tedaviler ve uyarıcı koşullar) veya monosit zenginleştirme için işlenen (bkz. Adım 2: monosit PBMCs üzerinden hazırlanması), ya da buz aşağı sonraki kullanım için (bkz: adım 5: Monosit ve yordamlar donma/çözülme PBMCs).
2. monosit PBMCs üzerinden hazırlanması
- Ayrılık arabellek 1,10 adımda elde PBMCs resuspend ve bunları 5 x 107hücre/mL ulaşmak için kabul.
- Hücre süspansiyon 14 mL konik santrifüj tüpü kap ile içine aktarın.
- Monosit zenginleştirme antikor hücre süspansiyon, mL kokteyl 50 µL eklemek girdap ve 4 ° C'de 10 dakika kuluçkaya
- Monosit zenginleştirme boncuk mL hücre başına 50 µL ekleyin.
Not: Boncuk iyice süspansiyon polimerlerin sağlamak için vortexed olması gerekir. - Boncuklar, kısa bir süre sonra girdap hücre süspansiyon ekleme ve kuluçkaya 4 ° C'de 5 dk sonra
- Tüp 10 mL doldurulana kadar ayrılık arabellek ile tüp üst kısmındaki durulayın.
- Yavaş yavaş çözüm yukarı ve aşağı pipetting tarafından karıştırın.
- Tüp cap olmadan bir ayrılık mıknatıs yerleştirin.
- 2.5 dakika oda sıcaklığında kuluçkaya.
- Yavaş yavaş bir 15 mL konik santrifüj tüpüne dökün.
- Bu aşamada, monosit doğrudan kullanın (bkz. Adım 3: PBMCs ve monosit tedaviler ve uyarıcı koşullar) veya bunları mmature Monocyte türetilmiş Dendritic Cells (iMoDCs) benayırt (bkz. Adım 4) veya sonraki kullanım için bunları dondurmak (bkz. Adım 5).
3. PBMCs ve monosit tedaviler ve uyarıcı koşulları
- Saymak hücreleri ve onları kültür ortamında seyreltik (Roswell Park Memorial Enstitüsü Orta (RPMI) %10 FBS + 1 mM sodyum Pyruvate + 100 U/mL penisilin streptomisin (kalem/Strep) + 5 mikron β-mercaptoethanol), 1,25 x 104 hücreleri/iyi aşağı.
- Hücre süspansiyon 384-şey plaka kuyu başına 30 µL dağıtın.
- 4 konsantre bileşik çözümleri x 15 µL ekleyin ve 37 ° c, % 5 CO21 h için önceden kuluçkaya.
- Lipopolysaccharide (LPS) 10 ng/mL, son bir konsantrasyon için ekleme veya 100 µg/mL nihai bir konsantrasyon zymosan (DZ) tükenmiş veya düz ortamda tutmak.
- Gecede 37 ° C, % 5 CO2kuluçkaya.
- TNF-a salgılanan düzeylerini ölçmek için süpernatant ile 10 µL al (bkz. Adım 7: sitokinler ve canlılığı ölçümler).
4. monosit farklılaşma iMoDCs ve uyarıcı koşullar içine
- Monosit (vasıl adım 2 zenginleştirilmiş) sayısı ve hücre süspansiyon vasıl 520 x g 5 dk santrifüj kapasitesi.
- Süpernatant pipet ve kültür orta ekleyin (RPMI + % 10 x 106 hücre/mL 0,4 bir son hücre askıya almak için FBS.
- 80 ng/mL rekombinant insan Il-4 + 100 ng/mL GM-CSF ekleyin.
- Hücre süspansiyon 6-şey plaka bir kuyu başına 5 mL dağıtmak.
- 37 ° c, % 5 CO27 gün kuluçkaya.
- Gün 7, yavaşça onların harekete geçirmek önlemek için pipetting tarafından hücre hasat.
- 5 min için 520 x g , santrifüj.
- Vakum aspiratı ve büyüme faktörleri olmadan kültür ortamının 50 ml resuspend.
- Vasıl 520 x g 5 dk santrifüj kapasitesi ve 1 x 106 hücre/mL kültür ortamında, resuspend.
- Hücre süspansiyon (105 hücreleri), 100 µL 96-şey düz alt plaka kuyu dağıtmak.
- 37 ° C'de 50 ekledikten sonra 1 h için önceden incubate µL 4 x 8 adımda açıklandığı gibi hazırlanan bileşik çözümleri konsantre: bileşikler hazırlık.
- 50 µL uyaranların (4 x) konsantre, hazırlanan 9 adımda açıklandığı gibi ekleyin.
- 37 ° C'de 24 saat kuluçkaya
- Her şey ve transfer hücreleri ve (SN) süpernatant 96-şey V-alt plaka karıştırın.
- Spin aşağı 475 x g 5 min için de.
- Süpernatant yeni bir 96-şey düz alt plaka aktarmak, mühür ve daha fazla kullanılmasını kadar-20 ° C'de dondurmak.
5. monosit ve PBMCs yordamları donma/çözülme
-
Buz gibi
- Spin aşağı PBMC veya monosit hücre hazırlıkları vasıl 520 x g 5 dak.
- Vakum süpernatant Aspire edin ve hücreleri orta 1 x 107 hücre/mL, dondurma resuspend.
- Hücre süspansiyon 1 mL cryotubes dağıtmak, tüpler için belirli bir soğutma aygıtı transfer (bkz: malzemeler tablo) ve-80 ° C'de yer
-
Çözdürme
- Cryotube çözülme ve hızlı bir şekilde içeriğini kültür ortamının 9 mL içeren bir 15 mL konik santrifüj tüpüne aktarın.
- 5 min için 520 x g , santrifüj.
- Vakum aspiratı süpernatant ve resuspend hücre Pelet kültür orta 5 ml. Şimdi daha fazla deneysel işleme için hazır hücrelerdir.
6. fare dalak hücreleri hazırlık ve tedavi
Not: Biz hayvan kurban kuralları ve standartları Novartis hayvan refah kuruluşun göre yapılan. Çalışmalar bölgesel hükümet yetkilisi Etik Komitesi tarafından kabul (Kantonales Veterinäramt der Stadt Basel). Tüm çabalar acı en aza indirmek için yapılan isoflurane tarafından aşırı pozlama, hayvanlar kurban.
- Dalak hasat ve mekanik doku değirmeni aygıt ile donatılmış ve soğuk RPMI orta 5 mL ile dolu bir tüp kullanarak doku ayırmak.
- Organları öğütmek için ayrılma makinenin dalak programını kullanın.
- Hücreleri 100 mm naylon hücre süzgeç aracılığıyla filtre.
- Süspansiyon 50 mL tüpler ve 320 x g, 10 min için 4 ° C'de santrifüj içine aktarın.
- Vakum aspiratı süpernatant, hücre Pelet 3 mL buz gibi lizis arabellek resuspend ve ≤2 min buz için kuluçkaya.
- Lizis RPMI orta 7 mL ekleyerek durdurmak.
- Yine bir 100 µm naylon hücre süzgeç aracılığıyla filtre.
- Spin aşağı vasıl 330 x g 4 ° C'de 10 dakika için hücre süspansiyon
- Aspiratı süpernatant vakum ve hücreleri 11 x 106 hücre/mL tam orta (RPMI %10 FBS, 100 U/mL kalem/adım ve 5 mikron β-Mercaptoethanol ile birlikte), resuspend.
- 1 x 106 hücreler/iyi (90 µL) bir 96-şey plaka (düz dipli) plaka.
- 20 x 5 µL konsantre daha önce RPMI ortamda 8.3 adımda anlatıldığı gibi seyreltilmiş bileşik çözüm ekleyin: fare dalak hücreler için seri seyreltme.
- 30 dk 37 ° c, % 5 CO2için kuluçkaya.
- 20 x 5 µL DZ (son konsantrasyonu 30 µg/mL) konsantre veya 20 x konsantre LPS + IFN-g (TLR-4) (son konsantrasyonu 1 µM LPS ve 10 ng/mL IFN-g) ekleyin.
- Gecede 37 ° C, % 5 CO2kuluçkaya.
- 330 x g , santrifüj 10 dk için.
- Supernatants Yeni tabaklar içinde transfer, mühür ve daha fazla kullanılmasını kadar-20 ° C'de dondurmak.
7. sitokinler ve canlılığı ölçümleri
-
TNF-a insan ölçüm HTRF (homojen zaman çözüldü floresan) tarafından
Not: İletişim kuralı kısaca aşağıda özetlenmiştir tedarikçi firmanın tavsiyeleri takip.- 1 (anti TNF-a-cryptate ve XL665 anti TNF) Sulandırılan reaktif hacmi sulandırma arabellek (50 mM fosfat tampon pH 7,0, 0, 8 M potasyum florür (KF), % 0,2 sığır serum albumin (BSA)) 19 birimleri ile karıştırın.
- İki kullanıma hazır antikor çözüm 1:1 sadece reaktifleri dağıtımı önce karıştırın.
- Supernatants adım 3.6 beyaz 384-şey tabak içine 10 µL dağıtmak.
- Antikor Mix 10 µL dağıtmak.
- Bir mühürleyen ile plaka kapak ve gecede 4 ° C'de kuluçkaya.
- Plaka üzerinde bir Mikroplaka Okuyucu (50-200 flash) okuyun.
- İnsan IL-23 ölçüm HTRF (homojen zaman çözüldü floresan) tarafından
Not: İletişim kuralı kısaca aşağıda özetlenmiştir tedarikçi firmanın tavsiyeleri takip.- Bir birim (anti IL-23-cryptate-antikor ve anti-IL-23 D2-antikor) Sulandırılan reaktif algılama tampon #3 19 birimleri ile karıştırın.
- İki kullanıma hazır antikor çözüm 1:1 sadece reaktifleri dağıtımı önce karıştırın.
- Supernatants adım 3.6 beyaz 384-şey tabak içine 10 µL dağıtmak.
- Antikor Mix 10 µL dağıtmak.
- Bir mühürleyen ile plaka kapak ve gecede 4 ° C'de kuluçkaya.
- Plaka üzerinde bir Mikroplaka Okuyucu (50-200 nm flash) okuyun.
-
İnsan Il-6, Il-8, IL-1β ve TNF-α ölçümleri electrochemiluminescence tarafından
Not: Tüm örnekleri 1/150 Dilüent 2 seyreltilmiş (ilk seyreltme: 150 µL 10 µL sonra 180 µL 20 µL). Protokol tedarikçi firmanın tavsiyeleri takip:- Örnekleri ve standart Dilüent 2 oranında seyreltin.
- Dilüent 2 1/4 seri kat dilüsyonu kullanılarak Standart seyreltme için devam edin.
- Tabak yıkama arabelleği ile üç kez yıkayın.
- Örnekleri veya standart iyi başına 50 µL dağıtmak.
- Ajitasyon altında oda sıcaklığında 2 h için kuluçkaya.
- Dört kez PBS + % 0.05 ile tabak yıkama Polysorbate 20.
- Algılama antikor (her antikor için 3 mL son 60 µL) 25 µL Dilüent 3'te ekleyin.
- Ajitasyon altında oda sıcaklığında 2 h için kuluçkaya.
- Dört kez PBS + % 0.05 ile tabak yıkama Polysorbate 20.
- Bubbles kaçınmak, okuma tamponu kuyu başına 150 µL eklemek (tripropylamine, içeren Tris tabanlı arabellek seyreltilmiş GKD20 2 x) olarak electrochemiluminescence uzun ışık üretimi için ortak bir kapatsınlar.
- (Gecikme) olmadan plaka üzerinde bir multiplex plaka okuyucu okumak.
-
Fare TNF-a tedarikçinin protokol sonrası ELISA tarafından ölçüm
- 1: tahlil seyreltici (protein içeren bir arabellek kullanmaya hazır) 1 süpernatant sulandırmak.
- Reaktifler, örnekler ve standart dilutions Kit'te açıklandığı şekilde hazırlayın. Testin Dilüent 50 μL her şey için ekleyin.
- 50 μL standart, denetim veya örnek iyi başına ekleyin.
- Plaka çerçevesi 1 dk. için hafifçe dokunarak karıştırın.
- Sağlanan yapıştırıcı şerit ile kapak ve oda sıcaklığında 2 h için kuluçkaya.
- Her iyi ve yıkama 400 μL/iyi (Bu adım toplam beş kez tekrar) ile Aspire edin.
- Son yıkama sonra kalan herhangi bir yıkama arabellek tarafından alıyorum kaldırın.
- Plaka ters çevir ve karşı temiz kağıt havlu leke.
- Fare TNF-α eşlenik 100 μL her şey için ekleyin. Yeni bir yapıştırıcı şerit ile kapak.
- Oda sıcaklığında 2 h için kuluçkaya.
- Aspirasyon/yıkama adım 7.4.4 olduğu gibi tekrar.
- Her şey için 100 μL substrat çözeltisi ekleyin ve ışıktan korunan oda sıcaklığında 30 dk için kuluçkaya.
- Seyreltik hidroklorik asit çözüm (durmak eriyik) 100 μL her şey için ekleyin. Ayrıntılı karıştırma sağlamak için plaka hafifçe dokunun.
- 450 de optik yoğunluk ölçmek nm (560 ayarla düzeltme dalga boyu ile nm) Mikroplaka Okuyucu (30 dk içinde yapılması gereken) kullanarak.
- 1: tahlil seyreltici (protein içeren bir arabellek kullanmaya hazır) 1 süpernatant sulandırmak.
-
Hücre canlılığı
- Supernatants PBMC veya monosit hazırlıkları çıkardıktan sonra % 10 son konsantrasyonu hücre süspansiyon doğrudan eklenen resazurin çözümü (korunmada gereken indirgeme potansiyelini göstergesi) kullanmak için bir hazır kullanarak hücre canlılığı değerlendirmek.
- 1-2 h 37 ° c, % 5 CO2için kuluçkaya.
- Floresans 590, okumak bir Mikroplaka Okuyucu kullanarak nm (uyarma 540 nm).
8. bileşik hazırlık
-
İMoDCs için seri seyreltme
- MIT-827 hisse senedi çözüm (dimetil sülfoksit (DMSO) bir seferde (4 x konsantre) 8 µM ulaşmak için orta içine 10 mM. seyreltik
- Kullanarak orta + %0,08 DMSO altı-adım 1:5 seri seyreltme gerçekleştirin. Aynı orta + %0,08 DMSO çözeltisi için araç (bileşik) koşul kullanın.
-
Tek doz iMoDCs için test
- MIT-827, AFN700 ve Cpd11 hisse senedi çözümler tek seferde (4 x konsantre) 4 µM ulaşmak için orta içine oranında seyreltin.
-
Fare dalak hücreler için seri seyreltme
- (Bir git seyreltme ortamda takip bir 10 mM hisse senedi çözüm elde edilen) bir 10 µM MLT-827 çözüm DMSO son konsantrasyonu % 0.1 ile 0,01 µM oranında seyreltin.
- Seyreltme adımlar için her seyreltme 2 µL al, 38 µL RPMI ve damlalıklı 5 µL kuyunun içine ekleyin.
Not: Tüm tedaviler nüsha gerçekleştirilir.
9. uyaranlara hazırlık
-
Tükenmiş zymosan (DZ)
- DZ için 10 mg 2 mL steril su endotoksin-ücretsiz Ekle
- Stok belgili tanımlık eriyik, girdap da önceki her kullanımdan homojenize girdap.
- -20 ° C'de aliquot çözüm ve mağaza aliquots
-
Trehalose-6,6-dibehenate (TDB)
- DMSO 100 µL 1 mg TDB, 15 – 30 s için bir su banyosunda 60 ° C'de ısı ekleyin.
- Girdap ve hemen steril PBS, girdap tekrar 900 µL ekleyin.
- 10-15 dk 60 ° C'de ısı ve vortexing rahip tarafından her kullanımdan lunaparkçı.
- Çözüm 4 ° C'de tutmak
- Seri dilutions ve tek doz hazırlık MLT-827 bileşik gelince gerçekleştirin.
Not: TDB DMSO içinde hazırlanması gerekir çünkü bir son %1 DMSO konsantrasyonu hücre stimülasyon sırasında mevcuttur.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Myeloid hücrelerin içinde harekete geçirmek sinyalleri aşağı Dectin-1, Dectin-2 ve MINCLE6gibi birkaç C tipi lektin-benzeri reseptörler MALT1 aktarır. Bu yollar üzerinde (hem) ITAM motifi içeren reseptörleri itimat (örneğin, Dectin-1) veya ITAM motifi içeren ortak reseptörleri (örneğin, FcRγ, Dectin-2 ve MINCLE için) bu işe ve SYK kinaz (Şekil 1) etkinleştirin. Bu bir protein kinaz C izoformu, yani PKCδ, CARD9, böylece CARD9/BCL10/MALT1 karmaşık oluşumu ve TRAF6 işe alım için aşağı akım NF-κB harekete geçirmek12uyarının harekete geçirilmesine karşılık phosphorylates aktivasyonu yol açar. Buna karşılık, TLR-4 yolu TRAF6 MALT1 bağımsız MYD88/Irak-bağımlı şekilde için NF-κB harekete geçirmek (Şekil 1) ama acemi. Kanıt MALT1 fark bu katılımı ile peptidic aktif inhibitörü z-VRPR-fmk11,13,14MALT1 eksikliği yanı sıra farmakolojik tedavi genetik modellerini kullanarak elde edildi.
Biz son zamanlarda bildirilen güçlü ve seçici MALT1 engelleyici MLT-82715 kullanılan ve bu bileşik TNF-üretimini aşağı C türü lektin-beğenmek ve Toll benzeri reseptörler, sırasıyla düzenleyen Eğer istedi. İnsan PBMCs ve fare dalak hücreleri tükenmiş zymosan (DZ, bilinen bir agonist Dectin-1) ile teşvik ya da lipopolysaccharide (LPS, TLR-4 bilinen bir agonist) ve biz TNF-yayın kültür süpernatant 20 h sonra ölçülen. Hem insan ve fare deneyleri, MIT-827 seçmeli olarak TNF-üretim Dectin-1 yol, ancak değil TLR-4 yolu (Şekil 2) tarafından tahrik engelledi. Z-VRPR-fmk bileşik (ek Şekil 1) ile kuluçka üzerine benzer veri aldı.
Yolu ilgili bilgi sahibi olmak, biz daha fazla insan monosit ve monosit elde edilen olgunlaşmamış dendritik hücreler (iMoDCs), MIT-827 etkisi SYK inhibitörü Cpd1116 ' e ve IKK inhibitörü AFN700 olan için karşılaştırma deneyler15 . Monosit LPS ile uyarılan, TNF-α üretimini neredeyse tamamen AFN700 tarafından kaldırıldı ancak Cpd11 için hassas değildi (Şekil 3A), NF-κB/SYK aktivite, sırasıyla (TLR-4 yolu bağımlılık/bağımsızlığı ile tutarlı olduğu bkz. Şekil 1). Buna karşılık, TNF-α üretim iMoDCs içinde Dectin-1 tarafından tahrik MLT-827 ve AFN700 duyarlılık ek olarak Cpd11 için duyarlılık görüntülenen (3B rakam, tamamlayıcı Şekil 2) bir SYK/CBM sinyal katılımı için daha fazla kanıt sağlayan Dectin-1 yolu (Şekil 1) çağlayan. Önemli, IL-1, üretimini Il-6 ve IL-23 Dectin-1 stimülasyon üzerine de üç inhibitörleri için hassas böylece gösteren düzenleyici mekanizmaları TNF - benzer. Ancak, Il-8 üretimi üzerinde sınırlı bir etkisi üç bileşiklerin bu sitokin (Şekil 3B, ek Şekil 2) için ayrı bir düzenleyici mekanizma önerdi.
Dectin-1 ek olarak, Dectin-2 ve MINCLE, CARD9 signalosome7uyarılması yoluyla işlevi gibi diğer CLLRs. Bu nedenle MLT-827 MINCLE agonist Trehalose-6,6-dibehenate (TBD) ile meydan iMoDCs içinde test ettik. TBD konsantrasyonları 50 µg/mL üzerinde yükselterek, TNF-, üretim için liderliğindeki Il-6 ve Il-1, MIT-827 (Şekil 4A) engelleme etkisinden görüldüğü gibi MALT1 paracaspase faaliyete dayanıyordu. Tutarlı sonuçlar ne zaman elde Dectin-1 (4B rakam) uyarmak için DZ konsantrasyonları artan iMoDCs zor.
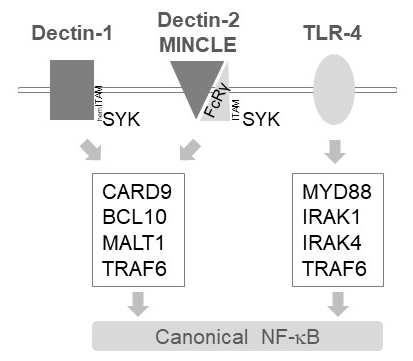
Şekil 1: sinyal NF-κB Dectin-1, MINCLE ve TLR-4 aşağı akım. Karikatür kurallı NF-κB etkinleştirme yolları aşağı Dectin-1, Dectin-2, MINCLE veya TLR-4'te myeloid hücrelerin temel özellikleri gösteriyor. HemITAM içeren Dectin-1 reseptör17 doğrudan SYK CBM (CARD9/BCL10/MALT1) karmaşık oluşumu, TRAF6 bağımlı NF-κB harekete geçirmek için önde gelen uyarmak için meşgul olabilir. Diğer C tipi lektin-benzeri reseptörler Dectin-2 veya MINCLE gibi bir CBM meşgul ve NF-κB etkinleştirmek için bir ITAM içeren FcRγ zinciri işe almak gerekir. TLR-4 reseptörleri için NF-κB harekete geçirmek, MYD88 ve IRAK1/IRAK4 kinaz TRAF6, üzerinde akıntıya karşı bağlı olduğu başka bir mekanizma kullanın.

Resim 2: Dectin-1 sinyalleri MALT1 TNF-α insan ve fare hücre üretimi için. (A)insan PBMCs veri Unterreiner olduğu gibi vd., 2017 (Şekil 2A)11. İnsan PBMCs LPS (TLR-4 agonist) 1 ng/mL veya 100 µg/mL DZ (Dectin-1 agonist) kademeli MLT-827 konsantrasyonları huzurunda 20 h için teşvik. TNF-süpernatant yayımlanan HTRF tarafından sayısal. DZ veya 1 µg/mL LPS 30 µg/mL ile (B) fare dalak hücreleri bir konsantrasyon aralığı, MIT-827 ile 30 dakika ve daha sonra tedavi edildi uyarılmış + 10 ng/mL IFN - 18 h. TNF-α süpernatant hücre kültüründe için ELISA tarafından ölçüldü. Benzer sonuçlar iki deneylerden biri, üç ölçümleri ± SEM aracı olarak gösterilir.

Şekil 3: IKK - ve/veya SYK-bağımlılık sitokin üretiminin aşağı TLR-4 ve Dectin-1. (A)insan monosit MLT-827 ile 1 h için önceden tedavi (1 µM), Cpd11 (1 µM), veya AFN700 (3 µM) ya da araç (DMSO). Hücreler için 20 h 10 ng/mL LPS ile teşvik ve TNF-süpernatant içinde HTRF tarafından sayısal. (B) TNF-α, Il-1β, IL-6, insan monosit kaynaklı dendritik hücreler (iMoDCs) DZ ile 24 h için uyarılmış tarafından IL-23 ve Il-8 üretim (100 µg/mL) 1 h ön kuluçka MLT-827, Cpd11, AFN700 (hiç 1 µM) ile sonra veya DMSO. Sitokin düzeyleri DMSO tedavi örneklerinde % 100 kuruldu. Veri anlamına gelir ± SD üç ölçümlerin ve üç bağımsız deneyler temsilcisi vardır. * P < 0,05; ** P < 0,01; P unpaired < 0,001, iki kuyruklu öğrenci t testi.

Şekil 4: C tipi lektin gibi bağımlı sitokin üretiminde iMoDCs. TNF-α, Il-1β ve Il-6 üretim iMoDCs tarafından uyarılan MINCLE agonist Trehalose-6,6-dibehenate ile 24 h için (TDB, 100 µg/mL)(a)veya Dectin-1 agonist DZ ile (100 µg/mL) (B) 1 h ön kuluçka MLT-827 ile sonra (1 µM) veya DMSO. Veri anlamına gelir ± SD üç ölçü ve üç bağımsız deneyler temsilcisi vardır.
Ek dosya 1. Bu dosyayı indirmek için buraya tıklayınız.
Ek dosya 2. Bu dosyayı indirmek için buraya tıklayınız.
Ek dosya 3. Bu dosyayı indirmek için buraya tıklayınız.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Bu çalışmada, insan sinyal yolları ve fare doğuştan gelen hücreler çalışma ve kendi bağımlılık MALT1 proteolitik işlevi sorguya basit deneysel ayarları kullanılır. Önceki çalışma11tarihinde genişletilmesi, bizim çalışma MALT1 paracaspase etkinliği C tipi indüklenen lektin benzeri reseptör sitokin üretim, TNF-α da dahil olmak üzere denetler gösterdi. Buna ek olarak, TLR-4-indüklenen TNF-α her iki tür MALT1 bağımsız. Toplu olarak, bu veri hangi önceki çalışmalar6,12',18örtüsünü açmak MALT1/CBM signalosome aşağı C tipi lektin benzeri reseptörlerinin anahtar ve seçici katkısını doğruladı.
Olup olmadığını TLR-4 MALT1 myeloid hücrelerin üzerinde sinyal açık bağımsızlığı için diğer geçerli hücre kalıntılar keşfedilmeyi türleri. Örneğin, B-lenfositleri, TLR sinyal daha önce B-hücre aktivasyonu B-hücresi antijen reseptör19için akıntı yönünde katkıda bulunmak için gösterildi. Aslında, TLR-4 insan uyarılmış ve fare B hücreleri MLT-827 için duyarlılık göstermek kanıt yayımlanmamış. Bu nedenle, B hücre reseptörü daha fazla mekanik anlayışlar aşağı değerli olacaktır. Bu bağlamda, B hücreli lenfoma son çalışmada sinyal yollar, B hücre reseptörü ve TLR9 reseptör20aşağı kümeleme için kanıt sağladı. NF-κB aktivasyonu B hücre reseptörü ve TLR yolları için bir aracı olarak gören TRAF6, her iki yolları duyarlılığını MALT1 proteaz inhibisyonu için açıklayabilir crosstalk bir noktası olabilir. Bunun tersi olarak, TRAF6 aynı zamanda NF-κB indüksiyon TLRs ve CLLRs ortak bir aşağı akım oyuncu ama bu iki yolları myeloid hücrelerin MALT1 paracaspase bağlı şekilde, crosstalk için görünmüyor.
Bu iş kolay bir okuma için sinyal yolları sağlar ve kolayca bileşik profil oluşturma için uygulanabilir sitokin üretim üzerinde duruldu. MALT1 selektif ve güçlü inhibitörleri unravelling MALT1 biyoloji değerini vurgulanır. Daha fazla mekanik anlayışlar elde ek çalışma ve gelişimi daha proksimal deneyleri, örneğin, yönetmelik sinyal yüzeylerde MALT1 içinde doğuştan gelen yer, karakterize etmek için gerektirir.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarlar ifşa gerek yok.
Acknowledgments
Elsevier burada Şekil 2A Unterreiner vd yeniden kendi yetkilendirme (lisans numarası 4334770630127) için teşekkür ederiz (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



