Summary
alt1 调节先天免疫, 但这种情况是如何发生的仍未确定。我们使用选择性 malt1 副囊酶抑制剂 mlt-827 来解开 malt1 对 toll 样或 c 型凝集素受体下游的先天信号的贡献, 证明 malt1 调节骨髓细胞因子的产生, 并在下游c 型乳素样受体, 选择性的。
Abstract
除了在淋巴细胞中的功能外, 还有许多研究都涉及到它的功能, 副胸酶 kalt1 在模式识别受体下游的先天细胞中也发挥着重要作用。最好的研究是 c 型乳素样受体家族的 dectin-1 和 dectin-2 成员, 它们以与 alt1 相关的方式诱导 syk 和 card9 依赖信号级联, 从而导致 nf-b 激活。相比之下, toll 样受体 (tlr), 如 tlr-4, 传播 nf-b 激活, 但通过 myd88/依赖 irak 级联发出信号。尽管如此, alt1 是否可能对 tlr-4 信号做出贡献仍不清楚。作为对 falt1 副酶活性的有效和选择性抑制剂, mlt-827 的最新证据表明, 人骨髓细胞中的 tnf-ptr-4 生产与 falt1 的下游无关, 而不是 ttint-1 下游的 tnf 生产, 而 ttint-1 是丙种细胞。依赖。在这里, 我们讨论了 alt1 在模式识别传感中的选择性参与, 进一步使用了各种人和小鼠的细胞制剂, 并刺激了十丁-1、mincle 或 tlr-4 途径。我们还通过探索 tnf 之外的细胞因子, 并将 mlt-827 与 syk 抑制剂 (cpd11) 和 ikk 抑制剂 (afn700) 进行比较, 提供了更多的见解。总体而言, 这些数据为 c 型乳素样受体的 alt1 依赖性提供了进一步的证据--与 tlr 信号相比, 信号传递。
Introduction
2008年1,2 例发现了菌核相关淋巴组织淋巴瘤移位蛋白 1) 的副适应酶活性。自那时以来, 一些研究报告了它对淋巴细胞抗原受体反应的重要贡献。小鼠遗传模型以及药理数据支持 t 细胞、t 细胞依赖性自身免疫和 b 细胞淋巴瘤设置3,4的关键作用。在淋巴细胞中, 在标记11-bcl10-alt1 复合物5的组装时, 会发生 alt1 副酶激活, 这是由 t-或 b 细胞受体下游的抗原受体近端信号触发的。还有充分的证据表明, 类似的 card9-bcl10-大力图1复合物对于在骨髓细胞 6,7 中传播 c 型乳素样受体 (cllr) 下游的信号非常重要, 例如, 十丁-1、十丁-2 和 mincle。十分蛋白-1 已得到特别好的研究, 因为这种途径是关键的主机防御真菌感染 8,9。然而, 在 toll 样受体 (tlr) 通路中, alt1 的含义仍有争议10。最近在人类骨髓细胞中的证据排除了 alt1 副酶活性在 tlr-411 下游tnf-生产监管中的直接作用。
在本工作中, 我们利用人类和小鼠骨髓细胞的各种实验设置和刺激条件, 利用特定的药理工具抑制剂和细胞因子产生的测量, 探索先天信号通路。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
实验是根据诺华人类研究伦理委员会的准则和标准进行的。
1. 用人药布制备外周血单个核细胞 (pbmc)
请注意:我们在收集了50毫升的袋子里, 从健康的志愿者那里收到了一件蓬松的外套。它们是在知情同意的情况下提供的, 并通过区域间 blutspende schweizeriches rotes kreuz 收集的。除非另有说明, 否则我们在室温下使用以下程序处理这些问题。
- 准备一把无菌干净的剪刀和一个带塑料袋的1升烧杯 (在层流下)。
- 把蓬松的外套转移到烧杯里, 用剪刀小心地打开它。
- 使用25毫升移液器, 加入100毫升磷酸盐缓冲盐水-乙二胺-四乙酸 (pbssedta:pbs 1xph 7.4 不含无 cl 2 和不 mgcl2, 辅以 2 mL edta ph 8.0)。
请注意:使用相同的移液器, 并在缓慢移液液上下后, 将稀释后的奶油涂层的25毫升放入 6个50毫升的锥形离心管中, 预先填充15毫升的多糖基密度梯度。 - 在 800 x g 下离心 20分钟, 具有适度加速度 (设置为4分 9), 无需刹车, 以便根据细胞的密度分离细胞。
请注意:离心后, 三层可见;一种含有红血球和粒细胞的颗粒, 是由血浆制成的上层, 位于含有外周血单个核细胞 (pbmc) 的白环之间。 - 使用10毫升移液器收获 pbmc 环, 并转移到新的50毫升管。
请注意:通常每件蓬松的外套需要2到 3个50毫升管。在这一阶段, 一些等离子体可能会污染收集到的 pbmc, 这应该不会对随后的浓缩步骤产生影响。 - 使用 pbssedta 顶上高达 50 ml 的每个管, 并以减少离心时间和速度进行三次连续清洗 (在 520 x g时 15分钟, 在 330 x g时 10分钟, 在 150 x g 处10分钟)。
请注意:每一步, 上清液被倒在一个液体废物容器中, 细胞颗粒被重新悬浮在50毫升的 pbssedta 中 (第一次清洗后可以将颗粒聚集在一起)。 - 最后清洗后, 重新悬浮冰凉洗涤缓冲液 (见材料表) 的25毫升中的颗粒, 通过渗透压裂解红血球。
- 孵化, 直到溶液变得清晰 (在室温下≤ 5分钟)。
- 通过添加25毫升的分离缓冲液 (pbs 1x ph 7.4 不含无 cl2和不无 mgcl2, 辅以2% 的热灭活胎儿牛血清 (fbs) 和 1 mL edta ph 8.0) 来停止反应。
- 在 150 x g处再清洗一次, 8分钟。
请注意:在这一阶段, pbmc 可用作散装种群 (见步骤 3: pbmc 和单核细胞治疗和刺激条件), 或加工用于单核细胞浓缩 (见步骤 2: 从 pbmc 制备单核细胞), 或冻结供以后使用 (见步骤 5:单核细胞和 pbmc 冷冻/解冻程序)。
2. 从 pbmc 制备单核细胞
- 将在分离缓冲液中的步骤1.10 获得的 pbmc 重新进行再利用, 并将其计数到 5 x10 7cellss/ml。
- 将细胞悬浮液转移到带有盖帽的14毫升锥形离心管中。
- 在细胞悬浮液、涡旋每毫升中加入50μl 单核细胞富集抗体鸡尾酒, 并在4°c 孵育10分钟。
- 每 ml 细胞加入50μl 单核细胞富集珠。
请注意:珠子必须彻底涡旋, 以确保悬浮物的均匀性。 - 加入珠子后, 不久就会使细胞悬浮液变动, 并在4°c 下孵育5分钟。
- 用分离缓冲液冲洗管的上部, 直到管被填充到10毫升。
- 通过上下移液慢慢混合溶液。
- 将没有盖帽的管放入分离磁铁中。
- 在室温下孵化2.5 分钟。
- 慢慢地倒进一个15毫升的锥形离心管。
- 在此阶段, 直接使用单核细胞 (见步骤3:pbmc 和单核细胞治疗和刺激条件) 或将其分化为immature mo nocytenytd d 内生 c s (imodc) (见步骤 4), 或将其冻结以供后续使用 (请参阅步骤 5)。
3. pbmc 和单核细胞的治疗和刺激条件
- 在培养基中计数细胞并稀释它们 (roswell park 纪念研究所中等 (rpmi) 10% fbs + 1 mm 丙酮酸钠 + 100 uml 青霉素链霉素 (pen/strepycin) + 5μm β-硫醇), 下降到 1.25 x 104 细胞。
- 每道384孔板的每口井分布30μl 的细胞悬浮液。
- 加入15μl 的4倍浓缩复合溶液, 在37°c、5% co2 下预孵育1小时。
- 在最终浓度为 10 ng/ml 的情况下加入脂多糖 (lps), 或将耗尽的 zymsol (dz) 添加到最终浓度为100μgml 的浓度中, 或保存在普通介质中。
- 在 37°c, 5% co2下过夜。
- 以10μl 的上清液来测量分泌的 tnf-a 水平 (见步骤 7: 细胞因子和生存能力测量)。
4. 单核细胞分化为 imodc 和刺激条件
- 计数单核细胞 (在步骤2浓缩) 和离心细胞悬浮在 520 x g 5分钟。
- 移液器关闭上清液并添加培养基 (rpmi + 10% fbs, 以获得 0.4 x10 6 cellsl 的最终细胞悬浮液。
- 加入 80 ngml 重组人 il-4 + 100 ngml gm-csf。
- 在6井板中, 每口井分配5毫升细胞悬浮液。
- 在37°c、5% co2 下孵化7天。
- 第7天, 通过轻轻移液收获细胞, 以避免其激活。
- 离心以 520 x g 5分钟。
- 在没有生长因子的培养基中真空吸气和再悬浮。
- 在 520 x g 离心 5分钟 , 并在培养基中以 1 x 106细胞的速度重新悬浮。
- 在96孔平底板的每口井中分配100μl 细胞悬浮液 (105个细胞)。
- 在37°c 条件下, 在添加50μl 的 4 x 浓缩复合溶液后, 预孵育 1小时, 如步骤 8: 化合物制备所述。
- 添加50μl 的刺激 (4倍浓缩), 如步骤9所述。
- 在37°c 下孵化24小时。
- 将每口井混合, 将细胞和上清液 (sn) 转移到一个96孔 v 型底板中。
- 在 475 x克向下旋转5分钟。
- 将上清液转移到新的96孔平板上, 在-20°c 处密封和冷冻, 直到进一步使用。
5. 单核细胞和 pbmc 冻融程序
-
冻结
- 在 520 x 克的情况下旋转 pbmc 或单核细胞制剂5分钟。
- 真空吸气上清液并在 1 x10 7 细胞的冷冻介质中重新悬浮细胞。
- 将1毫升的电池悬浮液分配到低温管中, 将管道转移到特定的冷却装置 (见材料表), 并将其放置在-80°c。
-
解冻
- 将低温管解冻后, 将其含量迅速转化为含有9毫升培养基的15毫升锥形离心管。
- 离心以 520 x g 5分钟。
- 真空吸气上清液和再悬浮细胞颗粒在5毫升培养基中。细胞现在已经可以进行进一步的实验处理了。
6. 小鼠脾细胞的制备与治疗
请注意:我们根据诺华动物福利组织的指导方针和标准进行了动物祭祀。研究报告得到了区域政府当局道德委员会 (kantonales 生林德拉姆特·德·斯塔特巴塞尔)的批准。我们通过过度暴露来牺牲动物, 尽一切努力将痛苦降到最低。
- 使用配备机械组织研磨装置并填充5毫升冷 rpmi 培养基的管子, 收获脾脏和离解组织。
- 使用分离机的脾脏程序来磨器官。
- 通过100毫米尼龙电池过滤器过滤电池。
- 将悬浮液转移到50°c 时的50毫升管和离心机中 10分钟, 在 320 x g。
- 真空吸气上清液, 在3毫升的冰凉裂解缓冲液中重新悬浮细胞颗粒, 并在冰上孵育≤2分钟。
- 通过添加7毫升的 rpmi 介质来停止裂解。
- 通过100μm 尼龙电池过滤器再次过滤。
- 在4°c 下, 在 330 x g处向下旋转细胞悬浮液10分钟。
- 真空吸气上清液和再悬浮细胞在 11 x10 6 cellsl 在完整的中等 (rpmi 补充 10% fbs, 100 uml pen/step 和5μm β-硫醇)。
- 板 1 x10 6 cells"井 (90μl) 在96孔板 (平底)。
- 如步骤 8.3: 小鼠脾脏细胞的串行稀释所述, 加入5μl 的20x 浓缩复合溶液, 以前在 rpmi 培养基中稀释。
- 在37°c 下孵化 30分钟, 5% co2。
- 加入 5μl 20x 浓缩 dz (最终浓度为 30μg/ml) 或20x 浓缩 lps + ifn-g (tlr-4) (最终浓度为 1μm lps 和 10 ngml ifn-g)。
- 在 37°c, 5% co2下过夜。
- 离心机在 330 x克下10分钟。
- 将上清液转移到新的板材中, 密封并冻结在-20°c, 直到进一步使用。
7. 细胞因子和可行性测量
-
用 htrf 测量人 tnf-a (同质时间分辨荧光)
请注意:该议定书遵循了供应商的建议, 简要概述如下。- 将重组试剂 (抗 tnf-a 隐酯和抗 tnf-a-xl665) 1 体积与19体积重组缓冲液 (50 mm 磷酸盐缓冲液 ph 值7.0、0.8 m 氟化物钾 (kf)、0.2% 牛血白蛋白 (bsa)) 混合。
- 在分配试剂之前, 将两个随时可用的抗体溶液1:1 混合在一起。
- 将进步级的10μl 上清清剂分配到白色384孔板中。
- 分配10μl 的抗体混合物。
- 用封口机覆盖板, 在4°c 下孵育过夜。
- 在微板读取器上读取板 (50–200闪光灯)。
- htrf 法测量人 il-23 (同质时间分辨荧光)
请注意:该议定书遵循了供应商的建议, 简要概述如下。- 将一体积重组试剂 (抗 il-23 密码抗体和抗 il-23 d2 抗体) 与19卷检测缓冲液 #3 混合。
- 在分配试剂之前, 将两个随时可用的抗体溶液1:1 混合在一起。
- 将进步级的10μl 上清清剂分配到白色384孔板中。
- 分配10μl 的抗体混合物。
- 用封口机覆盖板, 在4°c 下孵育过夜。
- 在微板读取器上读取板 (50–200 nm 闪光灯)。
-
通过电化学发光测量人白细胞介素-6、il-8、il-1β和 tnf-α
请注意:所有样品均以稀释剂2的1.5 稀释 (第一次稀释: 150μl 中的 10μl, 180μl 的20μl 稀释)。该协议遵循了供应商的建议:- 稀释样品和标准在稀释剂2。
- 使用 1. 连续褶皱稀释法, 对稀释剂2中的标准进行稀释。
- 用洗涤缓冲液清洗盘子三次。
- 每口井分配50μl 的样品或标准样品。
- 在室温下搅拌2小时。
- 用 pbs + 0.05% 聚山梨酸酯20清洗板四次。
- 在稀释剂3中加入25μl 的检测抗体 (每个抗体的60μl 为3毫升的最终抗体)。
- 在室温下搅拌2小时。
- 用 pbs + 0.05% 聚山梨酸酯20清洗板四次。
- 避免气泡, 添加150μl 每井读缓冲液 (基于特里丝的缓冲液含有三丙胺, 稀释2倍在 ddh20) 作为共同反应物, 用于电化学发光免疫测定中的发光。
- 读取多路板读取器上的板 (无延迟)。
-
按照供应商协议, 通过 elisa 测量鼠标 tnf-a
- 稀释上清液 1: 1 在测定稀释剂 (准备使用含蛋白质的缓冲液)。
- 准备试剂、样品和标准稀释剂, 如试剂盒中所述。在每口井加入50μl 的检测稀释剂。
- 每口井加入50μl 的标准、控制或样品。
- 将板框轻轻敲击1分钟。
- 盖上所提供的胶粘条, 在室温下孵育2小时。
- 对每口井进行吸气, 用 400μl/井清洗 (共重复这一步骤五次)。
- 最后清洗后, 通过吸气取出任何剩余的洗涤缓冲液。
- 将盘子反转, 并将斑点擦到干净的纸巾上。
- 在每口井中加入100μl 的小鼠 tnf-α共轭。盖上新的胶粘条。
- 在室温下孵化2小时。
- 重复吸气/清洗, 如7.4.4 的步骤。
- 在每口井中加入100μl 的基板溶液, 并在室温下培养 30分钟, 不受光线影响。
- 在每口井加入100μl 稀释的盐酸溶液 (停止溶液)。轻轻轻触板材, 以确保彻底混合。
- 使用微板读取器 (在30分钟内完成) 测量 450 nm 的光学密度 (校正波长设置为 560 nm)。
- 稀释上清液 1: 1 在测定稀释剂 (准备使用含蛋白质的缓冲液)。
-
细胞活力
- 从 pbmc 或单核细胞制剂中去除上清液后, 使用可随时使用重新待命液 (氧化还原指示剂) 的方法评估细胞的活力, 该溶液直接添加到细胞悬浮液中, 最终浓度为10%。
- 在37°c 下培养 1至2小时, 5% co2。
- 使用微板读取器在 590 nm (励磁540纳米) 处阅读荧光。
8. 化合物制备
-
immodc 的串行稀释
- 将 mlt-827 库存溶液 (二甲基亚硫酸盐 (dmso) 中的 10 mm) 稀释到介质中, 一次性达到 8μm (浓缩 4倍)。
- 使用中等 + 0.08% dmso 进行六步 1: 5 串行稀释。对于车辆 (无复合), 请使用相同的介质 + 0.08% dmso 解决方案。
-
immodc 的单剂量检测
- 将 mlt-827、afn700 和 cpd11 库存解决方案稀释到介质中, 一次性达到 4μm (浓缩 4倍)。
-
小鼠脾脏细胞的连续稀释
- 将 10μm mlt-827 溶液 (在介质中一次稀释后从10mm 库存溶液中提取) 稀释至 0.01μm, dmso 端部浓度为0.1%。
- 对于稀释步骤, 对每次稀释采取 2μl, 加入 38μl rpmi, 并将5μl 移入井中。
请注意:所有治疗均为一式三份。
9. 刺激准备
-
贫化 (dz)
- 在10毫克 dz 中加入2毫升无菌内毒素水。
- 涡旋对股票溶液进行均质化, 涡旋也优先于每次使用。
- 液体溶液, 并在-20°c 下储存脂肪。
-
海藻糖-6, 6-二苯甲酸酯 (tdb)
- 在1毫克 tdb 中加入100μl 的 dmso, 在水浴中加热15–30秒。
- 涡旋并立即加入900μl 的无菌 pbs, 涡旋再次。
- 在60°c 下加热 10-15分钟, 每次使用前通过涡流进行均质化。
- 将溶液保持在4°c。
- 为 mlt-827 化合物进行连续稀释和单剂量制备。
请注意:由于 tdb 需要在 dmso 中制备, 因此在细胞刺激过程中会出现最终1% 的 dmso 浓度。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
在骨髓细胞中, alt1 将激活信号传递到几种 c 型乳素样受体的下游, 如十氯化锡-1、十丁-2 和 mincle6。这些途径依赖于 (下摆) 含 itam 图案的受体 (例如, dectin-1) 或含有 itam 的共同受体 (例如, fcrγ, 用于 Dectin-1 和 mincle), 用于招募和激活 sykinase (图 1)。这导致激活蛋白激酶 c 等形, 即 pkc, 磷酸化 card9, 从而触发 card9/bcl/alt1 复合物的形成和招募 traf6 为下游 nf-b 活化12。相比之下, tlr-4 通路以独立于 alt1 但依赖 myd88/irak 的方式招募 traf6 进行 nf-b 激活 (图 1)。利用 malt1 缺乏症的遗传模型以及肽活性位点抑制剂 z-vpr-fmk11、13、14的药理治疗, 获得了 malt1 这种差异参与的证据。
我们使用最近报道的强效和选择性 malt1 抑制剂 mlt-82715,并询问这种化合物是否将调节 tnf 生产下游的 c 型凝集素样和 toll 样受体, 分别。人 pbmc 和小鼠脾脏细胞受到贫化的 zymosan (dz, 一种已知的十分-1 的激动剂) 或脂多糖 (lps, tlr-4 的已知激动剂) 的刺激, 我们测量了 tnf 释放在培养上清液20小时后。在人类和小鼠的检测中, mlt-827 选择性地阻断了由 decint-1 途径驱动的 tnf-生产, 但不是由 tlr-4 途径 (图 2)。我们在与 z-vrpr-fmk 化合物孵育时获得了类似的数据 (补充图 1)。
为了获得途径洞察, 我们在人类单核细胞和未成熟的单核细胞衍生树突状细胞 (imdoc) 中进行了进一步的实验, 将 mlt-827 与 syk 抑制剂 cpd11 16 和 ikk 抑制剂 afn700 15 的效果进行了比较 ..在 lps 刺激的单核细胞中, tnf-α的生产几乎完全被 afn700 废除, 但对 cpd11 (图 3a) 不敏感, 这分别与 tlr-4 通路对 nf-b/syk 活性的依赖性 (请参见图 1)。相比之下, 由 dectin-1 驱动的 itf-α生产在 Cpd11 中除了对 mlt-827 和 afn700 的敏感性外, 还显示了对 cpd11 的敏感性 (图 3b, 补充图 2), 为参与 sykcbm 信号提供了进一步的证据在 dectin-1 路径中的级联 (图 1)。值得注意的是, 在十丁-1 刺激时生产 il-1、il-6 和 il-23 对这三种抑制剂也很敏感, 从而表明了类似于 tnf 的调节机制。然而, 这三种化合物对 il-8 生产的影响有限, 表明这种细胞因子有一个独特的调节机制 (图 3b,补充图 2)。
除了 dectin-1 之外, 其他 cllr, 如 dectin-2 和 mincle, 还通过刺激 card9 信号组7来发挥作用。因此, 我们在 imodc 中测试了 mlt-827, 并对 mincle 激动剂-6-6-二苯并酸盐 (tbd) 进行了挑战。将 tbd 浓度提高到50μgml 以上导致 tnf-6、il-6 和 il-1 的生产, 从 mlt-827 的阻断效应 (图 4 a) 中可以看出, 这些浓度依赖于 malt1 副酶酶活性。当挑战 dz 浓度不断增加以刺激十金-1 的 imodc 时, 获得了一致的结果 (图 4b)。
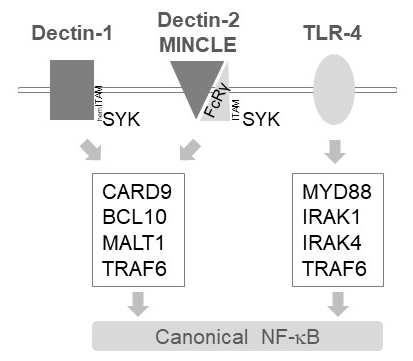
图 1: 十分-1、mincle 和 tlr-4 下游的 nf-b 信号.这幅漫画描绘了骨髓细胞中十丁-1、十丁-2、mincle 或 tlr-4 下游的规范 nf-b 激活途径的主要特征。含有血红素的十氢-1 受体17可以直接与 syk 接触, 刺激 cbm (card9/bcl/alt1) 复杂的形成, 导致 traf6 依赖 nf-b 激活。其他 c 型类似盐酸盐的受体, 如 dectin-2 或 mincle 需要招募含有 itam 的 fcrγ链, 以参与 cbm 并激活 nf b。tlr-4 受体利用另一种机制进行 nf-b 激活, 依靠 trf6 上游的 myd88 和 iraknerak4 激酶。

图2:modtin-1 通过 alt1 的信号, 用于在人和小鼠细胞中生产 tnf-α 。(a) 人类 pbmc 数据, 如 unterreiner 等人 (unterreiner 等人), 2017年 (图 2a)11。在 mlt-827 分级浓度的情况下, 用 llr-4 激动剂 (tlr-4 激动剂) 或 100μgml dz (十元-1 激动剂) 对人体 pbmc 进行了20小时的刺激。由 htrf 对上清液中释放的 tnf 进行了量化。(b) 用 mlt-827 浓度范围的小鼠脾脏细胞进行30分钟的治疗, 然后用 30μgml dz 或 1μgml lps + 10 ngml ifn. tnf-α在细胞培养中进行了18h 的刺激。显示了具有相似结果的两个实验中的一个, 即三个测量值的伪 sem。

图 3: tlr-4 和 dectin-1 下游细胞因子生产的 ikk-and/or syk 依赖关系.(a) 用 mlt-827 (1μm)、cpd11 (1μm) 或 afn700 (3μm) 或车辆 (dmso) 对人单核细胞进行了1小时的预处理。用 10 ngml lps 刺激细胞, 时间为 20小时, tnf--用 htrf 对上清液进行量化。(b) tnf-α, il-1β, 用 mlt-827、cpd11、afn700 (均在1微米) 或 dmso 预孵育1小时后, 由人类单核细胞衍生树突状细胞 (imodc) 生产的 il-6、il-23 和 il-8 刺激了 24小时, dz (100μg/ml)。dmso 处理样品中的细胞因子水平定为100%。数据是三种测量的手段±sd, 代表了三个独立的实验。* p < 0.05;* * p < 0.01;p < 0.001, 未配对的双尾学生 t 测试。

图4:c 型乳素依赖细胞因子由 icmodc 生产.tnf-α、il-1β和 il-6 由 icodc 生产刺激24小时与 mincle 激动剂 trehaloe-6, 6-二贝酸盐 (tdb, 100μgml) (a) 或与十元-1 激动剂 dz (100μgml) (b) 在用 mlt-827 (1μm) 或 dmso 预培养1小时后。数据是三种测量的手段±sd, 代表了三个独立的实验。
补充文件 1.请点击此处下载此文件.
补充文件 2.请点击此处下载此文件.
补充文件 3.请点击此处下载此文件.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
在这项工作中, 我们使用简单的实验设置来研究人和小鼠先天细胞的信号通路, 并询问他们对 alt1 蛋白溶解功能的依赖。在先前工作11的基础上, 我们的研究表明, alt1 副酶活性控制 c 型肌肽样受体诱导的细胞因子的产生, 包括 tnf-α。相反, tlr-4 诱导的 tnf-α在这两个物种中都与 alt1 无关。这些数据总体上证实了 c 型乳素样受体下游的 m异位谱的关键和选择性贡献, 早期的研究6,12,18揭示了这一贡献。
骨髓细胞中的 tlr-1 信号的清晰独立性是否适用于其他细胞类型还有待探讨。例如, 在 b 淋巴细胞中, tlr 信号以前被证明有助于 b 细胞抗原受体19 下游的 b 细胞激活。事实上, 我们有未公布的证据表明, tlr-4 刺激了人和小鼠 b 细胞对 mlt-827 的敏感性。因此, b 细胞受体下游的进一步机械洞察将是有价值的。在此背景下, 最近对 b 细胞淋巴瘤的一项研究为 b 细胞受体和 tlr9 受体20下游的信号通路的聚集提供了证据。traf6 在 b 细胞受体和 tlr 通路中充当 nf-b 激活的介质, 可能是一个串扰点, 这可以解释这两种途径对 alt1 蛋白酶抑制的敏感性。相反, tref6 也是 cllr 和 tlr 的一个常见的下游播放器, 用于诱导 nf-b, 但这两种途径在骨髓细胞中似乎不会以与 palt1 旁侧向依赖的方式串扰。
这项工作的重点是细胞因子的生产, 它提供了一个简单的读出信号通路, 并可以很容易地实现复合分析。它强调了选择性和有效的 alt1 抑制剂的价值, 以解开 alt1 生物学。获得进一步的机械洞察将需要额外的工作和开发更近端的检测, 例如, 定性的 matr1 的基板涉及固有的信号调节。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可透露的。
Acknowledgments
我们感谢 elsevier 授权 (许可证编号 4334770630127) 在这里复制来自 unterreiner等人的图 2a 。(2017年)。
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



