Summary
MALT1 regulerer medfødt immunitet, men hvor dette sker fortsat er uklare. Vi brugte den selektive MALT1 paracaspase hæmmer MLT-827 for at trævle MALT1 bidrag til medfødte signalering neden for Toll-lignende eller C-type lektin-lignende receptorer, demonstrerer, at MALT1 regulerer produktionen af myeloide cytokiner, og downstream af C-typen lektin-lignende receptorer selektivt.
Abstract
Udover sin funktion i lymfoide celler, som er blevet behandlet af talrige undersøgelser, spiller paracaspase MALT1 også en vigtig rolle i medfødte celler nedstrøms mønster anerkendelse receptorer. Bedst undersøgt er de Dectin-1 og Dectin-2 medlemmer af familien C-type lektin-lignende receptor, der inducerer en SYK - og CARD9-afhængige signalering cascade fører til NF-κB aktivering, på en måde, MALT1-afhængige. Af kontrast, Toll-lignende receptorer (TLR), såsom TLR-4, udbrede NF-κB aktivisering men signal via en MYD88/IRAK-afhængige cascade. Ikke desto mindre, om MALT1 kan bidrage til TLR-4 signalering er forblevet uklart. Seneste beviser med MLT-827, en potent og selektiv hæmmer af MALT1 paracaspase aktivitet, angiver, at TNF-produktion nedstrøms TLR-4 i menneskelige myeloide celler er uafhængig af MALT1, i stedet for TNF-produktion nedstrøms Dectin-1, som er MALT1 afhængige. Her, vi har behandlet den selektive inddragelse af MALT1 i mønstergenkendelse sensing yderligere, ved hjælp af en række menneskelige og mus cellulære præparater og stimulering af Dectin-1, MINCLE eller TLR-4 veje. Vi gav også yderligere indsigt ved at udforske cytokiner ud over TNF- og ved at sammenligne MLT-827 en SYK hæmmer (Cpd11) og en IKK hæmmer (AFN700). Kollektivt, de data, som yderligere bevis for MALT1-afhængighed af C-typen lektin-lignende receptor-signalering i modsætning til TLR-signalering.
Introduction
Paracaspase aktivitet af MALT1 (slimhinde-associerede lymfoide væv lymfom translokation protein 1) blev afsløret i 20081,2. Siden da, har en række undersøgelser rapporterede sin kritiske bidrag til antigen receptor svar i lymfocytter. Genetiske modeller i mus samt farmakologi data understøtter en nøglerolle i T-celler, T-celle afhængige autoimmunitet og B-celle lymfom indstillinger3,4. I lymfocytter, MALT1 paracaspase Aktivering sker ved montering af en CARD11-BCL10-MALT1 komplekse5, som er udløst af antigen-receptor proksimale signalering neden for T - eller B-celle receptoren. Der er også rigeligt med beviser for at en lignende CARD9-BCL10-MALT1-kompleks er vigtigt for formerings signaler nedstrøms af C-typen lektin-lignende receptorer (CLLR), fx, Dectin-1, Dectin-2 og MINCLE i myeloide celler6,7. Dectin-1 er blevet særligt godt undersøgt, da denne vej er kritiske for værten forsvar mod svampeinfektioner8,9. Konsekvenser af MALT1 i Toll-lignende receptor (TLR) veje, dog forblevet kontroversielle10. Seneste beviser i menneskelige myeloide celler udelukket en direkte rolle for MALT1 paracaspase aktivitet i reguleringen af TNF-produktion nedstrøms TLR-411.
I det foreliggende arbejde brugte vi forskellige eksperimentelle indstillinger og stimulerende forhold i menneskelige og mus myeloide celler for at sonde medfødte signaling veje, afhængige af bestemte farmakologisk værktøj hæmmere og måling af cytokin produktion.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Eksperimenter blev udført efter de retningslinjer og standarder for Novartis menneskelige forskning etiske komité.
1. forberedelse af perifert blod mononukleære celler (PBMC) fra menneskelige Buffy frakker
Bemærk: Vi fik buffy frakker fra raske frivillige en dag efter indsamling, i 50 mL poser. De blev leveret under informeret samtykke og indsamlet gennem Interregionale Blutspende Schweizeriches Rotes Kreuz. Vi håndteret dem ved hjælp af fremgangsmåden nedenfor, ved stuetemperatur, medmindre andet er angivet.
- Forberede en sterile og rene par saks og et 1 L bæger med en plasticpose (under en lamina flow).
- Overføre buffy coat i bægerglasset og forsigtigt åbne den med saksen.
- Ved hjælp af en 25 mL pipette, tilsættes 100 mL af phosphat bufferet saltvand buffer/ethylendiamintetra syre (PBS/EDTA: PBS 1 x pH 7,4 indeholdende CaCl2 og MgCl2, suppleret med 2 mM EDTA pH 8.0).
Bemærk: Ved hjælp af den samme afpipetteres og efter langsomt pipettering løsningen op og ned, afpipetteres 25 mL af det fortyndede buffy coat til 6 konisk centrifugeglas på 50 mL fyldt med 15 mL af polysaccharid-baserede tæthed farveforløb. - Der centrifugeres 20 min. ved 800 x g med moderat acceleration (sat til 4 ud af 9) og uden bremse at give mulighed for adskillelse af celler baseret på deres tætheder.
Bemærk: Efter centrifugering bliver tre lag synlige; en pille indeholdende rød blod celler og granulocytter, en øvre lag lavet af plasma, og i mellem en hvid ring perifert blod mononukleære celler (PBMC). - Høste PBMC ringen ved hjælp af en 10 mL pipette og overførsel til nye 50 mL rør.
Bemærk: To til tre 50 mL rør er normalt kræves pr. buffy coat. På dette stadium forurener nogle plasma sandsynligvis de indsamlede PBMC, som ikke bør have indflydelse på de efterfølgende berigelse trin. - Top op til 50 mL hver tube ved hjælp af PBS/EDTA og gå videre til tre successive vasker med faldende centrifugeringstiden og hastighed (15 min på 520 x g, 10 min på 330 x g, 8 min ved 150 x g).
Bemærk: På hvert trin, supernatanten hældes ned i en flydende spildbakken og celle pellet er genopslemmes i 50 mL PBS/EDTA (pellets kan samles efter første vask). - Efter den sidste vask, resuspenderes i 25 mL af en iskold lysisbuffer (Se Tabel af materialer) at lyse røde blodlegemer af osmotisk tryk.
- Inkuber indtil løsningen bliver klart (≤5 min ved stuetemperatur).
- Reaktionen standses ved tilsætning af 25 mL af adskillelse buffer (PBS 1 x pH 7,4 indeholdende CaCl2 og ingen MgCl2, suppleret med 2% varme-inaktiverede føtal bovint serum (FBS) og 1 mM EDTA pH 8.0).
- Vask en gang mere ved 150 x g i 8 min.
Bemærk: På dette stadium PBMC kan bruges som en bulk befolkning (Se trin 3: PBMC og monocytter behandlinger og stimulerende betingelser) eller behandlet for monocyt berigelse (Se trin 2: forberedelse af monocytter fra PBMC), eller frosset ned til senere brug (Se trin 5: Monocytter og PBMC frysning/optøning procedurer).
2. forberedelse af monocytter fra PBMC
- Resuspend PBMC fremstillet på trin 1.10 i adskillelse buffer og regne dem for at nå 5 x 107celler/mL.
- Overføre cellesuspension til en 14 mL konisk centrifugeglas med hætte.
- Tilsæt 50 µL af monocyt berigelse antistof cocktail pr. mL cellesuspension, vortex, og Inkuber 10 min. ved 4 ° C.
- Tilsæt 50 µL af monocyt berigelse perler pr. mL af celler.
Bemærk: Perlerne skal være grundigt vortexed at sikre homogeniteten af suspensionen. - Efter at tilføje perler, kort tid vortex cellesuspension og Ruger 5 min. ved 4 ° C.
- Skyl den øverste del af røret med adskillelse buffer, indtil røret er fyldt op til 10 mL.
- Langsomt Bland løsningen af pipettering op og ned.
- Sted rør uden cap i en separation magnet.
- Inkuber i 2,5 min ved stuetemperatur.
- Hæld langsomt i en 15 mL konisk centrifugeglas.
- På nuværende tidspunkt bruge monocytter direkte (Se trin 3: PBMC og monocytter behandlinger og stimulerende betingelser) eller adskille dem i jegmmature Monocyte-afledte Dendritic Cells (iMoDCs) (Se trin 4), eller fryse dem ned til senere brug (Se trin 5).
3. PBMC og monocytter behandlinger og stimulerende betingelser
- Tælle celler og udvande dem dyrkningsmedium (Roswell Park Memorial Institute medium (RPMI) 10% FBS + 1 mM natrium pyruvat + 100 U/mL Penicillin Streptomycin (Pen/Strep) + 5 µM β-mercaptoethanol), ned til 1.25 x 104 celler/brønd.
- Distribuere 30 µL af cellesuspension pr. brønd af et 384-godt plade.
- Tilføj 15 µL af 4 x koncentreret sammensatte løsninger og pre Inkuber i 1 time ved 37 ° C, 5% CO2.
- Tilføje LPS (LPS) til en slutkoncentration på 10 ng/mL, eller forarmet zymosan (DZ) til en endelig koncentration på 100 µg/mL, eller holde i almindelig medium.
- Der inkuberes natten over ved 37 ° C, 5% CO2.
- Tage 10 µL af supernatanten at måle udskilles TNF-a niveauer (Se trin 7: cytokiner og levedygtighed målinger).
4. monocytter differentiering i iMoDCs og stimulerende betingelser
- Tælle monocytter (beriget på trin 2) og centrifugeres cellesuspension ved 520 x g i 5 min.
- Afpipetteres off supernatanten og tilføje næringssubstratet (RPMI + 10% FBS at opnå en endelig cellesuspension af 0,4 x 106 celler/mL.
- Tilføje 80 ng/mL rekombinant humant IL-4 + 100 ng/mL GM-CSF.
- Der afpipetteres 5 mL cellesuspension pr. brønd i en 6-godt plade.
- Inkuber i 7 dage ved 37 ° C, 5% CO2.
- På dag 7, skal du høste celler af pipettering forsigtigt for at undgå deres aktivering.
- Der centrifugeres ved 520 x g i 5 min.
- Vakuum aspirat og resuspend i 50 mL af næringssubstratet uden vækstfaktorer.
- Der centrifugeres ved 520 x g i 5 min og resuspend på 1 x 106 celler/mL i dyrkningsmediet.
- Afpipetteres 100 µL af cellesuspension (105 celler) pr. brønd af en 96-godt flad bundplade.
- Pre incubate i 1 timer ved 37 ° C efter tilsætning af 50 µL af 4 x koncentreret sammensatte løsninger, forberedt som beskrevet i trin 8: forbindelser forberedelse.
- Tilsæt 50 µL af stimuli (4 x koncentreret), forberedt som beskrevet i trin 9.
- Inkuber 24 timer ved 37 ° C.
- Bland hver brønd og overførsel celler og supernatanten (SN) i V-bundplade med 96 brønde.
- Spin ned på 475 x g i 5 min.
- Overføre supernatanten ind i en ny 96-godt flad bundplade, forsegle og fryse ved-20 ° C indtil videre anvendelse.
5. monocytter og PBMC frysning/optøning procedurer
-
Frysning
- Spin ned PBMC eller monocyt celle præparater på 520 x g i 5 min.
- Vakuum Aspirér supernatanten og resuspend celler i frysning medium på 1 x 107 celler/mL.
- Dispensere 1 mL cellesuspension til cryotubes, overføre rør til en bestemt afkøling enhed (Se materialer tabel), og Placer den ved-80 ° C.
-
Optøning
- Optø cryotube og hurtigt overføre indholdet i en 15 mL konisk centrifugeglas indeholder 9 mL af næringssubstratet.
- Der centrifugeres ved 520 x g i 5 min.
- Vakuum aspirat supernatanten og resuspend celle pellet i 5 mL af næringssubstratet. Cellerne er nu klar til yderligere eksperimentel behandling.
6. mus milt celler forberedelse og behandling
Bemærk: Vi gennemførte animalsk ofre ifølge de retningslinjer og standarder for Novartis animalsk velfærd organisation. Undersøgelser blev godkendt af den etiske komité i den regionale statslige myndighed (Kantonales Veterinäramt der Stadt Basel). Vi ofrede dyr af isofluran overeksponering, med alle bestræbelser på at minimere lidelse.
- Høste milten og adskille væv ved hjælp af en tube udstyret med en mekanisk væv grinder og fyldt med 5 mL af kolde RPMI medium.
- Bruge programmet milten af dissociation maskine til at findele organer.
- Filtrere cellerne gennem en 100 mm nylon celle si.
- Overføre suspension til 50 mL rør og centrifugeres ved 4 ° C i 10 min. ved 320 x g.
- Vakuum aspirat supernatanten, resuspenderes celle i 3 mL iskold lysisbuffer og Inkuber i ≤2 min på is.
- Stop lysis ved at tilføje 7 mL af RPMI medium.
- Filtrere igen gennem en 100 µm nylon celle si.
- Spin ned cellesuspension ved 330 x g i 10 min. ved 4 ° C.
- Vakuum aspirat supernatanten og resuspend celler på 11 x 106 celler/mL i komplet medium (RPMI suppleret med 10% FBS, 100 U/mL Pen/skridt og 5 µM β-Mercaptoethanol).
- Plade 1 x 106 celler/brønd (90 µL) i en 96-brønd plade (flad bund).
- Tilføj 5 µL af 20 x koncentreret sammensatte løsning forud er fortyndet i RPMI medium som beskrevet i trin 8.3: seriel fortynding for murine milt celler.
- Inkuber i 30 minutter ved 37 ° C, 5% CO2.
- Tilføj 5 µL af 20 x koncentreret DZ (endelig koncentration 30 µg/mL) eller 20 x koncentreret LP'ER + IFN-g (TLR-4) (slutkoncentration 1 µM LP'ER og 10 ng/mL IFN-g).
- Der inkuberes natten over ved 37 ° C, 5% CO2.
- Der centrifugeres ved 330 x g i 10 min.
- Overføre analysere i nye plader, forsegle og fryse ved-20 ° C indtil videre anvendelse.
7. cytokiner og levedygtighed målinger
-
Menneskelige TNF-en måling af HTRF (homogen tid løst fluorescens)
Bemærk: Protokollen fulgte leverandørens anbefalinger, kort opsummeret nedenfor.- Mix 1 bind af rekonstitueret reagens (anti TNF-a-cryptate og anti-TNF-a-XL665) med 19 bind af rekonstitution buffer (50 mM fosfat buffer pH 7,0, 0,8 M kalium fluor (KF), 0,2% bovint serumalbumin (BSA)).
- Bland de to klar-til-brug antistof løsninger 1:1 lige før udlevering af reagenser.
- Undvære 10 µL af supernatanter fra trin 3.6 i hvid 384-godt plader.
- Undvære 10 µL antistof-mix.
- Dække pladen med en sealer og inkuberes ved 4 ° C natten over.
- Læs plade på en mikrotiterplade læser (50-200 flash).
- Menneskelige IL-23 måling af HTRF (homogen tid løst fluorescens)
Bemærk: Protokollen fulgte leverandørens anbefalinger, kort opsummeret nedenfor.- Blandes én diskenhed rekonstitueret reagens (anti-IL-23-cryptate-antistof, og anti-IL-23 D2-antistof) med 19 bind af påvisning buffer #3.
- Bland de to klar-til-brug antistof løsninger 1:1 lige før udlevering af reagenser.
- Undvære 10 µL af supernatanter fra trin 3.6 i hvid 384-godt plader.
- Undvære 10 µL antistof-mix.
- Dække pladen med en sealer og inkuberes ved 4 ° C natten over.
- Læs plade på en mikrotiterplade læser (50-200 nm flash).
-
Menneskelige IL-6, IL-8, IL-1β og TNF-α målinger af electrochemiluminescence
Bemærk: Alle prøver blev fortyndet til 1/150 i fortyndingsmiddel 2 (første fortynding: 10 µL i 150 µL, så 20 µL i 180 µL). Protokollen fulgte leverandørens anbefalinger:- Fortynd prøver og standard i fortyndingsmiddel 2.
- Fortsæt til fortynding af standarden på fortynder 2 ved hjælp af en 1/4 serie fold fortynding.
- Vaske pladerne tre gange med wash buffer.
- Undvære 50 µL af prøver eller standard pr. brønd.
- Der inkuberes i 2 timer ved stuetemperatur under agitation.
- Vaske pladen fire gange med PBS + 0,05% Polysorbat 20.
- Tilføj 25 µL af detektor-antistof (60 µL af hver antistof til 3 mL endelige) i fortyndingsmiddel 3.
- Der inkuberes i 2 timer ved stuetemperatur under agitation.
- Vaske pladen fire gange med PBS + 0,05% Polysorbat 20.
- Undgå boblerne, Tilføj 150 µL pr. brønd af læsebufferen (Tris-baseret buffer indeholdende derunderbromid, fortyndet 2 x i ddH20) som en co reaktanter for lys generation i electrochemiluminescence immunassays.
- Læs plade (uden forsinkelse) på et multiplex pladelæseren.
-
Musen TNF-a måling ved ELISA efter leverandørens protokol
- Fortynd supernatanten 1:1 i assay fortyndingsmiddel (klar til at bruge protein-holdige buffer).
- Forbered reagenser, prøver og standard fortyndinger, som beskrevet i sættet. Tilsæt 50 μL af assay fortynder til hver brønd.
- Tilsæt 50 μL af standard, kontrol eller prøve pr. brønd.
- Bland ved forsigtigt at trykke pladen rammen for 1 min.
- Dække med den medfølgende selvklæbende strimler og inkuberes i 2 timer ved stuetemperatur.
- Opsug hver godt og vask med 400 μL/brønd (Gentag dette trin fem gange i alt).
- Efter den sidste vask, skal du fjerne eventuelle resterende vaskebuffer ved sugning.
- Vend pladen og duppes mod rene papirservietter.
- Tilsæt 100 μL af musen TNF-α konjugat til hver brønd. Dække med en ny selvklæbende strimmel.
- Der inkuberes i 2 timer ved stuetemperatur.
- Gentag aspiration/vask som i trin 7.4.4.
- Tilsæt 100 μL substratopløsning til hver brønd og Inkuber i 30 min. ved stuetemperatur beskyttet mod lys.
- Tilsæt 100 μL fortyndet saltsyreopløsning (stopopløsning) til hver brønd. Tryk forsigtigt på pladen for at sikre grundig blanding.
- Måle det optiske densitet ved 450 nm (med korrektion bølgelængde på 560 nm) ved hjælp af en mikrotiterplade læser (skal gøres inden for 30 min).
- Fortynd supernatanten 1:1 i assay fortyndingsmiddel (klar til at bruge protein-holdige buffer).
-
Cellernes levedygtighed
- Efter fjernelse supernatanter fra PBMC eller monocyt præparater, vurdere cellernes levedygtighed ved hjælp af en klar til at bruge resazurin løsning (thermodynamikken indikator) tilsættes direkte til cellesuspension til 10% endelige koncentration.
- Inkuber i 1 til 2 timer ved 37 ° C, 5% CO2.
- Læs fluorescens på 590 nm (Excitation 540 nm) ved hjælp af en mikrotiterplade læser.
8. sammensatte forberedelse
-
Seriel fortynding for iMoDCs
- Fortynd MLT-827 stamopløsningen (10 mM i dimethylsulfoxid (DMSO) i medium at nå 8 µM på én gang (4 x koncentreret).
- Udføre en seks-trin 1:5 seriel fortynding, ved hjælp af medium + 0,08% DMSO. Brug den samme medium + 0,08% DMSO løsning for køretøjet (ingen sammensatte) tilstand.
-
Enkeltdosis test for iMoDCs
- Fortynd de MLT-827, AFN700 og Cpd11 stamopløsninger i medium at nå 4 µM på én gang (4 x koncentreret).
-
Seriel fortynding for murine milt celler
- Fortynde en 10 µM MLT-827 løsning (fremstillet af en 10 mM stamopløsning efter en én gå fortynding i medium) til 0,01 µM, DMSO ende koncentration på 0,1%.
- For fortynding skridt, tage 2 µL af hver fortynding, tilføje 38 µL RPMI, og med pipette overfoeres 5 µL i brønden.
Bemærk: Alle behandlinger udføres i tre eksemplarer.
9. stimuli forberedelse
-
Forarmet zymosan (DZ)
- Der tilsættes 2 mL sterilt endotoxin-gratis vand til 10 mg DZ.
- Vortex at homogenisere stamopløsning, vortex også forudgående hver brug.
- Alikvot løsning og butik alikvoter ved-20 ° C.
-
Trehalose-6,6-dibehenate (TDB)
- Tilføje 100 µL af DMSO til 1 mg TDB, varme ved 60 ° C i et vandbad til 15-30 s.
- Vortex og straks tilføje 900 µL sterilt PBS, vortex igen.
- Varme i 10-15 min. ved 60 ° C og homogeniseres ved vortexing før hver brug.
- Holde løsningen ved 4 ° C.
- Udføre serielle fortyndinger og enkeltdosis forberedelse som MLT-827 sammensatte.
Bemærk: Fordi TDB skal forberedes i DMSO, er en slutkoncentration 1% DMSO til stede under celle stimulation.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
I myeloide celler relæer MALT1 aktivering signaler nedstrøms af flere C-type lektin-lignende receptorer, som Dectin-1, Dectin-2 og MINCLE6. Disse veje stole på (forneden) ITAM motiv-holdige receptorer (f.eks., Dectin-1) eller ITAM motiv-holdige Co receptorer (f.eks., FcRγ, Dectin-2 og MINCLE) at rekruttere og aktivere SYK kinase (figur 1). Dette fører til aktivering af en protein kinase C isoform, nemlig PKCδ, som phosphorylates CARD9, derved udløser CARD9/BCL10/MALT1 kompleks dannelse og rekruttering af TRAF6 til downstream NF-κB aktivisering12. Derimod rekrutter TLR-4 pathway TRAF6 i en MALT1-uafhængig men MYD88/IRAK-afhængige måde for NF-κB aktivering (figur 1). Beviser for denne differentieret inddragelse af MALT1 blev opnået med genetiske modeller af MALT1 mangel samt farmakologisk behandling med peptidic active-site hæmmer z-VRPR-fmk11,13,14.
Vi brugte det for nylig rapporteret potent og selektiv MALT1 hæmmer MLT-82715 og spurgte, hvis dette stof ville regulere TNF-produktion nedstrøms C type lektin-lignende og Toll-lignende receptorer, henholdsvis. Menneskelige PBMC og mus milt celler blev stimuleret med forarmet zymosan (DZ, en kendt agonist af Dectin-1) eller LPS (LP'ER, en kendt agonist af TLR-4) og vi målte TNF-release i kultur supernatanten efter 20 h. I både menneskelige og mus assays blokeret MLT-827 selektivt TNF-produktion drives af Dectin-1 vej, men ikke af TLR-4 vej (figur 2). Vi opnåede lignende data ved inkubering med z-VRPR-fmk sammensatte (tillægs figur 1).
For at få pathway indsigt, vi gennemført yderligere eksperimenter i humane monocytter og umodne monocytter-afledte dendritiske celler (iMoDCs), sammenligne effekten af MLT-827, SYK hæmmer Cpd1116 og IKK hæmmer AFN70015 . I monocytter stimuleret med LP'ER, produktion af TNF-α blev næsten fuldstændig ophævet ved AFN700 men ikke var følsomme over for Cpd11 (figur 3A), som er konsistent med afhængighed/uafhængighed af TLR-4 pathway på NF-κB/SYK aktivitet, henholdsvis () Se figur 1). Derimod TNF-α produktion drives af Dectin-1 i iMoDCs vises følsomhed til Cpd11 ud over følsomhed over for MLT-827 og AFN700 (figur 3B, supplerende figur 2), leverer yderligere beviser for inddragelse af et SYK/CBM signalering kaskade i Dectin-1 vej (figur 1). Bemærkelsesværdig, produktion af IL-1, IL-6 og IL-23 efter Dectin-1 stimulation blev også følsomme over for de tre hæmmere, der derved viser reguleringsmekanismer ligner TNF-. Dog foreslået en begrænset effekt af de tre forbindelser på IL-8 produktion en særskilt reguleringsmekanisme for denne cytokin (figur 3B, tillægs figur 2).
Ud over Dectin-1, andre CLLRs, såsom Dectin-2 og MINCLE, funktionen via stimulation af et CARD9 signalosome7. Vi har derfor testet MLT-827 i iMoDCs udfordret med MINCLE agonist Trehalose-6,6-dibehenate (TBD). At hæve TBD koncentrationer over 50 µg/mL førte til produktion af TNF-, IL-6 og IL-1, som påberåbt MALT1 paracaspase aktivitet, som set fra den blokerende virkning af MLT-827 (figur 4A). Ensartede resultater blev opnået når udfordrende iMoDCs med stigende koncentrationer af DZ at stimulere Dectin-1 (figur 4B).
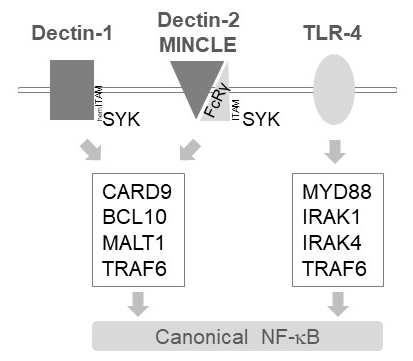
Figur 1: NF-κB signalering neden for Dectin-1, MINCLE og TLR-4. Tegneserien skildrer de nøglen egenskaber i canonical NF-κB aktivisering veje neden for Dectin-1, Dectin-2, MINCLE eller TLR-4 i myeloide celler. HemITAM-holdige Dectin-1 receptoren17 kan direkte engagere SYK at stimulere CBM (CARD9/BCL10/MALT1) kompleks dannelse, fører til TRAF6 afhængige NF-κB aktivering. Andre C-type lektin-lignende receptorer som Dectin-2 eller MINCLE skal ansætte en ITAM-holdige FcRγ kæde for at engagere en CBM og aktivere NF-κB. TLR-4 receptorer bruge en anden mekanisme til NF-κB aktivisering, afhængige af MYD88 og IRAK1/IRAK4 kinaser opstrøms af TRAF6.

Figur 2: Dectin-1 signaler via MALT1 til produktion af TNF-α i mennesker og mus celler. (A) menneskelige PBMC data som i Unterreiner et al., 2017 (figur 2A)11. Menneskelige PBMC blev stimuleret med 1 ng/mL af LP'ER (TLR-4 agonist) eller 100 µg/mL DZ (Dectin-1 agonist) til 20 h i overværelse af sorterede koncentrationer af MLT-827. TNF-udgivet i supernatanten var bestemt af HTRF. (B) mus milt celler blev behandlet med en koncentration vifte af MLT-827 i 30 min og efterfølgende stimuleret med 30 µg/mL DZ eller 1 µg/mL LP'ER + 10 ng/mL IFN - for 18 h. TNF-α i cellekultur supernatanten blev målt ved ELISA. En af to eksperimenter med lignende resultater er vist, som betyder ± SEM af tre målinger.

Figur 3: IKK - og/eller SYK-afhængighed af cytokin produktion nedstrøms TLR-4 og Dectin-1. (A) humane monocytter blev forbehandlet for 1 h med MLT-827 (1 µM), Cpd11 (1 µM), eller AFN700 (3 µM) eller køretøj (DMSO). Celler blev stimuleret med 10 ng/mL LP'ER til 20 h og TNF-i supernatanten var bestemt af HTRF. (B) TNF-α, IL-1β, IL-6, IL-23 og IL-8 produktion af humane monocytter-afledte dendritiske celler (iMoDCs) stimuleres i 24 timer med DZ (100 µg/mL) efter 1 time før inkubation med MLT-827, Cpd11, AFN700 (alle på 1 µM) eller DMSO. Cytokin niveauer i DMSO-behandlede prøver blev fastsat til 100%. Data er middel ± SD af tre målinger, og repræsentant for tre uafhængige forsøg. * P < 0,05; ** P < 0,01; P < 0,001, uparrede tosidede Student's t-test.

Figur 4: C type lektin-lignende-afhængige cytokin produktion af iMoDCs. TNF-α, IL-1β, og IL-6 produktion af iMoDCs stimuleres i 24 timer med MINCLE agonist Trehalose-6,6-dibehenate (TDB, 100 µg/mL) (A) eller med Dectin-1 agonist DZ (100 µg/mL) (B) efter 1 time før inkubation med MLT-827 (1 µM) eller DMSO. Data er middel ± SD af tre målinger og repræsentant for tre uafhængige forsøg.
Supplerende fil 1. Venligst klik her for at downloade denne fil.
Supplerende fil 2. Venligst klik her for at downloade denne fil.
Supplerende fil 3. Venligst klik her for at downloade denne fil.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I dette arbejde brugte vi simple eksperimentelle indstillinger til at studere signaling veje i menneskelige og mus medfødte celler, og afhøre deres afhængighed af MALT1 proteolytiske funktion. Udvide på tidligere arbejde11, viste vores undersøgelse, at MALT1 paracaspase aktivitet styrer C-type lektin-lignende receptor induceret cytokin produktion, herunder TNF-α. Derimod var TLR-4-induceret TNF-α uafhængige af MALT1 i begge arter. Kollektivt, bekræftede disse data den centrale og selektiv bidrag af den MALT1/CBM signalosome nedstrøms af C-typen lektin-lignende receptorer, som blev afsløret af tidligere studier6,12,18.
Om den klare uafhængighed af TLR-4 signalering på MALT1 i myeloide celler gælder for andre typer celle rester at blive udforsket. For eksempel, i B-lymfocytter, var TLR signalering tidligere vist at bidrage til B-celle aktivering nedstrøms af B-celle antigen receptor19. Faktisk har vi ikke-offentliggjorte beviser at TLR-4 stimuleret humane og mus B celler vise følsomhed til MLT-827. Yderligere mekanistiske indblik nedstrøms af B-celle receptoren vil derfor være værdifuld. I denne sammenhæng, en nylig undersøgelse i B-celle lymfom fremlagde beviser for klynger af signaling veje nedstrøms af B-celle receptoren og TLR9 receptor20. TRAF6, der fungerer som mægler for NF-κB aktivisering i både B-celle receptoren og TLR veje, kan være et punkt af krydstale, som kunne forklare følsomheden af begge veje MALT1 protease hæmning. Omvendt, TRAF6 er også en fælles downstream spiller CLLRs og TLRs for induktion af NF-κB, men disse to veje synes ikke at krydstale på MALT1 paracaspase-afhængige måde i myeloide celler.
Dette arbejde fokuseret på cytokin produktion, som giver en let udlæsning til signalering veje og kan gennemføres let for sammensatte profilering. Det understregede værdien af selektiv og potente hæmmere af MALT1 for optrævling MALT1 biologi. At opnå yderligere mekanistiske indsigter vil kræve ekstra arbejde og udvikling af mere proksimale assays, f.eks., for at karakterisere substrater af MALT1 involveret i medfødte signalering forordning.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
Vi takker Elsevier om deres tilladelse (licensnummer 4334770630127) til at gengive her figur 2A fra Unterreiner et al. (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



