Summary
MALT1 regulerer medfødt immunitet men hvordan dette skjer fortsatt dårlig definerte. Vi brukte den selektive MALT1 paracaspase inhibitor MLT-827 for å rakne bidraget fra MALT1 til medfødte signalering nedstrøms Toll-like eller C-type Lektiner-like reseptorer, viser at MALT1 regulerer produksjonen av myelogen cytokiner, og nedstrøms av C-type Lektiner-like reseptorer, selektivt.
Abstract
Foruten dens funksjon i lymfoide celler, som er rettet av en rekke studier, spiller paracaspase MALT1 også en viktig rolle i medfødte cellene nedstrøms i mønster anerkjennelse reseptorer. Best studerte er Dectin-1 og Dectin-2 medlemmer av C-type Lektiner-like reseptor familien som induserer en SYK - og CARD9-avhengige signalering gjennomgripende fører til NF-κB aktivisering, på en måte som MALT1-avhengige. I motsetning Toll-like reseptorer (TLR), for eksempel TLR-4, overføre NF-κB aktivisering men signalet via en MYD88/IRAK-avhengige cascade. Likevel har om MALT1 kan bidra til TLR-4 signalering forblitt uklart. Nyere bevis med MLT-827, en potent og selektiv hemmer MALT1 paracaspase aktivitet, angir at TNF-produksjon nedstrøms av TLR-4 i menneskelige myeloide celler er uavhengig av MALT1, i motsetning til TNF-produksjon nedstrøms av Dectin-1, som er MALT1 avhengige. Her behandlet vi selektiv involvering av MALT1 i mønstergjenkjenning sensing videre, ved hjelp av en rekke menneskelige og mus mobilnettet forberedelser og stimulering av Dectin-1, MINCLE eller TLR-4. Vi har også gitt ytterligere innsikt ved å utforske cytokiner TNF- og sammenligne MLT-827 en SYK hemmer (Cpd11) og en IKK inhibitor (AFN700). Kollektivt, oppgitt ytterligere bevis for MALT1-avhengigheten av C-type Lektiner-like reseptor-signalisering derimot til TLR-signalisering.
Introduction
Paracaspase aktiviteten til MALT1 (Mucosa-assosiert lymfoid vev lymfom translokasjon protein 1) ble avslørt i 20081,2. Siden da har en rekke studier rapportert sitt viktige bidrag til antigen reseptor svar i lymfocytter. Genetisk modeller i musen samt farmakologi dataene støtter en nøkkelrolle i T-celler, T-celle avhengige autoimmunitet og B-celle lymfom innstillinger3,4. Lymfocytter, MALT1 paracaspase aktivisering oppstår ved montering av CARD11-BCL10-MALT1 komplekse5, som utløses av antigen-reseptor proksimale signalering nedstrøms T - eller B-celle reseptor. Det er også rikelig bevis for at en lignende CARD9-BCL10-MALT1-komplekset er viktig for å spre signaler nedstrøms av C-type Lektiner-like reseptorer (CLLR), f.eks, Dectin-1, Dectin-2 og MINCLE i myeloide celler6,7. Dectin-1 har vært spesielt godt studert fordi denne veien er avgjørende for vert forsvar mot soppinfeksjoner8,9. Implikasjonen av MALT1 i Toll-like reseptor (TLR) veier, men har vært kontroversielle10. Nyere bevis i menneskelige myeloide celler beherske ut en direkte rolle for MALT1 paracaspase aktivitet i regulering av TNF-produksjon nedstrøms TLR-4-11.
I den nåværende arbeidet brukt vi ulike eksperimentelle innstillinger og stimulerende forhold i menneskelig og mus myeloide celler for å undersøke medfødte signalveier, avhengig av spesifikke farmakologiske verktøyet hemmere og måling av cytokiner produksjonen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Eksperimenter ble utført i henhold til retningslinjer og standarder for etikk for Novartis menneskelige forskning.
1. forberedelse til perifert blod mononukleære celler (PBMCs) fra menneskelig Buffy strøk
Merk: Vi fikk buffy strøk fra friske frivillige dagen etter samling, i 50 mL poser. De ble gitt under samtykke og samles inn gjennom Interregionale Blutspende Schweizeriches Rotes Kreuz. Vi behandlet dem ved hjelp av fremgangsmåten nedenfor, i romtemperatur, hvis ikke annet.
- Forberede et sterilt og ren par saks og en 1 liters kanne med en plastpose (under en lamina flyt).
- Overføre buffy pelsen til begeret og nøye åpne den med saksen.
- Bruke en 25 mL pipette, legge til 100 mL fosfat-bufret saltvann buffer/ethylenediaminetetraacetic syre (PBS/EDTA: PBS 1 x pH 7.4 inneholder ingen CaCl2 og ingen MgCl2, supplert med 2 mM EDTA pH 8.0).
Merk: Bruker samme Pipetter og etter sakte pipettering løsningen opp og ned, dispensere 25 mL utvannet buffy pelsen til 6 konisk sentrifuge rør av 50 mL forhåndsutfylt med 15 mL polysakkarid-baserte tetthet graderingen. - Sentrifuge 20 min 800 x g med moderat akselerasjon (satt på 4 av 9) og uten brems å tillate for separasjon av cellene basert på deres tettheter.
Merk: Etter sentrifugering, ville tre lag være synlig; pellets med røde blodceller og granulocytter, en øvre lag laget av plasma, og mellom en hvit ring som inneholder perifert blod mononukleære celler (PBMCs). - Høste PBMC ringen bruker 10 mL pipette og overføring til ny 50 mL rør.
Merk: To til tre 50 mL rør kreves vanligvis per buffy strøk. På dette stadiet forurenser noen plasma sannsynlig de samlet PBMCs, som ikke bør ha noen innvirkning på etterfølgende berikelse trinnene. - Topp opptil 50 mL hver tube med PBS/EDTA og videre til tre påfølgende vasker med minkende sentrifugering tid og fart (15 min på 520 x g, 10 min 330 x g, 8 min på 150 x g).
Merk: På hvert trinn, nedbryting helles ut i en flytende avfall beholder og celle pellets er resuspended i 50 mL av PBS/EDTA (pellets kan samordnes etter første vask). - Etter siste vask, resuspend pellet i 25 mL av en iskald lyseringsbuffer (se Tabell of Materials) til lyse røde blod celler av osmotisk trykk.
- Inkuber til løsningen blir klart (≤5 min ved romtemperatur).
- Stoppe reaksjonen ved å legge til 25 mL av separasjon buffer (PBS 1 x pH 7.4 inneholder ingen CaCl2 og ingen MgCl2, supplert med 2% inaktivert fosterets bovin serum (FBS) og 1 mM EDTA pH 8.0).
- Vask en gang på 150 x g i 8 min.
Merk: På dette stadiet PBMCs kan brukes som en bulk befolkning (se trinn 3: PBMCs og monocytter og stimulerende forhold) eller behandlet for monocytt berikelse (se trinn 2: Forberedelse av monocytter fra PBMCs), eller frosset ned for senere bruk (se trinn 5: Monocytter og PBMCs frysing/tining prosedyrer).
2. forberedelse av monocytter fra PBMCs
- Resuspend PBMCs på trinn 1,10 separasjon buffer og telle dem å nå 5 x 107celler/mL.
- Overføre celle suspensjon i en 14 mL konisk sentrifuge tube med cap.
- Legge til 50 µL monocytt berikelse antistoff cocktail per mL av cellen suspensjon virvelen, og Inkuber 10 min på 4 ° C.
- Legge til 50 µL av monocyte berikelse perler per mL av celler.
Merk: Perler må være grundig vortexed å sikre homogenitet av suspensjon. - Etter å legge perler, kort tid vortex celle suspensjon og ruge 5 min på 4 ° C.
- Skyll den øvre delen av røret med separasjon buffer til røret er fylt opp til 10 mL.
- Sakte blande løsningen av pipettering opp og ned.
- Sett røret uten cap til en separasjon magnet.
- Inkuber for 2,5 min ved romtemperatur.
- Hell sakte i en 15 mL konisk sentrifuge rør.
- På dette stadiet, bruke monocytter direkte (se trinn 3: PBMCs og monocytter og stimulerende forhold) eller skille dem i jegmmature Monocyte-avledet Dendritic Cells (iMoDCs) (se trinn 4), eller fryse dem ned for senere bruk (se trinn 5).
3. PBMCs og monocytter behandlinger og stimulerende vilkår
- Telle celler og fortynne dem i kultur medium (Roswell Park Memorial Institute medium (RPMI) 10% FBS + 1 mM natrium Pyruvate + 100 U/mL Penicillin Streptomycin (penn/Strep) + 5 µM β-mercaptoethanol), til 1,25 x 104 celler/godt.
- Distribuere 30 µL av cellen suspensjon per brønn av en 384-vel plate.
- Legg til 15 µL av 4 x konsentrert sammensatte løsninger og pre ruge 1t ved 37 ° C, 5% CO2.
- Legg lipopolysakkarid (LPS) til en siste konsentrasjon av 10 ng/mL, utarmet zymosan (DZ) til en siste konsentrasjon 100 µg/ml eller holde i vanlig medium.
- Ruge over natten ved 37 ° C, 5% CO2.
- Ta 10 µL av nedbryting å måle utskilles TNF-a nivåer (se trinn 7: cytokiner og levedyktighet mål).
4. monocytter differensiering inn iMoDCs og stimulerende betingelser
- Telle monocytter (beriket med trinn 2) og sentrifuge celle suspensjon 520 x g i 5 min.
- Pipetter av nedbryting og legge kultur medium (RPMI + 10% FBS å få en siste celle suspensjon av 0,4 x 106 celler/mL.
- Legge til 80 ng/mL rekombinant menneskelige IL-4 + 100 ng/mL GM-CSF.
- Dispensere 5 mL av cellen suspensjon per brønn i en 6-vel plate.
- Inkuber i 7 dager på 37 ° C, 5% CO2.
- På dag 7, høste celler av pipettering forsiktig for å unngå aktivisering.
- Sentrifuger 520 x g i 5 min.
- Vakuum leveringstanken og resuspend i 50 mL av kultur medium uten vekstfaktorer.
- Sentrifuge 520 x g i 5 min og resuspend på 1 x 106 celler/mL i kultur medium.
- Dispensere 100 µL av cellen suspensjon (105 celler) per brønn av en 96-brønns flat bunn plate.
- Pre incubate 1t på 37 ° C etter 50 µL av 4 x konsentrert sammensatte løsninger, forberedt som beskrevet i trinn 8: forbindelser forberedelse.
- Legge til 50 µL av stimuli (4 x konsentrert), utarbeidet som beskrevet i trinn 9.
- Inkuber 24 h på 37 ° C.
- Bland hver brønn og overføre celler og nedbryting (SN) inn i en 96-brønns V-bunnplaten.
- Nedspinning 475 x g i 5 min.
- Overføre nedbryting til en ny 96-brønns flat bunn plate, seal og fryse på 20 ° C til videre bruk.
5. monocytter og PBMCs frysing/tining prosedyrer
-
Frysing
- Nedspinning PBMC eller monocytt celle forberedelser 520 x g for 5 min.
- Vakuum sug opp nedbryting og resuspend celler i iskaldt medium på 1 x 107 celler/mL.
- Dispensere 1 mL av cellen fjæring i cryotubes, overføre rør til en bestemt kjøling enhet (se materialer tabell) og sted den på-80 ° C.
-
Tiner
- Tine i cryotube og raskt overføre innholdet i et 15 mL konisk sentrifuge rør som inneholder 9 mL kultur medium.
- Sentrifuger 520 x g i 5 min.
- Vakuum leveringstanken nedbryting og resuspend celle pellet i 5 mL av kultur medium. Celler er nå klar for videre eksperimentell behandling.
6. musen milt celler forberedelse og behandling
Merk: Vi gjennomførte dyreoffer i henhold til retningslinjer og standarder for Novartis dyr velferd organisasjonen. Studier ble godkjent av den etiske komiteen av de regionale statlig myndigheten (Kantonales Veterinäramt der Stadt Basel). Vi ofret dyr av isoflurane, med alle anstrengelser gjøres for å minimere lidelse.
- Høste milten og dissociate vev ved hjelp av et rør utstyrt med en mekanisk vev jeksel enhet og fylt med 5 mL kaldt RPMI medium.
- Bruk programmet milten av dissosiasjon maskinen for å slipe organer.
- Filtrere cellene gjennom en 100 mm nylon celle sil.
- Overføre suspensjon i 50 mL rør og sentrifuge på 4 ° C for 10 min 320 x g.
- Vakuum leveringstanken nedbryting, resuspend celle pellet i 3 mL iskald lyseringsbuffer og ruge i ≤2 min på is.
- Stopp lysis av legge 7 mL av RPMI medium.
- Filtrere igjen gjennom en 100 µm nylon celle sil.
- Nedspinning celle suspensjon på 330 x g i 10 min på 4 ° C.
- Vakuum leveringstanken nedbryting og resuspend celler på 11 x 106 celler/mL i fullstendig medium (RPMI supplert med 10% FBS, 100 U/mL penn/trinn og 5 µM β-Mercaptoethanol).
- Plate 1 x 106 celler/vel (90 µL) i en 96-brønns plate (flat bunn).
- Legge til 5 µL av 20 x konsentrert sammensatte løsning tidligere fortynnet i RPMI medium som beskrevet i trinn 8.3: føljetong fortynning for murine milt celler.
- Inkuber i 30 min ved 37 ° C, 5% CO2.
- Legge til 5 µL av 20 x konsentrert DZ (siste konsentrasjon 30 µg/mL) eller 20 x konsentrert LPS + IFN-g (TLR-4) (siste konsentrasjon 1 µM LPS og 10 ng/mL IFN-g).
- Ruge over natten ved 37 ° C, 5% CO2.
- Sentrifuger 330 x g i 10 min.
- Overføre supernatants i nye plater, sel og fryse på 20 ° C til videre bruk.
7. cytokiner og levedyktighet målinger
-
Menneskelige TNF-en måling av HTRF (homogen tid løst fluorescens)
Merk: Protokollen etterfulgt leverandørens anbefalinger, kort oppsummert nedenfor.- Bland 1-volum av rekonstituert reagensen (anti TNF-a-cryptate og anti-TNF-a-XL665) med 19 mengder rekonstituering buffer (50 mM fosfat buffer pH 7.0, 0,8 M kalium fluor (KF), 0,2% bovin serum albumin (BSA)).
- Bland de to klar-å-bruke antistoff løsningene 1:1 rett før utlevering reagenser.
- Dispensere 10 µL av supernatants fra trinn 3.6 i hvit 384-vel platene.
- Dispensere 10 µL av antistoff miksen.
- Dekk platen med en sealer og ruge på 4 ° C over natten.
- Lese plate på en microplate leser (50-200 flash).
- Menneskelige IL-23 måling av HTRF (homogen tid løst fluorescens)
Merk: Protokollen etterfulgt leverandørens anbefalinger, kort oppsummert nedenfor.- Bland ett volum av rekonstituert reagensen (anti IL-23-cryptate-antistoffer og anti-IL-23 D2-antistoffer) med 19 mengder oppdagelsen buffer #3.
- Bland de to klar-å-bruke antistoff løsningene 1:1 rett før utlevering reagenser.
- Dispensere 10 µL av supernatants fra trinn 3.6 i hvit 384-vel platene.
- Dispensere 10 µL av antistoff miksen.
- Dekk platen med en sealer og ruge på 4 ° C over natten.
- Lese plate på en microplate leser (50-200 nm flash).
-
Menneskelige IL-6, IL-8, IL-1β og TNF-α målinger ved electrochemiluminescence
Merk: Alle prøver ble utvannet på 1/150 i fortynningsmiddel 2 (første fortynning: 10 µL i 150 µL og 20 µL i 180 µL). Protokollen etterfulgt leverandørens anbefalinger:- Fortynne prøver og standard i fortynningsmiddel 2.
- Videre til fortynning av standarden i fortynningsmiddel 2 bruke en 1/4 føljetong fold fortynning.
- Vask plater tre ganger med vaskebuffer.
- Dispensere 50 µL av prøver eller standard per brønn.
- Inkuber for 2 timer ved romtemperatur under omrøring.
- Vaske platen fire ganger med PBS + 0,05% polysorbat 20.
- Legg til 25 µL oppdagelsen antistoff (60 µL hver antistoff for 3 mL endelige) i fortynningsmiddel 3.
- Inkuber for 2 timer ved romtemperatur under omrøring.
- Vaske platen fire ganger med PBS + 0,05% polysorbat 20.
- Unngå bobler, legge til 150 µL per brønn på lesebufferen (Tris-baserte bufferen som inneholder tripropylamine, utvannet 2 x i ddH20) som en co reactant for lette generasjon i electrochemiluminescence immunanalyser.
- Lese plate (uten forsinkelse), en multiplex plate leser.
-
Musen TNF-en måling med ELISA etter leverandørens protokoll
- Fortynne nedbryting 1:1 i analysen fortynner (klar til å bruke protein inneholder buffer).
- Forberede reagenser, eksempler og standard fortynninger som beskrevet i kit. Tilsett 50 μL av analysen fortynningsmiddel i hver brønn.
- Tilsett 50 μL av standard, kontroll eller vareprøve per brønn.
- Bland ved trykke forsiktig plate rammen for 1 min.
- Dekk med angitte selvklebende stripen og ruge for 2 timer ved romtemperatur.
- Sug opp hver godt og vask med 400 μL/godt (gjenta dette trinnet fem ganger totalt).
- Etter siste vask, fjerne eventuelle gjenværende vaskebuffer ved aspirating.
- Snu platen opp ned og blot mot ren papirhåndklær.
- Tilsett 100 μL av musen TNF-α konjugert i hver brønn. Dekk med en ny lim stripe.
- Inkuber for 2 timer ved romtemperatur.
- Gjenta aspirasjon/vask som i trinn 7.4.4.
- Tilsett 100 μL av substratløsningen i hver brønn og ruge i 30 min ved romtemperatur beskyttet mot lyset.
- Tilsett 100 μL av fortynnet saltsyre løsning (stopp løsning) i hver brønn. Slå lett på platen for å sikre grundig blande.
- Måle optisk densitet ved 450 nm (med korreksjon bølgelengden satt til 560 nm) bruker en microplate reader (for å bli gjort innen 30 min).
- Fortynne nedbryting 1:1 i analysen fortynner (klar til å bruke protein inneholder buffer).
-
Cellen levedyktighet
- Etter fjerner supernatants fra PBMC eller monocytt forberedelser, vurdere celle levedyktighet bruker en klar til å bruke resazurin løsning (oksidasjon-reduksjon indikator) lagt direkte til cellen suspensjon til 10% siste konsentrasjon.
- Inkuber for 1-2 h på 37 ° C, 5% CO2.
- Lese fluorescens på 590 nm (eksitasjon 540 nm) bruker en microplate reader.
8. sammensatte forberedelse
-
Seriell fortynning for iMoDCs
- Fortynne MLT-827 lager løsningen (10 mM dimethyl sulfoxide (DMSO) til medium å nå 8 µM på en gang (4 x konsentrert).
- Utføre en seks-trinns 1:5 føljetong fortynning, bruker medium + 0,08% DMSO. Bruk samme medium + 0,08% DMSO løsning for kjøretøy (ingen sammensatte) betingelsen.
-
Enkelt dose tester for iMoDCs
- Fortynne MLT-827, AFN700 og Cpd11 lager løsninger til medium å nå 4 µM på en gang (4 x konsentrert).
-
Seriell fortynning for murine milt celler
- Fortynne en 10 µM MLT-827 løsning (hentes fra en 10 mM lagerløsning etter en en gå fortynning i medium) til 0,01 µM, med en DMSO slutten konsentrasjon på 0,1%.
- Fortynning trinnene, ta 2 µL av hver fortynning, legge til 38 µL RPMI og Pipetter 5 µL i brønnen.
Merk: Alle behandlinger er utført i tre eksemplarer.
9. stimuli forberedelse
-
Utarmet zymosan (DZ)
- Legge til 2 mL steril endotoxin-fritt vann 10 mg av DZ.
- Vortex til homogenize lager løsningen, vortex også før bruk.
- Aliquot løsning og lagre dele på 20 ° C.
-
Trehalose-6,6-dibehenate (TDB)
- Legge til 100 µL av DMSO 1 mg TDB, varme ved 60 ° C i et vannbad for 15 – 30 s.
- Vortex og umiddelbart legge 900 µL av sterile PBS, vortex igjen.
- Varme i 10-15 minutter ved 60 ° C og homogenize av vortexing før bruk.
- Holde løsningen på 4 ° C.
- Utføre føljetong fortynninger og enkelt dose forberedelse for MLT-827 sammensatte.
Merk: Fordi TDB må være forberedt i DMSO, er en siste 1% DMSO konsentrasjon under cellen stimulering.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
I myeloide celler reléer MALT1 aktivisering signalene nedstrøms flere C-type Lektiner-like reseptorer, for eksempel Dectin-1, Dectin-2 og MINCLE6. Disse veiene avhengige (hem) ITAM motiv inneholder reseptorer (f.eks, Dectin-1) eller ITAM motiv inneholder co reseptorer (f.eks, FcRγ, for Dectin-2 og MINCLE) som rekruttere og aktivere forhold kinase (figur 1). Dette fører til aktivering av et protein kinase C isoformen, nemlig PKCδ, som phosphorylates CARD9, og dermed utløser CARD9/BCL10/MALT1 komplekse dannelse og rekruttering av TRAF6 for nedstrøms NF-κB aktivisering12. Derimot rekrutter TLR-4 veien TRAF6 i et MALT1-uavhengig men MYD88/IRAK-avhengige måte for NF-κB Aktivisering (figur 1). Bevis for denne differensial involvering av MALT1 ble oppnådd med genetisk modeller av MALT1 mangel samt farmakologisk behandling med peptidic active-området hemmer z-VRPR-fmk11,13,14.
Vi brukte den nylig rapportert potent og selektiv MALT1 inhibitor MLT-82715 og spurte Hvis denne forbindelsen vil regulere TNF-produksjon nedstrøms av C type Lektiner-like og Toll-like reseptorer, henholdsvis. Menneskelig PBMCs og mus milt celler ble stimulert med utarmet zymosan (DZ, en kjent Agonistiske av Dectin-1) eller lipopolysakkarid (LPS, en kjent Agonistiske TLR-4) og målt TNF-release i kulturen supernatant etter 20 h. Både menneskelige og mus analyser blokkert MLT-827 selektivt TNF-produksjon drevet av Dectin-1 veien, men ikke av TLR-4 veien (figur 2). Vi fikk lignende data inkubasjon med z-VRPR-fmk sammensatte (supplerende figur 1).
For å få sti innsikt, gjennomførte vi ytterligere eksperimenter i menneskelig monocytter og umodne monocytter-avledet dendrittiske celler (iMoDCs), sammenligne effekten av MLT-827 for SYK hemmer Cpd1116 og som for den IKK inhibitor AFN70015 . I monocytter stimulert med LPS, produksjon av TNF-α var nesten helt avskaffet av AFN700, men var ikke følsom for Cpd11 (figur 3A), hvilke er gjennomført med avhengighet/independency av den TLR-4 veien på NF-κB/forhold aktivitet, henholdsvis ( se figur 1). Derimot TNF-α produksjon drevet av Dectin-1 i iMoDCs vises følsomheten til Cpd11 i tillegg til følsomhet for MLT-827 og AFN700 (figur 3B, utfyllende figur 2), gir ytterligere bevis for involvering av en SYK/CBM signalisering Overlapp i Dectin-1 veien (figur 1). Merke, produksjon av IL-1, IL-6 og IL-23 på Dectin-1 stimulering var også følsom for de tre hemmere, og dermed indikerer regulatoriske mekanismer ligner TNF-. Men foreslått en begrenset effekt av tre forbindelser på IL-8 produksjon en distinkt regulatoriske mekanisme for denne cytokin (figur 3B, utfyllende figur 2).
I tillegg til Dectin-1, andre CLLRs, som Dectin-2 og MINCLE, funksjonen via stimulering av en CARD9 signalosome7. Vi testet derfor MLT-827 i iMoDCs utfordret med MINCLE Agonistiske Trehalose-6,6-dibehenate (TBD). Heve TBD konsentrasjoner over 50 µg/mL førte til produksjon av TNF-, IL-6 og IL-1, som støttet seg på MALT1 paracaspase aktivitet som blokkerer effekten av MLT-827 (figur 4A). Konsekvente resultater ble oppnådd når utfordrende iMoDCs med økende konsentrasjoner av DZ å stimulere Dectin-1 (figur 4B).
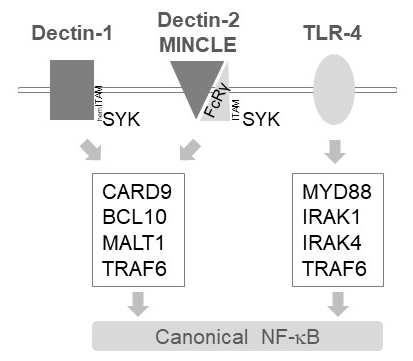
Figur 1: NF-κB signalering nedstrøms Dectin-1, MINCLE og TLR-4. Tegneserien skildrer de viktigste funksjonene i Kanonisk NF-κB aktivisering trasé nedstrøms for Dectin-1, Dectin-2, MINCLE eller TLR-4 i myeloide celler. De hemITAM som inneholder Dectin-1 reseptor17 kan direkte delta forhold å stimulere CBM (CARD9/BCL10/MALT1) komplekse formasjon, fører til TRAF6 avhengige NF-κB aktivisering. Andre C-type Lektiner-like reseptorer som Dectin-2 eller MINCLE trenger å rekruttere en ITAM inneholder FcRγ kjeden å engasjere en CBM og aktivere NF-κB. TLR-4 reseptorer bruker en annen mekanisme for NF-κB aktivisering, avhengig av MYD88 og IRAK1/IRAK4 kinaser oppstrøms av TRAF6.

Figur 2: Dectin-1-signaler via MALT1 for produksjon av TNF-α i menneskelig og mus celler. (A) Human PBMCs data som Unterreiner et al., 2017 (figur 2A)11. Menneskelige PBMCs ble stimulert med 1 ng/mL av LPS (TLR-4 Agonistiske) eller 100 µg/mL DZ (Dectin-1 Agonistiske) 20 h i nærvær av gradert konsentrasjoner av MLT-827. TNF-utgitt i nedbryting ble kvantifisert ved HTRF. (B) musen milt celler ble behandlet med en konsentrasjon utvalg av MLT-827 i 30 min og deretter stimulert med 30 µg/mL DZ eller 1 µg/mL LPS + 10 ng/mL IFN - for 18 h. TNF-α i cellekultur supernatant ble målt med ELISA. En av to eksperimenter med lignende resultater er vist, som betyr ± SEM av tre målinger.

Figur 3: IKK - og/eller forhold-avhengighet av cytokin produksjon nedstrøms av TLR-4 og Dectin-1. (A) Human monocytter var pre-behandlet 1t med MLT-827 (1 µM), Cpd11 (1 µM), eller AFN700 (3 µM) eller kjøretøy (DMSO). Cellene ble stimulert med 10 ng/mL LPS for 20 h og TNF-i nedbryting ble kvantifisert ved HTRF. (B) TNF-α, IL-1β, IL-6, IL-23 og IL-8 produksjon av menneskelig monocytter-avledet dendrittiske celler (iMoDCs) stimulert 24 h med DZ (100 µg/mL) etter 1t pre-inkubering med MLT-827, Cpd11, AFN700 (alle på 1 µM) eller DMSO. Cytokin nivåer i DMSO-behandlet prøver ble satt til 100%. Dataene er betyr ± SD av tre målinger og er tre uavhengige eksperimenter. * P < 0,05; ** P < 0.01; P < 0,001, unpaired tosidige Student t-test.

Figur 4: C type Lektiner-lignende-avhengige cytokiner produksjonen av iMoDCs. TNF-α, IL-1β og IL-6 produksjon av iMoDCs stimulert 24 h med MINCLE Agonistiske Trehalose-6,6-dibehenate (TDB, 100 µg/mL) (A) eller Dectin-1 Agonistiske DZ (100 µg/mL) (B) etter 1t pre-inkubering med MLT-827 (1 µM) eller DMSO. Dataene er betyr ± SD av tre målinger og representant for tre uavhengige eksperimenter.
Ekstra fil 1. Klikk her for å laste ned denne filen.
Ekstra filen 2. Klikk her for å laste ned denne filen.
Ekstra filen 3. Klikk her for å laste ned denne filen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
I dette arbeidet brukte vi enkle eksperimentelle innstillinger å studere signalveier i menneskelig og mus medfødte celler, og avhøre avhengigheten MALT1 proteolytisk funksjonen. Utvide på tidligere arbeid11, viste vår studie at MALT1 paracaspase aktivitet styrer C-type Lektiner-like reseptor indusert cytokin produksjon, inkludert TNF-α. Derimot var TLR-4-indusert TNF-α uavhengig av MALT1 i begge arter. Samlet bekreftet disse data nøkkel og selektivt bidrag av MALT1/CBM signalosome nedstrøms av C-type Lektiner-like reseptorer, som ble offentliggjort av tidligere studier6,12,18.
Om den klare independency TLR-4 signalisering på MALT1 i myeloide celler gjelder for andre typer celle gjenstår å bli utforsket. For eksempel i B-lymfocytter, ble TLR signalering tidligere vist å bidra til B-celle aktivering nedstrøms av B-celle antigen reseptor19. Faktisk har vi upubliserte bevis på at TLR-4 stimulert menneskelige og mus B celler vise følsomhet til MLT-827. Derfor vil videre mekanistisk innsikt nedstrøms av B-celle reseptor være verdifulle. I denne sammenheng en fersk studie i B-celle lymfom sørget for klynging av de signalnettverk trasé nedstrøms for B-celle reseptor og den TLR9 reseptor20. TRAF6, som fungerer som en megler for NF-κB aktivisering både B-celle reseptor og TLR veier, kan være et kontaktpunkt crosstalk, som kan forklare følsomheten på begge veier MALT1 protease hemming. Derimot TRAF6 er også vanlig nedstrøms spiller på CLLRs og TLRs for induksjon av NF-κB, men disse to veier synes ikke å crosstalk på en MALT1 paracaspase-avhengige måte i myeloide celler.
Dette arbeidet fokuserer på cytokin produksjon, som gir en enkel avlesning signalveier og kan gjennomføres lett for sammensatte profilering. Det uthevet verdien av selektiv og potent hemmere av MALT1 for rakne MALT1 biologi. Innhenter fremme mekanistisk innsikt krever ekstra arbeid og utvikling av mer proksimale analyser, f.eks for å karakterisere underlag av MALT1 involvert i medfødte signalering regulering.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Vi takker Elsevier om deres tillatelse (med lisens antallet 4334770630127) til å gjengi her figur 2A fra Unterreiner et al. (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



