Summary
MALT1 régule l’immunité innée, mais comment dans ce cas reste mal défini. Nous avons utilisé l’inhibiteur sélectif du paracaspase MALT1 MLT-827 à démêler la contribution de MALT1 innée de signalisation en aval des récepteurs Toll-like ou type C de type lectine, démontrant que la MALT1 régule la production de cytokines myéloïde et en aval des récepteurs de type lectine de type C, sélectivement.
Abstract
En plus de sa fonction dans les cellules lymphoïdes, qui a été traitée par de nombreuses études, la paracaspase MALT1 joue également un rôle important dans les cellules innées en aval des récepteurs de reconnaissance de modèle. Mieux étudiés sont les membres de la famille des récepteurs de type lectine de type C Dectin-1 et Dectin-2 qui induisent une fonction SYK et CARD9 signalisation cascade conduisant à l’activation de NF-κB, d’une manière MALT1-dépendante. Par contre, les récepteurs Toll-like (TLR), tels que le TLR-4, propager l’activation de NF-κB, mais le signal via une cascade de MYD88/IRAK-dépendante. Néanmoins, si MALT1 pourrait contribuer à la signalisation TLR-4 est restée incertaine. Des preuves récentes MLT-827, un inhibiteur puissant et sélectif de la MALT1 paracaspase activité, indiquent que TNF-production en aval du TLR-4 dans les cellules myéloïdes humains est indépendante de la MALT1, par opposition à la production de TNF en aval du Dectin-1, qui est MALT1 dépendant. Ici, nous avons abordé la participation sélective des MALT1 en reconnaissance des formes de détection plus loin, en utilisant une variété de préparations cellulaires de souris de l’homme et la stimulation des voies Dectin-1, MINCLE ou TLR-4. Nous avons également fourni des perspicacités supplémentaires en explorant les cytokines au-delà de TNF-et en comparant les MLT-827 à un inhibiteur SYK (Cpd11) et d’un inhibiteur de l’IKK (AFN700). Collectivement, les données fournies preuves supplémentaires pour la MALT1-dépendance du récepteur de type lectine de type C — signalisation en revanche à la signalisation TLR.
Introduction
L’activité paracaspase de la MALT1 (protéine de translocation du tissu lymphoïde associé aux muqueuses lymphome 1) a été révélé en 20081,2. Depuis lors, un certain nombre d’études ont signalé sa contribution essentielle aux réponses du récepteur antigène dans les lymphocytes. Modèles génétiques chez la souris ainsie que les données pharmacologiques appuient un rôle clé dans les cellules de T, en auto-immunité dépendante de lymphocytes T et B-cell lymphoma paramètres3,4. Dans les lymphocytes, MALT1 paracaspase activation se produit lors de l’Assemblée d’un CARD11-BCL10-MALT1 complexe5, qui est déclenchée par le récepteur d’antigène-signalisation proximale en aval du récepteur T - ou B-cellule. Il y a aussi amplement prouvé qu’un complexe CARD9-BCL10-MALT1 semblable est important pour la propagation des signaux en aval des récepteurs de type lectine de type C (m.), par exemple, Dectin-1, 2-Dectin et MINCLE dans myéloïde cellules6,7. Dectin-1 a été particulièrement bien étudié car cette voie est critique pour la défense de l’hôte contre les infections fongiques8,9. Implication de la MALT1 dans les voies du récepteur Toll-like (TLR), cependant, est resté controversé10. Des preuves récentes dans les cellules myéloïdes humaines exclue un rôle direct pour l’activité paracaspase MALT1 dans la régulation du TNF-production en aval de TLR-411.
Dans le présent travail, nous avons utilisé divers paramètres expérimentaux, stimulateurs conditions chez les humains et les cellules myéloïdes souris pour sonder les voies de signalisation innées, en s’appuyant sur les inhibiteurs de l’outil pharmacologique spécifique et la mesure de la production de cytokines.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Des expériences ont été menées selon les lignes directrices et les normes de la Novartis Human Research Ethics Committee.
1. préparation des cellules mononucléaires de sang périphérique (PBMC) de manteaux Buffy humaine
Remarque : Nous avons reçu buffy manteaux de volontaires sains, un jour après le prélèvement, dans des sacs de 50 mL. Ils ont été fournis en vertu du consentement éclairé et recueillies par le biais de l' Interregionale Blutspende Schweizeriches Rotes Kreuz. Nous avons traité à l’aide de la procédure ci-dessous, à la température ambiante, sauf indication contraire.
- Préparer une stérile et propre paire de ciseaux et un bécher de 1 L avec un sac en plastique (sous un flot de limbe).
- Transférer la couche leuco-plaquettaire dans le bécher et ouvrez-le avec précaution avec les ciseaux.
- À l’aide d’une pipette 25 mL, ajouter 100 mL de tampon/EDTA solution saline tamponnée au phosphate (PBS/EDTA : pH de PBS 1 x 7,4 contenant aucune CaCl2 et aucun MgCl2, additionné de 2 mM EDTA pH 8.0).
Remarque : Utilisant la même pipette et après avoir lentement effectué la solution de haut en bas, diluer 25 mL de la couche leuco-plaquettaire diluée dans 6 tubes à centrifuger conique de 50 mL pré-remplie avec 15 mL de gradient de densité à base de polysaccharide. - Centrifuger 20 min à 800 x g avec accélération modérée (fixé à 4 sur 9) et sans frein permettant la séparation des cellules selon leurs densités.
Remarque : Après centrifugation, trois couches seront visibles ; une pastille contenant des globules rouges et les granulocytes, une couche supérieure faite de plasma et entre un anneau de couleur blanche contenant des cellules mononucléaires du sang périphérique (PBMC). - Récolter l’anneau PBMC à l’aide d’une pipette 10 mL et le transfert dans de nouveaux tubes de 50 mL.
Remarque : Deux ou trois tubes de 50 mL sont normalement exigées par la couche leuco-plaquettaire. À ce stade, certains plasma susceptible de contamine les PBMC recueillies, qui ne devraient avoir aucune incidence sur les étapes ultérieures de l’enrichissement. - Supérieure à 50 mL chaque tube à l’aide de PBS/EDTA et procéder à trois lavages successifs avec la diminution des temps de centrifugation et de la vitesse (15 min à 520 x g, 10 min à 330 x g, 8 min à 150 x g).
Remarque : À chaque étape, le surnageant est coulé au large dans un conteneur à déchets liquid et le culot cellulaire est remis en suspension dans 50 mL de PBS/EDTA (granulés peuvent être mises en commun après le premier lavage). - Après le lavage final, resuspendre le culot dans 25 mL d’un tampon de lyse glacee (voir Table des matières) pour lyser les globules rouges par la pression osmotique.
- Incuber jusqu'à ce que la solution devienne claire (plus de 5 min à température ambiante).
- Arrêter la réaction en ajoutant 25 mL de tampon de séparation (PBS 1 x pH 7,4 contenant aucune CaCl2 et aucun MgCl2, additionné de 2 % inactivés par la chaleur bovine sérum fœtal (SVF) et 1 mM EDTA pH 8.0).
- Laver une fois de plus à 150 x g pendant 8 min.
Remarque : À ce stade les PBMC peut être utilisé comme une population en vrac (voir étape 3 : traitements PBMC et les monocytes et les conditions stimulantes) ou transformés pour l’enrichissement de monocyte (voir étape 2 : préparation des monocytes de PBMC), ou congelés vers le bas pour une utilisation ultérieure (voir l’étape 5 : Monocytes et PBMC procédures de gel/dégel).
2. préparation des Monocytes de PBMC
- Remettre en suspension les PBMC obtenues à l’étape 1.10 dans le tampon de séparation et les compter pour atteindre 5 x 107cellules/mL.
- Transférer la suspension de cellules dans un tube à centrifuger conique 14 mL avec bouchon.
- Ajouter 50 µL d’anticorps d’enrichissement de monocyte cocktail par mL de suspension cellulaire, vortex et incuber 10 min à 4 ° C.
- Ajouter 50 µL de perles enrichissement monocyte de cellules par mL.
Remarque : Les billes doivent être soigneusement mixés afin d’assurer l’homogénéité de la suspension. - Après l’ajout des perles, peu vortex la suspension cellulaire et incuber 5 min à 4 ° C.
- Rincer la partie supérieure du tube avec le tampon de séparation jusqu'à ce que le tube est rempli jusqu'à 10 mL.
- Mélangez lentement la solution de pipetage de haut en bas.
- Placer le tube sans bouchon dans un aimant de séparation.
- Incuber pendant 2,5 min à température ambiante.
- Verser lentement dans un tube à centrifuger conique 15 mL.
- À ce stade, utilisez monocytes directement (voir étape 3 : traitements PBMC et les monocytes et les conditions stimulantes) ou différencier dans jemichielsmariepaule Monocyte-dérivé Dendritic Cells (iMoDCs) (voir étape 4), ou Congelez-les vers le bas pour une utilisation ultérieure (voir étape 5).
3. PBMC et Monocytes traitements et Conditions stimulantes
- Compter les cellules et diluez-les dans le milieu de culture (milieu de Roswell Park Memorial Institute (RPMI) 10 % BF + 1 mM de Pyruvate de Sodium, 100 U/mL de pénicilline streptomycine (Pen/Strep) + 5 µM β-mercaptoéthanol), jusqu'à 1,25 x 104 cellules/puits.
- Distribuer 30 µL de la suspension de cellules / puits d’une plaque 384 puits.
- Ajouter 15 µL de 4 x solutions concentrées de composés et les incuber pendant 1 heure à 37 ° C, 5 % de CO2.
- Ajouter le lipopolysaccharide (LPS) à une concentration finale de 10 ng/mL, appauvri zymosan (DZ) à une concentration finale de 100 µg/mL ou maintenir en milieu ordinaire.
- Incuber une nuit à 37 ° C, 5 % de CO2.
- Prendre 10 µL du liquide surnageant pour mesurer les concentrations de TNF-a sécrété (voir étape 7 : mesures de Cytokines et de viabilité).
4. monocytes différenciation en iMoDCs et Conditions stimulant
- Compter les monocytes (enrichis à l’étape 2) et centrifuger la suspension cellulaire à 520 x g pendant 5 min.
- Pipeter hors le surnageant et ajouter le milieu de culture (RPMI + 10 % FBS pour obtenir une suspension cellulaire finale de 0,4 x 106 cellules/mL.
- Ajouter 80 ng/mL recombinante humaine IL-4 + 100 ng/mL GM-CSF.
- Diluer 5 mL de suspension de cellules par puits dans une plaque 6 puits.
- Incuber pendant 7 jours à 37 ° C, 5 % de CO2.
- Au jour 7, récolter les cellules par pipetage doucement afin d’éviter leur mise en route.
- Centrifuger à 520 x g pendant 5 min.
- L’aspirateur aspirer et remettre en suspension dans 50 mL de milieu de culture sans facteurs de croissance.
- Centrifuger à 520 x g pendant 5 minutes et remettre en suspension à 1 x 106 cellules/mL dans le milieu de culture.
- Déposer 100 µL de la suspension (105 cellules) de cellules / puits d’une plaque de fond plat de 96 puits.
- Avant incubate pendant 1 h à 37 ° C après l’ajout de 50 µL de 4 x concentré composées solutions, préparées comme décrit à l’étape 8 : préparation des composés.
- Ajouter 50 µL de stimuli (4 x concentré), préparé comme décrit à l’étape 9.
- Incuber 24 h à 37 ° C.
- Mélanger chaque puits et le transfert de cellules et le surnageant (SN) dans une plaque de fond en V 96 puits.
- Tournez en bas à 475 x g pendant 5 min.
- Transvaser le surnageant dans une nouvelle plaque de fond plat de 96 puits, sceller et congeler à-20 ° C jusqu'à l’utilisation ultérieure.
5. les monocytes et les procédures de gel/dégel PBMC
-
Point de congélation
- Tournez en bas PBMC ou monocyte préparations de cellules à 520 x g pendant 5 min.
- Aspirateur aspirer le surnageant et remettre en suspension des cellules dans un milieu à 1 x 107 cellules/mL de gel.
- Diluer 1 mL de suspension cellulaire dans des cryotubes, les tubes de transfert à un dispositif de refroidissement spécifique (voir tableau des matériaux) et placez-le à-80 ° C.
-
Dégel
- Décongeler le cryotube et transférer rapidement son contenu dans un tube à centrifuger conique 15 mL contenant 9 mL de milieu de culture.
- Centrifuger à 520 x g pendant 5 min.
- L’aspirateur aspirer surnageant et resuspendre le culot dans 5 mL de milieu de culture. Les cellules sont maintenant prêts pour traitement expérimental.
6. cellules de rate de souris préparation et traitement
Remarque : Nous avons effectué des sacrifices d’animaux selon les lignes directrices et les normes de l’organisation de bien-être Animal Novartis. Des études ont été approuvées par le Comité d’éthique de l’autorité gouvernementale régionale (Kantonales Veterinäramt der Stadt Basel). Nous avons sacrifié animaux par surexposition isoflurane, avec tous les efforts faits pour réduire au minimum les souffrances.
- Récolter de la rate et se dissocient les tissus à l’aide d’un tube munis d’un broyeur mécanique tissulaire et contenant 5 mL de froid milieu RPMI.
- Utilisez le programme rate de la machine de dissociation pour moudre des organes.
- Filtrer les cellules à travers un tamis cellulaire de 100 mm en nylon.
- Transférer la suspension dans les tubes de 50 mL et centrifuger à 4 ° C pendant 10 min à 320 x g.
- Aspirateur aspirer le surnageant, resuspendre le culot dans 3 mL de tampon de lyse glacee et laisser incuber à ≤ 2 min sur la glace.
- Arrêtez la lyse en ajoutant 7 mL de milieu RPMI.
- Filtrer à nouveau à travers un tamis de cellule 100 µm en nylon.
- Tournez en bas la suspension cellulaire à 330 x g pendant 10 min à 4 ° C.
- L’aspirateur aspirer surnageant et remettre en suspension les cellules à 11 x 106 cellules/mL dans le milieu complet (RPMI additionné de 10 % FBS, 100 U/mL stylo/Step et 5 µM β-mercaptoéthanol).
- Plaque de 1 x 106 cellules/puits (90 µL) dans une plaque à 96 puits (fond plat).
- Ajouter 5 µL de 20 x concentré composé en solution dilué auparavant dans un milieu RPMI comme indiqué au point 8.3 : dilution en série de cellules spléniques de souris.
- Incuber 30 min à 37 ° C, 5 % de CO2.
- Ajouter 5 µL de 20 x concentrés DZ (concentration finale 30 µg/mL) ou 20 x concentrés LPS + IFN-g (TLR-4) (concentration finale 1 µM LPS et 10 ng/mL IFN-g).
- Incuber une nuit à 37 ° C, 5 % de CO2.
- Centrifuger à 330 x g pendant 10 min.
- Transfert de surnageants en nouvelles plaques, sceller et congeler à-20 ° C jusqu'à l’utilisation ultérieure.
7. les Cytokines et les mesures de viabilité
-
Mesure de TNF-a humaine par HTRF (homogène temps Fluorescence résolue)
Remarque : Le protocole suivi les recommandations du fournisseur, brièvement résumées ci-dessous.- Mélanger 1 volume de réactif reconstitué (anti-TNF-a-cryptate et anti-TNF-a-XL665) avec 19 volumes de tampon de reconstitution (50 mM tampon phosphate pH 7.0, 0,8 M fluorure de potassium (KF), 0,2 % d’albumine sérique bovine (BSA)).
- Mélanger les deux solutions de prêt-à-utiliser anticorps 1:1 juste avant la distribution des réactifs.
- Administrer 10 µL de surnageants de l’étape 3.6 dans les plaques 384 puits blanches.
- Distribuer 10 µL du mélange anticorps.
- Couvrir la plaque avec un scellant et incuber une nuit à 4 ° C.
- Lire la plaque sur un lecteur de microplaques (50 – 200 flash).
- Humaine IL-23 mesure de HTRF (homogène temps Fluorescence résolue)
Remarque : Le protocole suivi les recommandations du fournisseur, brièvement résumées ci-dessous.- Mélanger 1 volume de réactif reconstitué (anti-IL-23-cryptate-anticorps et anti-IL-23 D2-anticorps) avec 19 volumes de tampon de détection #3.
- Mélanger les deux solutions de prêt-à-utiliser anticorps 1:1 juste avant la distribution des réactifs.
- Administrer 10 µL de surnageants de l’étape 3.6 dans les plaques 384 puits blanches.
- Distribuer 10 µL du mélange anticorps.
- Couvrir la plaque avec un scellant et incuber une nuit à 4 ° C.
- Lire la plaque sur un lecteur de microplaques (50 – 200 flash de nm).
-
Humaine IL-6, IL-8, IL-1β et mesures de TNF-α par électrochimiluminescence
Remarque : Tous les échantillons ont été dilués au 1/150 en diluant 2 (première dilution : 10 µL dans 150 µL, puis 20 µL dans 180 µL). Le protocole de suivi des recommandations du fournisseur :- Diluer les échantillons et la norme en diluant 2.
- Procéder à une dilution de la norme en diluant 2 à l’aide d’une dilution au 1/4 série pli.
- Laver les plaques trois fois avec le tampon de lavage.
- Administrer 50 µL d’échantillons ou de la norme / puits.
- Incuber pendant 2 h à température ambiante sous agitation.
- Laver la plaque quatre fois avec PBS + 0.05 % Polysorbate 20.
- Ajouter 25 µL d’anticorps de détection (60 µL de chaque anticorps pour 3 mL final) en diluant 3.
- Incuber pendant 2 h à température ambiante sous agitation.
- Laver la plaque quatre fois avec PBS + 0.05 % Polysorbate 20.
- Éviter les bulles, ajouter 150 µL / puits de tampon de lecture (tampon Tris contenant des groupements, dilué 2 x FD20) comme réactif pour la production de lumière dans les Immunoessais par électrochimiluminescence co.
- Lire la plaque (sans délai) sur un lecteur de plaques multiplex.
-
Souris de TNF-a mesure par ELISA suivant le protocole du fournisseur
- Diluer le liquide surnageant 1:1 dans le diluant de dosage (prêt à l’emploi de tampons contenant des protéines).
- Préparer des réactifs, des échantillons et des dilutions standards tel que décrit dans le kit. Ajouter 50 μL de dosage diluant dans chaque puits.
- Ajouter 50 μL de standard, contrôle ou échantillon / puits.
- Mélanger en tapotant doucement le cadre de la plaque pendant 1 min.
- Recouvrir avec la bande adhésive fournie et incuber pendant 2 h à température ambiante.
- Aspirez chaque puits et laver avec 400 μL/puits (Répétez cette étape cinq fois au total).
- Après le lavage final, supprimer n’importe quel tampon de lavage restant en aspirant.
- Inverser la plaque et tache contre essuie-tout propre.
- Ajouter 100 μL de conjugué de TNF-α de la souris dans chaque puits. Couvrir avec une nouvelle bandelette adhésive.
- Incuber pendant 2 h à température ambiante.
- Répétez l’aspiration/lavage comme à l’étape 7.4.4.
- Ajouter 100 μL de solution de substrat dans chaque puits et incuber pendant 30 minutes à température ambiante, Abrie de la lumière.
- Ajouter 100 μL de solution d’acide chlorhydrique dilué (solution d’arrêt) dans chaque puits. Tapoter légèrement la plaque pour assurer un mélange complet.
- Mesurer la densité optique à 450 nm (avec la longueur d’onde de correction fixé à 560 nm) à l’aide d’un lecteur de microplaques (à faire dans les 30 minutes).
- Diluer le liquide surnageant 1:1 dans le diluant de dosage (prêt à l’emploi de tampons contenant des protéines).
-
Viabilité cellulaire
- Après avoir retiré les surnageants de préparations PBMC ou monocytes, évaluer la viabilité des cellules à l’aide d’un prêt à utiliser la solution de résazurine (indicateur d’oxydo-réduction) ajoutée directement à la suspension de cellules à une concentration finale de 10 %.
- Incuber pendant 1 à 2 h à 37 ° C, 5 % de CO2.
- Lecture de fluorescence à 590 nm (Excitation 540 nm) à l’aide d’un lecteur de microplaques.
8. composé de préparation
-
Dilution en série pour iMoDCs
- Diluer la solution mère de MLT-827 (10 mM en diméthylsulfoxyde (DMSO) en moyenne pour atteindre 8 µM en une seule fois (4 x concentré).
- Effectuer une dilution en série six-étape 1:5, à l’aide de médium + 0,08 % DMSO. Utilisez le même support + solution DMSO 0,08 % pour l’état du véhicule (aucun composé).
-
Dose unique test pour iMoDCs
- Diluer les solutions mères MLT-827, AFN700 et Cpd11 en moyenne pour atteindre 4 µM en une seule fois (4 x concentré).
-
Dilution en série de cellules spléniques de souris
- Diluer une solution de MLT-827 10 µM (obtenue à partir d’une solution stock de 10 mM après une un dilution aller dans le milieu) à 0,01 µM, avec une concentration de fin de DMSO de 0,1 %.
- Pour les étapes de la dilution, prenez 2 µL de chaque dilution, ajouter 38 µL RPMI et ajouter 5 µL dans le puits.
Remarque : Tous les traitements sont effectués en trois exemplaires.
9. préparation de stimuli
-
Zymosan appauvri (DZ)
- Ajouter 2 mL d’eau stérile exempt d’endotoxine à 10 mg de DZ.
- Vortex pour homogénéiser la solution mère, vortex aussi avant chaque utilisation.
- Aliquotes aliquotes de solution et magasin à-20 ° C.
-
Tréhalose-6, 6-dibehenate (TDB)
- Ajouter 100 µL de DMSO à 1 mg TDB, chaleur à 60 ° C dans un bain-marie pendant 15 à 30 s.
- Vortex et ajouter immédiatement 900 µL de PBS stérile, vortex à nouveau.
- Chauffer pendant 10 à 15 min à 60 ° C et homogénéiser par avant l’utilisation du vortex à chaque utilisation.
- Conserver la solution à 4 ° C.
- Effectuer des dilutions successives et préparation de la dose unique comme pour le composé de MLT-827.
Remarque : Parce que le TDB doit être préparé dans le DMSO, une concentration finale de 1 % DMSO est présente lors de la stimulation des cellules.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Dans les cellules myéloïdes, MALT1 relaie les signaux d’activation en aval de plusieurs récepteurs de type lectine de type C, tels que Dectin-1, 2-Dectin et MINCLE6. Ces voies s’appuient sur les récepteurs contenant du motif (hem) ITAM (p. ex., Dectin-1) ou corécepteurs contenant du motif ITAM (p. ex., FcRγ, pour Dectin-2 et MINCLE) qui recrutent et activer la kinase SYK (Figure 1). Cela conduit à l’activation d’une protéine kinase C isoforme, nommément PKCδ, qui phosphoryle CARD9, déclenchant ainsi la formation d’un complexe australienne9/BCL10/MALT1 et le recrutement des TRAF6 en aval d’activation de NF-κB12. En revanche, la voie du TLR-4 recrues TRAF6 dans un MALT1 indépendant mais MYD88/IRAK-dépendant pour l’activation de NF-κB (Figure 1). Preuve de cette implication différentielle de MALT1 a été obtenue à l’aide de modèles génétiques de carence MALT1 ainsi que le traitement pharmacologique avec l’inhibiteur de site actif peptidique z-VRPR-fmk11,13,14.
Nous avons utilisé l’inhibiteur MALT1 récemment déclaré puissant et sélectif de MLT-82715 et a demandé si ce composé réglementerait TNF-production en aval des récepteurs Toll-like et de type lectine de type C, respectivement. PBMC humaines et cellules spléniques de souris ont été stimulées avec zymosan appauvri (DZ, un agoniste connu du Dectin-1) ou le lipopolysaccharide (LPS, un agoniste connu de TLR-4) et nous avons mesuré TNF-sortie dans le surnageant de culture après 20 h. Dans l’homme et les essais sur les souris, MLT-827 bloqué sélectivement TNF-production mues par la voie du Dectin-1, mais pas par la voie du TLR-4 (Figure 2). Nous avons obtenu des données similaires lors de l’incubation avec le z-VRPR-fmk composé (supplémentaire Figure 1).
Pour éclairer la voie, nous avons mené d’autres expériences dans les monocytes humains et de cellules dendritiques dérivées de monocytes immatures (iMoDCs), en comparant l’effet de la MLT-827 à celle de l' inhibiteur de la Cpd11 SYK16 , ainsi qu’à celui de l’inhibiteur IKK AFN70015 . Dans les monocytes stimulées par LPS, production de TNF-α a été presque complètement abrogée par AFN700 mais n’est pas sensible à la Cpd11 (Figure 3 a), qui est conforme à la dépendance/indépendance du TLR-4 parcours sur l’activité de NF-κB/SYK, respectivement () voir Figure 1). En revanche, la production de TNF-α pilotée par Dectin-1 dans iMoDCs affiché sensibilité à Cpd11 en plus de la sensibilité à la MLT-827 et AFN700 (Figure 3 b, complémentaire de la Figure 2), fournissant une preuve supplémentaire pour la participation d’une signalisation de SYK/CBM cascade dans la voie de Dectin-1 (Figure 1). Remarquable, la production de IL-1, IL-6 et IL-23 lors de la stimulation Dectin-1 était également sensible aux inhibiteurs de la trois, indiquant ainsi les mécanismes de réglementation semblables à TNF-. Cependant, un effet limité des trois composés sur la production d’IL-8 a proposé un mécanisme de régulation distinct pour cette cytokine (Figure 3 b, supplémentaire , Figure 2).
En plus des autres CLLRs, tels que Dectin-2 et MINCLE, la fonction via la stimulation d’un CARD9 signalosome7Dectin-1. Nous avons donc testé MLT-827 iMoDCs contesté avec l’agoniste MINCLE tréhalose-6, 6-dibehenate (TBD). Élever des concentrations supérieures à 50 µg/mL TBD a conduit à la production de TNF-, IL-6 et IL-1, qui s’appuyait sur l’activité MALT1 paracaspase vu de l’effet de blocage de MLT-827 (Figure 4 a). Des résultats constants ont été obtenus lorsque contestant iMoDCs avec des concentrations croissantes de DZ pour stimuler Dectin-1 (Figure 4 b).
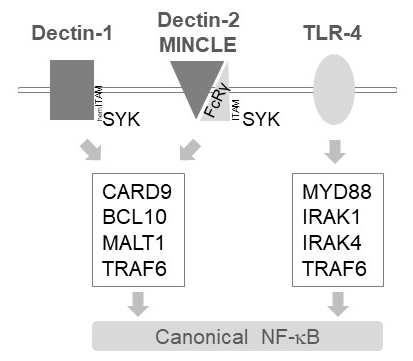
Figure 1 : NF-κB signalisation en aval du Dectin-1, MINCLE et TLR-4. La caricature illustre les principales caractéristiques de canonique NF-κB voies d’activation en aval de Dectin-1, 2-Dectin, MINCLE ou TLR-4 dans les cellules myéloïdes. Le contenant du hemITAM Dectin-1 récepteur17 peut engager directement SYK pour stimuler la formation de complexes CBM (australienne9/BCL10/MALT1), conduisant à l’activation de NF-κB dépendante de TRAF6. Autres récepteurs de type lectine de type C comme Dectin-2 ou MINCLE besoin de recruter une chaîne contenant ITAM FcRγ pour engager un CBM et activer NF-κB. Les récepteurs TLR-4 utilisent un autre mécanisme pour l’activation de NF-κB, en s’appuyant sur les kinases MYD88 et IRAK1/IRAK4 en amont de TRAF6.

Figure 2 : Dectin-1 signaux via MALT1 pour la production de TNF-α chez les humains et les cellules de souris. (A) données de PBMC humaines comme Unterreiner et al., 2017 (Figure 2 a)11. PBMC humaines ont été stimulées avec 1 ng/mL de LPS (agoniste de TLR-4) ou 100 µg/mL DZ (agoniste Dectin-1) à 20 h en présence de concentrations graduelles de MLT-827. TNF-a publié dans le surnageant a été quantifié par HTRF. (B) souris, cellules de la rate ont été traités avec une concentration gamme de MLT-827 pendant 30 min, puis stimulées avec 30 µg/mL DZ ou LPS 1 µg/mL + 10 ng/mL IFN - 18 h. TNF-α dans le surnageant de culture cellulaire a été mesurée par ELISA. Un des deux expériences avec des résultats similaires est indiqué, que signifie ± SEM des trois mesures.

Figure 3 : IKK - et/ou SYK-dépendance de la production de cytokines en aval de TLR-4 et Dectin-1. (A) des monocytes humains ont été traités au préalable pendant 1 h avec MLT-827 (1 µM), Cpd11 (1 µM), ou AFN700 (3 µM) ou d’un véhicule (DMSO). Les cellules sont stimulées avec 10 ng/mL LPS pendant 20 h et TNF-dans le surnageant a été quantifié par HTRF. (B) TNF-α, IL-1β, IL-6, IL-23 et IL-8 production de dérivés de monocytes les cellules dendritiques humaines (iMoDCs) stimulées pendant 24 h avec DZ (100 µg/mL) après incubation avant 1 h avec MLT-827, Cpd11, AFN700 (tous à 1 µM) ou le DMSO. Des niveaux de cytokine dans les échantillons traités DMSO ont été fixés à 100 %. Données sont moyen ± SD de trois mesures et sont représentatifs de trois expériences indépendantes. * P < 0,05 ; ** P < 0,01 ; P < 0,001, non appariés test t de Student bilatéral.

Figure 4 : production de cytokine lectine-like-dépendant de type C par iMoDCs. TNF-α, IL-1β et IL-6 production par iMoDCs stimulent pendant 24 h avec l’agoniste MINCLE tréhalose-6, 6-dibehenate (TDB, 100 µg/mL) (A) ou avec l’agoniste Dectin-1 DZ (100 µg/mL) (B) après incubation avant 1 h avec MLT-827 (1 µM) ou le DMSO. Les données sont moyen ± SD de trois mesures et sont représentatifs de trois expériences indépendantes.
Fichier supplémentaires 1. S’il vous plaît cliquez ici pour télécharger ce fichier.
Fichier supplémentaire 2. S’il vous plaît cliquez ici pour télécharger ce fichier.
Fichier supplémentaires 3. S’il vous plaît cliquez ici pour télécharger ce fichier.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dans ce travail, nous avons utilisé les paramètres expérimentaux simples pour étudier les voies de signalisation chez les humains et les cellules de souris innée et interroger leur dépendance sur la MALT1 fonction protéolytique. Élargissant le précédent travail11, notre étude a montré que la MALT1 paracaspase activité contrôle type C type lectine récepteurs induit la production de cytokines, dont le TNF-α. En revanche, les TLR 4-induite par le TNF-α est indépendante de la MALT1 chez les deux espèces. Collectivement, ces données corroborent la contribution clée et sélective de la MALT1/CBM signalosome en aval des récepteurs de type lectine de type C, qui a été dévoilé par les précédentes études6,12,18.
Si l’indépendance claire de TLR-4 signalisation sur MALT1 dans les cellules myéloïdes s’applique aux autres types de cellule reste à explorer. Par exemple, dans les lymphocytes B, signalisation TLR a été précédemment montrée à contribuer à l’activation des lymphocytes B en aval de la cellule B antigène récepteur19. En fait, nous avons inédites preuve que TLR-4 stimulé humain et les cellules de souris B affichent sensibilité à MLT-827. Par conséquent, plus mécanistes aperçus en aval du récepteur des cellules B seront utiles. Dans ce contexte, une étude récente au lymphome à cellules B fourni la preuve pour le clustering des voies de signalisation en aval du récepteur des cellules B et les TLR9 récepteur20. TRAF6, qui agit comme un médiateur pour l’activation de NF-κB dans le récepteur des cellules B et les voies TLR, pourrait être un point de la diaphonie, ce qui pourrait expliquer la sensibilité de ces deux voies à l’inhibition de protéase MALT1. À l’inverse, TRAF6 est également un joueur commun en aval de CLLRs et TLR pour l’induction de NF-κB, mais ces deux voies ne semblent pas de diaphonie d’une manière paracaspase-dépendante de MALT1 dans les cellules myéloïdes.
Ce travail a porté sur la production de cytokines, qui fournit une lecture facile pour voies de signalisation et peut être exécutée facilement pour le profilage de composés. Il a souligné la valeur des inhibiteurs sélectifs et puissants de MALT1 pour démêler MALT1 biologie. Obtenir un complément de perspicacités mécanistes nécessitera des travaux supplémentaires et le développement de dosages plus proximales, par exemple, pour caractériser les substrats de MALT1 impliqués dans innée règlement de signalisation.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Nous remercions Elsevier pour leur autorisation (numéro de licence 4334770630127) reproduire ici la Figure 2 a de Unterreiner et al. (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



