Summary
MALT1 타고 난 면역을 조절 하지만 병이 정의 남아 어떻게이 발생 합니다. 우리는 타고 난 신호 통행세 같이 또는 C 형 lectin 같이 수용 체의, MALT1 골수성 cytokines의 생산 조절 시연 다운스트림 다운스트림 MALT1의 기여를 푸는 선택적 MALT1 paracaspase 억제제 MLT-827 사용 C-타입 lectin 같이 수용 체의 선택적으로.
Abstract
수많은 연구에 의해 해결 되었습니다, 림프 세포, 그것의 기능 외 paracaspase MALT1 또한 패턴 인식 수용 체의 타고 난 셀 하류에 중요 한 역할을 재생 합니다. 최고의 공부는 Dectin-1 및 Dectin-2 일원 이다 C 형 lectin 같이 수용 체 가족의 SYK-및 CARD9-종속 MALT1 종속 방식에서 NF-κB 활성화를 선도 하는 캐스케이드 신호를 유도 하는. 대비, 통행세 같이 수용 체 (TLR), TLR-4, 같은 의해 NF-κB 활성화 하지만 신호는 MYD88/IRAK 종속 캐스케이드를 통해 전파 합니다. 그럼에도 불구 하 고, MALT1 TLR 4 신호에 기여할 수 있습니다 여부 불분명 남아 있다. MLT-827, MALT1 paracaspase 활동의 강력 하 고 선택적 억제제와 최근 증거가 나타냅니다 TNF-생산 하류 TLR-4 인간의 골수성 세포에서의 Dectin-1, TNF-생산 하류 반대로 MALT1의 독립적인 MALT1은 종속. 여기, 우리는 더 이상 감지, 및 마우스 세포 준비, Dectin 1, MINCLE 또는 TLR 4 통로의 자극의 다양 한 사용 패턴 인식에 MALT1의 선택적 참여 해결. 우리는 또한 넘어 TNF-, cytokines를 탐험 하 고 SYK 억제제 (Cpd11)와 IKK 억제제 (AFN700) MLT-827를 비교 하 여 추가적인 통찰력을 제공 했습니다. C-타입 lectin 같이 수용 체의 MALT1 종속성에 대 한 제공 하는 데이터 추가, 증거를-반대로 TLR 신호를 신호.
Introduction
MALT1의 paracaspase 활동 (점 막 관련 림프 조직 림프 종 전 좌 단백질 1) 20081,2에서 밝혀졌다. 그 이후, 연구의 여러 세포에 항 원 수용 체 응답의 중요 한 기여를 보고 있다. 유전자 모델 마우스 뿐만 아니라 T 세포, T 세포 의존 면역 및 B-세포 림프 종 설정3,4약리학 데이터는 중요 한 역할을 지원. MALT1 paracaspase 활성화는 CARD11-BCL10-MALT1 복잡 한5, 항 원 수용 체 근 위 신호에 의해 트리거되는 조립 시 발생 하는 림프 톨에 T 또는 B 세포 수용 체의 다운스트림. 또한 유사한 CARD9-BCL10-MALT1 복잡 한 예를 들어 C 형 lectin 같이 수용 체 (CLLR)의 하류 신호를 전파에 대 한 중요 하다는 충분 한 증거가 있다, Dectin-1, Dectin 2, MINCLE에 골수성 세포6,7. Dectin-1이이 통로 곰 팡이 감염8,9에 대 한 호스트 방어에 매우 중요 하기 때문에 특히 잘 공부 되었습니다 했다. 그러나, 수용 체 통행세 같이 (TLR) 경로에서 MALT1의 의미는 논란이10남아 있다. 인간의 골수성 세포에서 최근 증거 MALT1 paracaspase 활동 TNF-생산의 하류 TLR 411의 규정에 대 한 직접적인 역할을 배제.
현재 작업에서 다양 한 실험 설정 물질로 인간의 및 마우스 골수성 세포 타고 난 신호 경로, 특정 약리 도구 억제제 및 cytokine 생산의 측정 프로브를 사용 우리.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
실험 지침 및 노바 티 스 인간의 연구 윤리 위원회의 기준에 따라 실시 했다.
1. 인간의 버 피 코트에서 말 초 혈액 단 세포 (PBMCs)의 준비
참고: 우리 컬렉션, 50 mL 가방에서 후에 1 일 건강 한 지원자에서 버 피 코트를 받았다. 그들은 동의에서 제공 하 고 Interregionale Blutspende Schweizeriches Rotes Kreuz통해 수집 했다. 우리는 다르게 지정 하지 않는 한에 실 온에서 아래 절차를 사용 하 여 처리 합니다.
- 가 위 (아래 lamina 흐름) 비닐 봉지 1 리터 비 커의 살 균 하 고 깨끗 한 쌍을 준비 합니다.
- 비 커에 버 피 코트를 전송 하 고 신중 하 게는 위.
- 25 mL 피 펫을 사용 하 여 추가 100 mL의 인산 염 버퍼 염 분 버퍼/ethylenediaminetetraacetic 산 (PBS/EDTA: PBS 1 x pH 7.4 아니 CaCl2 및 없음 MgCl2, 보충 2 mM EDTA pH 8.0).
참고: 동일을 사용 하 여 플라스틱 그리고 pipetting 솔루션을 위아래로 천천히, 후 미리 가득 다 당 류 기반 밀도 기울기의 15 mL 50 mL의 6 원뿔 원심 분리기 튜브 25 mL 희석된 버 피 코트의 분배. - 적당 한 가속 (4 개의 9 설정) 800 x g 20 분 원심 브레이크를 그들의 밀도에 따라 세포의 분리에 대 한 허용 없이.
참고: 원심, 후 3 개의 레이어를 볼; 수 있습니다. 적혈구 및 granulocytes, 플라즈마, 그리고 주변 혈액 단 세포 (PBMCs)를 포함 하는 백색 반지 사이 하는 상위 계층을 포함 하는 펠 릿. - PBMC 링 10 mL 피 펫 및 새로운 50 mL 튜브에 사용 하 여 수확.
참고: 2 ~ 3 50 mL 튜브는 일반적으로 버 피 코트 당 필요 합니다. 이 단계에서 일부 플라즈마 가능성이 오염 후속 농축 단계에 영향을 주지 않습니다 있어야 수집된 PBMCs. - 최대 50 mL PBS/EDTA를 사용 하 여 모든 튜브 탑 하 고 감소 하는 원심 분리 시간 및 속도 (520 g, 330 x g에서 10 분, 150 x g8 분 x 15 분)와 함께 3 연속 세척을 진행 합니다.
참고: 각 단계에서 액체 폐기물 컨테이너에는 상쾌한 떨어져 부 어 있으며 셀 펠 렛 50 ml PBS/EDTA의 resuspended (펠 릿 첫 세척 후 풀링된 수 있습니다). - 최종 세척 후 얼음 세포의 용 해 버퍼의 25 mL에 있는 펠 릿 resuspend ( 테이블의 자료참조)를 삼투성 압력에 의해 붉은 혈액 세포를 lyse.
- 솔루션 취소 될 때까지 품 어 (실 온에서 ≤ 5 분).
- 분리 버퍼 (PBS 1 pH 7.4 아니 CaCl2 없음 MgCl2, 2% 열 비활성화 태아 둔감 한 혈 청 (FBS)와 보충을 포함 하 고 1 mM EDTA pH 8.0 x) 25 mL를 추가 하 여 반응을 중지 합니다.
- 150 x g 8 분에 한 번 더 씻는 다.
참고: 이 단계에서 PBMCs 대량 인구로 사용할 수 있습니다 (3 단계 참조: PBMCs 및 monocytes 물질로 조건 및) monocyte 농축 처리 또는 (단계 2 참조: PBMCs에서 monocytes의 준비), 또는 사용에 대 한 아래로 냉동 (단계 5 참조: Monocytes 그리고 PBMCs 냉동/해 동 절차).
2입니다. PBMCs에서 Monocytes의 준비
- 1.10 분리 버퍼에 단계에서 얻은 PBMCs resuspend 및 5 x 107셀/mL를 도달 하는 그들.
- 모자와 14 mL 원뿔 원심 분리기 튜브에 세포 현 탁 액을 전송 합니다.
- 추가 50 µ L monocyte 농축 항 체 세포 현 탁 액의 mL 당 칵테일의 소용돌이, 4 ° c.에서 10 분을 품 어 고
- 셀의 mL 당 monocyte 농축 구슬의 50 µ L를 추가 합니다.
참고: 구슬 vortexed는 서 스 펜 션의 균질 성을 보장 하 철저 하 게 수 있어야 합니다. - 후 구슬, 곧 소용돌이 세포 현 탁 액을 추가 하 고 4 ° c.에서 5 분을 품 어
- 튜브는 최대 10 mL 때까지 분리 버퍼 튜브의 위쪽 부분을 씻어.
- 천천히 아래로 pipetting으로 솔루션을 혼합.
- 분리 자석에 모자 없이 튜브를 놓습니다.
- 실 온에서 2.5 분 동안 품 어.
- 15 mL 원뿔 원심 분리기 튜브에 천천히 붓는 다.
- 이 단계에서 직접 사용 monocytes (3 단계 참조: PBMCs 및 monocytes 치료 및 물질로 조건) 또는 나mmature 모nocyte 파생 Dendritic Cells (iMoDCs)으로 구분 (4 단계 참조), 또는 이후 사용에 대 한 그들을 내려 고정 (단계 5 참조).
3. PBMCs 및 Monocytes 치료 물질로 조건
- 셀의 개수와 문화 매체에서 그들을 희석 (로스웰 파크 기념 연구소 매체 (RPMI) 10 %FBS + 1mm 나트륨 Pyruvate + 100 U/mL 페니실린 스 (펜/Strep) 5 µ M β-mercaptoethanol), 104 셀/잘 x 1.25까지.
- 384-잘 접시의 당 세포 현 탁 액의 30 µ L를 배포 합니다.
- 4 집중된 복합 솔루션 x 15 µ L을 추가 하 고 37 ° C, 5% CO2에서 1 시간에 대 한 사전 품 어.
- 10 ng/mL의 최종 농도에 lipopolysaccharide (LPS)를 추가 또는 zymosan (DZ) 100 µ g/mL의 최종 농도에 소진 하거나 일반 매체에 계속.
- 37 ° C, 5% CO2에서 밤새 품 어.
- 분 비 되는 TNF 수준을 측정 하는 상쾌한의 10 µ L를가지고 (단계 7를 참조 하십시오: Cytokines 및 생존 능력 측정).
4. iMoDCs와 물질로 조건 monocytes 분화
- Monocytes (단계 2에서 농축)을 계산 하 고 5 분 동안 520 x g 에 세포 현 탁 액을 원심.
- 상쾌한에서 플라스틱 및 문화 매체 추가 (RPMI + 10 %FBS 106 셀/mL x 0.4의 최종 세포 현 탁 액.
- 80 ng/mL 재조합 인간 IL-4 + 100 ng/mL GM-CSF를 추가 합니다.
- 6 잘 플레이트에 잘 당 세포 현 탁 액의 5 mL을 분배.
- 37 ° C, 5% CO2에서 7 일 동안 품 어.
- 7 일에 그들의 정품 인증 피하기 위해 부드럽게 pipetting으로 세포를 수확.
- 5 분 동안 520 x g 에서 원심 분리기.
- Aspirate 진공 및 성장 인자 없이 문화 매체의 50 mL에 resuspend.
- 520 x g 5 분에 centrifuge 고 1 x 106 셀/mL 문화 매체에서에서 resuspend.
- 세포 현 탁 액 (105 셀)의 100 µ L 당 96 잘 플랫 바닥판의 분배.
- 1 h 50 추가한 후 37 ° C에 대 한 사전 incubate µ L 4 x의 집중 복합 솔루션, 8 단계에서 설명한 대로 준비: 준비 화합물.
- 9 단계에서 설명한 대로 준비 자극 (4 x 집중), 50 µ L를 추가 합니다.
- 37 ° c.에 24 시간을 품 어
- 96-잘 V-아래 접시에 각 잘 및 전송 셀과 상쾌한 (SN)를 혼합.
- 475 x g 5 분에서 아래로 회전 합니다.
- 새로운 96-잘 플랫 바닥 접시에 상쾌한을 전송, 인감 및 사용까지-20 ° C에서 동결.
5. monocytes 그리고 PBMCs 냉동/해 동 절차
-
동결
- 5 분 동안 520 x g 에서 PBMC 또는 monocyte 셀 준비 아래로 회전 합니다.
- 진공은 상쾌한 발음 하 고 resuspend 1 x 107 셀/mL에서 중간에 셀.
- Cryotubes에 세포 현 탁 액 1 mL를 분배, 특정 냉각 장치에는 튜브를 전송 (참조 자료 테이블)-80 ° c.에 그것을 배치 하 고
-
녹고
- cryotube을 해 동 하 고 신속 하 게 문화 매체의 9 mL를 포함 하는 15 mL 원뿔 원심 분리기 관으로 콘텐츠를 전송.
- 5 분 동안 520 x g 에서 원심 분리기.
- Aspirate 상쾌한 진공 및 문화 매체의 5 mL에 셀 펠 릿 resuspend. 셀 더 실험적인 처리에 대 한 준비가 지금입니다.
6. 마우스 비장 세포 준비 및 치료
참고: 우리는 지침과 노바 티 스 동물 복지 조직의 표준에 따라 동물 희생을 실시. 연구는 지역 정부 기관의 윤리 위원회에 의해 승인 되었다 (Kantonales Veterinäramt 더 타트 바젤). 우리는 고통을 최소화 하기 위해 만든 모든 노력 isoflurane 노출, 여 동물을 희생.
- 비장을 수확 하 고 분열 조직 기계적 조직 분쇄기 장치를 장착 하 고 가득 찬 RPMI 매체의 5 mL 튜브를 사용 하 여.
- 분리 컴퓨터의 비장 프로그램을 사용 하 여 장기를 갈아.
- 100 m m 나일론 셀 스 트레이너를 통해 셀을 필터링 합니다.
- 현 탁 액 50 mL 튜브 및 320 x g에서 10 분 동안 4 ° C에서 원심 분리기로 전송.
- 진공 aspirate는 상쾌한 차가운 세포의 용 해 버퍼의 3 mL에 셀 펠 릿 resuspend 그리고 ≤2 분 얼음에 품 어.
- RPMI 매체의 7 mL을 추가 하 여 세포를 중지 합니다.
- 100 µ m 나일론 셀 스 트레이너를 통해 다시 필터링.
- 세포 현 탁 액 330 x g 4 ° c.에서 10 분 동안에 아래로 회전
- Aspirate 상쾌한 진공 및 11 x 106 셀/mL (RPMI 보충 10 %FBS, 100 U/mL 펜/단계, 5 µ M β-Mercaptoethanol) 완전 한 매체에서에서 세포를 resuspend.
- 플레이트 1 x 106 셀/잘 (90 µ L) 96 잘 접시 (플랫 바닥).
- 20 x 5 µ L 집중 단계 8.3에서에서 설명한 대로 이전 RPMI 매체에 희석 복합 솔루션 추가: murine 비장 세포에 대 한 직렬 희석.
- 37 ° C, 5% CO2에서 30 분 동안 품 어.
- 20 x 5 µ L 집중 DZ (최종 농도 30 µ g/mL) 또는 20 배 농축 LPS + IFN-g (TLR-4) (최종 농도 1 µ M LPS 및 10 ng/mL IFN-g)를 추가 합니다.
- 37 ° C, 5% CO2에서 밤새 품 어.
- 10 분 동안 330 x g 에서 원심 분리기.
- 새로운 접시에 supernatants 전송, 인감 및 추가 사용까지-20 ° C에서 동결.
7. Cytokines 및 생존 능력 측정
-
HTRF (균일 시간 해결 형광)에 의해 인간 TNF를 측정
참고: 프로토콜 다음 공급 업체의 권장 사항, 간단히 아래 요약.- 믹스 1 볼륨 재구성된 시 약 (항 TNF는 cryptate 및 안티 TNF-XL665)의 재구성 버퍼 (50 m m 인산 버퍼 pH 7.0, 0.8 M 칼륨 불 화물 (KF), 0.2% 소 혈 청 알 부 민 (BSA))의 19 볼륨.
- 두 항 체 준비-사용 솔루션은 시 약을 분배 하기 전에 1:1 혼합.
- 10 µ L 화이트 384-잘 접시에 3.6 단계에서 supernatants의 분배.
- 10 µ L 항 체 혼합의 분배.
- 커버 플레이트는 마감재와 고 하룻밤 4 ° C에서 품 어.
- 접시 microplate 리더 (50-200 플래시)에 읽기.
- HTRF (균일 시간 해결 형광)에 의해 인간의 IL 23 측정
참고: 프로토콜 다음 공급 업체의 권장 사항, 간단히 아래 요약.- 검색 버퍼 # 3의 19 볼륨 재구성된 시 약 (안티 IL-23-cryptate-항 체 및 안티-일-23 d 2 항)에의 한 볼륨 믹스.
- 두 항 체 준비-사용 솔루션은 시 약을 분배 하기 전에 1:1 혼합.
- 10 µ L 화이트 384-잘 접시에 3.6 단계에서 supernatants의 분배.
- 10 µ L 항 체 혼합의 분배.
- 커버 플레이트는 마감재와 고 하룻밤 4 ° C에서 품 어.
- 접시 microplate 리더 (50-200 nm 플래시)에 읽기.
-
인간의 일리노이-6, 일리노이-8, IL 1β 및 electrochemiluminescence에 의해 TNF-α 측정
참고: 모든 샘플 1/150 희석제 2에서에서 희석 했다 (첫번째 희석: 150 µ L에 10 µ L 다음 180 µ L에서 20 µ L). 프로토콜 다음 공급 업체의 권장 사항:- 샘플 및 희석제 2에서 표준 희석.
- 희석제 2 1/4 직렬 배 희석을 사용 하 여 표준의 희석을 진행 합니다.
- 세 번 세척 버퍼와 세척 접시입니다.
- 50 µ L 샘플 또는 잘 당 표준의 분배.
- 동요에서 실 온에서 2 h에 품 어.
- 4 시간 PBS + 0.05%와 접시를 씻고 음식을 20.
- 희석제 3에서 탐지 항 체 (최종 3 mL에 대 한 각 항 체의 60 µ L)의 25 µ L를 추가 합니다.
- 동요에서 실 온에서 2 h에 품 어.
- 4 시간 PBS + 0.05%와 접시를 씻고 음식을 20.
- 읽기 버퍼의 당 150 µ L 추가 거품을 피하고, (tripropylamine을 포함 하는 트리 기반 버퍼 ddH20에에서 2 배 희석) electrochemiluminescence immunoassays 가벼운 발생에 대 한 공동 반응으로.
- 멀티플렉스 플레이트 리더에 (지체) 없이 접시를 읽기.
-
마우스 공급 업체의 프로토콜을 따르고 ELISA에 의해 TNF를 측정
- 상쾌한 분석 결과 희석제 (단백질 포함 된 버퍼를 사용 하 여 준비)에 1:1 희석.
- 키트에 설명 된 대로 시 약, 예제 및 표준 희석을 준비 합니다. 각 잘 하 50 μ의 희석제 분석 결과 추가 합니다.
- 표준, 제어, 또는 잘 당 샘플의 50 μ를 추가 합니다.
- 부드럽게 1 분 동안 접시 프레임을 활용 하 여 혼합.
- 제공 된 접착제 스트립과 커버 하 고 실내 온도에서 2 h에 품 어.
- 각 잘 하 고 400 μ/잘 (반복이 총에서 5 번 단계) 세척 발음.
- 최종 세척 후 발음에 의해 모든 나머지 워시 버퍼를 제거 합니다.
- 접시를 반전 하 고 깨끗 한 종이 수건에 대 한 오 점.
- 각 잘 추가 마우스 TNF-α 켤레의 100 μ. 새로운 접착제 스트립 커버.
- 실 온에서 2 h에 품 어.
- 7.4.4 단계 에서처럼 포부/워시를 반복 합니다.
- 각 잘 하 기판 솔루션의 100 μ를 추가 하 고 빛 으로부터 보호 하는 실 온에서 30 분 동안 품 어.
- 각 우물에 염 산을 희석된 솔루션 (정지 솔루션)의 100 μ를 추가 합니다. 부드럽게 철저 하 게 혼합 되도록 접시를 누릅니다.
- 450에서 광학 밀도 측정 nm (560에서 설정 수정 파장으로 nm) (해야 할 30 분 이내) microplate 리더를 사용 하 여.
- 상쾌한 분석 결과 희석제 (단백질 포함 된 버퍼를 사용 하 여 준비)에 1:1 희석.
-
세포 생존 능력
- 제거한 후 supernatants PBMC 또는 monocyte 준비에서 resazurin 솔루션 (oxidation-reduction 포함) 10% 최종 농도에 세포 현 탁 액에 직접 추가 사용 하는 준비를 사용 하 여 세포 생존 능력을 평가 합니다.
- 1-2 h 37 ° C, 5% CO2에서 품 어.
- 590에서 형광을 읽고 nm (여기 540 nm) microplate 리더를 사용 하 여.
8. 복합 준비
-
IMoDCs에 대 한 직렬 희석
- 희석 MLT-827 재고 솔루션 (10 mM (4 x 집중)를에서 8 µ M를 도달 하는 중간에 디 메 틸 sulfoxide (DMSO)에.
- 6 단계 1:5 직렬 희석, 매체 + 0.08 %DMSO 사용 하 여 수행 합니다. 차량 (복합) 조건에 대 한 동일한 매체 + 0.08 %DMSO 솔루션을 사용 합니다.
-
단 하나의 복용량 iMoDCs에 대 한 테스트
- 한 가지 (4 x 집중) 4 µ M를 도달 하는 매체로 MLT-827, AFN700 및 Cpd11 재고 솔루션을 희석.
-
Murine 비장 세포에 대 한 직렬 희석
- 0.1%의 DMSO 최종 농도 0.01 µ m (중간에 한 가지 희석 다음 10 m m 재고 솔루션에서 얻은) 10 µ M MLT-827 솔루션을 희석.
- 희석 단계 각 희석의 2 µ L, 우물에 38 µ L RPMI, 피펫으로 5 µ L를 추가.
참고: 모든 치료는 3 중에서 수행 됩니다.
9. 자극 준비
-
고갈된 zymosan (DZ)
- Dz.의 10 mg을 멸 균도 무료 물 2 mL를 추가
- 균질 재고 솔루션, 소용돌이 사전 각 사용 하는 소용돌이.
- -20 ° c.에 aliquot 솔루션 및 저장소 aliquots
-
트 레 할 로스-6, 6-dibehenate (TDB)
- 1 mg TDB, 물 목욕 15-30 s의 60 ° C에서 열에 DMSO의 100 µ L를 추가 합니다.
- 와 동 즉시 살 균 PBS, 다시 소용돌이의 900 µ L을 추가 하 고.
- 60 ° C에서 10-15 분에 대 한 열 하 고 균질 vortexing 사전에 의해 사용 합니다.
- 4 ° c.에 솔루션을 계속
- 직렬 희석 MLT-827 화합물에 관해서는 단일 투여 준비를 수행 합니다.
참고: TDB DMSO에 준비 하기 때문에, 마지막 1 %DMSO 농도 세포 자극 중입니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
골수성 세포에서 MALT1 여러 C 형 lectin 같이 수용 체, Dectin 1, Dectin 2, MINCLE6등의 하류 활성화 신호를 릴레이합니다. (앙) ITAM는 수용 체를 포함 하는 주제에 의존 하는이 경로 (예:, Dectin-1) 또는 ITAM 주제 포함 된 공동 수용 체 (예:, FcRγ, Dectin 2, MINCLE)를 채용 하 고 SYK 키 (그림 1)을 활성화. 이 활성화 한 단백질 키 니 아 제 C isoform, 즉 PKCδ, phosphorylates CARD9, CARD9/BCL10/MALT1 복잡 한 형성 및 다운스트림 NF-κB 활성화12TRAF6의 채용 함으로써 실행을 이끌어 낸다. 대조적으로, TLR 4 통로 TRAF6 MYD88/IRAK 종속 방식으로 NF-κB 활성화 (그림 1)에 대 한 하지만 MALT1 독립에 보충 한다. MALT1의 차등이 참여에 대 한 증거는 peptidic 액티브 사이트 억제제 z-VRPR-fmk11,,1314MALT1 결핍 뿐만 아니라 약리 치료의 유전자 모델을 사용 하 여 얻은 했다.
우리는 최근 보고 된 강력 하 고 선택적인 MALT1 억제제 MLT-82715 를 사용 하 고 경우이 화합물 TNF-다운스트림의 생산 C 유형 lectin과 같은 그리고 통행세 같이 수용 체, 각각 규제 것 이라고 물었다. 인간 PBMCs 및 마우스 비장 세포 고갈된 zymosan (DZ, Dectin-1의 알려진된 주 작동 근)을 자극 했다 또는 lipopolysaccharide (LPS, TLR 4의 알려진된 주 작동 근)와 우리 문화 표면에 뜨는 20 h 후 TNF-릴리스 측정. 모두 인간와 마우스 분석 실험, MLT-827 선택적으로 TNF-생산 TLR 4 통로 (그림 2) 아니라 Dectin-1 통로 의해 구동을 차단. 우리는 z-VRPR-fmk 화합물 (보충 그림 1)과 부 화에 유사한 데이터를 얻었다.
통로 인 사이트를 얻으려면, 우리 실험 더 인간 monocytes 그리고 미 숙 monocytes 파생 된 모 수석 세포 (iMoDCs), SYK 억제제 Cpd1116 의 IKK 억제제 AFN700의 MLT-827의 효과 비교15 . Monocytes LPS로 자극된, TNF-α의 생산 하지만 AFN700에 의해 거의 완전 하 게 폐지 했다 Cpd11에 과민 했다 (그림 3A)는 NF-κB/SYK 활동, 각각 (TLR 4 통로의 종속성/독립와 일치 그림 1참조). 대조적으로, iMoDCs에 Dectin-1에 의해 구동 하는 TNF-α 생산 표시 감도 Cpd11 MLT-827 및 AFN700 감도 뿐만 아니라 (그림 3B, 보충 그림 2), 신호 SYK/CBM의 참여에 대 한 추가 증거를 제공 하 Dectin-1 통로 (그림 1)에서 계단식. 주목, 일리노이-1의 생산 일리노이-6, 일리노이-23 Dectin-1 자극에는 또한 3 억제제에 민감한 따라서 TNF-비슷한 규제 메커니즘을 나타내는. 그러나, IL-8 생산에 세 가지 화합물의 제한 된 효과이 cytokine (그림 3B, 보 그림 2)에 대 한 뚜렷한 규제 메커니즘을 제안 했다.
Dectin-1, Dectin 2, MINCLE, CARD9 signalosome7의 자극을 통해 기능 등 다른 CLLRs 외. 우리는 따라서 iMoDCs MINCLE 주 작동 근 트 레 할 로스-6, 6-dibehenate (미정)와 도전 MLT-827를 테스트. TNF-의 생산을 주도 50 µ g/mL 이상의 미정 농도 높이 일리노이-6와 일리노이-1, MLT-827 (그림 4A)의 차단 효과에서 보듯이 MALT1 paracaspase 활동에 의존. 일관 된 결과 때 가져온 iMoDCs Dectin-1 (그림 4B)를 자극 하는 DZ의 농도 증가 함께 도전.
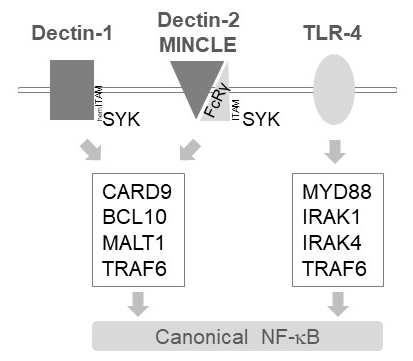
그림 1: NF-κB 신호 Dectin 1, MINCLE, TLR 4의 다운스트림. 만화는 Dectin 1, Dectin 2, MINCLE 또는 골수성 세포에서 TLR 4의 정식 NF-κB 활성화 경로 다운스트림의 주요 기능을 보여 줍니다. Dectin-1 hemITAM-포함 된 수용 체17 직접 SYK TRAF6 종속 NF-κB 활성화로 이어지는 CBM (CARD9/BCL10/MALT1) 복잡 한 대형 자극을 참여하실 수 있습니다. Dectin-2 또는 MINCLE 같은 다른 C 형 Lectin 같이 수용 체는 CBM 고 NF-κB 활성화 ITAM 포함 된 FcRγ 체인 모집 해야 합니다. TLR 4 수용 체 의존 하는 MYD88 및 IRAK1/IRAK4 kinases 상류 TRAF6의 NF-κB 활성화를 위해 다른 메커니즘을 사용 합니다.

그림 2: Dectin-1 인간에서 TNF-α와 마우스 세포의 생산에 대 한 통해 MALT1 신호. (A) Unterreiner에서 인간 PBMCs 데이터 그 외 여러분, 2017 (그림 2A)11. 인간의 PBMCs LPS (TLR 4 주 작동 근)의 1 ng/mL와 µ g/100ml DZ (Dectin-1 주 작동 근) 20 h 등급된 농도 MLT-827의 존재에 대 한 자극 했다. TNF-는 상쾌한에 출시 된 HTRF에 의해 정량 했다. DZ 또는 1 µ g/mL LPS (B) 마우스 비장 세포 치료와 함께 한 농도 범위의 MLT-827 30 분 및 그 후 30 µ g/mL로 자극 + 10 ng/mL IFN-18 헤 TNF-α 세포 배양 표면에 뜨는 ELISA에 의해 측정 되었다. 3 측정의 ± SEM을 수단으로 비슷한 결과 두 실험 중 하나 표시 됩니다.

그림 3: IKK-또는 SYK-종속성 cytokine 생산의 하류 TLR 4 및 Dectin-1. (A) 인간 monocytes MLT-827로 1 시간에 대 한 사전 처리 했다 (1 µ M), Cpd11 (1 µ M), 또는 AFN700 (3 µ M) 또는 차량 (DMSO). 셀 20 h 10 ng/mL LPS로 자극 했다와 TNF-는 상쾌한에는 HTRF에 의해 계량. (B) TNF-α, 일리노이-1β, 일리노이-6, 인간 monocytes 파생 수지상 세포 (iMoDCs)와 DZ 24 h에 대 한 자극된에 의해 일-23, IL-8 생산 (100 µ g/mL) MLT-827, Cpd11, AFN700 (1 µ M)에 모두와 함께 h 1 사전 부 화 후 또는 DMSO. DMSO 치료 샘플에서 Cytokine 수준 100%에서 설정 했다. 데이터의 3 측정 수단 ± SD 고 3 개의 독립적인 실험의 대표. * P < 0.05; * * P < 0.01; P < 0.001, 짝이 없는 양측 학생의 t 시험.

그림 4: C 타입 lectin 같은 종속 cytokine 생산 iMoDCs. TNF-α, 일리노이-1β, 및 iMoDCs에 의해 일리노이-6 생산 MINCLE 주 작동 근 트 레 할 로스-6, 6-dibehenate (TDB, 100 µ g/mL) 24 h에 대 한 자극 (A) 또는 Dectin-1 주 작동 근 DZ (100 µ g/mL) (B) MLT-827로 1 h 사전 부 화 후 (1 µ M) 또는 DMSO. 데이터의 3 측정 수단 ± SD 고 3 개의 독립적인 실험의 대표.
보충 파일 1. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보조 파일 2. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보충 파일 3. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
이 작품에서 우리 인간의 신호 통로 마우스 타고 난 세포를 연구 하 고 MALT1 분해 기능에 대 한 그들의 의존성을 심문 간단한 실험 설정 사용. 이전 작업11에 확대, 우리의 연구 MALT1 paracaspase 활동 C 형 lectin 같은 수용 체 유도 cytokine 생산, TNF-α를 포함 하 여 컨트롤을 보여주었다. 반면, TLR 4 유도 하는 TNF-α MALT1 두 종에서 독립 했다. 샨 다, 이러한 데이터는 MALT1/CBM signalosome 하류 C 형 lectin 같이 수용 체의 이전 연구6,12,18에 의해 공개 됐다이의 키와 선택적 기여 뒷받침.
TLR 4 MALT1 골수성 세포에서에 신호의 명확한 독립 다른 적용 여부 셀 유형 탐험 남아 있다. 예를 들어, B 림프 톨에 TLR 신호 이전 표시 했다 B 세포 항 원 수용 체19의 하류 B 세포 활성화에 기여. 사실, 우리는 증거 TLR 4 자극 인간의 마우스 B 세포 MLT-827에 감도 표시 되지 않은 있다. 따라서, 추가 기계 통찰력 B 세포 수용 체의 하류 귀중 한 것입니다. 이러한 맥락에서 B 세포 림프 종에서 최근 연구는 B 세포 수용 체 및 TLR9 수용 체20의 하류 신호 통로의 클러스터링에 대 한 증거를 제공. B 세포 수용 체에 TLR 경로 NF-κB 활성화를 위한 중재자 역할 TRAF6 MALT1 효소 저해에 두 통로의 감도 설명할 수 있는 크로스 토크의 포인트 될 수도 있습니다. 반대로, TRAF6 NF-κB의 유도 대 한 CLLRs 및 TLRs의 일반적인 다운스트림 선수 이기도 하지만이 두 경로 골수성 세포에서 MALT1 paracaspase 종속 방식에서 누화에 표시 되지 않습니다.
이 작품은 신호 경로 대 한 쉬운 판독을 제공 하 고 복합 프로 파일링 쉽게 구현할 수 있다 cytokine 생산에 집중 했다. 그것은 몇몇 MALT1 생물학 MALT1의 선택적이 고 강력한 억제제의 가치를 강조 했다. 기계적 통찰력을 더 얻기 필요 합니다 추가 작업 및 개발 보다 근 분석 실험의 예를 들어, 레 귤 레이 션 신호 MALT1 타고 난에 참여의 기판의 특성.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 공개 없다.
Acknowledgments
우리에 대 한 그들의 허가 (면허 번호 4334770630127) Unterreiner 그 외 여러분 에서 여기 그림 2A 를 재현 하는 Elsevier 감사 (2017)입니다.
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



