Summary
MALT1 regula a imunidade inata, mas como isso ocorre permanece indefinida. Usamos o inibidor seletivo de paracaspase MALT1 MIT-827 para desvendar a contribuição da MALT1 para sinalização inata, a jusante dos receptores Toll-like ou tipo C do tipo lectina, demonstrando que MALT1 regula a produção de citocinas mieloides e a jusante dos receptores do tipo lectina do tipo C, seletivamente.
Abstract
Além de sua função nas células linfoides, que foi abordada por numerosos estudos, o paracaspase MALT1 também desempenha um papel importante nas células inatas a jusante dos receptores de reconhecimento padrão. Mais bem estudados são os membros da família de receptores de lectina tipo C-tipo Dectin-1 e Dectin-2 que induzem um dependente SYK - e CARD9-sinalização em cascata, levando a ativação do NF-κB, em uma maneira MALT1-dependente. Por outro lado, receptores do tipo Toll (TLR), como o TLR-4, propaga a ativação de NF-κB, mas sinal através de uma cascata de MYD88/IRAK-dependente. No entanto, se MALT1 possam contribuir para a sinalização de TLR-4 manteve-se pouco clara. Evidências recentes com MIT-827, um inibidor potente e seletivo da MALT1 paracaspase atividade, indicam que o TNF-produção a jusante de TLR-4 em células mieloides humanas é independente de MALT1, ao contrário do TNF-produção a jusante de Dectin-1, que é MALT1 dependente. Aqui, abordámos o envolvimento seletivo de MALT1 em reconhecimento de padrões, sentindo-se ainda mais, usando uma variedade de humanos e rato celular, produtos de higiene e estimulação de Dectin-1, MINCLE ou TLR-4 vias. Nós também forneceu insights adicionais explorando citocinas TNF-e comparando MIT-827 para um inibidor SYK (Cpd11) e um inibidor IKK (AFN700). Coletivamente, os dados fornecidos ainda mais evidência para a dependência de MALT1 dos receptores de lectina tipo C-tipo — sinalização em contrapartida para sinalização de TLR.
Introduction
A atividade de paracaspase de MALT1 (proteína associada a Mucosa tecido linfoide linfoma translocação 1) foi revelada em 20081,2. Desde então, vários estudos têm relatado sua contribuição fundamental para respostas de receptor do antígeno em linfócitos. Modelos genéticos no mouse, bem como dados de farmacologia suportam um papel-chave em células T, de auto-imunidade dependente de células T e células B linfoma configurações3,4. Em linfócitos, MALT1 paracaspase ativação ocorre após a montagem de um CARD11-BCL10-MALT1 complexo5, que é acionado por sinalização proximal do antigénio-receptor a jusante do receptor de células T ou B. Também há ampla evidência de que um complexo CARD9-BCL10-MALT1 semelhante é importante para a propagação de sinais a jusante dos receptores do tipo lectina tipo C (CLLR), por exemplo,, Dectin-1, Dectin-2 e MINCLE em mieloide células6,7. Dectin-1 tem sido particularmente bem estudado, pois esta via é fundamental para a defesa do hospedeiro contra infecções fúngicas8,9. Implicação de MALT1 em vias de receptores do tipo Toll (TLR), no entanto, manteve-se controversa10. Evidências recentes em células mieloides humanas descartaram um papel direto para a atividade de paracaspase MALT1 na regulação do TNF-produção a jusante de TLR-411.
No presente trabalho, costumávamos várias configurações experimentais e condições estimulatórios em humanos e pilhas myeloid rato sonda inatas vias de sinalização, baseando-se na ferramenta farmacológica específica inibidores e medição da produção de citocinas.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Experimentos foram conduzidos de acordo com as diretrizes e normas do Comitê de ética pesquisa humana da Novartis.
1. preparação de células mononucleares do sangue periférico (PBMC) de casacos Buffy humanas
Nota: Recebemos a buffy casacos de voluntários saudáveis, um dia após a coleta, em sacos de 50 mL. Foram fornecidas sob consentimento informado e coletadas através do Interregionale Blutspende Schweizeriches Rotes Kreuz. Lidamos com eles usando o procedimento abaixo, à temperatura ambiente, a menos que especificado em contrário.
- Prepare um par limpo e estéril de tesoura e um copo de 1 L com um saco de plástico (sob um fluxo de lâmina).
- Transferir o buffy coat para o copo e com cuidado, abra-o com a tesoura.
- Utilizando uma pipeta de 25 mL, adicionar 100 mL de ácido tampão fosfato salina tampão/etilenodiaminotetracético (EDTA/PBS: pH de 1X PBS 7,4 contendo não CaCl2 e não MgCl2, suplementado com 2 mM pH EDTA 8.0).
Nota: Usando a mesma pipeta e depois lentamente pipetagem a solução acima e para baixo, dispense 25 mL do revestimento buffy diluído em 6 tubos de centrifuga conico de pré-preenchido com 15 mL de gradiente de densidade baseados em polissacarídeo de 50 mL. - Centrífuga 20 min a 800 x g com aceleração moderada (fixado em 4 de 9) e sem freio para permitir a separação de células com base em suas densidades.
Nota: Após a centrifugação, três camadas serão visíveis; uma pelota contendo hemácias e granulócitos, uma camada superior feita de plasma e no meio de um anel branco contendo células mononucleares de sangue periférico (PBMC). - Colha o anel PBMC usando uma pipeta de 10 mL e transferência para novos tubos de 50 mL.
Nota: Dois ou três tubos de 50 mL são normalmente exigidos por demão buffy. Nesta fase, alguns plasma provável contamina os PBMCs coletados, que devem ter nenhum impacto sobre as etapas subsequentes de enriquecimento. - Superior a 50 mL cada tubo utilizando PBS/EDTA e proceder a três lavagens sucessivas com diminuindo o tempo de centrifugação e velocidade (15 min 520 x g, 10 min a 330 x g, 8 min a 150 x g).
Nota: A cada passo, o sobrenadante é coado em um recipiente de resíduos líquido e o centrifugado é resuspended em 50 mL de PBS/EDTA (Pelotas podem ser colocados em pool após a primeira lavagem). - Após a lavagem final, resuspenda o pellet em 25 mL de um tampão de Lise gelada (consulte a Tabela de materiais) para lisar os glóbulos vermelhos por pressão osmótica.
- Incubar até que a solução torna-se claro (≤ 5 min à temperatura ambiente).
- Pare a reação adicionando 25 mL de tampão de separação (PBS 1 x pH 7,4 contendo não CaCl2 e não MgCl2, suplementado com 2% inactivadas pelo calor fetal de soro bovino (FBS) e 1 mM EDTA pH 8.0).
- Lave mais uma vez a 150 x g por 8 min.
Nota: Nesta fase PBMCs podem ser usados como uma população em massa (consulte a etapa 3: tratamentos PBMCs e monócitos e condições estimulatórios) ou transformadas para enriquecimento de monócitos (consulte a etapa 2: preparação de monócitos de PBMC), ou congelado para baixo para uso subsequente (consulte a etapa 5: Monócitos e PBMCs procedimentos de congelamento/descongelamento).
2. preparação de monócitos de PBMC
- Ressuspender os PBMCs obtidos no passo 1.10 no buffer de separação e contá-las para alcançar 5 x 107células/mL.
- Transferi a suspensão de células para um tubo de centrifuga conico de 14 mL com tampa.
- Adicionar 50 µ l de anticorpo de enriquecimento monócito cocktail por mL de suspensão de células, vórtice e incube 10 minutos a 4 ° C.
- Adicione 50 µ l de grânulos de enriquecimento monócito de células por mL.
Nota: Os grânulos devem ser completamente vortexed para garantir a homogeneidade da suspensão. - Depois de adicionar as contas, em breve levar a suspensão de célula e incubar 5 min a 4 ° C.
- Lave a parte superior do tubo com buffer de separação até que o tubo está cheio até 10 mL.
- Misture lentamente a solução pipetando para cima e para baixo.
- Coloca o tubo sem tampa em um ímã de separação.
- Incube durante 2,5 min à temperatura ambiente.
- Despeje lentamente em um tubo de centrifuga conico de 15 mL.
- Nesta fase, use os monócitos diretamente (consulte a etapa 3: tratamentos PBMCs e monócitos e condições estimulatórios) ou diferenciá-los em euangelinhos Monocyte-derivado Dendritic Cells (iMoDCs) (consulte a etapa 4), ou congelá-los para baixo para uso subsequente (Veja passo 5).
3. PBMCs e tratamentos de monócitos e estimulatórios condições
- Contar as células e diluí-los em meio de cultura (meio de Roswell Park Memorial Institute (RPMI) 10% FBS 1 mM piruvato de sódio + 100 U/mL Estreptomicina de penicilina (Pen/Strep) + β-Mercaptoetanol de 5 µM), até 1,25 x 104 células/poço.
- Distribua 30 µ l de suspensão de células por poço de uma placa de 384.
- Adicionar 15 µ l de 4 x soluções concentradas de composto e pre-incubar durante 1 h a 37 ° C, 5% de CO2.
- Adicionar lipopolissacarídeo (LPS) a uma concentração final de 10 ng/mL, ou empobrecido ZnPPIX (DZ) a uma concentração final de 100 µ g/mL ou manter-se em simples meio.
- Incube durante uma noite a 37 ° C, 5% de CO2.
- Leve 10 µ l do sobrenadante para medir níveis de TNF-a secretada (consulte a etapa 7: medições de citocinas e viabilidade).
4. monócitos diferenciação em iMoDCs e estimulatórios condições
- Contagem de monócitos (enriquecidos no passo 2) e centrifugar a suspensão de eritrócitos a 520 x g por 5 min.
- Pipetar fora o sobrenadante e adicionar o meio de cultura (RPMI + 10% FBS para obter uma suspensão de célula final de 0,4 x 106 células/mL.
- Adicione 80 ng/mL recombinante humano IL-4 + 100 ng/mL GM-CSF.
- Dispense a 5 mL de suspensão de células por poço em uma placa de 6.
- Incube durante 7 dias a 37 ° C, 5% de CO2.
- No dia 7, colha células pipetando suavemente para evitar a sua ativação.
- Centrifugar a 520 x g por 5 min.
- Aspirado de vácuo e ressuspender em 50 mL de meio de cultura sem fatores de crescimento.
- Centrifugar a 520 x g por 5 min e ressuspender a 1 x 106 células/mL em meio de cultura.
- Dispense 100 µ l de suspensão de células (105 células) por bem de uma placa de fundo chato de 96 poços.
- Pre-incubate por 1 h a 37 ° C, após a adição de 50 µ l de 4 x concentrado compostas soluções, preparadas como descrito no passo 8: preparação de compostos.
- Adicione 50 µ l de estímulos (4 x concentrado), preparado como descrito no passo 9.
- Incubar 24 horas a 37 ° C.
- Misture cada poço e transferência de células e o sobrenadante (SN) em uma placa de V-fundo de 96 poços.
- Spin para baixo a 475 x g por 5 min.
- Transferir o sobrenadante para um novo prato fundo plano 96 poços, selar e congelar a-20 ° C até utilização posterior.
5. monócitos e procedimentos de congelamento/descongelamento PBMCs
-
Congelamento
- Spin para baixo PBMC ou monócitos preparações da pilha a 520 x g por 5 min.
- Vácuo, aspirar o sobrenadante e ressuspender as células em congelamento médio a 1 x 107 células/mL.
- Diluir 1 mL de suspensão de células em cryotubes, transferir os tubos para um dispositivo de resfriamento específico (veja a tabela dos materiais) e coloque-a-80 ° C.
-
Descongelamento
- Descongelar o criotubo e rapidamente transferir seu conteúdo para um tubo de centrifuga conico de 15 mL contendo 9 mL de meio de cultura.
- Centrifugar a 520 x g por 5 min.
- Aspirador de aspirado de sobrenadante e ressuspender células em 5 mL de meio de cultura. Células estão agora prontas para mais processamento experimental.
6. Mouse baço células preparação e tratamento
Nota: Realizamos sacrifícios de animais, de acordo com as diretrizes e normas da organização de bem-estar Animal Novartis. Estudos foram aprovados pelo Comitê de ética da autoridade governamental regional (Kantonales Veterinäramt der Stadt Basel). Sacrificamos animais por excesso de exposição de isoflurano, com todos os esforços para minimizar o sofrimento.
- Colheita do baço e dissociar o tecido usando um tubo equipado com um dispositivo de moedor de tecido mecânico e preenchido com 5 mL de meio RPMI frio.
- Use o programa de baço da máquina dissociação para moer os órgãos.
- Filtre as células através de um filtro de célula de nylon 100mm.
- Transferi a suspensão em tubos de 50 mL e centrifugar a 4 ° C por 10 min a 320 x g.
- Vácuo, aspirar o sobrenadante, Ressuspender as células em 3 mL de tampão de Lise gelada e incube por ≤ 2 min no gelo.
- Pare lise adicionando 7 mL de meio RPMI.
- Filtrar novamente através de um filtro de célula de nylon µm 100.
- Spin para baixo a suspensão de células a 330 x g durante 10 minutos a 4 ° C.
- Aspirador de aspirado de sobrenadante e ressuspender as células em 11 x 106 células/mL em meio completo (RPMI suplementado com 10% FBS, 100 U/mL caneta/etapa e β-Mercaptoetanol de 5 µM).
- Placa 1 x 106 células/poço (90 µ l) em uma placa de 96 poços (fundo plano).
- Adicionar 5 µ l de 20 x concentrado composta solução previamente diluída em meio RPMI conforme descrito no passo 8.3: diluição Serial para células de baço murino.
- Incube durante 30 min a 37 ° C, 5% de CO2.
- Adicione 5 µ l de 20 x concentrado DZ (concentração final de 30 µ g/mL) ou 20 x concentrado LPS + IFN-g (TLR-4) (concentração final de 1 µM LPS e 10 ng/mL IFN-g).
- Incube durante uma noite a 37 ° C, 5% de CO2.
- Centrifugar a 330 x g por 10 min.
- Sobrenadantes em novas placas de transferência, selar e congelar a-20 ° C até utilização posterior.
7. citocinas e medições de viabilidade
-
Medição humana de TNF-a por HTRF (homogênea tempo resolvido fluorescência)
Nota: O protocolo seguido as recomendações do fornecedor, brevemente resumidas a seguir.- Misturar 1 volume de reagente reconstituído (anti-TNF-por-cryptate e anti-TNF-a-XL665) com 19 volumes de tampão de reconstituição (50mm tampão fosfato pH 7,0, 0,8 M de fluoreto de potássio (KF), 0,2% albumina de soro bovino (BSA)).
- Misture as duas soluções ready-to-use anticorpo 1:1 antes de dispensar os reagentes.
- Dispense 10 µ l de sobrenadantes de passo 3.6 em chapas de 384-poço brancos.
- Dispense 10 µ l da mistura anticorpo.
- Cubra o prato com um aferidor e incubar a 4 ° C durante a noite.
- Leia a placa em um leitor de microplacas (50 – 200 flash).
- Medição de IL-23 humana por HTRF (homogênea tempo resolvido fluorescência)
Nota: O protocolo seguido as recomendações do fornecedor, brevemente resumidas a seguir.- Misture um volume de reagente reconstituído (anti-IL-23-cryptate-anticorpo e anti-IL-23 D2-anticorpo) com 19 volumes de tampão de deteção #3.
- Misture as duas soluções ready-to-use anticorpo 1:1 antes de dispensar os reagentes.
- Dispense 10 µ l de sobrenadantes de passo 3.6 em chapas de 384-poço brancos.
- Dispense 10 µ l da mistura anticorpo.
- Cubra o prato com um aferidor e incubar a 4 ° C durante a noite.
- Leia a placa em um leitor de microplacas (flash de 50 – 200 nm).
-
Humano IL-6, IL-8, IL-1 β e medições de TNF-α por eletroquimioluminescência
Nota: Todas as amostras foram diluídas em 1/150 em diluente 2 (primeira diluição: 10 µ l em 150 µ l e, em seguida, 20 µ l de 180 µ l). O protocolo seguido as recomendações do fornecedor:- Dilua as amostras e padrão em diluente 2.
- Proceda à diluição da norma em diluente 2 usando uma diluição de série dobra de 1/4.
- Placas de lavar três vezes com tampão de lavagem.
- Dispense a 50 µ l de norma por alvéolo ou amostras.
- Incube durante 2 h à temperatura ambiente sob agitação.
- Lavar a placa quatro vezes com PBS + 0,05% polissorbato 20.
- Adicione 25 µ l de anticorpo de detecção (60 µ l de cada anticorpo para final 3 mL) no diluente de 3.
- Incube durante 2 h à temperatura ambiente sob agitação.
- Lavar a placa quatro vezes com PBS + 0,05% polissorbato 20.
- Evitando bolhas, adicionar 150 µ l por alvéolo do buffer de leitura (buffer de Tris contendo tripropilamina, diluídas 2x em ddH20) como um reagente co para a geração de luz em imunoensaios eletroquimioluminescência.
- Leia a placa (sem atraso) em um leitor de placa multiplex.
-
Mouse TNF-a medição por ELISA seguindo o protocolo do fornecedor
- Dilua o sobrenadante 1:1 em diluente de ensaio (pronto para usar tampão proteicos).
- Prepare reagentes, amostras e diluições padrão conforme descrito no kit. Adicione 50 μL de diluente de ensaio para cada poço.
- Adicione 50 μL de amostra por alvéolo, controle ou padrão.
- Misture suavemente tocando a moldura da placa por 1 min.
- Cubra com a fita adesiva fornecida e incubar durante 2 h à temperatura ambiente.
- Aspire cada bem e lave com 400 μL/poço (repetir este passo cinco vezes no total).
- Após a lavagem final, remova qualquer restantes tampão de lavagem por aspiração.
- Inverter a placa e borre contra toalhas de papel limpo.
- Adicione 100 μL de conjugado de rato TNF-α em cada poço. Cobrir com uma nova tira adesiva.
- Incube durante 2 h à temperatura ambiente.
- Repita a aspiração/lavagem como na etapa 7.4.4.
- Adicionar 100 μL de solução de substrato a cada poço e incube por 30 minutos em temperatura ambiente protegido da luz.
- Adicione 100 μL de solução de ácido clorídrico diluído (solução de paragem) a cada poço. Bata levemente a placa para assegurar uma mistura completa.
- Medir a densidade óptica a 450 nm (com o comprimento de onda de correção fixado em 560 nm) usando um leitor de microplacas (para ser feito dentro de 30 min).
- Dilua o sobrenadante 1:1 em diluente de ensaio (pronto para usar tampão proteicos).
-
Viabilidade celular
- Depois de remover sobrenadantes de preparações PBMC ou monócitos, avalie a viabilidade celular usando um pronto para usar a solução de resazurina (indicador de oxidação-redução) adicionada diretamente à suspensão de células para a concentração final de 10%.
- Incube durante 1 a 2 h a 37 ° C, 5% de CO2.
- Lê a fluorescência em 590 nm (excitação 540 nm), utilizando um leitor de microplacas.
8. preparação de compostos
-
Diluição serial para iMoDCs
- Diluir a solução estoque MIT-827 (10mm em dimetilsulfóxido (DMSO) em média para chegar a 8 µM de uma só vez (4 x concentrada).
- Realize uma diluição serial da seis-etapa 1:5, usando médio + 0,08% DMSO. Use o mesmo meio de + 0,08% solução de DMSO para a condição do veículo (não composto).
-
Dose única de teste para iMoDCs
- Dilua as soluções estoque MIT-827, AFN700 e Cpd11 em meio para chegar a 4 µM de uma só vez (4 x concentrada).
-
Diluição serial para células de baço murino
- Dilua uma solução de MIT-827 de 10 µM (obtido de uma solução stock de 10mm, seguindo uma diluição vá em média) de 0,01 µM, com uma concentração final de DMSO de 0,1%.
- Para as etapas de diluição, tome 2 µ l de cada diluição, adicione 38 µ l RPMI e pipetar 5 µ l para o poço.
Nota: Todos os tratamentos são realizados em triplicado.
9. estímulos preparação
-
ZnPPIX empobrecido (DZ)
- Adicionar 2 mL de água livre de endotoxinas estéril a 10 mg de DZ.
- Vórtice para homogeneizar a solução-mãe, vórtice também prévia de cada utilização.
- Alíquotas alíquotas de solução e loja a-20 ° C.
-
Trealose-6,6-dibehenate (TDB)
- Adicione 100 µ l de DMSO TDB, calor de 60 ° C em um banho de água durante 15-30 s de 1 mg.
- Vórtice e imediatamente adicionar 900 µ l de PBS estéril, vórtice novamente.
- Aquecer durante 10 a 15 min a 60 ° C e homogeneizar por prévio num Vortex de cada utilização.
- Manter a solução a 4 ° C.
- Realize diluições em série e dose única preparação quanto o composto do MIT-827.
Nota: Porque TDB precisa ser preparado em DMSO, uma concentração de DMSO final 1% está presente durante a estimulação da célula.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Em células mieloides, MALT1 transmitem sinais de ativação a jusante dos vários receptores do tipo lectina tipo C, tais como Dectin-1, Dectin-2 e MINCLE6. Essas vias dependem de receptores de (bainha) ITAM contendo motivo (por exemplo,, Dectin-1) ou receptores de co ITAM contendo motivo (por exemplo,, FcRγ, Dectin-2 e MINCLE) que recrutar e ativar a quinase SYK (Figura 1). Isto leva à ativação de uma proteína quinase C isoform, nomeadamente PKCδ, que fosforila CARD9, disparando CARD9/BCL10/MALT1 complexa formação e recrutamento de TRAF6 para a jusante de ativação de NF-κB12. Por outro lado, a via TLR-4 recrutas TRAF6 em um MALT1 independente mas MYD88/IRAK-dependente para a ativação do NF-κB (Figura 1). Evidência para este envolvimento diferencial de MALT1 foi obtida usando modelos genéticos de MALT1 deficiência, bem como o tratamento farmacológico com o peptídicos inibidor ativo-site z-VRPR-fmk11,13,14.
Usamos o recentemente relatado potente MALT1 inibidor seletivo MIT-82715 e perguntou se este composto regularia TNF-produção a jusante de C tipo Toll-like e lectina como receptores, respectivamente. PBMC humano e células de baço de rato foram estimuladas com ZnPPIX empobrecido (DZ, um agonista conhecido de Dectin-1) ou lipopolissacarídeo (LPS, um agonista conhecido de TLR-4) e nós medidos TNF-lançamento no sobrenadante da cultura após 20 h. Em ambos os humanos e os ensaios de rato, MIT-827 seletivamente bloqueado TNF-produção impulsionada pela via Dectin-1, mas não por via TLR-4 (Figura 2). Obtivemos dados similares após a incubação com o composto z-VRPR-fmk (complementar a Figura 1).
Para obter insights de caminho, realizamos mais experiências em monócitos humanos e em células dendríticas derivadas de monócitos imaturas (iMoDCs), comparando o efeito do MIT-827 do SYK inibidor Cpd1116 e do inibidor IKK AFN70015 . Em monócitos estimulados com LPS, a produção de TNF-α quase completamente foi revogada por AFN700 mas não foi sensível para Cpd11 (Figura 3A), que é consistente com a dependência/independência do percurso na atividade do NF-κB/SYK, respectivamente (TLR-4 Ver Figura 1). Por outro lado, produção de TNF-α, conduzida por Dectin-1 em iMoDCs exibido sensibilidade para Cpd11 além de sensibilidade ao MIT-827 e AFN700 (Figura 3B, complementar a Figura 2), fornecendo a evidência adicional para o envolvimento de uma sinalização SYK/CBM cascata na via Dectin-1 (Figura 1). Notável, produção de Il-1, IL-6 e IL-23, após estimulação Dectin-1 também foi sensível para os três inibidores, indicando desse modo semelhante ao TNF - mecanismos de regulação. No entanto, um efeito limitado sobre a produção de IL-8 dos três compostos sugeriu um mecanismo regulatório distinto para esta citocina (Figura 3B, complementar a Figura 2).
Além de outros CLLRs, tais como Dectin-2 e MINCLE, função através da estimulação de um CARD9 signalosome7, Dectin-1. Portanto, testamos MIT-827 em iMoDCs desafiados com o agonista MINCLE trealose-6,6-dibehenate (TBD). Aumentar as concentrações de TBD acima de 50 µ g/mL conduziu à produção de TNF-, IL-6 e Il-1, que se baseava em MALT1 paracaspase atividade como visto do efeito bloqueador do MIT-827 (Figura 4A). Foram obtidos resultados consistentes quando desafiando iMoDCs com concentrações crescentes de DZ para estimular a Dectin-1 (Figura 4B).
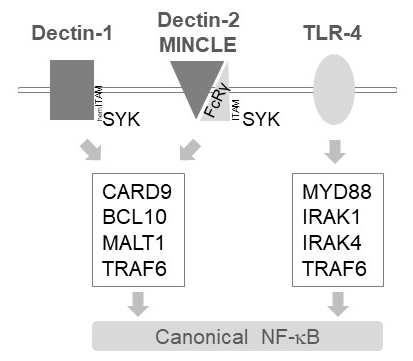
Figura 1: sinalização do NF-κB a jusante da Dectin-1, MINCLE e TLR-4. A Charge retrata as principais características da canonical NF-κB ativação caminhos a jusante de Dectin-1, Dectin-2, MINCLE ou TLR-4 em células mieloides. O que contém hemITAM Dectin-1 receptor17 diretamente podem se engajar SYK para estimular a formação do complexo CBM (CARD9/BCL10/MALT1), levando a ativação de NF-κB dependente TRAF6. Outros receptores do tipo lectina tipo C como Dectin-2 ou MINCLE necessidade de recrutar uma cadeia contendo ITAM FcRγ para envolver um CBM e ativar o NF-κB. Os receptores TLR-4 usam outro mecanismo para a ativação do NF-κB, depender de quinases MYD88 e IRAK1/IRAK4 rio acima de TRAF6.

Figura 2: Dectin-1 sinais através de MALT1 para a produção de TNF-α em humanos e pilhas do rato. (A) dados de PBMC humano como em Unterreiner et al, 2017 (Figura 2A)11. PBMC humano foram estimulado com 1 ng/mL de LPS (TLR-4 agonista) ou 100 mg/mL DZ (Dectin-1 agonista) para 20 h na presença de concentrações graduais de MIT-827. TNF-lançado no sobrenadante foi quantificada por HTRF. Mouse (B) células do baço foram tratadas com uma concentração gama de MIT-827 por 30 min e posteriormente estimulado com 30 µ g/mL, DZ ou 1 µ g/mL LPS + 10 ng/mL IFN - para 18 h. TNF-α no sobrenadante de cultura de pilha foi medida por ELISA. Um dos dois experimentos com resultados semelhantes é mostrado, como média ± SEM das três medições.

Figura 3: IKK - e/ou SYK-dependência da produção de citocinas a jusante de TLR-4 e Dectin-1. (A) monócitos humanos foram pré-tratados para 1 h com MIT-827 (1 µM), Cpd11 (1 µM), ou AFN700 (3 µM) ou veículo (DMSO). As células foram estimuladas com 10 LPS ng/mL para 20 h e TNF no sobrenadante foi quantificado por HTRF. (B) TNF-α, IL-1 β, IL-6, IL-23 e IL-8 produção de derivados de monócitos dendríticas células humanas (iMoDCs) estimuladas por 24 h com DZ (100 µ g/mL) após a pré-incubação 1h com MIT-827, Cpd11, AFN700 (tudo em 1 µM) ou DMSO. Níveis de citocina nas amostras tratadas DMSO foram fixados no 100%. Dados são meios ± SD de três medições e representante de três experimentos independentes. * P < 0,05; * * P < 0,01; P < 0,001, pareado, teste t de Student bicaudal.

Figura 4: produção de citocina lectina-como-dependente tipo C por iMoDCs. TNF-α, IL-1 β e produção de IL-6 por iMoDCs estimularam por 24 h com o agonista MINCLE trealose-6,6-dibehenate (TDB, 100 µ g/mL) (A) ou com o agonista Dectin-1 DZ (100 µ g/mL) (B) após a pré-incubação 1h com MIT-827 (1 µM) ou DMSO. Dados são meios ± SD de três medições e representante de três experimentos independentes.
Arquivo suplementar 1. Clique aqui para baixar este arquivo.
Arquivo suplementar 2. Clique aqui para baixar este arquivo.
Arquivo suplementar 3. Clique aqui para baixar este arquivo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Neste trabalho, usamos configurações simples experimentais para estudar a sinalização percursos em humanos e inata pilhas do rato e interrogar sua dependência na função proteolítica MALT1. Expansão no anterior trabalho11, nosso estudo mostrou que MALT1 paracaspase atividade controla tipo C lectin como receptor induzida produção de citocinas, incluindo TNF-α. Em contraste, o TLR 4-induzida por TNF-α foi independente de MALT1 em ambas as espécies. Coletivamente, estes dados corroboram a contribuição chave e seletiva do MALT1/CBM signalosome a jusante dos receptores do tipo lectina do tipo C, que foi revelado pelo anteriores estudos6,12,18.
Se a clara independência do TLR-4 sinalização na MALT1 em células mieloides aplica-se a outros tipos de célula continua a ser explorado. Por exemplo, em linfócitos B, TLR sinalização foi previamente demonstrado contribuir para a ativação de células B a jusante da B-pilha antígeno receptor19. Na verdade, podemos ter inéditas evidências que TLR-4 estimulado humana e rato B células exibem sensibilidade para MIT-827. Portanto, mais mecanicistas introspecções a jusante do receptor célula B será valiosas. Neste contexto, um estudo recente no linfoma de células B apresentou provas para clusterização das vias de sinalização a jusante do receptor de células B e o receptor de TLR920. TRAF6, que atua como um mediador para a ativação do NF-κB em ambos o receptor de células B e as vias TLR, pode ser um ponto de interferência, o que poderia explicar a sensibilidade de ambos os percursos MALT1 inibição de protease. Por outro lado, TRAF6 também é um jogador comum de jusante de CLLRs e TLRs para indução do NF-κB, mas estes dois caminhos não parecem diagrama em forma de paracaspase-dependente MALT1 em células mieloides.
Este trabalho focado na produção de citocinas, que fornece uma leitura fácil para sinalização de vias e pode ser implementada facilmente para perfis compostos. Ele destacou o valor da seletivos e potentes inibidores da MALT1 para desfazer MALT1 de biologia. Obter mais ideias mecanicistas exigirá trabalho adicional e desenvolvimento dos ensaios mais proximais, por exemplo, para caracterizar os substratos MALT1 envolvidos na inata do Regulamento de sinalização.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Agradecemos a Elsevier para sua autorização (matrícula 4334770630127) reproduzir aqui Figura 2A de Unterreiner et al . (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



