Summary
MALT1 regola dell'immunità innata, ma come in questo caso rimane mal definita. Abbiamo usato l'inibitore selettivo della paracaspase MALT1 MLT-827 per svelare il contributo di MALT1 alla innata di segnalazione a valle dei Toll-like o C-tipo il lectin-like receptors, dimostrando che MALT1 regola la produzione di citochine mieloide e a valle dei recettori di tipo C il lectin-like, in modo selettivo.
Abstract
Oltre alla sua funzione in cellule linfoidi, che è stato affrontato da numerosi studi, la paracaspase MALT1 svolge anche un ruolo importante in cellule innate a valle dei recettori di riconoscimento di pattern. Meglio studiati sono i membri Dectin-1 e Dectin-2 della famiglia C-tipo recettore lectin-like che inducono un dipendente SYK e CARD9 segnalazione cascata che portano all'attivazione di NF-κB, in un modo MALT1-dipendente. Per contrasto, recettori Toll-like (TLR), ad esempio TLR-4, propagano l'attivazione n-f-κB ma segnale attraverso una cascata di MYD88/IRAK-dipendente. Comunque, se MALT1 potrebbe contribuire alla segnalazione TLR-4 è rimasto poco chiaro. La prova recente con MLT-827, un inibitore potente e selettivo di MALT1 paracaspase attività, indica che il TNF-produzione a valle di TLR-4 in cellule mieloidi umane è indipendente di MALT1, in contrasto con la produzione di TNF a valle di Dectin-1, che è MALT1 dipendente. Qui, abbiamo affrontato la partecipazione selettiva di MALT1 nel riconoscimento di pattern sensing ulteriormente, utilizzando una varietà di umani e preparazioni cellulari del mouse e stimolazione delle vie Dectin-1, MINCLE o TLR-4. Abbiamo anche fornito ulteriori approfondimenti esplorando citochine di là di TNF- e confrontando MLT-827 di un inibitore SYK (Cpd11) e di un inibitore IKK (AFN700). Collettivamente, i dati forniti ulteriori prove per la MALT1-dipendenza di recettori di tipo C il lectin-like — al contrario di segnalazione per TLR-segnalazione.
Introduction
L'attività di paracaspase di MALT1 (tessuto linfoide Mucosa-collegato linfoma traslocazione della proteina 1) è stata rivelata nel 20081,2. Da allora, una serie di studi hanno riferito suo contributo critico alla risposte del ricevitore dell'antigene nei linfociti. Modelli genetici nel topo come pure farmacologia dati supportano un ruolo chiave in cellule di T, nell'autoimmunità dipendente di cellule T e nelle cellule B linfoma impostazioni3,4. Nei linfociti, MALT1 paracaspase l'attivazione si verifica al momento del montaggio di un CARD11-BCL10-MALT1 complesso5, che viene attivato da prossimale di segnalazione del ricevitore dell'antigene a valle del recettore della cellula T o B. Inoltre ci sono ampie prove che un simile complesso CARD9-BCL10-MALT1 è importante per la propagazione di segnali a valle dei recettori di tipo C il lectin-like (CLLR), ad esempio, Dectin-1, Dectin-2 e MINCLE in mieloide cellule6,7. Dectin-1 è stato studiato particolarmente bene perché questa via è fondamentale per la difesa dell'ospite contro le infezioni fungine8,9. Implicazione di MALT1 nelle vie di recettori Toll-like (TLR), tuttavia, è rimasto controverso10. La prova recente in cellule mieloidi umane escluso un ruolo diretto per MALT1 paracaspase attività nella regolazione del TNF-produzione a valle di TLR-411.
Nel presente lavoro, abbiamo usato varie impostazioni sperimentali e stimolatori condizioni in essere umano e cellule mieloidi del mouse per sondare le vie di segnalazione innate, basandosi su inibitori specifici strumento farmacologico e misurazione della produzione di citochine.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Gli esperimenti sono stati condotti secondo le linee guida e standard del Comitato di etica Novartis umana ricerca.
1. preparazione di cellule mononucleari del sangue periferico (PBMCs) da umano Buffy Coats
Nota: Abbiamo ricevuto buffy cappotti da volontari sani un giorno dopo la raccolta, in sacchetti da 50 mL. Sono stati forniti sotto consenso informato e raccolti attraverso l' Interregionale trasfusione Schweizeriches Rotes Kreuz. Abbiamo gestito utilizzando la procedura qui di seguito, a temperatura ambiente, se non specificato diversamente.
- Preparare una coppia sterile e pulita di forbici e un becher da 1 litro con un sacchetto di plastica (sotto un flusso della lamina).
- Trasferire il buffy-coat nel becher e aprire con cautela con le forbici.
- Utilizzando una pipetta 25 mL, aggiungere 100 mL di acido etilendiamminotetracetico/tampone salina tampone fosfato (PBS/EDTA: pH di PBS 1X 7.4 contenente nessun CaCl2 e nessun MgCl2, completati con 2 mM pH 8.0 di EDTA).
Nota: Utilizzando la stessa pipetta e dopo lentamente pipettaggio la soluzione su e giù, dispensare 25 mL del cappotto buffy diluito in 6 tubi di centrifuga a fondo conico da 50 mL preriempita con 15 mL di pendenza di densità base polisaccaridica. - Centrifugare 20 min a 800 x g con moderata accelerazione (impostato a 4 su 9) e senza freno per consentire per la separazione delle cellule basato sulla loro densità.
Nota: Dopo la centrifugazione, tre strati sarà visibile; un pellet contenenti globuli rossi e granulociti, uno strato superiore in fatto di plasma e tra un anello bianco contenente cellule mononucleari del sangue periferico (PBMCs). - Raccogliere l'anello PBMC utilizzando una pipetta da 10 mL e trasferimento in nuove provette da 50 mL.
Nota: Due o tre provette da 50 mL sono normalmente richieste per buffy-coat. In questa fase, alcuni plasma probabile contamina i PBMCs raccolti, che non dovrebbe incidere sui passi successivi arricchimento. - Top fino a 50 mL ogni tubo con PBS/EDTA e procedere a tre lavaggi successivi con la diminuzione della velocità (15 min a 520 x g, 10 min a 330 x g, 8 min a 150 x g) e tempo di centrifugazione.
Nota: Ad ogni passo, il surnatante è travasato in un contenitore per rifiuti liquidi e il pellet cellulare è risospeso in 50 mL di PBS/EDTA (pellet può essere riunita dopo il primo lavaggio). - Dopo il lavaggio finale, risospendere il pellet in 25 mL di un tampone di lisi ghiacciata (Vedi Tabella materiali) per lisare le cellule di anima rosse di pressione osmotica.
- Incubare fino a quando la soluzione diventa chiara (≤ 5 min a temperatura ambiente).
- Fermare la reazione aggiungendo 25 mL di tampone di separazione (PBS 1 x pH 7.4 contenente nessun CaCl2 e nessun MgCl2, completati con 2% inattivati siero bovino fetale (FBS) e 1 mM EDTA pH 8.0).
- Lavare un'altra volta a 150 x g per 8 min.
Nota: In questa fase PBMCs può essere utilizzato come una popolazione di massa (vedere il passaggio 3: trattamenti PBMCs e monociti e stimolatori condizioni) o trattati per l'arricchimento del monocito (vedere il passaggio 2: preparazione dei monociti da PBMCs), o congelati giù per un uso successivo (vedere passaggio 5: Monociti e PBMCs procedure di congelamento/scongelamento).
2. preparazione dei monociti da PBMC
- Risospendere i PBMC ottenuti al punto 1.10 nel buffer di separazione e contarli per raggiungere 5 x 107cellule/mL.
- Trasferire la sospensione cellulare in una provetta conica per centrifuga 14 mL con tappo.
- Aggiungere 50 µ l di anticorpo di arricchimento del monocito cocktail per mL di sospensione cellulare, vortice e incubare per 10 minuti a 4 ° C.
- Aggiungere 50 µ l di perline di arricchimento del monocito di cellule per mL.
Nota: Le perline devono essere accuratamente agitati con vortex per garantire omogeneità della sospensione. - Dopo aver aggiunto le perline, poco vortice la sospensione cellulare e incubare per 5 minuti a 4 ° C.
- Sciacquare la parte superiore del tubo con il tampone di separazione fino a quando il tubo è riempito fino a 10 mL.
- Mescolare lentamente la soluzione pipettando su e giù.
- Posizionare il tubo senza cappuccio in un magnete di separazione.
- Incubare per 2,5 min a temperatura ambiente.
- Versare lentamente in una provetta conica per centrifuga da 15 mL.
- In questa fase, utilizzare direttamente i monociti (vedere il passaggio 3: trattamenti PBMCs e monociti e stimolatori condizioni) o li differenziano in hommature Monocyte-derivato Dendritic Cells (iMoDCs) (Vedi punto 4), o congelarli giù per un uso successivo (Vedi punto 5).
3. PBMCs, monociti trattamenti e condizioni stimolatore
- Contare le celle e diluirli in terreno di coltura (medie Roswell Park Memorial Institute (RPMI) 10% FBS, 100 U/mL penicillina streptomicina (Pen/Strep) + 1 mM sodio piruvato + µM 5 β-mercaptoetanolo), fino a 1,25 x 104 cellule/pozzetto.
- Distribuire 30 µ l della sospensione di cellule per pozzetto di una piastra 384 pozzetti.
- Aggiungere 15 µ l di 4 x soluzioni concentrate di composte e pre-Incubare per 1h a 37 ° C, 5% CO2.
- Aggiungere il lipopolisaccaride (LPS) ad una concentrazione finale di 10 ng/mL, impoverito zymosan (DZ) a una concentrazione finale di 100 µ g/mL o tenere nel mezzo di pianura.
- Incubare per una notte a 37 ° C, 5% CO2.
- Prendere 10 µ l del surnatante per misurare i livelli di TNF-a secrete (vedere il passaggio 7: misure di citochine e redditività).
4. monociti differenziazione in iMoDCs e condizioni stimolatore
- Contare i monociti (arricchiti al passo 2) e centrifugare la sospensione cellulare a 520 x g per 5 min.
- Pipettare il sovranatante ed aggiungere il terreno di coltura (RPMI + 10% FBS per ottenere una sospensione cellulare finale di 0,4 x 106 cellule/mL.
- Aggiungere 80 ng/mL ricombinante umano IL-4 + 100 ng/mL GM-CSF.
- Pipettare 5 mL della sospensione di cellule per pozzetto di una piastra a 6 pozzetti.
- Incubare per 7 giorni a 37 ° C, 5% CO2.
- Al giorno 7, è possibile raccogliere le cellule pipettando delicatamente per evitare la loro attivazione.
- Centrifuga a 520 x g per 5 min.
- Aspirato di vuoto e risospendere in 50 mL di terreno di coltura senza fattori di crescita.
- Centrifugare a 520 x g per 5 min e risospendere a 1 x 106 cellule/mL nel terreno di coltura.
- Pipettare 100 µ l di sospensione cellulare (105 celle) per pozzetto di una piastra 96 pozzetti piatto inferiore.
- Pre-incubate per 1 h a 37 ° C dopo l'aggiunta di 50 µ l di 4x concentrato soluzioni composti, preparati come descritto al passo 8: preparazione di composti.
- Aggiungere 50 µ l di stimoli (4x concentrato), preparato come descritto al passaggio 9.
- Incubare per 24 h a 37 ° C.
- Mescolare ogni bene e trasferimento di cellule e il surnatante (SN) in una piastra a 96 pozzetti fondo V.
- Rotazione verso il basso a 475 x g per 5 min.
- Trasferire il surnatante in una nuova piastra di fondo piatto 96 pozzetti, sigillare e congelare a-20 ° C fino al successivo utilizzo.
5. i monociti e le procedure di congelamento/scongelamento di PBMCs
-
Congelamento
- Rotazione verso il basso PBMC o monocito preparazioni di cellule a 520 x g per 5 min.
- Vuoto di aspirare il supernatante e risospendere le cellule in mezzo a 1 x 107 cellule/mL di congelamento.
- Dispensare 1 mL di sospensione cellulare in provette per criogenia, i tubi di trasferimento a un dispositivo di raffreddamento specifico (Vedi tabella materiali) e posizionarlo a-80 ° C.
-
Lo scongelamento
- Scongelare lo stoccaggio provette criogenia e trasferire rapidamente il suo contenuto in una provetta da centrifuga a fondo conico da 15 mL contenente 9 mL di terreno di coltura.
- Centrifuga a 520 x g per 5 min.
- Vuoto di aspirare il surnatante e risospendere il pellet cellulare in 5 mL di terreno di coltura. Le cellule sono pronte per l'ulteriore elaborazione sperimentale.
6. Mouse milza cellule preparazione e trattamento
Nota: Abbiamo condotto i sacrifici animali secondo le linee guida e norme dell'organizzazione Novartis Animal Welfare. Gli studi sono stati approvati dal comitato etico dell'autorità pubblica regionale (Kantonales Veterinäramt der Stadt Basel). Abbiamo sacrificato animali da sovraesposizione isoflurano, con tutti gli sforzi compiuti per ridurre al minimo la sofferenza.
- Raccogliere la milza e dissociare tessuto usando un tubo dotato di un dispositivo di smerigliatrice meccanica del tessuto e riempito con 5 mL di fluido freddo RPMI.
- Utilizzare il programma di milza della macchina dissociazione per macinare gli organi.
- Le celle filtranti attraverso un colino di cella di 100 mm in nylon.
- Trasferire la sospensione in provette da 50 mL e centrifugare a 4 ° C per 10 min a 320 x g.
- Vuoto aspirato il sovranatante, risospendere il pellet cellulare in 3 mL di tampone di lisi ghiacciata e incubare per ≤ 2 min sul ghiaccio.
- Smettere di lisi aggiungendo 7 mL di terreno RPMI.
- Filtrare nuovamente attraverso un colino di cella di 100 µm in nylon.
- Rotazione verso il basso sospensione cellulare a 330 x g per 10 min a 4 ° C.
- Vuoto di aspirare il surnatante e risospendere le cellule a 11 x 106 cellule/mL in medium completo (RPMI supplementato con 10% FBS, 100 U/mL penna/Step e 5 µM. β-mercaptoetanolo).
- Piastra di 1 x 106 cellule/pozzetto (90 µ l) in una piastra a 96 pozzetti (fondo piatto).
- Aggiungere 5 µ l di 20x concentrata soluzione composto precedentemente diluito nel medium RPMI come descritto al punto 8.3: diluizione seriale per cellule murine della milza.
- Incubare per 30 min a 37 ° C, 5% CO2.
- Aggiungere 5 µ l di 20x concentrata DZ (concentrazione finale di 30 µ g/mL) o 20x concentrata LPS + IFN-g (TLR-4) (concentrazione finale di 1 µM LPS e 10 ng/mL IFN-g).
- Incubare per una notte a 37 ° C, 5% CO2.
- Centrifuga a 330 x g per 10 min.
- Trasferire i surnatanti in nuove piastre, sigillare e congelare a-20 ° C fino al successivo utilizzo.
7. citochine e misure di redditività
-
Umano TNF-a misura di HTRF (omogeneo tempo risolto fluorescenza)
Nota: Il protocollo seguito le raccomandazioni del fornitore, brevemente riassunte di seguito.- Mescolare 1 volume di reagente ricostituito (anti-TNF-a-cryptate e anti-TNF-a-XL665) con 19 volumi di tampone di ricostituzione (50 mM tampone fosfato a pH 7.0, fluoruro di potassio 0,8 M (KF), 0,2% albumina di siero bovino (BSA)).
- Mescolare le due soluzioni di ready-to-use anticorpo 1:1 solo prima dell'erogazione i reagenti.
- Pipettare 10 µ l di surnatanti dal passaggio 3.6 in piastre da 384 pozzetti bianche.
- Pipettare 10 µ l della miscela dell'anticorpo.
- Coprire la piastra con un foglio sigillante e incubare a 4 ° C durante la notte.
- Leggere la piastra su un lettore di micropiastre (50 – 200 flash).
- Umano IL-23 misura di HTRF (omogeneo tempo risolto fluorescenza)
Nota: Il protocollo seguito le raccomandazioni del fornitore, brevemente riassunte di seguito.- Mescolare 1 volume di reagente ricostituito (anti IL-23-cryptate-anticorpo e anti-IL-23 D2-anticorpo) con 19 volumi di tampone di rilevamento #3.
- Mescolare le due soluzioni di ready-to-use anticorpo 1:1 solo prima dell'erogazione i reagenti.
- Pipettare 10 µ l di surnatanti dal passaggio 3.6 in piastre da 384 pozzetti bianche.
- Pipettare 10 µ l della miscela dell'anticorpo.
- Coprire la piastra con un foglio sigillante e incubare a 4 ° C durante la notte.
- Leggere la piastra su un lettore di micropiastre (50 – 200 flash nm).
-
Umano IL-6, IL-8, IL-1 β e TNF-α misure di elettrochemiluminescenza
Nota: Tutti i campioni sono stati diluiti a 1/150 in diluente 2 (prima diluizione: 10 µ l in 150 µ l, poi 20 µ l in 180 µ l). Il protocollo seguito le raccomandazioni del fornitore:- Diluire i campioni e standard in diluente 2.
- Procedere alla diluizione dello standard in diluente 2 utilizzando una diluizione seriale piega 1/4.
- Lavare le piastre tre volte con tampone di lavaggio.
- Pipettare 50 µ l di campioni o standard per pozzetto.
- Incubare per 2 ore a temperatura ambiente sotto agitazione.
- Lavare la piastra quattro volte con PBS + 0.05% polisorbato 20.
- Aggiungere 25 µ l di anticorpo di rilevazione (60 µ l di ciascun anticorpo per 3 mL finale) nel diluente 3.
- Incubare per 2 ore a temperatura ambiente sotto agitazione.
- Lavare la piastra quattro volte con PBS + 0.05% polisorbato 20.
- Evitando bolle, aggiungere 150 µ l di buffer di lettura (tampone Tris-base contenente tripropilammina, diluito 2 x ddH20) come un co-reagente per la generazione di luce nei immunoassays elettrochemiluminescenza.
- Leggere la piastra (senza ritardo) su un lettore di multiplex.
-
Mouse TNF-a misura di ELISA seguendo il protocollo del fornitore
- Diluire il sopranatante 1:1 in diluente di dosaggio (pronto per l'uso tampone contenente proteine).
- Preparare i reagenti, campioni e diluizioni standard, come descritto nel kit. Aggiungere 50 μL di dosaggio diluente a ciascun pozzetto.
- Aggiungere 50 μL di standard, controllo o campione per pozzetto.
- Mescolare scuotendo leggermente il telaio piatto per 1 min.
- Coprire con il nastro adesivo fornito e incubare per 2 ore a temperatura ambiente.
- Aspirare ogni bene e lavare con 400 μL/pozzetto (Ripeti questo passo cinque volte in totale).
- Dopo il lavaggio finale, rimuovere qualsiasi residuo tampone di lavaggio aspirando.
- Capovolgere la piastra e macchia contro gli asciugamani di carta pulito.
- Aggiungere 100 μL di coniugato del mouse TNF-α in ciascun pozzetto. Coprire con una nuova striscia adesiva.
- Incubare per 2 ore a temperatura ambiente.
- Ripetere il lavaggio/aspirazione come descritto al punto 7.4.4.
- Aggiungere 100 μL di soluzione di substrato in ogni pozzetto e incubare per 30 min a temperatura ambiente al riparo dalla luce.
- Aggiungere 100 μL di soluzione di acido cloridrico diluito (soluzione di stop) in ciascun pozzetto. Picchiettare delicatamente la piastra per garantire la completa miscelazione.
- Misurare la densità ottica a 450 nm (con la lunghezza d'onda di correzione impostato a 560 nm) utilizzando un lettore di micropiastre (da fare entro 30 min).
- Diluire il sopranatante 1:1 in diluente di dosaggio (pronto per l'uso tampone contenente proteine).
-
Vitalità cellulare
- Dopo aver rimosso i surnatanti dalle preparazioni di PBMC o monocito, valutare la vitalità cellulare utilizzando un pronto per usare resazurin soluzione (indicatore di ossido-riduzione) aggiunto direttamente alla sospensione di cellule a concentrazione finale di 10%.
- Incubare per 1-2 ore a 37 ° C, 5% CO2.
- Leggere fluorescenza a 590 nm (eccitazione 540 nm) utilizzando un lettore di micropiastre.
8. Preparazione mescole
-
Diluizione seriale per iMoDCs
- Diluire la soluzione di riserva di MLT-827 (10 mM di solfossido dimetilico (DMSO) in mezzo a raggiungere 8 µM in una sola volta (4x concentrato).
- Eseguire una diluizione seriale di sei-punto 1:5, utilizzando medium + 0,08% DMSO. Utilizzare la stessa medium + 0,08% soluzione di DMSO per la condizione di veicolo (nessun residuo).
-
Singola dose test per iMoDCs
- Diluire le soluzioni stock MLT-827, AFN700 e Cpd11 nel mezzo per raggiungere 4 µM in una sola volta (4x concentrato).
-
Diluizione seriale per cellule murine della milza
- Diluire una soluzione di MLT-827 10 µM (ottenuta da una soluzione madre di 10mm seguendo un'una diluizione vanno in mezzo) a 0.01 µM, con una concentrazione di DMSO fine dello 0,1%.
- Per i passaggi di diluizione, prendere 2 µ l di ciascuna diluizione, aggiungere 38 µ l RPMI e pipettare 5 µ l nel pozzo.
Nota: Tutti i trattamenti sono eseguiti in triplice copia.
9. stimoli preparazione
-
Impoverito zymosan (DZ)
- Aggiungere 2 mL di acqua sterile privo di endotossina a 10 mg di DZ.
- Vortice per omogeneizzare la soluzione di riserva, vortice anche preventiva ogni uso.
- Aliquotare aliquote soluzione e conservare a-20 ° C.
-
Trealosio-6,6-dibeenato di glicerina (TDB)
- Aggiungere 100 µ l di DMSO a 1mg TDB, riscaldare a 60 ° C a bagnomaria per 15 – 30 s.
- Vortice e immediatamente 900 µ l di PBS sterile, vortice nuovamente.
- Riscaldare per 10 – 15 minuti a 60 ° C e omogeneizzare previo Vortex ogni uso.
- Mantenere la soluzione a 4 ° C.
- Effettuare diluizioni seriali e dose singola preparazione per quanto riguarda il composto MLT-827.
Nota: Perché TDB deve essere preparato in DMSO, un finale 1% di concentrazione di DMSO è presente durante la stimolazione di cellule.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
In cellule mieloidi, MALT1 trasmette i segnali di attivazione a valle di parecchi ricevitori di lectin-come di tipo C, ad esempio Dectin-1, Dectin-2 e MINCLE6. Queste vie si basano sui recettori contenenti motivi (orlo) ITAM (ad es., Dectin-1) o ITAM contenenti motivi Co-recettori (ad es., FcRγ, per Dectin-2 e MINCLE) che reclutano ed attivano la chinasi SYK (Figura 1). Questo porta all'attivazione di una proteina chinasi C isoforma, vale a dire PKCδ, che fosforila CARD9, innescando quindi CARD9/BCL10/MALT1 complessa formazione e reclutamento di TRAF6 per downstream l'attivazione di NF-κB12. Al contrario, la via di TLR-4 reclute TRAF6 in una MALT1-indipendente ma MYD88/IRAK-dipendente per l'attivazione di NF-κB (Figura 1). Prova per questo coinvolgimento differenziale di MALT1 è stata ottenuta utilizzando modelli genetici di carenza di MALT1 così come il trattamento farmacologico con peptidici sito attivo inibitore z-VRPR-fmk11,13,14.
Abbiamo usato il recentemente segnalati MALT1 potente e selettivo inibitore MLT-82715 e chiesto se questo composto regolerebbe TNF-produzione a valle dei recettori di lectin-like e Toll-like di tipo C, rispettivamente. PBMCs umano e cellule della milza del topo sono state stimolate con zymosan impoverito (DZ, un noto agonista di Dectin-1) o lipopolysaccharide (LPS, un noto agonisti dei TLR-4) e abbiamo misurato TNF-rilascio nel surnatante della cultura dopo 20 h. In entrambi l'essere umano e i saggi del mouse, MLT-827 bloccato selettivamente TNF-produzione guidato dalla via del Dectin-1, ma non dalla via del TLR-4 (Figura 2). Abbiamo ottenuto dati simili sopra incubazione con il composto di z-VRPR-fmk (complementare Figura 1).
Per via alcuni spunti, abbiamo condotto ulteriori esperimenti in monociti umani e nelle cellule dendritiche derivate da monociti immature (iMoDCs), che confronta l'effetto di MLT-827 a quella del SYK inibitore Cpd1116 e a quella dell'inibitore IKK AFN70015 . In monociti stimolati con LPS, produzione di TNF-α quasi completamente è stata abrogata da AFN700 ma non era sensibile a Cpd11 (Figura 3A), che è coerente con la dipendenza/indipendenza del pathway TLR4 sull'attività di NF-κB/SYK, rispettivamente ( vedere la Figura 1). Al contrario, produzione di TNF-α guidato da Dectin-1 in iMoDCs visualizzato sensibilità agli Cpd11 oltre alla sensibilità al MLT-827 e AFN700 (Figura 3B, complementare Figura 2), che fornisce ulteriore prova per il coinvolgimento di una segnalazione di SYK/CBM cascata nella via Dectin-1 (Figura 1). Degno di nota, produzione del-1, IL-6 e IL-23 Dectin-1 stimolazione era anche sensibili agli inibitori di tre, indicando così simile al TNF - meccanismi di regolazione. Tuttavia, un effetto limitato dei tre composti sulla produzione di IL-8 ha suggerito un meccanismo di regolazione distinto per questa citochina (Figura 3B, integrativa Figura 2).
Oltre a Dectin-1, altri CLLRs, come Dectin-2 e MINCLE, funzione attraverso la stimolazione di un CARD9 signalosoma7. Quindi abbiamo verificato MLT-827 in iMoDCs sfidati con l'agonista MINCLE trealosio-6,6-dibeenato di glicerina (TBD). Aumentare le concentrazioni di TBD superiori a 50 µ g/mL ha portato alla produzione di TNF-, IL-6 e il-1, che viene invocata MALT1 paracaspase attività come visto dall'effetto di blocco di MLT-827 (Figura 4A). Sono stati ottenuti risultati coerenti quando sfidando iMoDCs con aumento delle concentrazioni di DZ per stimolare la Dectin-1 (Figura 4B).
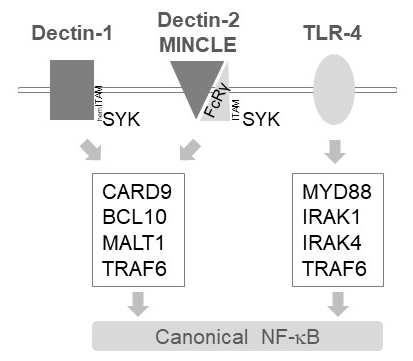
Figura 1: N-f-κB segnalazione a valle della Dectin-1, MINCLE e TLR-4. Il cartone raffigura le caratteristiche principali del canoniche vie di attivazione n-f-κB a valle di Dectin-1, Dectin-2, MINCLE o TLR-4 in cellule mieloidi. Recettore Dectin-1 hemITAM-contenente17 può impegnarsi direttamente SYK per stimolare la formazione di complessi di CBM (CARD9/BCL10/MALT1), che portano all'attivazione di NF-κB dipendente TRAF6. Altri recettori di Lectin-like C-tipo ad esempio Dectin-2 o MINCLE bisogno di reclutare una catena FcRγ ITAM-contenente per coinvolgere un CBM e attivare NF-κB. I recettori TLR-4 utilizzano un altro meccanismo per l'attivazione di NF-κB, basandosi sulle chinasi MYD88 e IRAK1/IRAK4 a Monte di TRAF6.

Figura 2: Dectin-1 segnali via MALT1 per la produzione di TNF-α in umani e cellule di topo. (A) dati di PBMCs umano come in Unterreiner et al., 2017 (Figura 2A)11. PBMCs umano sono stati stimolati con 1 ng/mL di LPS (agonisti dei TLR-4) o 100 µ g/mL DZ (Dectin-1 agonista) per 20 h in presenza di concentrazioni graduate di MLT-827. TNF-rilasciato nel surnatante è stato quantificato dall'HTRF. Mouse (B) cellule della milza sono state trattate con una concentrazione gamma di MLT-827 per 30 min e successivamente stimolato con 30 µ g/mL DZ o LPS di 1 µ g/mL + 10 ng/mL IFN - per 18 h. TNF-α nel surnatante della cultura delle cellule è stato misurato da ELISA. Uno dei due esperimenti con risultati simili è raffigurato, come significa ± SEM di tre misurazioni.

Figura 3: IKK - e/o SYK-dipendenza della produzione di citochine a valle di TLR-4 e Dectin-1. (A) monociti umani sono stati pre-trattati per 1 h con MLT-827 (1 µM), Cpd11 (1 µM), o AFN700 (3 µM) o veicolo (DMSO). Le cellule sono state stimolate con 10 ng/mL LPS per 20 h e TNF-al surnatante è stato quantificato dall'HTRF. (B) TNF-α, IL-1 β, IL-6, IL 23 e IL-8 la produzione da monociti-derivate cellule dentritiche umane (iMoDCs) stimolate per 24 h con DZ (100 µ g/mL) dopo 1 h di pre-incubazione con MLT-827, Cpd11, AFN700 (tutto a 1 µM) o DMSO. Livelli di citochina nei campioni trattati con DMSO sono stati impostati al 100%. Dati sono mezzi ± SD di tre misurazioni e sono rappresentativi di tre esperimenti indipendenti. * P < 0,05; * * P < 0.01; P < 0,001, spaiati test t di Student a due code.

Figura 4: produzione di citochina di lectin-like-dipendente di tipo C di iMoDCs. TNF-α, IL-1 β e la produzione di IL-6 da iMoDCs stimolato per 24 h con l'agonista MINCLE trealosio-6,6-dibeenato di glicerina (TDB, 100 µ g/mL) (A) o con l'agonista Dectin-1 DZ (100 µ g/mL) (B) dopo 1 h di pre-incubazione con MLT-827 (1 µM) o DMSO. Dati sono mezzi ± SD di tre misurazioni e sono rappresentativi di tre esperimenti indipendenti.
File supplementare 1. Per favore clicca qui per scaricare questo file.
File supplementare 2. Per favore clicca qui per scaricare questo file.
File supplementare 3. Per favore clicca qui per scaricare questo file.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In questo lavoro, abbiamo usato semplici impostazioni sperimentali per studiare le vie di segnalazione in umani e cellule innate del mouse e interrogare la loro dipendenza sulla funzione proteolitica MALT1. Espansione sul precedente lavoro11, il nostro studio ha mostrato che MALT1 paracaspase attività controlla C-tipo recettore di lectin-like indotto produzione di citochine, tra cui TNF-α. Al contrario, TLR-4-induced TNF-α è stato indipendente di MALT1 in entrambe le specie. Collettivamente, questi dati hanno confermato il contributo chiave e selettivo del MALT1/CBM signalosoma a valle dei recettori di tipo C il lectin-like, che è stato presentato da precedenti studi6,12,18.
Se l'indipendenza chiaro di TLR-4 segnalazione su MALT1 in cellule mieloidi si applica ad altri tipi di cellule rimane da esplorare. Per esempio, nei linfociti di B, TLR segnalazione precedentemente è stato indicato per contribuire all'attivazione di cellule B a valle del B-cella antigene recettore19. Infatti, noi abbiamo inedite prove che TLR-4 stimolato umano e cellule di topo B visualizzano sensibilità MLT-827. Di conseguenza, ulteriori meccanicistici intuizioni a valle del recettore delle cellule di B sarà preziosi. In questo contesto, uno studio recente nel linfoma a cellule B fornito la prova per il clustering delle vie di segnalazione a valle del recettore delle cellule di B e il recettore TLR920. TRAF6, che agisce come mediatore per l'attivazione di NF-κB sia il recettore delle cellule B e le vie TLR, potrebbe essere un punto di crosstalk, che potrebbe spiegare la sensibilità di entrambe le vie di inibizione delle proteasi MALT1. Al contrario, TRAF6 è anche un comune lettore a valle di CLLRs e TLR per induzione di NF-κB, ma queste due vie non sembrano area interattiva in modo MALT1 paracaspase-dipendente in cellule mieloidi.
Questo lavoro incentrato sulla produzione di citochine, che fornisce una lettura facile per vie di segnalazione e può essere implementata facilmente per la profilatura composto. Esso ha evidenziato il valore di inibitori selettivi e potenti di MALT1 per dipanarsi MALT1 biologia. Ottenere ulteriori approfondimenti meccanicistici richiederà ulteriore lavoro e sviluppo di saggi più prossimale, ad esempio, per caratterizzare i substrati di MALT1 coinvolti nella innata regolamento di segnalazione.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla a rivelare.
Acknowledgments
Ringraziamo Elsevier per la loro autorizzazione (numero di licenza 4334770630127) di riprodurre qui Figura 2A da Unterreiner et al. (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



