Summary
ספקטרוסקופיית פאראמגנטיים תהודה (EPR) היא שיטה ברורה וחד משמעית למדוד בחינם רדיקלים. השימוש של הגששים ספין סלקטיבי מאפשר זיהוי של רדיקלים חופשיים בתאים הסלולר שונה. אנו מציגים שיטה מעשית ויעילה, לאסוף דגימות ביולוגיות המסייעים בטיפול, אחסון של העברת דגימות EPR מעבדתיים.
Abstract
זיהוי מדויק וספציפי של מינים חמצן תגובתי (ROS) בתאים הסלולר ורקמות שונים חיוני למחקר של חמצון-חיזור מוסדר איתות בהגדרות ביולוגי. ספקטרוסקופיית פאראמגנטיים תהודה (EPR) היא השיטה רק ישיר כדי להעריך רדיקלים חופשיים חד משמעית. היתרון שלו הוא שהוא מזהה רמות הפיזיולוגיות של מינים ספציפיים עם ירידה לפרטים גבוה, אבל זה דורש טכנולוגיה מיוחדת, הכנת הדוגמא זהיר, ולהבטיח הפקדים המתאימים לפירוש מדויק של הנתונים. Hydroxylamine מחזורית ספין הגששים להגיב באופן סלקטיבי סופראוקסיד או אחרים רדיקלים ליצירת אות nitroxide זה ניתן לכמת על ידי EPR ספקטרוסקופיה. ספין תא חדיר הגששים וזונדים ספין שנועד לצבור במהירות בתוך המיטוכונדריה לאפשר קביעת ריכוז סופראוקסיד בתאים הסלולר שונה.
תאים בתרבית, השימוש הסלולרי חדיר 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) יחד עם וללא תא אטום סופראוקסיד דיסמוטאז (SOD) רעלני או השימוש תא חדיר פג-SOD, מאפשר הבידול של חוץ-תאי של סופראוקסיד cytosolic. 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido מיטוכונדריאלי] piperidinium dichloride (mito-טמפו-H) מאפשר מדידה של ROS מיטוכונדריאלי (בעיקר סופראוקסיד).
ניתן להחיל ספין הגששים וספקטרוסקופיה EPR גם למודלים ויוו . סופראוקסיד יכול להתגלות חוץ-תאית נוזלים כגון דם ונוזלי מכתשי, כמו גם רקמות כגון רקמת הריאה. מספר שיטות מוצגים לעבד, לאחסן רקמות למדידות EPR ולהעביר תוך ורידי 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) ספין המקדח בתוך vivo. בזמן מדידות יכול להתבצע בטמפרטורת החדר, המתקבל במבחנה ויוו דגמים יכול גם להיות מאוחסן ב- 80 ° C ודוגמאות נותחו על ידי EPR-77 K... הדגימות יכול להיות מאוחסנת באורווה צינורות מיוחדים ב-80 מעלות צלזיוס ולהפעיל ב K 77 כדי לאפשר מעשית, יעיל, ושיטה לשחזור מקלה על אחסון, העברת דגימות.
Introduction
בעוד אמצעים של סטרס חמצוני, מינים חמצן תגובתי חשובים בחקר מחלות מגוונות בכל מערכות איברים, הגילוי של מינים חמצן תגובתי (ROS) הוא מאתגר עקב מחצית חיים קצר תגובתיות גבוהה. טכניקת פאראמגנטיים תהודה (EPR) אלקטרון הוא השיטה ברורה וחד משמעית ביותר לגילוי רדיקלים חופשיים. ספין הגששים יש יתרונות על פני הגששים פלורסנט הנפוצות. למרות הגששים פלורסנט הם יחסית זול וקל להשתמש ולספק גילוי מהיר, רגיש של ROS, יש להם מגבלות רציניות בשל אותות מלאכותית, חוסר יכולת לחשב ריכוזים ROS, וחוסר כללי ירידה לפרטים1 .
כדי להקל על השימוש של EPR עבור מחקרים ביולוגיים, מגוון רחב של ספין הגששים היו מסונתז שיכול למדוד מגוון מינים רדיקלים חופשיים ביולוגית רלוונטית וכן פו2, pH וחמצון-חיזור קובע2,3, 4,5,6,7. ספין מלכודות גם פותחו כדי ללכוד רדיקלים קצרת ימים, טופס ארוך-חי adducts, אשר מאפשר זיהוי על ידי EPR8. שני המעמדות (ספין הגששים ומלכודות ספין) יש יתרונות ומגבלות. שיעור נפוץ אחד של הגששים ספין הם hydroxylamines מחזורית, אשר EPR-שקט ו להגיב עם רדיקלים קצרת ימים כדי ליצור nitroxide יציב. Hydroxylamines מחזורית להגיב עם סופראוקסיד 100 פעמים מהר יותר מאשר מלכודות ספין, ומאפשרת להם להתחרות עם נוגדי חמצון הסלולר, אך הם חוסר ירידה לפרטים, דורשים שימוש הפקדים המתאימים, כדי לזהות את המינים רדיקלי או מקור אחראית על האות nitroxide. בעוד ספין מלכודות ירידה לפרטים מוצג עם ברורים ספקטרלי שדפוסי בהתאם המינים לכוד, יש להם קינטיקה איטי סופראוקסיד ספין השמנה, נוטים כילוי של הקיצוני adducts. יישומים עבור ספין השמנה כבר מתועדת היטב המחקר הביו-רפואי9,10,11,12,13.
המטרה של הפרויקט הזה היא להדגים שיטות מעשיות EPR לעיצוב ניסויים, הכנת דוגמאות כדי לזהות סופראוקסיד באמצעות ספין רגשים תאים סלולריים שונים בתוך חוץ גופית , רקמות שונות תאים ויוו. מספר כתבי יד פרסום פרוטוקולים רלוונטיים מטרות אלה, באמצעות ספין יישוב חדיר התא, התא אטום, מיטוכונדריאלי הגששים לרקמות היעד תאים סלולריים שונים במבחנה ואת תהליך לניתוח במודלים של העכבר 14 , 15. אנחנו בונים על הגוף הזה של הספרות על-ידי אימות גישה כדי למדוד סופראוקסיד באמצעות בדיקה ספין (CMH) 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine תאים סלולריים שונים במבחנה כדי להבטיח מדויק מדידות, סימון בעיות פוטנציאליות טכני אשר עשויים להטות את תוצאות. כמו כן, אנו מספקים שיטות לביצוע מדידות EPR ב דם נוזל שטיפה bronchoalveolar, רקמת הריאה באמצעות המכשיר ספין CMH. מחקרים אלה השוואה בין שיטות שונות כדי לעבד את הרקמות, כמו גם להציג שיטה להזריק עוד ספין הגישוש, CPH, לתוך עכברים לפני קצירת רקמות. לבסוף, אנו מפתחים שיטה מעשית כדי לאחסן דגימות אבובים טפלון (PTFE) כדי לאפשר אחסון והעברת דגימות לפני EPR מדידות-77 K...
Subscription Required. Please recommend JoVE to your librarian.
Protocol
מחקרים שנעשו בבעלי חיים כל אושרו על ידי אוניברסיטת קולורדו בדנוור אכפת חיה המוסדית והוועדה שימוש.
1. הכנת נוגדנים
-
Diethylenetriaminepentaacetic חומצה (DTPA) מניות (150 מ"מ)
- להוסיף 2.95 גר' DTPA (393.35 g/mol) עד 10 מ"ל מים יונים.
- כדי להמיס DTPA, להוסיף 1 M NaOH dropwise ולהביא pH של 7.0.
- להביא את אמצעי האחסון 50 מ ל מים עבור ריכוז DTPA הסופי של 150 מ מ, ולאחסן ב 4 º C.
-
פוספט מאגר תמיסת מלח (PBS) (50 מ מ, pH 7.4)
- להכין 5 מ' של נתרן כלורי (NaCl) (g 58.44/mol; 29.22 g/100 מ"ל).
- להכין 1 מ' של אשלגן פוספט dibasic HK2PO4 (g 174.18/mol; 17.42 g/100 מ"ל)
- להכין 1 מ' של אשלגן פוספט monobasic ח'2PO4 (g 136.1/mol; 13.61 g/100 מ"ל). מערבבים 3 מ"ל של 5 M NaCl עם mL 4.24 של 1 מ' אשלגן פוספט dibasic ו- 0.760 מ של 1 מ' אשלגן פוספט monobasic. בדוק את ה-pH.
- להביא את אמצעי האחסון 100 מ ל מים יונים.
- לאחסן בטמפרטורת החדר (RT) לטווח קצר (ימים) ב 4 ° C לאחסון לטווח ארוך (שבועות).
-
מאגר קרבס-Henseleit (KHB) המכיל 100 מיקרומטר DTPA
- 50 מ ל צינור חרוטי צנטריפוגה, להוסיף µL 33.3 בפתרון מניות DTPA 150 מ מ.
- להביא אמצעי אחסון 50 מ עם מאגר קרבס-Henseleit (KHB).
- להכין מאגר טריים עם DTPA בכל יום, לשמור את זה RT.
-
טריס-EDTA מאגר המכיל סוכרוז
- להכין מלאי טריס 0.5 M: להמיס 15.14 גר' טריס בסיס (121.14 g/mol) 150 מ ל מים יונים. באמצעות HCl, להתאים את רמת ה-pH ל 7.8 ולהביא נפח סופי של 250 מ.
- להמיס נמצא 21.4 גר' סוכרוז (g 342.29/mol; ריכוז סופי = 0.25 mM) ב- 150 מ ל מים יונים.
- הוסף 5 מ של מניות טריס סוכרוז להשגת ריכוז טריס הסופי של 10 מ מ.
- להוסיף 0.5 מ"ל של 0.5 M EDTA מניות טריס-סוכרוז להשגת ריכוז סופי של 1 מ מ.
- בדוק את ה-pH ולהתאים אותו כך 7.4.
- להביא נפח סופי של 250 מ ל מים יונים ולאחסן ב 4 º C.
-
שור כדוריות דם אדומות Cu/Zn סופראוקסיד דיסמוטאז (SOD) מניות (30,000 U/mL)
- לשקם U 30,000 של SOD 1 מ"ל ל- PBS (כ 5.7 מ ג, בהתאם לפעילות של SOD הרבה).
- מערבבים היטב, aliquot, ולאחסן ב-20 ° C לטווח קצר (6-12 חודשים) וב-80 מעלות לאחסון לטווח ארוך.
-
הפתרון עובד SOD (1000 U/mL)
- להעביר aliquot 30 µL של 30,000 מניות SOD U/mL µL 870 ל- PBS סטרילי.
- לשמור את הפתרון על קרח, ולהשתמש בו טריים.
-
Phorbol 12-פעילים 13-אצטט (PMA) מניות (5 מ מ)
- להמיס 1 מ ג של PMA (616.83 g/mol) בשנת 325 µL של דימתיל סולפוקסיד (ריכוז סופי = 5 מ מ).
- Aliquot פתרון PMA 5 מ מ ואחסן אותו ב-20 ° C.
-
הפתרון עובד PMA (125 µM)
- לדלל עם aliquot 10 µL מניות PMA 5 מ מ לתוך µL 390 ל- PBS סטרילי.
- לשמור את הפתרון על הקרח ולהשתמש בו טריים.
- עבור פקד הרכב עבור ובחום, להשתמש µL 10 של דימתיל סולפוקסיד ב 390 µL ל- PBS.
-
Diphenyliodonium כלוריד (מח ש) (2.5 mM)
- להמיס 3.2 מ"ג וטבול (316.57 g/mol) 4 מ"ל. להשיג מלאי 2.5 מ מ.
- להכין את הפתרון ולהשתמש בו טריים.
-
דפרוקסמין מסילייט מלח (DFO) (20 מ מ)
- להמיס 4.5 מ"ג של DFO (656.79 g / mol) ב- µL 340 להשיג מלאי 20 מ מ.
- להכין את הפתרון ולהשתמש בו טריים.
-
הכנת antimycin A (AA) מניות (5 מ מ)
- להמיס 5.4 מ ג של. אלכוהוליסטים אנונימיים (g 532/mol) ב 2 מ"ל אתנול (ריכוז סופי = 5 מ מ).
- Aliquot המניות של צלוחיות זכוכית וחנות ב-20 ° C.
-
הכנה של הגששים ספין
- בועה 50 מ מ פוספט מאגר המכיל 100 מיקרומטר DTPA עם חנקן למשך 30 דקות כדי להסיר חמצן מומס מתוך המאגר.
- להסיר את המכשיר ספין מהמקפיא-20 ° C ולאפשר את המיכל לבוא RT (10-15 דקות).
- שוקלים לצאת 2.4 מ ג של 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237.8 g/mol)
- יתמוסס CMH 1 מ"ל המאגר פוספט רווית ריכוז סופי של 10 מ מ.
- שוקלים לצאת 5 מ"ג של 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride (mito-טמפו-H) (529.1 g/mol).
- יתמוסס mito-טמפו-H 1 מ"ל המאגר פוספט רווית ריכוז סופי של 9.5 מ מ.
- שוקלים לצאת 4.9 מ ג של 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223.7 g/mol).
- יתמוסס CPH 1 מ"ל המאגר פוספט רווית ריכוז סופי של 22 מ מ.
- Aliquot וחנות ב-80 מעלות צלזיוס (הפשרת ההקפאה לא מומלץ).
2. זיהוי של סופראוקסיד חוץ גופית בתוך
-
זיהוי של סופראוקסיד הכולל, חוץ-תאית, תאיים בתאים מגורה-PMA 264.7 RAW ב- RT
- בעקבות טכניקה נכונה aseptic, להפשיר תאים RAW 264.7, מעבר להם בתקשורת DMEM בתוספת 10% FBS (נמוך ללא אנדוטוקסין) ו 1% antimycotic/אמפיצילין-37 מעלות צלזיוס ב CO2 מיכלים.
- זרע תאים RAW 264.7-עונה 1 פרק 106 תאים/היטב לתוך צלחות 6-ובכן יום אחד לפני הטיפול.
- בעדינות להסיר מדיה ולשטוף את התאים פעם אחת עם 1 מ"ל KHB המאגר.
- להוסיף KHB המכיל 100 מיקרומטר DTPA כדי מכל קידוח, ולטיפול ב הנפח הכולל של 500 µL בפריטים הבאים:
- עבור בארות pretreated עם מפגר, להוסיף 15 µL/טוב של הפתרון עובד SOD (1000 U/mL; הריכוז הסופי של SOD = 30 U/mL) דגירה 10 דקות ב 37 מעלות צלזיוס לפני תוספת של CMH, ובחום.
- להוסיף µL 12.5/טוב של מניות CMH 10 מ מ (ריכוז סופי = 0.25 מ מ).
- להוסיף µL 40/טוב של הפתרון עובד PMA 125 µM (ריכוז סופי = 10 מיקרומטר) או µL 40 רכב (המניות 10 µL של דימתיל סולפוקסיד ב 390 µL ל- PBS).
- תקופת דגירה של 50 דקות ב- 37 מעלות צלזיוס חממה2 CO.
- הסר את הצלחות של החממה ולמקם אותם מיד על קרח.
- לאסוף מאגר מכל קידוח ב mL 1.5 נפרדים, שכותרתו צינורות. לשמור על הקרח ברחבי.
- להוסיף 100 µL טריים KHB מאגר המכיל 100 מיקרומטר DTPA, בעדינות לגרד את התאים, resuspend על ידי pipetting למעלה ולמטה מספר פעמים. לשמור על הקרח ברחבי תא resuspension.
- טען הדגימה אסף בשלבים 2.1.10 ו 2.1.11 (50 µL) בכל אחד צינורות קפילר. חותם בשני הקצוות ולהפעיל את EPR.
הערה: תמיד לבדוק את צינור או טוב (ללא תאים) המכיל את החללית במאגר (ריכוז זהה = 0.25 מ מ), התייחס תחת באותם התנאים כמו התאים (באותו זמן דגירה וטמפרטורה) כפקד, מאז רקע בעוצמה של המכשיר הוא חום - תלויי-זמן. - קבע את הפרמטרים רכישה EPR לגורמים הבאים: מיקרוגל תדירות = 9.65 ג'יגה-הרץ; מרכז השדה = 3432 G; אפנון משרעת = 2.0 G; לטאטא רוחב = 80 גר'; מיקרוגל כוח = 19.9 mW; המספר הכולל של סריקות = 10; טאטא זמן = 12.11 s; זמן מתמדת = 20.48 ms.
-
זיהוי של סופראוקסיד מיטוכונדריאלי בתאים 264.7 גולמי
- בצע שלבים 2.1.1 ו 2.1.2 לתאי הזרע 264.7 גלם יום אחד לפני הניסוי.
- להסיר מדיה ולשטוף את התאים פעם אחת עם 1 מ"ל KHB המאגר.
- להוסיף 200 µL של KHB המכיל 100 מיקרומטר DTPA כדי מכל קידוח.
- להוסיף 5.3 µL טוב של מניות mito-טמפו-ה 9.5 מ מ (ריכוז סופי = 0.25 מ מ)
- תקופת דגירה של 10 דקות ב- RT.
- להוסיף 1 µL/טוב של antimycin A (AA), 5 מ מ פתרון מניות אתנול (ריכוז סופי = מיקרומטר 25).
- תקופת דגירה של 50 דקות ב- 37 מעלות צלזיוס חממה2 CO.
- הסר את הצלחות של החממה ולמקם אותם מיד על קרח.
- בעדינות לגרד את התאים, resuspend על ידי pipetting למעלה ולמטה. לשמור על הקרח.
- לטעון את הדגימה צינור קפילרי. חותם בשני הקצוות.
- עיין בסעיף הקודם עבור EPR הגדרה.
-
זיהוי של סופראוקסיד בתאים RAW 264.7 ב- 77 K
- מקום המאגר שנאספו בשלב 1.1.10 ב PTFE מוכן מראש צינורות 1-2 ס מ אורך (3 / "16" OD x 1/8 פלייר מזהה). ודא כי הצנרת PTFE הוא ישר אז זה יכול להיות בקלות להוסיף, להסיר את האצבע דיואר. השתמש פקק גומי כדי לסגור את קצה אחד של הצנרת PTFE, pipette את המאגר או תא ההשעיה (100 עד 150 µL) אל הצנרת PTFE, לאטום את הצנרור עם פקק השני.
- פלאש להקפיא את הדגימה של חנקן נוזלי. המדגם יכולים להעביר צינור הקפאה קריוגנית שכותרתו לאחסון ב-80 מעלות צלזיוס או להפעיל באופן מיידי.
- למלא את האצבע דיואר עם חנקן נוזלי, הוסף הצנרור PTFE המכיל את הדגימה לאצבע דיואר. ודא המדגם הוא ממורכז במרחב פעיל של מהוד ולהפעיל EPR-77 K...
הערה: להתחיל את זרימת גז חנקן ספקטרומטר שלך 15-30 דקות לפני המדידות, ולהמשיך לזרימה לאורך כל המדידות כדי למנוע עיבוי מים ב מהוד. - הגדרת פרמטרים לרכישת EPR לגורמים הבאים: מיקרוגל תדירות = 9.65 ג'יגה-הרץ; מרכז השדה = 3438 G; אפנון משרעת = 4.0 G; לטאטא רוחב = 150 גרם; מיקרוגל כוח = 0.316 mW; המספר הכולל של סריקות = 10; טאטא זמן = 60 s; זמן מתמדת = 1.28 ms.
3. EPR מידות נוזלים
-
דם מלא
- פנקו עכברים (בת 8-12 שבועות) עם מנה אחת של bleomycin intratracheal (Bleo; µL 100-1 U/mL) מומס PBS או PBS לבד כמו שתואר לעיל16,17.
- המתת חסד עכברים על ידי מתן בשאיפה איזופלוריין (1.5-4%) ואחריו דימום למוות, נקע בצוואר הרחם. האחות דם דרך החדר הימני לתוך מזרק מצופה עם הפרין (1000 USP/mL) המכילה 100 מיקרומטר DTPA, העברת צינור 1.5 מ.
- בשפופרת mL 1.5 נפרדים, להוסיף µL 15 ל- PBS המכיל 100 מיקרומטר DTPA, µL 3 של CMH (10 מ מ) כדי µL 132 דם עבור הנפח הכולל של 150 µL וריכוז CMH הסופי של 0.2 מ מ.
- דגירה דם למשך 10 דקות ב 37 מעלות צלזיוס בתוך אמבט מים.
- הסר את הצינורות המים הרותחים.
- לקחת את aliquot על-ידי טעינת דם צינור קפילרי ולהפעיל EPR ב RT עם הפרמטרים הבאים של רכישת EPR: מיקרוגל תדירות = 9.65 ג'יגה-הרץ; מרכז השדה = 3432 G; אפנון משרעת = 1.0 G; לטאטא רוחב = 80 גר'; מיקרוגל כוח = 19.9 mW; המספר הכולל של סריקות = 3; טאטא זמן = 12.11 s; זמן מתמדת = גב' 20.48. לחלופין, דגימות יכול להיות הוקפא במהירות כשלב שמתואר 2.3 עבור מדידות-77 ק' EPR רכישה הפרמטרים הם הבאים: מיקרוגל תדירות = 9.65 ג'יגה-הרץ; מרכז השדה = 3438 G; אפנון משרעת = 4.0 G; לטאטא רוחב = 150 גרם; מיקרוגל כוח = 0.316 mW; המספר הכולל של סריקות = 2; טאטא זמן = 60 s; זמן מתמדת = 1.28 ms.
-
נוזל שטיפה Bronchoalveolar (BALF)
- לאחר המתת חסד (ראה שלב 3.1.2), לאסוף BALF על ידי לאט הקניית פורש 1 מ"ל של PBS המכיל 100 מיקרומטר DTPA שלוש פעמים ב מזרק דרך בצינורית להציב קנה הנשימה.
- צינור 1.5 mL, לפנק µL 200 של BALF עם 4 µL של CMH (10 מ מ) בריכוז הסופי של 0.2 מ מ.
- תקופת דגירה BALF של 50 דקות ב 37 מעלות צלזיוס בתוך אמבט מים.
- לקחת את צינורות מהאמבטיה מים ומניחים אותם על קרח.
- עומס BALF צינור קפילרי ו EPR לרוץ ב RT עם EPR באותן ההגדרות כמו בשימוש צעד 1.1.13, או פלאש להקפיא במצב חנקן נוזלי כפי שמתואר בשלב 2.3.
-
מידות EPR דם, BALF-77 K
- לפי התקנון הנ ל כדי לאסוף דם (צעדים 3.1.1. כדי 3.1.4) ו BALF (שלבים 3.2.1 כדי 3.2.4).
- במקום 150 µL של דם המטופל או BALF ב PTFE אבובים (ב 1-2). השתמש פקק גומי לסגירת קצה אחד של הצנרת PTFE לפני הוספת המדגם ו עוד פקק כדי לאטום את הצנרור.
- פלאש להקפיא את הדגימה של חנקן נוזלי.
- עיין בסעיף 2.3 בהרצה EPR בדגימות קפוא באבובים PTFE באמצעות האצבע שדיואר-ק' 77 בניהול קפוא CMH מטופלים דגימות דם עם תוך שבוע.
4. EPR המידות רקמת הריאה
-
פלאש רקמת הריאה קפוא
- לאחר איסוף של BALF בשלב 3.2.1, פתיחת בית החזה, הריאות סמוקות עם 10 מ"ל של קר PBS דרך החדר הימני כדי להסיר דם. פלאש הקפאת רקמת הריאה בחנקן נוזלי. ניתן לאחסן רקמת הריאה קפוא ב-80 מעלות צלזיוס עד 6 חודשים עד השימוש EPR מעבדתיים.
- לייצב את רקמת הריאה בקרח יבש עם פינצטה וחותכים מספר חתיכות קטנות (5-15 מ ג) של רקמת הריאה באמצעות סכין קצה חד.
- שוקל את רקמת צינור 1.5 mL, למקם את הצינורית על הסולם להקרע הסקאלה, ולאחר מכן להוסיף את חתיכות רקמה, רושמות את המשקל.
- לרקמת בצינור 1.5 mL, להוסיף µL 196 של KHB המכילה DTPA, µL 4 של CMH (0.2 מ מ) כדי להשיג את הנפח הכולל 200 µL.
- תקופת דגירה של h 1 ב 37 מעלות צלזיוס בתוך אמבט מים.
- ספין למטה (למשך כמה שניות) ב- microcentrifuge ב 3,884 x g.
- מניחים על הקרח פיפטה µL 150 של תגובת שיקוע לתוך הצנרת PTFE, ומקפיאים המידות 77 K כמתואר בסעיף 2.3.
הערה: עבור שיטה זו, הטרוגניות של הפגיעה צריך להיחשב. עבור פגיעת ריאות הנגרמת bleomycin, בהתחשב בעובדה שעברו פציעה הטרוגנית מאוד, מומלץ לחתוך כמה חתיכות רקמה מחלקים שונים של הריאות של כל עכבר. לחלופין, חתיכה גדולה של רקמות יכול להיות הומוגני KHB מאגר המכיל 100 מיקרומטר DTPA-יחס משקל-כדי-כרך 1:6 (מ ג/µL) כפי שמתואר להלן.
-
רקמת הריאה טריים נשמר במאגר סוכרוז
- ריקון הריאות lavaged עם PBS קר ולהסיר את הדם כפי שנעשה צעד 3.1.2.
- Homogenize רקמת הריאה טריים טריס-EDTA מאגר המכיל 0.25 M סוכרוז עם יחס 1:6 מאגר/ריאות (mg/µL) באמצעות דאונס רקמות מטחנה עם זכוכית או PTFE המרוסקים.
- להוסיף 50 µL של homogenate הריאה µL 450 של KHB המכיל 100 מיקרומטר DTPA.
- ב- 1.5 mL צינור (הנפח הכולל של 100 µL), כדי µL 98 של homogenate ריאות ב- KHB, להוסיף 2 µL של CMH של 10 מ מ מניות הסופי בריכוז של 0.2 מ מ.
- תקופת דגירה של 20 דקות 37 מעלות צלזיוס בתוך אמבט מים.
- למקם את הדגימות הקרח ולהעמיס על צינור קפילרי. הפעל EPR ב RT (הגדרות בשימוש בשלב 2.1.13).
- כדי לבדוק את התרומה של מינים ספציפיים ומקורות בעזרת מעכבי שונים, מראש לטיפול µL 88 של הריאות homogenate + /-מעכב, התאמה באמצעות KHB כדי להשיג נפח סופי של 98 µL. בניסוי זה, כללו מעכבי µL 10 מקומות (100 U/mL), 4 µL של דפרוקסמין (DFO; הריכוז הסופי = 800 מיקרומטר), או µL 4 של diphenyliodonium כלוריד (DIP; הריכוז הסופי = 100 מיקרומטר). תקופת דגירה של 20 דקות ב 37 מעלות צלזיוס בתוך אמבט מים.
- להוסיף 2 µL של CMH, תקופת דגירה של עוד 20 דקות ב 37 מעלות צלזיוס, ואחריו EPR מדידות כמתואר לעיל. כוללים מדגם ריק בהתאמה חד פעמי עם KHB CMH המכיל מאגר סוכרוז. לחלופין, חנות aliquots של homogenates הריאה הנותרת (שלב 3.1.2) ב-80 מעלות צלזיוס למדידות בעתיד.
הערה: הנפח הכולל וניתן לשנותם לפי הצורך.
-
המידות EPR רקמת הריאה של עכברים מוזרק עם ספין הגששים ויוו (ב RT באמצעות רקמות תאים)
- להכין פתרון מניות CPH על ידי המסת 4.9 מ ג של CPH ב 1 מ"ל מאגר פוספט מסוננות ולא רווית 50 מ מ.
- עזים ומתנגד עכברים עם בשאיפה איזופלוריין (1.5-4%) למשך 20-30 שניות עד להגיב טו צביטה. מזריקים עכברים דרך כביש retroorbital 100 µL של רגש ספין CPH משקל הגוף העכבר 25 גרם (מנה הסופי = 20 מ"ג/ק"ג), ולאפשר החללית הפיצו עבור ה 1 מיד לאחר הזרקת retroorbital, להוסיף טיפה אחת של 0.5% proparacaine HCl על אזור העין למנוע nt העין כאבים ויובש. לפקח על עכברים עבור 1 h והמשך קצירת רקמות.
- הקציר רקמת הריאה, כמתואר לעיל, פלאש להקפיא את הריאות.
- 20-30 מ"ג של רקמות קפוא בקרח יבש גזורה רושמות את משקל מדויק.
- נגב בעדינות את הרקמה עם ניקוי מגבונים לספוג מים עיליים.
- מקם את הרקמה בתוך החלון של התא רקמות (אביזר מאפשר EPR מידות עבור דגימות רקמה) ולהפעיל EPR כדי לקבוע את סך ספינים. הנתונים ניתן לבטא ספינים הכולל לכל מ"ג של רקמות.
5. ניתוח נתונים
- לדמות ספקטרום EPR שימוש במודול SpinFit שולבו התוכנה קסנון של ספקטרומטר EMXnano EPR הספסל-העליון. לקבוע את הריכוז nitroxide על ידי מודול SpinCount. לחלופין, עקומת כיול של nitroxide יציב כגון 4-הידרוקסי-טמפו או TEMPOL יכול להתבצע, הריכוז יכולה להיות מושגת על-ידי השוואת את עוצמת האות עם דוגמה, תקן.
- לשימוש הנתונים שנאספו ב 77 K, שילוב זוגי ואחריו SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
איתור סופראוקסיד CMH אומתה באמצעות ה-X / הקמב ץ סופראוקסיד יצירת מערכת כדי להדגים כי האות nitroxide (ס. מ..) היה מלא מעוכבים על ידי SOD, בעוד קטלאז היו אין השפעה (איור 1 א'). סופראוקסיד סה כ, חוץ-תאית הוערך אז בתאים 264.7 גלם על ידי תאים ומוכנסות עם החללית ספין CMH תא חדיר + /-SOD רעלני. Nitroxide הריכוז נמדד תא ההשעיה והן מאגר, אשר הראו כי הערכים של שני הסוגים לדוגמה היו דומים בשל equilibration מהירה של המכשיר ספין (איור 1B) והטבע חדיר. האות הרדיקלי nitroxide גדל בתאים RAW 264.7, מגורה עם PMA בהשוואה לתאי הבקרה. האות הזה היה משמעותי הקלוש בתאים מיוחדים עם תא-אטום SOD (איור 1C). כל צבע מייצג בארות נבדק בימים שונים, מפגין מרקם של נתונים שנאספו בימים ספציפיים, הפארמצבטית של התוצאות לאורך זמן. הריכוז של סופראוקסיד חוץ-תאית נקבע על-ידי חיסור האות בתאים PMA pretreated עם השתילות האות לאחר PMA בהיעדרו של SOD (T). האות הנותרים יוחס תאיים סופראוקסיד (איור 1C). איור 1D ממחיש את החישוב של סופראוקסיד הכולל, חוץ-תאית. (ה) אותות תאיים אושר בתאים שטופלו PMA לאחר הסרת המדיה ועל ידי ההשפעה של פג-SOD על האות. בגרף זה, בניגוד (ג), הריק CMH היה לא המופחת המדידות, מוצגים הנתונים הגולמיים.
סופראוקסיד מיטוכונדריאלי בתאים 264.7 גלם זוהה באמצעות את EPR ספין בדיקה mito-טמפו-H, אשר צוברת ב- mitochondia. (א) נציג EPR spectra עבור האות mito-טמפו-H בסיסית מאגר, האות mito-טמפו-H מוגברת בתאי שליטה (Con), ואת האות משופרת עוד יותר בתאים מגורה עם החומר המדכא מיטוכונדריאלי Antimycin A (AA). הגדלת האות היה לייחס את סופראוקסיד מיטוכונדריאלי בהתבסס על המחקר הקודם שלנו מציג את ביטוי SOD2 מדידות נחלש באופן משמעותי עם mito-טמפו-H10. ב. איור 2B, ריכוז nitroxide מיטוכונדריאלי נקבע על-ידי חיסור האות mito-טמפו-H במאגר מתאימים-זמן מן המדידות תא. האות ס. מ.. שהושג בטמפרטורות נמוכות בתאים RAW 264.7 לאחר גירוי עם PMA נוכחות, היעדר SOD. (איור 3 א) האות ס. מ.. היה הקלוש בנוכחות SOD, בקנה אחד עם הנתונים בטמפרטורת החדר (איור 1). איור 3B מראה הצילום של PTFE אבובים עם פקקים המשמש לאיסוף נתונים ב- 77 K עבור תאים ודוגמאות ויוו . סופראוקסיד ייצור זוהה BALF באמצעות המכשיר ספין CMH ודם. דגימות דם או BALF היו שנאספו PBS ו Bleo-מטופלים עכברים, מתפשט מיד עם CMH. הדגימות הועברו PTFE אבובים ופלאש קפוא, EPR הנתונים נאספו ב 77 ק... הריכוז של nitroxide (ס.) שהצטברו בדם מודגרות עם CMH (0.2 מ מ)-37 מעלות למשך 10 דקות (איור 4A). Nitroxide (ס.) ריכוז של BALF הדגירה למשך 50 דקות (איור 4B). ריכוז Nitroxide מייצג את הריכוז (.ס מ) שנצבר נפח הדם או BALF המשמשים הניסוי.
שלוש שיטות נבדקו כדי להעריך את מספר טכניקות שפורסמו לשימור רקמות, מנהלה של ספין רגשים ex-vivo vs. ויוו. כדי לבצע מדידות EPR על רקמת הריאה, אנו קודם בשימוש רקמת הריאה קפוא פלאש של פקד או נפגע עכברים. איור 5A מציגה את האות ס. מ.. הכולל תגובת שיקוע של חתיכה קטנה של רקמת הריאה מודגרות ב 37 ° C עם CMH ב- PBS ו Bleo-מטופלים עכברים, בהתאמה. בשל הטרוגניות של הפגיעה ריאות לאחר טיפול Bleo, מומלץ לחתוך חתיכות מאזורים שונים של הריאה, ממוצע מספר מדידות כדי לספק ערך יותר ייצוגית. לחלופין, אחד יכול homogenize הריאה כולה, השתמשו בדוגמה אחת של homogenate הזה. הנתונים הנאספים K 77 באמצעות צינורות PTFE, אצבע דיואר. איור 5B מציג ספקטרה נציג של nitroxide (ס. מ..) אותות PBS ו Bleo-מטופלים עכברים, בהתאמה.
מגבלה אחת בטיפול הריאות לרקמות שמחוץ היא שזה לא אפשרי להבחין בצורה אמינה חוץ-תאי של סופראוקסיד תאיים בשל העיבוד של הרקמה את זה. משבש את קרום התא. אם המידע הזה חשוב לשאלה ניסיוני, זה ניתן לטפל באמצעות ויוו CPH החדרה בשיטה המתוארת להלן. רקמות קפוא לא ניתן להשתמש כדי להעריך סופראוקסיד מיטוכונדריאלי; אבל עבור יחידת מידה זו, הפרוטוקול ניתן להתאים לשימוש mito-טמפו-H רקמות או המיטוכונדריה טרי מבודד.
כשיטה השני למדידות EPR ברקמת הריאה, רקמות טרי היה הומוגני במאגר סוכרוז. Homogenate הריאות, נדגרה עם CMH בדיקה במאגר KHB המכיל DTPA. EPR מדידות בוצעו בחוץ RT. 6A איור מדגים עליית ס. עם Bleo. הצגנו נוספים בדיקות בעזרת מעכבי שונים יכול לשמש כדי לקבוע את המין שתורמים ס. האות. להבהיר את מקור האות ס. מ.. שנוצר מתוך רקמת הריאה, אנחנו pretreated את homogenates ריאות עם מספר אוכלי נבלות, מעכבי אנזימים. Homogenates ריאות היו מודגרות עם CMH העדר או הנוכחות של כלוריד SOD דפרוקסמין (DFO), diphenyliodonium (מח ש) להביא בחשבון (בהתאמה) התרומה סופראוקסיד, ברזל או סופראוקסיד שנוצר מן המכילות פלווין אנזימים (איור 6B). גישה זו יכולה להיות מותאם כדי להעריך את המין קיצוני מסוים שנוצר במערכת או להבהיר את התרומה של מקורות אנזימטי אחרים (למשל., NOX, אנוס או xanthine אוקסידאז).
עכברים הוזרקו CPH ספין רגשים (20 מ"ג/ק"ג) דרך המסלול retroorbital כדי לבצע מדידות EPR בתוך vivo. זה לא ידוע אם CMH יכול בבטחה להינתן לבעלי חיים, בעוד החללית CPH דווחה יהיה רעיל; לכן, בחרנו CPH לניסויים ויוו . רקמות הריאה היו שנקטפו פלאש קפוא חנקן נוזלי 1 h לאחר מחזור CPH הגששים. עכברים יכולים להיות מטופלים בו זמנית עם נוגדי חמצון ספציפיים כדי להבדיל בין המינים אחראי על האות. איור 7 א מראה המוצב גבוה יותר. אות בעכברים שטופלו Bleo לעומת בקרת עכברים. ספקטרה נציג של רקמת הריאה לבין שליטה עכברים שטופלו Bleo מוצגים באיור 7. ספקטרום EPR מעורבות של CP. חומצה אסקורבית רדיקלי נצפתה. הערכים דיווחו איור 7 א הם הריכוזים של CP. רכיבים. הנתונים נאספו ב RT שימוש בתא רקמות.
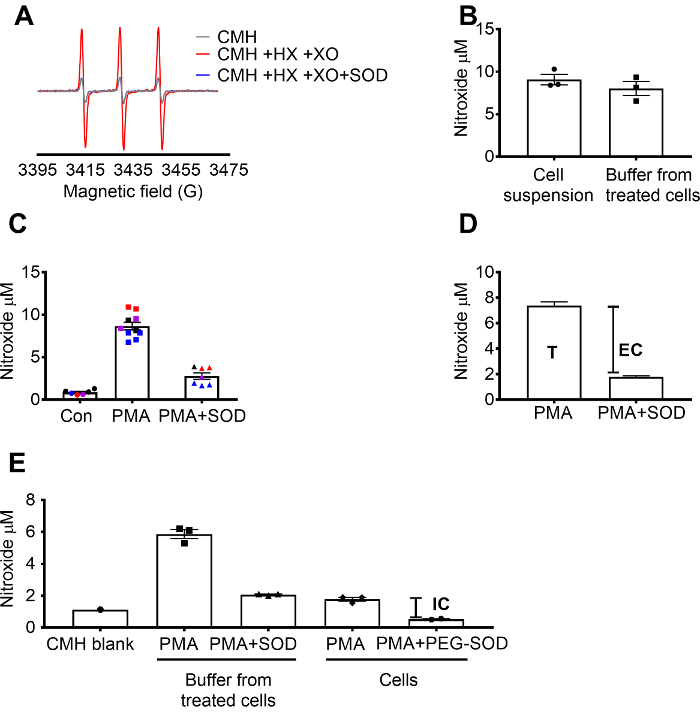
איור 1: זיהוי של סופראוקסיד בתאים שונים תא. (א) ספקטרה EPR שנוצר על ידי 0.25 מ מ CMH 0.5 מ מ hypoxanthine/xanthine אוקסידאז (מו 8/mL) עם או בלי SOD (30 U/mL). (ב) גלם 264.7 תאים (1 x 106 תאים/טוב) היו מגורה עם 10 מיקרומטר PMA בנוכחות CMH עבור 50 min-ריכוז 37 ° C ו- nitroxide (מיקרומטר) זוהה תא ההשעיה (תאים + מאגר) ומאגר שנאסף תאים שטופלו. תאים 264.7 (ג) גלם היו מגורה עם PMA vs. בקרת הרכב (קון). סט אחד של תאים היו pretreated 10 דקות עם 30 U/mL תא אטום SOD (PMA + SOD). כל צבע מייצג נתונים שונים ימים ניסיוני ומייצג בכל נקודה תאים מאדם בודד היטב. האות nitroxide על ריק מתאימים-הזמן עם CMH ב- KHB היה המופחת כל אות כדי להשיג את הערכים הסופיים. (ד) חישוב של סופראוקסיד הכולל, חוץ-תאית ב- PMA גירוי תאים; T = סה כ סופראוקסיד, EC = חוץ-תאית סופראוקסיד (SOD אות inhibitable). (ה) כדי להעריך את האות סופראוקסיד תאיים (IC), האות במאגר לאחר PMA + SOD היה לעומת תאים שטופלו PMA לאחר הסרת מאגר. כדי לאשר, וולס היו מיוחדים עם 60 U/mL תא חדיר פג-SOD 1.5 שעות כדי לקבוע את השתילות תאיים inhibitable. הריק CMH מתאימים-הזמן מוצג, הנתונים משקפים אות nitroxide מוחלטת. נתונים לבטא זאת אומרת ± ב- SEM אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: זיהוי של סופראוקסיד מיטוכונדריאלי בתאים RAW מגורה עם antimycin א (א) ספקטרום נציג של ספין EPR מיטוכונדריאלי ספציפיים של בדיקה, 0.25 mM mito-טמפו-H בתאים 264.7 גלם מבלי (קון) או עם antimycin מיקרומטר 25 א (AA) למשך 50 דקות ב 37 º C. (ב) ריכוז. ס מ (מיקרומטר) תאים שטופלו AA לעומת שליטה. האות nitroxide על ריק mito-טמפו-H מתאימים-זמן היה מהמספר הכולל אות כדי להשיג את הערכים הסופיים. נתונים לבטא זאת אומרת ± ב- SEM אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: זיהוי של סופראוקסיד ב RAW 264.7 תאים ב- 77K. (א) RAW מגורה עם 10 מיקרומטר PMA ו EPR ספין הגישוש, CMH 0.25 מ מ (50 דקות ב 37 ° C) עם (שחור) 264.7 תאים או בלי רעלני (אדום) עם 30 U/mL SOD. µL 100 של תגובת שיקוע נטען ב 1 אינץ בחתיכה אורך של אבובים PTFE, ולאחר מכן פלאש קפוא חנקן נוזלי. פקקים הוסרו, אבובים PTFE קפוא הונח באצבע דיואר עבור רכישת נתונים ב- 77 ק' (B) A צילום של אבובים PTFE, פקקים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: מידות EPR דם, BALF של שליטה ועכברים שטופלו bleomycin. עכברים שטופלו מנה אחת של bleomycin intratracheal (זה Bleo) (100 µL-1 U/mL) או רכב PBS. ב 7 ימים, עכברים היו מרדימים, מורדמים. . הדם היה שנאספו באמצעות ניקוב חדרית ישר לתוך מזרק מצופה 1000 הפארין USP/mL המכיל 100 מיקרומטר DTPA. נוזל שטיפה Bronchoalveolar (BALF) נאסף ע י lavaging הריאות עם 1 מ"ל של 100 מיקרומטר DTPA ב- PBS. דם, BALF היו הדגירה למשך 10 או 50 דקות, בהתאמה, עם 0.2 מ מ CMH ב 37 º C. µL 150 של דם או BALF נטען ב- flash אבובים PTFE קפוא חנקן נוזלי ונתונים EPR שייאסף K 77 באמצעות אצבע דיואר. נתונים הצג ריכוזי nitroxide דם (א) ו- (ב) BALF של PBS ו Bleo-מטופלים עכברים (n = 4-6). נתונים הביע אומר ± ספקטרום ב- SEM. (ג) נציג של nitroxide בדם של PBS ו Bleo-מטופלים עכברים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5: מידות EPR רקמת הריאה קפוא פלאש- עכברים שטופלו מנה אחת של bleomycin intratracheal (זה bleo) (100 µL-1 U/mL) או רכב PBS. ב 7 ימים, הריאות היו סמוקות עם PBS קר כדי להסיר דם ו- flash קפוא חנקן נוזלי. 5-15 מ ג של רקמת הריאה קפואה היה מתפשט עם 0.2 מ"מ CMH ב- KHB המכיל 100 מיקרומטר ב 200 µL של הנפח הכולל עבור h 1 ° 37 ג. תגובת שיקוע היה אסף והושמו PTFE אבובים ולרוץ K 77 באצבע דיואר. (א) ריכוז Nitroxide (מיקרומטר של nitroxide מנורמל 1 מ ג של רקמות). נתונים מייצגים את הממוצע של 2-3 מידות עבור כל ריאה. נתונים המבוטא מתכוון ± ב- SEM (B) ספקטרום נציג של nitroxide ברקמת הריאה של PBS ו Bleo-מטופלים עכברים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 6: מידות EPR רקמת הריאה נשמר במאגר סוכרוז. עכברים שטופלו מנה אחת של bleomycin intratracheal (100 µL-1 U/mL). ב 7 ימים שלאחר הטיפול, הריאות היו סמוקות עם PBS קר כדי להסיר דם, רקמת הריאה טרי היה הומוגני טריס-EDTA מאגר המכיל סוכרוז 0.25 mM ביחס 1:6 ריאות מאגר/משקל נפח (mg/µL). µL 50 של הריאות homogenate היה preincubated עם KHB עם או בלי את מעכבי הבאים עבור 20 דקות ב- 37 ° c: SOD (100 U/mL), דפרוקסמין (DFO; 800 מיקרומטר), diphenyliodonium כלוריד (DIP; 100 μM) ואחריו הדגירה עם 0.2 מ"מ CMH ב- KHB המכיל 100 מיקרומטר DTPA עבור 20 דקות ב 37 º C. נתונים הושג ב RT באמצעות צינורות קפילר EPR. (א) Nitroxide ריכוז בריאות של PBS ו Bleo-מטופלים עכברים. (ב) Nitroxide ריכוז Bleo בריאות העדר או הנוכחות של מעכבי (n = 3). נתונים לבטא זאת אומרת ± ב- SEM אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 7: מידות EPR רקמת הריאה של עכברים הזריק CPH ספין בדיקה. µL 100 של CPH היה מנוהל באמצעות retroorbital זריקה עבור ריכוז סופי של 20 מ ג של CPH לכל ק ג משקל גוף. לאחר h 1 מחזור, עכברים היו מורדמים, הריאות היו סמוקות עם 10 מ"ל של קר PBS דרך החדר הימני, רקמת הריאה היה הוקפא במהירות. 20-30 מ"ג של רקמת הריאה הושם בתא רקמות, מדידות EPR בנטילת RT. (א) נתונים המבוטא ספינים / מ ג. ספקטרום (ב) נציג של nitroxide אות ברקמות הריאה PBS ו- Bleo (* מציין את החפיפה עם חומצה אסקורבית רדיקלי). נתונים לבטא זאת אומרת ± ב- SEM אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| מעכבי | מינים |
| סופראוקסיד דיסמוטאז (SOD) | סופראוקסיד חוץ-תאית |
| סופראוקסיד דיסמוטאז – פוליאתילן גליקול (PEG-SOD) | סופראוקסיד תאיים |
| קטלאז | מימן על-חמצני לפי רדיקלים |
| Urate | Peroxynitrate |
| אתנול וביו -דימתיל סולפוקסיד | רדיקלי הידרוקסיל |
| Chelators מתכת | יונים מתכתיים (ברזל ונחושת) |
טבלה 1. מעכבי נפוץ המשמש להבחנה מינים אחראי ספין בדיקה חמצון.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
הערכת ייצור רדיקלים חופשיים בהגדרות ביולוגי חשוב להבין חמצון-חיזור מוסדר איתות על בריאות ומחלה, אבל המדד של המינים הללו הוא מאוד מאתגר בשל זמן מחצית החיים הקצר של רדיקלים חופשיים מינים וטכני מגבלות עם השיטות הנפוצות. EPR הוא כלי חשוב ורב עוצמה בביולוגיה חמצון-חיזור, כמו גם את שיטת ברורה וחד משמעית רק לגילוי רדיקלים חופשיים. בפרויקט זה, נדגים שיטות EPR מעשי בעיצוב ניסויים, הכנת דוגמאות כדי לזהות ROS באמצעות ספין רגשים תאים סלולריים שונים במבחנה , תאי רקמות שונות ויוו. כמו כן, אנו מספקים שיטות מעשיות להתמודד עם דגימות ביולוגיות ולאחסן דוגמאות כדי לשפר את היעילות.
ספין הגששים להגיב ביעילות עם ROS ומפיקים הרדיקלי nitroxide יציב שניתן לאתר עם EPR. יש כבר מסונתז נגזרים מספר של המכשיר ספין (hydroxylamine מחזורית) עם מאפיינים שונים פרמאביליות, מה שהופך אותם מתאימים לגילוי ייצור רדיקלים חופשיים תאים סלולריים שונים10. פרוטוקול זה מנוצל החללית ספין תא-חדיר, CMH; למרות זאת, כלוריד 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium בדיקה HCl (CAT1H) ספין אטום יכול לשמש כדי לזהות סופראוקסיד חוץ-תאית. בדומה המחקר שלנו מוקדמת lymphoblast האנושי תא קווים18, הצלחנו לאמת את השימוש של המכשיר ספין CMH חדיר עם השתילות אטום וסלולרי חדיר פג-SOD בתאי RAW264.7 (העכבר ריאות macrophage התא קו) מגורה עם PMA כדי להבדיל בין חוץ-תאית, תאיים סופראוקסיד.
אנחנו גם לאמת את equilibration המהירה של CMH בין אינטרה - ו תוספת - cellular התאים, מצאנו גם האות סופראוקסיד ב תאים טיפות באופן משמעותי אחרי שטיפת התאים רק פעם אחת עם KHB (נתונים לא מוצג). אישרנו זאת התועלת ספין ספציפי מיטוכונדריאלי בדיקה mito-טמפו-H בתאים 264.7 גלם כדי למדוד את סופראוקסיד מיטוכונדריאלי מוגברת שנוצר על גירוי עם תחבורה אלקטרון מיטוכונדריאלי שרשרת מעכב antimycin א התרומה ספציפי של ייצור סופראוקסיד מיטוכונדריאלי mito-טמפו-ה כבר הוכיחה בעבר, הניתנים לאימות בניסויים באמצעות מבודד המיטוכונדריה טריים או מערכות עם מיטוכונדריאלי סופראוקסיד דיסמוטאז MnSOD (SOD2) ביטוי10.
ההערכה של ROS ייצור ויוו מאתגר במיוחד, אבל היכולת לזהות הייצור של ROS ספציפי מספק מידע חשוב כאשר חוקר את התפקיד של סטרס חמצוני או חמצון-חיזור מוסדר איתות בביולוגית הגדרות. הטיפול של רקמות בעת שימוש ספין רגשים, EPR הוא חיוני כדי להפיק תוצאות משמעותיות הדירים. השימוש של הגששים ספין עם רקמות יהיה לא מידה סביר סופראוקסיד רדיקלים בהווה בזמנו של קצירת רקמות עקב מחצית חיים קצרה, אבל במקום זאת הוא מזהה סופראוקסיד המיוצר על ידי אנזימים כמו NAPDH אוקסידאז, תחמוצת החנקן אנדותל חשיפות סינתאז , או אוקסידאז xanthine כאשר רקמת הריאה או homogenates מודגרת עם החללית ספין-37 מעלות צלזיוס. השימוש של רקמות קפוא לא יכללו סופראוקסיד שנוצר על ידי המיטוכונדריה, מאז מקפיא נזקים תחבורה אלקטרון מיטוכונדריאלי שרשרת פעילות. כדי לבדוק סופראוקסיד מיטוכונדריאלי, חוקרים צריך ולבודד המיטוכונדריה טריים או שימוש הגששים ספציפי מיטוכונדריאלי ויוו או ברקמת טריים.
מספר פרוטוקולים שונים כדי לשמר את רקמת פורסמו בספרות14,15. השווינו שלוש שיטות שפורסמו למדידות EPR ברקמת הריאה: 1) פלאש קפוא הרקמה בחנקן נוזלי, 2) homogenizing רקמות במאגר סוכרוז ו- 3) לטיפול עכברים ויוו עם ספין בדיקה שעה אחת לפני קצירת רקמות. אנחנו לעומת בקרת עכברים לעכברים עם דלקת ריאות חמורה סטרס חמצוני שנגזרות bleomycin כדי לבחון את היכולת של כל שיטת להראות הבדלים עקביים אותות nitroxide בריאות הפצועים. שלוש השיטות הראו עלייה יחסית דומה nitroxide אות של הריאות של מטופלים bleomycin עכברים. השימוש של רקמות קפוא פלאש כנראה תהיה הגישה הקלה ביותר לאיסוף רקמות עבור רוב מעבדות, שלילת הצורך לעבד רקמות במאגר של סוכרוז בזמנו של קציר. ההזרקה של CPH ללכוד רדיקלים חופשיים ויוו חזקה, אבל כדי לאשר את המין הספציפי, זה דורש קבוצת הטיפול כולל נוגד חמצון המתאים.
אתגר אחד של שימוש הגששים ספין היא כי החמצון של הגששים ספין כדי nitroxide מייצר מגוון EPR שלוש שורות דומה בין המינים אחראי החמצון; לפיכך, הוא אינו מבחין בין מינים שונים של ROS. כמו כן, דווח כי ישנן תגובות אפשריות של הגששים hydroxylamine עם תחבורה אלקטרון פוטוסינתטיים שרשרת, ציטוכרום c אוקסידאז19,20. תצפיות אלה יש לשקול בעת פירוש תוצאות. ב פרוטוקול זה, המערכת פוטוסינתטיים אינו נוכח, הכללת DTPA עם המאגר מעכב זיהום פוטנציאליים של יונים חופשיים ferric, cuprous10 . להדגים כיצד להשתמש סדרה של אנזימים מסוימים או chelators ברקמת הריאה כדי לקבוע את התרומה של ROS מסוים או מעכבי אנזימים כדי לקבוע את מקור ROS. בגישה זו נעשה שימוש בעבר כדי לקבוע את התרומה של ROS עקב חשיפות אנוס13,15עם EPR. אנו מספקים רשימה של מעכבי נפוץ המשמש להבחנה מינים אחראי ספין בדיקה חמצון (טבלה 1).
גם להדגים את החשיבות של אופטימיזציה של זמן הדגירה עבור כל תנאי הניסוי. בעת השוואת ספין probes לסובב מלכודות, ספין מלכודות ליצור ספקטרום ייחודי בהתאם מגיבים המאפשר ירידה לפרטים של רדיקלים חופשיים המינים; עם זאת, הם גם התערוכה קינטיקה איטי עבור סופראוקסיד ספין השמנה, נוטים כילוי. הטיפול של רקמת הריאה עם EPR בדיקה שמחוץ גם מוגבל על ידי חוסר יכולת להבחין שלמאחה חוץ-תאי של סופראוקסיד תאיים עקב שיבוש קרום התא במהלך העיבוד של הרקמה (קפוא או homogenizing). השימוש של ה ספין מוזרק בדיקה ויוו בשיתוף עם השתילות או תא-חדיר פג-SOD יכול לפתור בעיה זו.
מטרה אחת היה להקים פרוטוקול ביעילות לאסוף דגימות ולאחסן אותם ב-80 מעלות צלזיוס לפני EPR מדידות. לכן פיתחנו שיטה מעשית לשימוש PTFE אבובים מחזיק את הדגימות. אבובים הזה ימוקם ישירות האצבע דיואר לניתוח EPR-77 K ללא צורך לנקות את דיואר בין הדגימות. זה אלטרנטיבה לשיטת שפורסמו לאחרונה מעורבים על הקפאת דגימות במזרקים 1 מ"ל. ניתן לחזור על המדידות בדגימות קפוא המאוחסן PTFE אבובים על פני מספר ימים להפגין יציבות של האות. גישה זו מאפשרת batching המדידות EPR ואסטמה ומקילה על העברת הדגימות בין מעבדות כדי מתקן EPR מרוחק להריץ דגימות.
בסך הכל, פרוטוקולים אלה מספקים גישה ישירה כדי הכנת תאים ורקמות למדידות EPR מערכות ביולוגיות. הפרוטוקולים ניתן להתאים דגמים אחרים הקשורים עם סטרס חמצוני, עם השימוש של הגששים ספין אחרים. התזמון ואת ריכוז של המכשיר ספין יהיה עליך לכוונן את כל תנאי הניסוי. היכולת של EPR כדי לקבוע את הנוכחות ואת ייצור של רדיקלים חופשיים מינים חד משמעית מספק הקשיחות גישות ניסיוני בתחום הביולוגיה חמצון-חיזור.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים אין לחשוף.
Acknowledgments
עבודה זו נתמכה על ידי בית הספר באוניברסיטת קולורדו של רפואה דין פרס תשתיות מחקר אסטרטגי, R01 HL086680-09, 1R35HL139726-01, כדי E.N.G. ו- UCD CFReT מלגת פרס (הוא). המחברים תודה ד ר סנדרה איטון, ד ר גארת איטון (באוניברסיטת דנבר), ד ר ג'רלד רוזן, ד ר יוסף עמ' קאו (אוניברסיטת מרילנד), ד ר תהיה ונקאטרמאן (אוניברסיטת קולורדו בדנוור) דיונים מועילים ואני ג'ואן Maltzahn, אשלי Trumpie, אייבי מקדרמוט (אוניברסיטת קולורדו בדנוור) לקבלת תמיכה טכנית.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



