Summary
Спектроскопия парамагнитного резонанса (EPR) является недвусмысленным метод измерения свободных радикалов. Использование селективного спин зондов позволяет для обнаружения свободных радикалов в различных клеточных отсеках. Мы представляем практический и эффективный метод для сбора биологических проб, которые облегчают обработки, хранения и передачи образцы для измерения ОРЭД.
Abstract
Точным и конкретным обнаружение реактивнооксигенных видов (ров) в разных отсеках, клеточные и тканевые имеет важное значение для изучения редокс регулируемых сигнализации в биологических параметров. Спектроскопия парамагнитного резонанса (EPR) является единственным прямым методом однозначно оценить свободных радикалов. Его преимущество заключается в том, что он обнаруживает физиологических уровнях конкретных видов с высокой точностью, но он требует специализированной технологии, тщательно пробоподготовки и соответствующие элементы управления для обеспечения точной интерпретации данных. Циклические гидроксиламина спин зонды избирательно реагируют с супероксид или другие радикалы для генерации сигнала nitroxide, которые могут быть количественно методом ЭПР спектроскопии. Ячейки проницаемой спин зонды и спин датчики предназначены для накопления быстро в митохондриях позволяют для определения концентрации супероксид в различных клеточных отсеках.
В культивируемых клеток, использование клеток проницаемых 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) наряду с и без предварительной обработки клеток непроницаемый супероксид дисмутаза (SOD) или использование клеток проницаемой PEG-SOD, позволяет дифференциация внеклеточного от цитозольной супероксида. Митохондриальной 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] piperidinium дихлорид (mito темп-H) позволяет для измерения митохондриальной Рось (преимущественно супероксиддисмутаза).
ЭПР спектроскопии и спин зонды также может применяться к моделям в естественных условиях . Супероксид могут быть обнаружены в внеклеточной жидкости, крови и альвеолярной жидкости, а также ткани, такие как легочной ткани. Несколько методов представлены для обработки и хранения тканей для измерений ОРЭД и доставки внутривенных 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) спина зонд в естественных условиях. Во время измерения могут быть выполнены при комнатной температуре, образцы, полученные in vitro и in vivo модели также могут быть хранятся при температуре-80 ° C и проанализированы по ОРЭД в 77 K. Образцы можно хранить в специализированных трубы стабильной температуре-80 ° C и работать на 77 K чтобы практическая, эффективную и воспроизводимый метод, который облегчает хранение и передача образцов.
Introduction
Меры оксидативного стресса и реактивнооксигенных видов имеют важное значение для изучения различных заболеваний во всех органов и систем, обнаружение реактивнооксигенных видов (ров) является сложной задачей из-за короткий период полураспада и высокую реакционную способность. Электронного парамагнитного резонанса (EPR) техника является самым недвусмысленным метод для обнаружения свободных радикалов. Спин зонды имеют преимущества над более часто используемых флуоресцентных зондов. Хотя флуоресцентных зондов, относительно недорогой и простой в использовании и обеспечивают быстрый, чувствительность обнаружения ROS, они имеют серьезные ограничения, обусловленные артефакты сигналов, неспособность рассчитать концентрации рос и общее отсутствие конкретности1 .
Для облегчения использования ОРЭД для биологических исследований, различные датчики были синтезированы спина, что можно измерить широкий спектр видов биологически соответствующих свободных радикалов, а также ро2, pH и редокс государств2,3, 45,,6,7. Также были разработаны спин ловушки для захвата недолго радикалов и формы долгоживущие аддукты, который облегчает обнаружение по ОРЭД8. Оба класса (спин зондов и спин ловушки) имеют свои преимущества и ограничения. Один из часто используемых класс спин зонды являются циклических Гидроксиламины, которые НРА молчаливый и реагировать с недолгим радикалы для формирования стабильной nitroxide. Циклические Гидроксиламины реагируют с супероксид 100 раз быстрее, чем спин ловушки, что позволяет им конкурировать с сотовой антиоксидантов, но они неконкретны и требуют использования надлежащего контроля и ингибиторов для идентификации радикальной видов или источник ответственный за nitroxide сигнала. В то время как спина ловушки экспонат специфичности, с различных спектральных шаблонов в зависимости от захваченных видов, они имеют медленно кинетики супероксид спина треппинга и подвержен биодеградации радикала аддукты. Приложений для треппинга спин были хорошо документированы в биомедицинских исследований9,10,11,12,13.
Целью этого проекта является демонстрация практических методов ОРЭД для проектирования экспериментов и подготовка образцов для обнаружения супероксида с помощью спин зонды в различных клеточных отсеков в пробирке и в различные ткани отсеков в естественных условиях. Несколько рукописей были опубликованы протоколы соответствующих для этих целей, с использованием клеток проницаемой, клетки непроницаемый и митохондриальной целевых спин зонды для различных клеточных отсеков в пробирке и процесс ткани-мишени для анализа в модели мыши 14 , 15. Мы строим на этот орган литературы, проверяя подход к супероксиддисмутаза, используя 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine зонд спин (CMH) в различных клеточных отсеков в пробирке для обеспечения точного измерения измерения, подчеркнув потенциальные технические проблемы, которые могут исказить результаты. Мы также предоставляют методы для выполнения измерений ОРЭД в крови, Бронхоальвеолярный лаваж жидкости и легочной ткани с помощью зонда спин КМЗ. Эти исследования сравнить разные методы для обработки тканей, а также метод придать еще один спин зонд, CPH, мышей до уборки ткани. Наконец мы разрабатываем практический метод для хранения образцов труб из политетрафторэтилена (ПТФЭ) для хранения и передачи образцов до измерения ОРЭД в 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Все исследования на животных были утверждены в университете Колорадо Денвер институциональных животное уход и использование Комитета.
1. Подготовка реагентов
-
Diethylenetriaminepentaacetic кислота (DTPA) фондовой (150 мм)
- Добавить 2,95 g DTPA (393.35 г/моль) до 10 мл обессоленной воды.
- Чтобы растворить дтпа, добавить 1 M NaOH каплям и довести до pH 7.0.
- Довести объем до 50 мл с водой для окончательного DTPA концентрации 150 мм и хранить при 4 ° C.
-
Натрий-фосфатный буфер (PBS) (50 мм, рН 7,4)
- Подготовьте 5 M хлорида натрия (NaCl) (58.44 г/моль; 29.22 г/100 мл).
- Подготовка 1 М калия фосфат двухосновной HK2PO4 (174.18 г/моль; 17,42 г/100 мл)
- Подготовка 1 М калия фосфат монокальций KH2PO4 (136,1 г/моль; 13.61 г/100 мл). Смешайте 3 мл 5 М NaCl с 4.24 до 1 М калия фосфат двухосновной 0,760 мл 1 М калия монокальций фосфат. Проверьте рН.
- Довести объем до 100 мл деионизированной водой.
- Хранить при комнатной температуре (RT) для краткосрочного (дней) и на 4 ° C для хранения долгосрочных (недель).
-
Кребс-Henseleit буфер (Хо), содержащий 100 мкм дтпа
- В 50 мл конические пластиковых пробирок мкл 33.3 150 мм DTPA Стоковый раствор.
- Довести объем 50 мл с буфером Кребса-Henseleit (Хо).
- Подготовьте свежие буфер с дтпа каждый день и держать его на RT.
-
Буфер Tris-ЭДТА, содержащие сахарозы
- Подготовить 0,5 М трис складе: растворить 15.14 g Tris база (121.14 г/моль) в 150 мл деионизованной воды. С помощью HCl, скорректировать рН 7,8 и предавать конечный объем 250 мл.
- Распустить 21,4 г сахарозы (342.29 г/моль; конечная концентрация = 0,25 мм) в 150 мл деионизованной воды.
- Добавьте 5 мл трис акций сахарозы для достижения 10 mM концентрации выпускных трис.
- Добавьте 0,5 мл 0,5 М ЭДТА акций трис сахарозы для достижения 1 mM концентрации выпускных экзаменов.
- Проверьте pH и настроить его на 7,4.
- Привести в окончательный объем 250 мл деионизированной водой и хранить при 4 ° C.
-
Говядину эритроцитов Cu/Zn супероксид дисмутаза (SOD) запасов (30 000 ед/мл)
- Воссоздания 30 000 U SOD в 1 мл PBS (примерно 5,7 мг, в зависимости от активности дерново лота).
- Перемешать, Алиготе и хранить при температуре-20 ° C для краткосрочного (6-12 месяцев) и при температуре-80 ° C для длительного хранения.
-
SOD рабочего раствора (1000 ед/мл)
- Перевести 30 мкл Алиготе акций 30 000 ед/мл SOD в 870 мкл стерильных PBS.
- Держите решение на льду и использовать его свежим.
-
Phorbol 12-миристат 13-ацетат (PMA) фондовой (5 мм)
- Растворить 1 мг PMA (616.83 г/моль) в 325 мкл ДМСО (конечная концентрация = 5 мм).
- Алиготе раствором PMA 5 мм и хранить его при-20 ° C.
-
PMA рабочего раствора (125 мкм)
- Развести 10 мкл Алиготе акций 5 мм PMA в 390 мкл стерильных PBS.
- Держите решение на льду и использовать его свежим.
- Для контроля транспортных средств на PMA используйте 10 мкл ДМСО в 390 мкл PBS.
-
Хлорид Diphenyliodonium (DIP) (2,5 мм)
- Распустить 3,2 мг DIP (316.57 г/моль) в 4 мл получить запас 2,5 мм.
- Подготовить решение и использовать его свежим.
-
Дефероксамин мезилат соль (ДФО) (20 мм)
- Распустить 4,5 мг ДФО (656.79 г / моль) в 340 мкл получить запас 20 мм.
- Подготовить решение и использовать его свежим.
-
Подготовка antimycin (AA) запасов (5 мм)
- Распустить 5,4 мг АА (532 г/моль) в 2 мл этанола (конечная концентрация = 5 мм).
- Алиготе акций в стеклянных флаконах и хранить при температуре от-20 ° C.
-
Подготовка спин зонды
- Пузырь 50 мм фосфатного буфера содержащих 100 мкм DTPA азотом для 30 мин для удаления растворенного кислорода из буфера.
- Удалить спина зонд из морозильной камеры-20 ° C и позволяют контейнеру прийти к RT (10-15 мин).
- Весят, 2,4 мг 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237,8 г/моль)
- КМЗ растворяют в 1 мл венозная фосфатного буфера для конечной концентрации 10 мм.
- Весят из 5 мг 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium дихлорид (mito темп-H) (529.1 г/моль).
- Растворяются mito темп-H в 1 мл венозная фосфатного буфера для конечной концентрации 9,5 мм.
- Весят, 4,9 мг 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223.7 г/моль).
- CPH растворяют в 1 мл венозная фосфатного буфера для конечной концентрации 22 мм.
- Алиготе и хранить при температуре-80 ° C (замораживания оттаивания не рекомендуется).
2. Обнаружение супероксид в пробирке
-
Обнаружение всего, внеклеточная и внутриклеточных супероксидного в PMA-стимулирует RAW 264.7 клеток в РТ
- После правильной асептической техники растопить RAW 264.7 клетки и прохождения их в среде DMEM СМИ с 10% FBS (низкий эндотоксинов бесплатно) и 1% противогрибковое/ампициллин при 37 ° C в CO2 инкубатора.
- Семя RAW 264.7 клеток в 1 x 106 клеток/колодец в 6-ну плиты один день до начала лечения.
- Осторожно извлеките носитель и вымыть клетки один раз с 1 мл раствора Хо буфера.
- Добавить Хо, содержащие 100 мкм DTPA для каждой скважины и лечить в общем объеме 500 мкл следующим текстом:
- Для скважин, предварительно обработанных с SOD, добавьте 15 мкл/хорошо SOD рабочего раствора (1000 ед/мл; конечная концентрация SOD = 30 ед/мл) и инкубировать в течение 10 минут при 37 ° C до того КМЗ и PMA.
- Добавить 12,5 мкл/хорошо КМЗ акций 10 мм (конечная концентрация = 0,25 мм).
- Добавить 40 мкл/скважины 125 мкм PMA рабочего раствора (конечная концентрация = 10 мкм) или 40 мкл транспортного средства (фондовая 10 мкл ДМСО в 390 мкл PBS).
- Инкубируйте 50 минут при 37 ° C в инкубатор CO2 .
- Удаление пластины из инкубатора и поместите их непосредственно на льду.
- Соберите буфера от каждой скважины в отдельных, 1,5 мл, помечены трубы. Держите на льду во всем.
- 100 мкл свежие Хо буфер, содержащий 100 мкм дтпа, осторожно очистите клетки и Ресуспензируйте, закупорить вверх и вниз несколько раз. Держите на льду всей ячейки ресуспендирования.
- Загрузка образца собраны в шаги 2.1.10 и 2.1.11 (50 мкл) в каждом из капиллярных трубок. Уплотнение обоих концах и запустите ОРЭД.
Примечание: Всегда проверить трубку или хорошо (без клетки) содержащий зонд в буфере (же концентрация = 0,25 мм), обработанных на тех же условиях, как клетки (же время инкубации и температура) как элемент управления, так как интенсивность фона датчика температуры - и зависят от времени. - Установите параметры приобретения ОРЭД на следующее: Микроволновая печь частота = 9,65 ГГц; центр поля = 3432 G; амплитуда модуляции = 2,0 Г; развертки ширина = 80 G; микроволновая мощность = 19,9 МВт; Общее количество сканов = 10; развертки время = 12,11 s; и постоянная времени = 20,48 МС.
-
Обнаружение митохондриальной супероксидного в RAW 264.7 клетки
- Выполните шаги 2.1.1 и 2.1.2 семян RAW 264.7 клетки один день до эксперимента.
- Извлеките носитель и вымыть клетки один раз с 1 мл раствора Хо буфера.
- 200 мкл Хо, содержащие 100 мкм DTPA в каждой скважине.
- Добавить 5.3 мкл/хорошо акций mito темп-H 9,5 мм (конечная концентрация = 0,25 мм)
- Проинкубируйте втечение 10 мин на RT.
- Добавить 1 мкл/хорошо antimycin (AA), 5 мм раствор в этаноле (конечная концентрация = 25 мкм).
- Инкубируйте 50 минут при 37 ° C в инкубатор CO2 .
- Удаление пластины из инкубатора и поместите их непосредственно на льду.
- Аккуратно очистите клетки и Ресуспензируйте, закупорить вверх и вниз. Держите на льду.
- Загрузите образец в капиллярной трубке. Уплотнение обоих концах.
- Предыдущем разделе для параметра ОРЭД.
-
Обнаружение супероксидного в RAW 264.7 клеток на 77 K
- Место буфера, собранных на шаге 1.1.10 в заранее подготовленные PTFE 1-2 дюймов в длину (3/16" OD х 1/8" ID) труб. Убедитесь, что трубка PTFE прямо так он может быть легко вставляется и удалены из пальца Дьюара. Позволяет закрыть один конец трубки PTFE, Пипетка буфер или суспензию клеток (100-150 мкл) в трубопровод PTFE и герметизации труб с второй пробкой резиновой пробкой.
- Вспышки заморозить образца в жидком азоте. Образец может быть передана помечены криоконсервирования трубка для хранения при температуре-80 ° C или запустить немедленно.
- Заполните палец Дьюара с жидким азотом и вставить PTFE Шланги, содержащий образец в палец Дьюара. Убедитесь, что образец сосредоточена в активное пространство резонатора и запустить ОРЭД в 77 K.
Примечание: Начало потока газа азота для вашего спектрометр 15-30 мин до измерения и продолжать этот поток на протяжении измерений для предотвращения конденсации воды в резонаторе. - Задать параметры приобретения ОРЭД на следующее: Микроволновая печь частота = 9,65 ГГц; центр поля = 3438 G; амплитуда модуляции = 4.0 G; развертки ширина = 150 Г; микроволновая мощность = 0.316 МВт; Общее количество сканов = 10; развертки время = 60 s; и постоянная времени = 1.28 МС.
3. ОРЭД измерения в жидкостях
-
Цельная кровь
- Лечить мышей (8-12 недель) с однократным введением трахею Блеомицин (Bleo; 100 мкл на 1 ед/мл), растворенных в PBS или PBS только как описано16,17.
- Усыпить мышей управляющими вдыхаемого изофлюрановая (1,5-4%), следуют обескровливания и шейки матки дислокации. Аспирационная крови через правый желудочек в шприц с гепарином (1000 USP/мл), содержащие 100 мкм DTPA и передачи в 1,5 мл трубку покрытием.
- В отдельном 1,5 мл трубку, мкл 15 PBS, содержащие 100 мкм DTPA и 3 мкл КМЗ (10 мм) до 132 мкл крови на общий объем 150 мкл и окончательный КМЗ концентрации 0,2 мм.
- Инкубируйте крови в течение 10 минут при 37 ° C на водяной бане.
- Удаление трубы из водяной бани.
- Возьмите Алиготе, загрузив крови в капиллярной трубке и запустить ОРЭД в RT с параметрами приобретение ОРЭД: Микроволновая печь частота = 9,65 ГГц; центр поля = 3432 G; амплитуда модуляции = 1,0 Г; развертки ширина = 80 G; микроволновая мощность = 19,9 МВт; Общее количество сканов = 3; развертки время = 12,11 s; и постоянная времени = 20,48 г-жа альтернативно, образцы могут быть вспышка замороженные как описано в шаге 2.3 для измерений на 77 K. EPR приобретения параметры являются следующие: Микроволновая печь частота = 9,65 ГГц; центр поля = 3438 G; амплитуда модуляции = 4.0 G; развертки ширина = 150 Г; микроволновая мощность = 0.316 МВт; Общее количество сканов = 2; развертки время = 60 s; и постоянная времени = 1.28 МС.
-
Бронхоальвеолярный лаваж жидкость (BALF)
- После эвтаназии (см. шаг 3.1.2), собирать BALF, медленно воспитание и снятия 1 мл PBS, содержащие 100 мкм DTPA три раза в шприц через канюлю помещены в трахею.
- В 1,5 мл трубку лечить 200 мкл BALF с 4 мкл КМЗ (10 мм) для получения конечной концентрации 0,2 мм.
- Инкубируйте BALF 50 минут при 37 ° C на водяной бане.
- Возьмите трубы из водяной бани и поместите их на льду.
- Нагрузки BALF в капиллярную трубку и выполнения ОРЭД на RT с теми же настройками ОРЭД, используемый в шаг 1.1.13, или flash замораживание в жидком азоте, как описано в шаге 2.3.
-
ЭПР измерения в крови и BALF на 77 K
- Следовать протоколу выше для сбора крови (шаги 3.1.1. чтобы 3.1.4) и BALF (шаги 3.2.1 для 3.2.4).
- Место 150 мкл лечение крови или BALF в ПТФЭ Шланг (1-2 дюйма). Используйте резиновую пробку, чтобы закрыть один конец трубки PTFE перед добавлением образца и другая пробка для герметизации труб.
- Вспышки заморозить образца в жидком азоте.
- В разделе 2.3 по ОРЭД в замороженных пробах в PTFE Шланги с помощью пальцев, Дьюар в 77 K. Run замороженные КМЗ относились проб крови с в неделю.
4. ОРЭД измерения на ткани легких
-
Флэш замороженных легочной ткани
- После сбора BALF шаге 3.2.1, открыт груди и легких вспыхнул с 10 мл холодного PBS через правый желудочек для удаления крови. Вспышки заморозить легочной ткани в жидком азоте. Замороженные легочной ткани могут храниться при температуре-80 ° C до 6 месяцев до использования для измерения ОРЭД.
- Стабилизировать легочной ткани на сухой лед с помощью пинцета и вырезать несколько кусочков (5-15 мг) из легочной ткани с помощью одно край лезвия.
- Весят ткани в 1,5 мл, поместить трубку на шкале и Тара масштаб, затем добавить кусочки ткани и запишите вес.
- Ткани в 1,5 мл мкл 196 Хо, содержащих DTPA и 4 мкл КМЗ (0,2 мм) для достижения 200 мкл общий объем.
- Инкубируйте 1 час при 37 ° C на водяной бане.
- Спин вниз (в течение нескольких секунд) в microcentrifuge на 3 884 x g.
- Место на льду и Пипетка 150 мкл супернатант в трубопровод PTFE и заморозить для измерения 77 K, как описано в разделе 2.3.
Примечание: Для этого метода, неоднородность травмы необходимо рассматривать. Для легких блеомицин индуцированного повреждения учитывая, что он является весьма неоднородной травмы, рекомендуется сократить несколько кусков ткани из разных частей легкого от каждой мыши. Кроме того больший кусок ткани может быть гомогенизированные в Хо буфер, содержащий 100 мкм DTPA в соотношении 1:6 вес объем (мг/мкл), как описано ниже.
-
Свежий легочной ткани сохранились в буфере сахарозы
- Потолочные lavaged легких с холодной PBS для удаления крови, как это сделано в шаге 3.1.2.
- Однородный свежие легочной ткани в буфер Tris-ЭДТА, содержащий 0,25 М сахарозы с соотношением 1:6 легких/буфера (мг/мкл) с помощью мясорубки Dounce ткани с стекла или PTFE пестиком.
- Добавьте 50 мкл легких огневки 450 мкл Хо, содержащие 100 мкм DTPA.
- В 1,5 мл трубки (в общем объеме 100 мкл), 98 мкл легких огневки в Хо добавьте 2 мкл КМЗ акций 10 мм для получения конечной концентрации 0,2 мм.
- Проинкубируйте втечение 20 мин 37 ° C на водяной бане.
- Поместите образцы на льду и загрузить их в капиллярной трубке. Запустите ОРЭД на RT (параметры, используемые на шаге 2.1.13).
- Чтобы проверить вклада конкретных видов и источников с использованием разных ингибиторов, предварительно лечить 88 мкл легких огневки + / ингибитор, регулируя с Хо для достижения окончательный объем 98 мкл. В этом эксперименте, ингибиторы включены 10 мкл SOD (100 ед/мл), 4 мкл дефероксамин (DFO; конечная концентрация = 800 мкм), или 4 мкл diphenyliodonium хлорида (DIP; конечная концентрация = 100 мкм). Проинкубируйте втечение 20 мин при 37 ° C на водяной бане.
- 2 мкл КМЗ и инкубировать еще 20 минут при 37 ° C, следуют ОРЭД измерений, как описано выше. Включают единовременные соответствует пустой образец с CMH Хо, содержащие сахарозу буфера. Кроме того Храните аликвоты оставшихся легких гомогенатах (шаг 3.1.2) при температуре-80 ° C для будущих измерений.
Примечание: Общий объем могут быть расширены при необходимости.
-
ЭПР измерения на легочной ткани от мышей, вводится с спин зондов в естественных условиях (на RT с использованием клеток ткани)
- Подготовьте раствор CPH, растворяя CPH 4,9 мг в 1 мл раствора фосфатного буфера отфильтрованных и венозная 50 мм.
- 20-30 секунд, пока не реагирует на палец щепотку анестезировать мышей с вдыхаемого изофлюрановая (1,5-4%). Придать мышей через retroorbital маршрут с 100 мкл CPH спин зонда для веса тела мыши 25 g (окончательный доза = 20 мг/кг) и позволить зонд циркулировать по 1 ч. сразу же после инъекции retroorbital, добавить одну каплю proparacaine 0,5% HCl на область глаз в Преве NT глаз боль и сухости. Контролировать мышей для 1 h и приступить к уборке ткани.
- Урожай легочной ткани, как описано выше, и вспышки заморозить легких.
- Вырезать 20-30 мг замороженные ткани на сухой лед и запишите точный вес.
- Аккуратно протрите ткани с очищающие салфетки поглощать любые поверхностные воды.
- Место ткани внутри окна ткани клетки (аксессуар позволяет ОРЭД измерений для образцов ткани) и запустите ОРЭД для определения всего прокруток. Данные может быть выражен как общая спинов на мг ткани.
5. анализ данных
- Имитировать спектрам ЭПР, с помощью модуля SpinFit, включены в программное обеспечение ксенон-стендовые EMXnano ЭПР спектрометр. Определите концентрацию nitroxide модулем SpinCount. Кроме того градуировочному стабильной nitroxide например 4-гидрокси темп или TEMPOL могут быть сделаны, и концентрации могут быть получены путем сравнения интенсивности сигнала с образцом и стандарт.
- Для данных, собранных на 77 K используйте двойной интеграции, следуют SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Супероксид обнаружения с помощью КМЗ была проверена с помощью X / XO супероксид генерации системы, позволяющие продемонстрировать, что сигнал nitroxide (см..) полностью тормозится SOD, в то время как каталазы имел никакого эффекта (рис. 1A). Всего, внеклеточная супероксид затем оценивалась в клетках RAW 264.7 инкубирования клетками с клетки проницаемой зонд КМЗ спина + / SOD предварительной обработки. Nitroxide концентрация была измерена в суспензию клеток и буфер, который показал, что значения в двух типов образцов были похожи благодаря проницаемых характера и быстрого уравновешивания спин зонда (рис. 1B). Nitroxide радикальной сигнал, увеличилось в RAW 264.7 клетки стимулируется с PMA, по сравнению с клетки управления. Этот сигнал был значительно ослаблены в клетках, предварительно обработанных с клеток непроницаемый SOD (рис. 1 c). Каждый цвет соответствует скважины испытаны в разные дни, демонстрируя согласованности данных, собранных на определенные дни и воспроизводимость результатов во времени. Концентрации внеклеточного супероксид был определен путем вычитания сигнала в клетках PMA, предварительно обработанных с SOD сигнал после PMA в отсутствие SOD (T). Оставшиеся сигнал приписывали внутриклеточных супероксида (рис. 1 c). Рисунок 1 d иллюстрирует расчет общего и внеклеточной супероксида. (E внутриклеточного сигнала было подтверждено в PMA-лечение клеток после удаления средств массовой информации и влияние PEG-SOD на сигнал. В этом графике, в отличие от (C) бланк КМЗ не вычитается из измерений, и показано необработанные данные.
Митохондриальной супероксид в клетках RAW 264.7 был обнаружен с помощью ОРЭД спин зонд mito темп-H, который накапливается в факт. (A) представитель EPR спектры для базовых mito темп-H сигнала в буфер, увеличение mito темп-H в клетки управления (кон) и дальнейшее расширение сигналом в клетках стимулируется с митохондриальных ингибитор Antimycin (AA). Увеличение сигнала приписывали митохондриальной супероксиддисмутаза, основанный на наших предыдущих исследований, показываю что SOD2 гиперэкспрессия значительно ослабленный измерений с mito темп-H10. Рисунок 2Bконцентрация митохондриальной nitroxide был определен путем вычитания mito темп-H сигнала соответствует времени буфера от клеток измерений. Сигнал см. , полученных при низких температурах в RAW 264.7 клеток после стимуляции с PMA в присутствии и отсутствии SOD. (Рис. 3A) СМ. сигнал был ослабленного присутствии SOD, согласуются с данными комнатной температуры (рис. 1). Рисунок 3B показывает фотографию PTFE Шланги с пробками, используемых для сбора данных на 77 K для клетки и в естественных условиях образцы. Супероксид производства был обнаружен в крови и BALF с помощью зонда спин КМЗ. Образцы крови или BALF были собраны от мышей PBS - и Bleo лечение и немедленно инкубировали с КМЗ. Образцы были переданы PTFE Шланги и flash заморожены, и ОРЭД данные были собраны в 77 K. Концентрация nitroxide (CM.) накапливается в крови, инкубировали с КМЗ (0,2 мм) при температуре 37 градусов 10 минут (рис. 4A). Концентрация Nitroxide (CM.) из BALF инкубированы для 50 мин (рис. 4В). Nitroxide концентрация представляет концентрацию (см..) накапливается в объем крови или BALF используется в эксперименте.
Были протестированы три метода для оценки нескольких опубликованных методов для сохранения тканей и отправления спин датчики ex vivo vs. в-vivo. Для выполнения измерений ОРЭД по легочной ткани, мы сначала используется флэш замороженных легочной ткани от управления или ранения мышей. Рисунок 5A показывает общий сигнал см. в надосадке небольшой кусочек ткани легких, инкубировали при 37 ° C с КМЗ в мышей, лечение PBS и Bleo, соответственно. Из-за гетерогенности повреждения легких после Bleo лечения рекомендуется вырезать куски из разных регионов легких и средних несколько измерений для более представительным значение. В качестве альтернативы можно гомогенизировать весь легких и использовать один образец этого огневки. Данные, собранные на 77 K с помощью PTFE Шланги и палец Дьюара. Рисунок 5B показывает представитель спектры сигналов nitroxide (см.) от мышей, лечение PBS и Bleo, соответственно.
Одно ограничение для лечения легких тканей ex vivo является, что это не возможно достоверно различать внеклеточные от внутриклеточного супероксид благодаря обработке ткани, которая разрушает клеточные мембраны. Если эта информация имеет важное значение для экспериментальной вопрос, она может быть решена путем в vivo CPH инстилляции способом, описанным ниже. Замороженные ткани не могут использоваться для оценки митохондриальной супероксид; Однако для этого измерения, протокол может быть адаптирован для использования mito темп-H в ткани или свежевыделенных митохондрий.
Как второй метод измерения ОРЭД в легочной ткани свежие ткани был гомогенизации в буфере сахарозы. Гомогенат трутневых легких был инкубировали с зонд КМЗ в Хо буфер, содержащий DTPA. Были проведены ОРЭД измерения вне на RT. Рисунок 6A демонстрирует рост в см. с Bleo. Мы представили дополнительного тестирования с использованием разных ингибиторов, которые могут быть использованы для определения видов, которые способствуют см. сигнал. Для выяснения происхождения см. сигнал от легочной ткани, мы предварительно обработанных гомогенатах легких с несколькими мусорщиков и Ингибиторы ферментов. Легких гомогенатах инкубировали с КМЗ в отсутствие или наличие хлорида SOD, дефероксамин (ДФО) и diphenyliodonium (DIP) для учета (соответственно) взносы от супероксиддисмутаза, железа или супероксид генерируется из флавинсодержащих ферменты (Рисунок 6B). Этот подход может быть адаптирована для оценки конкретных видов радикальной, созданных в системе или прояснить вклад других ферментативные источников (например., оксидаза ксантина, NOX и Энос).
Мышей вводили с CPH спин зонды (20 мг/кг) через retroorbital маршрут для выполнения измерений ОРЭД в естественных условиях. Это неизвестно ли КМЗ можно безопасно вводить для животных, в то время, как было сообщено CPH зонд быть не токсичны; Таким образом мы выбрали CPH для экспериментов в естественных условиях . Легочной ткани были собранного и флэш-замороженные в жидком азоте 1 час после обращения CPH зондов. Мышей может рассматриваться одновременно с конкретными антиоксидантов для дифференциации видов ответственных за сигнала. 7а Рисунок показывает выше CP. сигнала в Bleo лечение мышей, по сравнению с контролем мышей. Представитель спектры легочной ткани от контроля и Bleo лечение мыши приведены в Рисунок 7B. Смешанные спектров ЭПР CP. и наблюдалось радикальное аскорбиновой кислоты. В рис. 7A значений концентрации CP. компоненты. Данные были собраны на RT, используя ткани клеток.
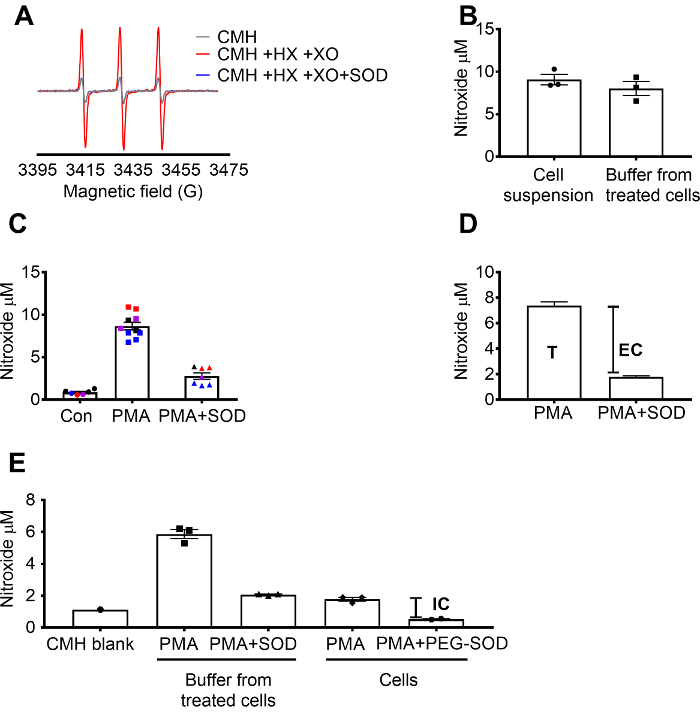
Рисунок 1: определение супероксид в различных клеточных компартментов. (A) ОРЭД спектры, порожденных 0,25 мм КМЗ в 0,5 мм гипоксантин/ксантиноксидаза (8 му/мл) и без SOD (30 ед/мл). (B) RAW 264.7 клетки (1 х 106 клеток/хорошо) были стимулируется с 10 мкм PMA присутствии КМЗ 50 минут при 37 ° C и nitroxide концентрации (мкм) обнаружены в суспензию клеток (клетки + буфера) и buffer, собранные из обработанных клеток. (C) RAW 264.7 клетки были стимулируется с PMA против. управления транспортным средством (кон). Один набор клеток были предварительно обработанных на 10 мин с 30 ед/мл клеток непроницаемый SOD (PMA + SOD). Каждый цвет представляет данные из различных экспериментальных дней, и каждая точка представляет клетки от индивидуального хорошо. Nitroxide сигнал в соответствующее время пустой с КМЗ в Хо был вычитается из каждого сигнала для получения окончательного значения. D расчет общего и внеклеточной супероксид в PMA стимулировал клетки; T = всего супероксид, EC = внеклеточного Супероксиддисмутаза (SOD inhibitable сигнал). (E) для оценки внутриклеточных супероксид сигнал (IC), сигнал в буфере после PMA + SOD был по сравнению с PMA-лечение клетки после удаления буфера. Для подтверждения, колодцы были предварительно обработанных с 60 ед/мл клеток проницаемой PEG-SOD на 1,5 часа для определения внутриклеточного inhibitable SOD. Показано время соответствует пустой КМЗ, и данные отражают абсолютное nitroxide сигнал. Данные, выраженные как среднее ± SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: определение митохондриальной супероксид в RAW клетки стимулируется с antimycin а. (A) представитель спектры спин ОРЭД митохондриальной конкретных зонд, 0,25 мм mito темп-H в RAW 264.7 клетки без (Con) или с 25 мкм antimycin (AA) для 50 минут при 37 ° C. (B) CM. концентрация (мкм) в клетках, обработанных с AA, по сравнению с контролем. Nitroxide сигнал в соответствующее время пустой mito темп-H был вычитается из общего сигнала для получения окончательного значения. Данные, выраженные как среднее ± SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: обнаружение супероксидного в RAW 264.7 клеток на 77K. (A) RAW 264.7 клетки стимулируется с 10 мкм PMA и ОРЭД спин зонд, КМЗ 0,25 мм (50 минут при 37 ° C) с (черный) или без предварительной (красный) с 30 ед/мл SOD. 100 мкл супернатант был загружен в 1-дюйма в длину кусок PTFE Шланги, то вспышки, замороженные в жидком азоте. Пробок были удалены, и замороженные PTFE Шланги был помещен в палец Дьюара для сбора данных на 77 фото к. (B) A PTFE Шланги и пробки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: ОРЭД измерения в крови и BALF от контроля и блеомицин лечение мышей. Мыши были относиться с однократной дозы блеомицина трахею (ИТ Bleo) (100 мкл на 1 ед/мл) или PBS транспортного средства. На 7 дней мышей были под наркозом и умерщвлены. Кровь была собраны через правого желудочка прокол в шприц с 1000 покрытием USP/мл гепарина, содержащие 100 мкм DTPA. Бронхоальвеолярный лаваж жидкости (BALF) была собрана lavaging легких с 1 мл раствора 100 мкм DTPA в PBS. Кровь и BALF были инкубировали для 10 или 50 мин, соответственно, с 0,2 мм КМЗ в 37 ° C. 150 мкл крови или BALF был загружен в PTFE Шланги флэш замороженных в жидком азоте и ОРЭД данных, собранных на 77 K с помощью пальца Дьюара. Данные показывают nitroxide концентрации в крови (A) и (B) BALF от PBS и Bleo лечение мышей (n = 4-6). Данные, выраженные как средний ± SEM. (C) представитель спектры nitroxide в крови от PBS и Bleo лечение мышей. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: ОРЭД измерения в флэш замороженных легочной ткани. Мыши были относиться с однократной дозы блеомицина трахею (ИТ bleo) (100 мкл на 1 ед/мл) или PBS транспортного средства. На 7 дней легкие были сброшены с холодной PBS для удаления крови и flash, замороженные в жидком азоте. 5-15 мг флэш замороженные легочной ткани был инкубировали с 0,2 мм КМЗ в Хо, содержащие 100 мкм в 200 мкл общего объема за 1 ч при 37° C. супернатант собраны и помещены в PTFE Шланги и запустить на 77 K в палец Дьюара. (A) Nitroxide концентрация (мкм nitroxide, нормализуется до 1 мг ткани). Данные представляют в среднем 2-3 измерений для каждого легкого. Данные, выраженные как средний ± SEM. (B) представитель спектры nitroxide в легочной ткани от PBS и Bleo лечение мышей. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6: ОРЭД измерения в легочной ткани, сохраняются в буфере сахарозы. Мышей были относиться с однократной дозы блеомицина трахею (100 мкл на 1 ед/мл). В 7 дней после лечения легкие были сброшены с холодной PBS для удаления крови и свежие легочной ткани был гомогенизации в буфер Tris-ЭДТА, содержащий 0,25 мм сахарозы в соотношении 1:6 легких вес/буфера тома (мг/мкл). 50 мкл легких огневки был преинкубации с хо, с или без следующих ингибиторов для 20 минут при 37 ° C: SOD (100 ед/мл), дефероксамин (DFO; 800 мкм) и хлорид diphenyliodonium (DIP; 100 мкм) следуют инкубации с 0,2 мм КМЗ в Хо, содержащие 100 мкм дтпа за 20 минут при 37 ° C. Данные были получены на RT с использованием капиллярной трубки ОРЭД. (A) Nitroxide концентрации в легких от PBS и Bleo лечение мышей. (B) Nitroxide концентрации в легких Bleo в отсутствие или наличие ингибиторов (n = 3). Данные, выраженные как среднее ± SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 7: ОРЭД измерения в легочной ткани от мышей, вводится с CPH спин зонд. 100 мкл CPH была управляемой через retroorbital инъекции для конечной концентрации 20 мг CPH на кг массы тела. После 1 h обращения мышей были умерщвлены, легкие были сброшены с 10 мл холодного PBS через правого желудочка и легочной ткани был флэш замороженных. 20-30 мг легочной ткани был помещен в камеру ткани и проведены ОРЭД измерения на RT. () данных, выраженных как спины / мг. (B) представитель спектры nitroxide сигнала в тканях легких PBS и Bleo (* указывает на совпадение с аскорбиновой кислотой радикальной). Данные, выраженные как среднее ± SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Ингибиторы | Виды |
| Супероксиддисмутаза (SOD) | Внеклеточные супероксид |
| Супероксид дисмутаза-Полиэтиленгликоль (PEG-SOD) | Внутриклеточные супероксид |
| Каталаза | Радикалы пероксида водорода на основе |
| Urate | Peroxynitrate |
| Этанола и ДМСО | Гидроксильная группа |
| Металлический хелаторов | Ионов металлов (железо и медь) |
Таблица 1. Общие ингибиторы, используемые для различения видов ответственных за спин зонд окисления.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Оценка производство свободных радикалов в биологических параметров имеет важное значение в понимании редокс регулируется сигнализации в здоровье и болезни, но мера этих видов является очень сложным из-за короткий период полураспада видов свободных радикалов и технического ограничения с часто используемых методов. ОРЭД является ценным и мощным инструментом в редокс биологии, как это только однозначные метод для обнаружения свободных радикалов. В этом проекте, мы демонстрируем практических методов ОРЭД для проектирования экспериментов и подготовка образцов для обнаружения рос с помощью спин зонды в различных клеточных отсеков в пробирке и различные ткани отсеков в vivo. Мы также предоставляем практические методы для обработки биологических образцов и образцов для повышения эффективности хранения.
Зонды спин эффективно реагировать с ROS и производить стабильный радикальной nitroxide, которая может быть обнаружена с ОРЭД. Несколько производных спин зонда (циклический гидроксиламина) синтезированы с различными проницаемость характеристиками, которые делают их пригодными для обнаружения производство свободных радикалов в10различных клеточных отсеков. Этот протокол используется зонд клетки проницаемой спина, КМЗ; Хотя непроницаемый спин зонд 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium хлорид HCl (CAT1H) может использоваться для обнаружения внеклеточного супероксид. Подобно нашего предварительного исследования в человека лимфобластный клеток линии18, мы смогли проверить использование проницаемых КМЗ спин зонд с непроницаемыми SOD и клеточной проницаемых PEG-SOD в RAW264.7 клетки (макрофаги мыши клеток легких линия) стимулируется с PMA в различать внеклеточные и внутриклеточных супероксида.
Мы также проверяются быстрого уравновешивания КМЗ между внутри и загородный cellular отсеков, и мы также обнаружили, что супероксид сигнала в клетки капли значительно после мытья клетки только один раз с Хо (данные не показаны). Мы подтвердили полезность митохондриальной конкретных спин зонд mito темп-H в RAW 264.7 клетки для измерения увеличения митохондриальной супероксиддисмутаза, созданные после стимуляции с митохондриальных переноса электронов цепи ингибитор antimycin а. Конкретный вклад митохондриальной супероксид производства mito темп-H продемонстрировала ранее и могут быть проверены в экспериментах с использованием изолированных митохондриях свежие или систем с митохондриальных супероксиддисмутаза MnSOD (SOD2) Гиперэкспрессия10.
Оценка ROS производства в естественных условиях является особенно сложным, но способность обнаруживать производства конкретных ROS обеспечивает важную информацию когда допрос роль оксидативного стресса или редокс регулируется сигнализации в биологических Параметры. Зонды соответствующей обработки ткани при использовании спин и ОРЭД имеет существенно важное значение для создания воспроизводимых и значимые результаты. Использование спин зонды с ткани не будет вероятно мера супероксидных радикалов присутствовать на время ткани сбора урожая из-за небольшой half-life, но вместо этого он обнаруживает супероксиддисмутаза, производимые ферментов, таких как NAPDH оксидазы, центровку эндотелиальной окиси азота NO-синтетазы , или ксантиноксидаза при легочной ткани или гомогенатах инкубируют с зонд спина на 37 ° C. Использование замороженных ткани не будет включать супероксиддисмутаза, порожденных митохондрий, после замораживания повреждения митохондриальных переноса электронов цепи активности. Чтобы проверить митохондриальной супероксиддисмутаза, следователи должны изолировать свежие митохондрий или использования митохондриальной конкретных зондов в естественных условиях или в свежие ткани.
Несколько различных протоколов для сохранения ткани были опубликованы в литературе14,15. Мы сравнили три опубликованные методы для измерения ОРЭД в легочной ткани: 1) flash замораживания тканей в жидком азоте, 2) гомогенизации ткани в буфере сахарозы и 3) лечении мышей в vivo с закруткой зонд 1 час до уборки ткани. Мы сравнили управления мышей для мышей с тяжелой легких воспаления и окислительного стресса, индуцированных блеомицин для тестирования каждого метода способность показать последовательное различия в nitroxide сигналов в раненых легких. Все три метода показали аналогичные относительное увеличение nitroxide сигнал в легких блеомицин лечение мышей. Использование флэш-замороженные ткани, вероятно, будет самым простым подходом к собирать ткани для большинства лабораторий, отрицая необходимость обработки ткани в буфере сахарозы на время сбора урожая. Инъекции CPH захватить свободных радикалов в естественных условиях является мощным, но для подтверждения конкретных видов, это требует лечения группы, включая соответствующие антиоксидант.
Одна проблема с использованием зондов спин является окисление спин зондов nitroxide создает аналогичные три линии спектра ЭПР независимо от видов ответственных за окисления; Таким образом она не делает различий между разными видами рос. Кроме того сообщалось, что существуют потенциальные реакции гидроксиламина зондов с фотосинтетической электрон транспортной цепи и цитохрома с-оксидазы19,20. Эти замечания следует учитывать при интерпретации результатов. В этом протоколе фотосинтетической системы не присутствует, и включение DTPA с буфером подавляет потенциальное загрязнение10 свободных ионов железа и меди. Мы показали, как использовать целый ряд специфических ферментов или хелаторов в легочной ткани установить вклад частности ROS или ингибиторы фермента для определения источника рос. Этот подход ранее используется с ОРЭД для определения вклада рос благодаря центровку Энос13,15. Мы предоставляем список общих ингибиторы, используемые для различения видов ответственных за спин зонд окисления (Таблица 1).
Мы также продемонстрировали важность оптимизации время инкубации для каждого экспериментальные условия. При сравнении спин зонды для Спиновые ловушки, спина ловушки генерировать уникальные спектров зависимости от реагент, который позволяет для специфики видов свободных радикалов; Однако они также проявляют медленно кинетики для супероксид Спиновые ловушки и подвержен биодеградации. Лечения легочной ткани с ОРЭД зонд ex vivo ограничивается также неспособность адекватно различать внеклеточные от внутриклеточного супероксид ввиду нарушения клеточных мембран во время обработки ткани (замораживание или гомогенизация). Эту проблему можно решить использование вводят спин зонд в естественных условиях в сочетании с SOD или ячейки проницаемой PEG-SOD.
Одна цель заключается в создании протокол для эффективного сбора образцов и хранить их в-80 ° C до измерения ОРЭД. Поэтому мы разработали практический метод использовать шланги PTFE для проведения пробы. Эта трубка помещается непосредственно в палец Дьюар на анализ ОРЭД в 77 K без необходимости очистить Дьюар между выборками. Это является альтернативой методу недавно опубликованные с участием замораживание образцов в 1 мл-шприцы. Измерения в замороженных образцов хранятся в PTFE Шланги может повторяться в течение нескольких дней, чтобы продемонстрировать стабильность сигнала. Этот подход позволяет для пакетной обработки измерения ОРЭД и облегчает передачу образцов между лабораториями так дистанционного ОРЭД могут запускать образцы.
В целом эти протоколы обеспечивают простой подход к подготовке клеток и тканей для измерения ОРЭД в биологических системах. Протоколы могут быть адаптированы для других моделей, связанных с окислительным стрессом и с использованием других спин зондов. Сроки и концентрация спин зонд нужно будет корректироваться для каждого экспериментальные условия. Способность ОРЭД для определения присутствия и производство свободных радикалов видов однозначно дает строгости для экспериментальных подходов в области биологии редокс.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не имеют ничего сообщать.
Acknowledgments
Эта работа была поддержана университета Колорадо школы медицины Дин стратегической инфраструктуры исследований премии, R01 HL086680-09 и 1R35HL139726-01, E.N.G. и UCD CFReT стипендия, (он). Авторы благодарят д-р Сандра Eaton и доктор Гарет Eaton (Денверский университет), д-р Джеральд Розен и д-р Джозеф P. Као (Университет штата Мэриленд) и доктор Суджатха Венкатараман (Университет штата Колорадо Денвер) для полезной дискуссии и Джоан Maltzahn, Эшли Trumpie и Ivy Макдермотт (Университет штата Колорадо Денвер) для технической поддержки.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



