Summary
Elektron paramagnetisk resonans (EPR) spektroskopi er en entydig metode til at måle frie radikaler. Brugen af selektive spin sonder giver mulighed for påvisning af frie radikaler i forskellige cellulære rum. Vi præsenterer en praktisk, effektiv metode til at indsamle biologiske prøver, som letter behandling, lagring og overførsel af prøver for EPR målinger.
Abstract
Præcis og specifik påvisning af reaktive ilt arter (ROS) i forskellige cellulære og væv rum er afgørende for studiet af redox-regulerede signalering i biologiske indstillinger. Elektron paramagnetisk resonans-spektroskopi (EPR) er den eneste direkte metode til at vurdere frie radikaler utvetydigt. Dens fordel er at det registrerer fysiologiske niveauer af specifikke arter med en høj specificitet, men det kræver specialiseret teknologi, omhyggelig prøveforberedelsen og passende kontrol for at sikre præcis fortolkning af data. Cyklisk hydroxylamin spin sonder reagerer selektivt med superoxid eller andre radikale til at generere en nitroxide signal, at kan kvantificeres ved EPR spektroskopi. Celle-gennemtrængelige spin sonder og spin sonder designet til at ophobe sig hurtigt i mitokondrierne mulighed for bestemmelse af superoxid koncentration i forskellige cellulære rum.
I dyrkede celler, brug af celle permeable 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) langs med og uden celle-vandtætte Superoxid dismutase (SOD) forbehandling eller anvendelse af celle-gennemtrængelige PIND-SOD, giver mulighed for at differentiering af ekstracellulære fra cytosole superoxid. Den mitokondrielle 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] piperidinium dichloride (mito-TEMPO-H) giver mulighed for måling af mitokondrie ROS (overvejende superoxid).
Spin sonder og EPR spektroskopi kan også anvendes til i vivo modeller. Superoxid kan påvises i ekstracellulære væske som blod og alveolær væske samt væv såsom lungevæv. Flere metoder præsenteres for at behandle og opbevare væv for EPR målinger og levere intravenøs 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) spin sonde in vivo. Mens målinger kan udføres ved stuetemperatur, kan prøver fra in vitro- og i vivo modeller også opbevares ved-80 ° C og analyseret af EPR på 77 K. Prøverne kan gemmes i specialiserede slanger stabile ved-80 ° C og køre på 77 K til at aktivere en praktisk, effektiv, og reproducerbar metode, der letter lagring og overførsel prøver.
Introduction
Mens oxidativ stress og reaktive ilt arter er vigtige for studiet af forskellige sygdomme på tværs af alle organsystemer, er påvisning af reaktive ilt arter (ROS) udfordrende på grund af en kort halveringstid og høj reaktivitet. En elektron paramagnetisk resonans (EPR) teknik er den mest utvetydige metode til påvisning af frie radikaler. Spin sonder har fordele frem for de mere almindeligt brugte fluorescerende sonder. Selvom fluorescerende sonder er relativt billig og nem at bruge og giver hurtige, følsomme påvisning af ROS, har de alvorlige begrænsninger på grund af kunstig signaler, manglende evne til at beregne ROS koncentrationer, og en generel mangel på specificitet1 .
For at lette anvendelsen af EPR til biologiske undersøgelser, en bred vifte af spin sonder har været syntetiseret, der kan måle en række biologisk relevante frie radikaler arter samt pO2, pH og redox hedder2,3, 4,5,6,7. Spin traps har også udviklet til at fange kortlivede radikaler og form long-levende adukter, hvilket muliggør detektion ved EPR8. Begge klasser (spin sonder og spin traps) har fordele og begrænsninger. Almindeligt anvendte klasser i spin sonder er cyklisk hydroxylamines, som er EPR-tavs og reagere med kortvarig radikaler til at danne en stabil nitroxide. Cyklisk hydroxylamines reagerer med superoxid 100 gange hurtigere end spin traps, gør det muligt for dem at konkurrere med cellulære antioxidanter, men de mangler specificitet og har brug for passende kontrol og hæmmere at identificere radikale arter eller kilde ansvarlig for nitroxide signal. Mens spin fælder udstille specificitet, med særskilte spektrale mønstre afhængig af de fangne arter, de har langsom kinetik for superoxid spin diffusering og er udsat for bionedbrydning af radikale adukter. Ansøgninger om spin fældefangst har været veldokumenteret i biomedicinsk forskning9,10,11,12,13.
Målet med dette projekt er at demonstrere praktisk EPR metoder til at designe eksperimenter og prøver at opdage superoxid ved hjælp af spin sonder i forskellige cellulære rum in vitro og i forskellige væv rum i vivo. Flere manuskripter er offentliggjort protokollerne relevante for disse mål, ved hjælp af celle-gennemtrængelige, celle-vandtætte og mitokondriel målrettede spin sonder til forskellige cellulære rum i vitro og proces målvæv for analyse i musemodeller 14 , 15. vi bygge videre på dette organ af litteratur ved at validere en tilgang til at måle superoxid ved hjælp af en 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) spin sonde i forskellige cellulære rum i vitro for at sikre nøjagtig målinger, fremhæve eventuelle tekniske problemer, som kan give en skævhed resultater. Vi leverer også metoder til at udføre EPR målinger i blod, bronchoalveolar lavage væske og lungevæv ved hjælp af CMH spin sonde. Disse undersøgelser sammenligne forskellige metoder til at behandle væv samt præsentere en metode til at injicere en anden spin sonde, CPH, ind i musene før høst væv. Endelig vil udvikle vi en praktisk metode til at gemme prøver i polytetrafluorethylen (PTFE) slanger at give mulighed for lagring og overførsel af prøver før EPR målinger på 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle dyreforsøg blev godkendt af University of Colorado Denver institutionelle Animal Care og brug udvalget.
1. forberedelse af reagenser
-
Diethylenetriaminepentaacetic syre (DTPA) bestand (150 mM)
- Tilføje 2,95 g DTPA (393.35 g/mol) til 10 mL deioniseret vand.
- At opløse DTPA, tilføje 1 M NaOH dråbevis og bringe til en pH-værdi 7.0.
- Bringe lydstyrken til 50 mL med vand til en slutkoncentration DTPA på 150 mM, og opbevares ved 4 ° C.
-
Fosfat buffer saltvand (PBS) (50 mM, pH 7,4)
- Forberede 5 M natriumchlorid (NaCl) (58.44 g/mol, 29.22 g/100 mL).
- Forberede 1 M af kalium fosfat dibasiske HK2PO4 (174.18 g/mol, 17.42 g/100 mL)
- Forberede 1 M af kalium fosfat monobasic KH2PO4 (136.1 g/mol, 13.61 g/100 mL). Bland 3 mL af 5 M NaCl med 4,24 mL 1 M kalium fosfat dibasiske og 0.760 mL 1 M kalium fosfat monobasic. Tjek pH.
- Bringe volumen til 100 mL med deioniseret vand.
- Opbevares ved stuetemperatur (RT) for kortsigtet (dage) og ved 4 ° C for langvarig (uger) opbevaring.
-
Krebs-Henseleit buffer (KHB) indeholdende 100 µM DTPA
- Tilføj 33.3 µL af 150 mM DTPA stamopløsning i 50 mL konisk centrifugeglas.
- Bringe til en 50 mL volumen med Krebs-Henseleit buffer (KHB).
- Forberede frisk buffer med DTPA hver dag og holde det på RT.
-
Tris-EDTA buffer der indeholder saccharose
- Forberede 0,5 M Tris lager: opløses 15.14 g af Tris base (121.14 g/mol) i 150 mL deioniseret vand. Bruger HCl, ph indstilles til 7,8 og bringe til en endelige rumfang 250 mL.
- Opløse 21.4 g saccharose (342.29 g/mol; slutkoncentration = 0,25 mM) på 150 mL deioniseret vand.
- Tilsættes 5 mL af Tris materiel til saccharose at opnå en 10 mM Tris slutkoncentration.
- Tilføje 0,5 mL 0,5 M EDTA materiel til Tris-saccharose at opnå en 1 mM endelige koncentration.
- Kontrollere pH og justere det til 7,4.
- Bringe en endelige rumfang 250 mL med deioniseret vand og opbevares ved 4 ° C.
-
Kvæg erytrocyt Cu/Zn Superoxid dismutase (SOD) bestand (30.000 U/mL)
- Rekonstruere 30.000 U af SOD i 1 mL PBS (ca 5,7 mg, afhængigt af aktiviteten af SOD masse).
- Bland godt, alikvot, og opbevares ved-20 ° C for kort sigt (6-12 måneder) og ved-80 ° C til langtidsopbevaring.
-
SOD brugsopløsning (1000 U/mL)
- Overføre en 30 µL alikvot af 30.000 U/mL SOD bestand i en 870 µL sterilt PBS.
- Opløsningen på isen, og bruge det friske.
-
Phorbol 12-myristate 13-acetat (PMA) bestand (5 mM)
- Opløs 1 mg af PMA (616.83 g/mol) i 325 µL af DMSO (slutkoncentration = 5 mM).
- Alikvot en 5 mM PMA løsning, og opbevar den ved-20 ° C.
-
PMA brugsopløsning (125 µM)
- Fortynde en 10 µL alikvot af 5 mM PMA lager i 390 µL sterilt PBS.
- Opløsningen på is og bruge det frisk.
- For et køretøj kontrol til PMA, bruge 10 µL af DMSO i 390 µL af PBS.
-
Diphenyliodonium chlorid (DIP) (2,5 mM)
- 3,2 mg opløses DYPPE (316.57 g/mol) i 4 mL til at opnå en 2,5 mM bestand.
- Forberede løsningen og bruge det frisk.
-
Deferoxamin mesylat salt (DFO) (20 mM)
- Opløse 4,5 mg af DFO (656.79 g / mol) i 340 µL til at opnå en 20 mM bestand.
- Forberede løsningen og bruge det frisk.
-
Forberedelse af antimycin A (AA) bestand (5 mM)
- Opløse 5,4 mg af AA (532 g/mol) med 2 mL ethanol (slutkoncentration = 5 mM).
- Alikvot bestanden i hætteglas og opbevares ved-20 ° C.
-
Forberedelse af spin sonder
- Boble 50 mM fosfat buffer indeholdende 100 µM DTPA med kvælstof i 30 min til at fjerne opløst ilt fra bufferen.
- Fjerne spin sonden fra-20 ° C fryser og lade beholderen at komme til RT (10-15 min).
- Afvejes 2,4 mg af 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237.8 g/mol)
- Opløses CMH i 1 mL af deoxygenated fosfat buffer til en slutkoncentration på 10 mM.
- Der afvejes 5 mg af 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride (mito-TEMPO-H) (529.1 g/mol).
- Opløses mito-TEMPO-H i 1 mL af deoxygenated fosfat buffer til en endelig koncentration på 9,5 mM.
- Afvejes 4,9 mg af 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223.7 g/mol).
- Opløses CPH i 1 mL af deoxygenated fosfat buffer til en endelig koncentration på 22 mM.
- Alikvot og opbevares ved-80 ° C (fryse-tø anbefales ikke).
2. påvisning af superoxid in vitro
-
Påvisning af total, ekstracellulære og intracellulære superoxid i PMA-stimuleret RAW 264.7 celler på RT
- Følgende korrekt aseptisk teknik, tø RAW 264.7 celler og passage dem i DMEM medier suppleret med 10% FBS (lav endotoxin-fri) og 1% antimykotikum/ampicillin ved 37 ° C i CO2 inkubator.
- Frø RAW 264.7 celler på 1 x 106 celler/brønd i 6-godt plader en dag før behandling.
- Forsigtigt fjerne medier og vaske cellerne en gang med 1 mL af KHB buffer.
- Tilføje KHB indeholdende 100 µM DTPA til hver brønd, og behandle i en samlet maengde paa 500 µL med følgende:
- For wells forbehandlet med SOD, tilføje 15 µL/brønd af SOD brugsopløsning (1000 U/mL; endelige koncentration af SOD = 30 U/mL) og inkuberes i 10 min. ved 37 ° C inden tilsætning af CMH og PMA.
- Tilføje 12,5 µL/brønd af 10 mM CMH stock (slutkoncentration = 0,25 mM).
- Tilføje 40 µL/brønd af 125 µM PMA brugsopløsning (slutkoncentration = 10 µM) eller 40 µL køretøj (stock 10 µL af DMSO i 390 µL af PBS).
- Inkuber i 50 minutter ved 37 ° C i en CO2 inkubator.
- Fjerne pladerne fra rugemaskinen, og læg dem straks på is.
- Indsamle buffer fra hver brønd i separate, 1,5 mL, mærket rør. Holde på is i hele.
- Tilsæt 100 µL af frisk KHB buffer indeholdende 100 µM DTPA, forsigtigt skrabe cellerne, og pelleten af pipettering op og ned flere gange. Holde på is i hele cellen resuspension.
- Belastning prøven indsamles i trin 2.1.10 og 2.1.11 (50 µL) i hver af de kapillarrør. Forsegle begge ender og køre EPR.
Bemærk: Altid teste et rør eller godt (uden celler) indeholder sonden i buffer (samme koncentration = 0,25 mM), behandles på samme betingelser som cellerne (samme inkubationstiden og temperatur) som et kontrolelement, da baggrunden intensiteten af sonden er temperatur - og tidsafhængig. - EPR erhvervelse parametre er angivet følgende: mikroovn frekvens = 9.65 GHz; Center felt = 3432 G; graduering amplitude = 2,0 G; feje bredde = 80 G; mikroovn magt = 19,9 mW; samlede antal scanninger = 10; feje tid = 12.11 s; og tid konstant = 20.48 ms.
-
Påvisning af mitokondrie superoxid i RAW 264.7 celler
- Følg trin 2.1.1 og 2.1.2 til frø RAW 264.7 celler en dag før eksperimentet.
- Fjerne medier og vaske cellerne en gang med 1 mL af KHB buffer.
- Tilføje 200 µL af KHB indeholdende 100 µM DTPA til hver brønd.
- Tilføje 5,3 µL/brønd af 9,5 mM mito-TEMPO-H stock (slutkoncentration = 0,25 mM)
- Der inkuberes i 10 min. ved RT.
- Tilføj 1 µL/brønd af antimycin A (AA), 5 mM stamopløsning i ethanol (slutkoncentration = 25 µM).
- Inkuber i 50 minutter ved 37 ° C i en CO2 inkubator.
- Fjerne pladerne fra rugemaskinen, og læg dem straks på is.
- Forsigtigt skrabe cellerne og resuspend af pipettering op og ned. Holde på is.
- Læg prøven i et kapillarrør. Forsegle begge ender.
- Se foregående sektion for EPR indstilling.
-
Påvisning af superoxid i RAW 264.7 celler på 77 K
- Sted bufferen, der opsamlet i trin 1.1.10 i tilberedte PTFE slanger 1-2 inches i længde (3/16" OD x 1/8"-ID). Sørg for PTFE slanger er lige så det nemt kan indsættes og fjernes fra finger dewar. Bruge en gummiprop lukke ene ende af PTFE slanger, afpipetteres buffer eller cellesuspension (100-150 µL) i PTFE slanger og forsegle slangen med en anden prop.
- Flash fryse prøven i flydende kvælstof. Prøven kan overføres til et mærket kryopræservering rør til opbevaring på-80 ° C eller køre straks.
- Fylde fingeren dewar med flydende kvælstof og Indsæt PTFE slanger med prøven i fingeren dewar. Sørg for, at prøven er centreret i den aktive plads af resonator og køre EPR på 77 K.
Bemærk: Start nitrogen gasflow til din spektrometer 15-30 min før målingerne, og fortsætte denne flow i hele målinger til at forhindre vandkondensation i resonator. - EPR erhvervelse parametre er angivet følgende: mikroovn frekvens = 9.65 GHz; Center felt = 3438 G; graduering amplitude = 4,0 G; feje bredde = 150 G; mikroovn magt = 0.316 mW; samlede antal scanninger = 10; feje tid = 60 s; og tid konstant = 1,28 ms.
3. EPR målinger i væsker
-
Fuldblod
- Behandle mus (8-12 uger gamle) med en enkelt dosis af intratrakeal bleomycin (Bleo; 100 µL på 1 U/mL) opløses i PBS eller PBS alene som tidligere beskrevet16,17.
- Aflive mus ved at administrere inhaleret isofluran (1,5-4%) efterfulgt af exsanguination og cervikal dislokation. Opsug blod gennem højre hjertekammer i en sprøjte, belagt med heparin (1000 USP/mL) der indeholder 100 µM DTPA og overførsel til en 1,5 mL tube.
- I en separat 1,5 mL tube, tilføje 15 µL af PBS, som indeholder 100 µM DTPA og 3 µL af CMH (10 mM) til 132 µL af blod for en samlet maengde paa 150 µL og CMH slutkoncentration på 0,2 mM.
- Inkuber blod i 10 minutter ved 37 ° C i et vandbad.
- Fjerne rørene af vandbad.
- Tage en alikvot af indlæsning af blod i et kapillarrør og køre EPR på RT med følgende EPR erhvervelse parametre: mikroovn frekvens = 9.65 GHz; Center felt = 3432 G; graduering amplitude = 1,0 G; feje bredde = 80 G; mikroovn magt = 19,9 mW; samlede antal scanninger = 3; feje tid = 12.11 s; og tid konstant = 20.48 ms. alternativt prøver kan være flash frosset som beskrevet i trin 2.3 for målinger på 77 K. EPR erhvervelse parametre er følgende: mikroovn frekvens = 9.65 GHz; Center felt = 3438 G; graduering amplitude = 4,0 G; feje bredde = 150 G; mikroovn magt = 0.316 mW; samlede antal scanninger = 2; feje tid = 60 s; og tid konstant = 1,28 ms.
-
Bronchoalveolar lavage væske (BALF)
- Efter eutanasi (Se trin 3.1.2), indsamle BALF ved langsomt indlæringen og fratagelse af 1 mL PBS, som indeholder 100 µM DTPA tre gange i en sprøjte via en kanyle lagt i luftrøret.
- I en 1,5 mL tube, behandle 200 µL af BALF med 4 µL af CMH (10 mM) at opnå en endelig koncentration på 0,2 mM.
- Inkubér BALF i 50 minutter ved 37 ° C i et vandbad.
- Tage rør ud af vandbadet og placere dem på is.
- Belastning BALF i et kapillarrør og køre EPR på RT med samme EPR indstillinger som bruges i trin 1.1.13, eller flash fryse i flydende kvælstof som beskrevet i trin 2.3.
-
EPR målinger i blod og BALF på 77 K
- Følge protokollen ovenfor for at indsamle blod (trin 3.1.1. til 3.1.4) og BALF (trin 3.2.1 til 3.2.4).
- Sted 150 µL af behandlede blod eller BALF i PTFE slanger (1-2 tommer). Brug en gummiprop til at lukke ene ende af PTFE slangen før tilføjelse af prøven og en anden prop til at forsegle slangen.
- Flash fryse prøven i flydende kvælstof.
- Se afsnit 2.3 for detaljer om kører EPR i frosne prøver i PTFE slanger bruger fingeren dewar på 77 K. Run frosne CMH behandlet blodprøver med i en uge.
4. EPR målinger på lungevæv
-
Flash-frosset lungevæv
- Efter at indsamle BALF i trin 3.2.1, brystet er åbnet og lungerne skylles med 10 mL af kolde PBS via højre ventrikel for at fjerne blod. Flash fryse lungevæv i flydende kvælstof. Frosne lungevæv kan opbevares ved-80 ° C i op til 6 måneder indtil brug for EPR målinger.
- Stabilisere lungevæv på tøris med pincet og skåret flere små stykker (5-15 mg) af lungevæv ved hjælp af en enkelt-kant klinge.
- Vejer vævet i en 1,5 mL tube, placere røret på skalaen og Tara skala, derefter tilføje væv stykker og optage vægten.
- Væv i 1,5 mL tube, tilføje 196 µL af KHB indeholdende DTPA og 4 µL af CMH (0.2 mM) for at opnå en 200 µL samlede volumen.
- Inkuber i 1 time ved 37 ° C i et vandbad.
- Spin ned (for et par sekunder) i en microcentrifuge på 3.884 x g.
- Anbring på is og afpipetteres 150 µL af supernatanten i PTFE slanger og fryse i 77 K målinger som beskrevet i afsnit 2.3.
Bemærk: For denne metode, heterogenitet af skaden, der skal overvejes. For en bleomycin-induceret lunge skade, at det er en meget heterogen skade, er det anbefales at skære flere væv stykker fra forskellige dele af lungen fra hver mus. Alternativt, et større stykke væv kan være homogeniseret i KHB buffer indeholdende 100 µM DTPA i forholdet 1:6 vægt-til-volumen (mg/µL) som beskrevet nedenfor.
-
Frisk lungevæv bevaret i saccharose buffer
- Skyl lavaged lungerne med kolde PBS til at fjerne blod som gjort i trin 3.1.2.
- Homogeniseres frisk lungevæv i Tris-EDTA buffer indeholdende 0,25 M saccharose med forholdet 1:6 lunge/buffer (mg/µL) ved hjælp af Dounce væv vinkelsliber med et glas eller PTFE pistil.
- Tilføje 50 µL af lunge homogenatet til 450 µL af KHB indeholdende 100 µM DTPA.
- En 1,5 mL tube (i en samlet maengde paa 100 µL), at 98 µL af lunge homogenatet i KHB, Tilføj 2 µL af CMH 10 mM materiel til at opnå en endelig koncentration på 0,2 mM.
- Ruger i 20 min. 37 ° C i et vandbad.
- Placer prøverne på is og indlæse dem i et kapillarrør. Køre EPR på RT (indstillinger, der bruges i trin 2.1.13).
- Du kan teste specifikke arter og kilder ved hjælp af forskellige hæmmere bidrag, behandle pre 88 µL af lunge homogenatet +/-inhibitor, justere med KHB at opnå en endelige mængden af 98 µL. I dette eksperiment, inhibitorer inkluderet 10 µL af SOD (100 U/mL), 4 µL af deferoxamin (DFO; slutkoncentration = 800 µM), eller 4 µL af diphenyliodonium chloride (DIP; slutkoncentration = 100 µM). Inkuber i 20 minutter ved 37 ° C i et vandbad.
- Tilføj 2 µL af CMH og inkuberes i en anden 20 min ved 37 ° C, efterfulgt af EPR målinger som beskrevet ovenfor. Omfatte en engangs matchede blindprøve med CMH KHB indeholder saccharose buffer. Alternativt kan du gemme delprøver af de resterende lunge homogeniseret (trin 3.1.2) ved-80 ° C i kommende målinger.
Bemærk: Det samlede volumen kan skaleres efter behov.
-
EPR målinger på lungevæv fra musene injiceret med spin sonder i vivo (på RT ved hjælp af væv celle)
- Forberede CPH stamopløsning ved at opløse 4,9 mg af CPH i 1 mL filtreret og deoxygenated 50 mM fosfat buffer.
- Bedøver mus med inhaleret isofluran (1,5-4%) i 20-30 sekunder, indtil unresponsive til tå knivspids. Injicere mus via retroorbital rute med 100 µL af CPH spin sonden for en 25 g mus kropsvægt (sidste dosis = 20 mg/kg), og tillade sonde til at cirkulere for 1 h. umiddelbart efter retroorbital injektion, tilføje en dråbe af 0,5% proparacaine HCl på øjet område at preve NT øjensmerter og tørhed. Overvåge mus for 1 h og fortsætte til væv høst.
- Høste lungevæv, som beskrevet ovenfor og flash fryse lungerne.
- Skære 20-30 mg af frossen væv på tøris og optage den nøjagtige vægt.
- Forsigtigt tørre væv med rengøring klude til at absorbere enhver overfladevand.
- Placere vævet i vinduet af cellen væv (tilbehør tillader EPR målinger for vævsprøver) og køre EPR for at bestemme alt spins. Dataene kan udtrykkes som samlede spins pr. mg af væv.
5. dataanalyse
- Simulere EPR spektrene ved hjælp af SpinFit modul indbygget i Xenon-software af bænken-top EMXnano EPR spektrometer. Bestemme nitroxide koncentrationen af modulet SpinCount. Alternativt, en kalibreringskurve for en stabil nitroxide som 4-hydroxy-TEMPO eller TEMPOL kan gøres, og koncentrationen kan opnås ved at sammenligne intensiteten af signalet med prøve og standard.
- Data indsamlet på 77 K, bruge dobbelt integration efterfulgt af SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Superoxid påvisning ved hjælp af CMH blev valideret ved hjælp af X / XO superoxid generering system til at demonstrere, at nitroxide (CM.) signal var fuldt hæmmes af SOD, mens katalase havde ingen effekt (figur 1A). Den samlede, ekstracellulære superoxid blev derefter evalueres i RAW 264.7 celler af kvægbruget celler med celle-gennemtrængelige CMH spin sonden +/-SOD forbehandling. Nitroxide-koncentrationen blev målt i både cellesuspension og buffer, som viste, at værdierne i de to prøve typer var lignende gennemtrængelig natur og hurtige ækvilibrering spin prøvetagningssonden (figur 1B). Nitroxide radikale signal steg i RAW 264.7 celler stimuleret med PMA sammenlignet med kontrol celler. Dette signal blev væsentligt svækket i celler forbehandlet med celle-vandtætte SOD (figur 1 c). Hver farve repræsenterer wells testet på forskellige dage, demonstrerer sammenhængen i data indsamlet på bestemte dage og reproducerbarhed af resultaterne på tværs af tid. Koncentrationen af ekstracellulære superoxid var bestemmes ved at fratrække signal i PMA celler forbehandlet med SOD fra signalet efter PMA i fravær af SOD (T). Det resterende signal blev tilskrevet intracellulære superoxid (figur 1 c). Figur 1 d viser beregningen af samlede og ekstracellulære superoxid. (E) den intracellulære signal blev bekræftet i PMA-behandlede celler efter fjernelse af medierne og af virkningen af PEG-SOD på signalet. I denne graf, i modsætning til C, CMH Tom var ikke trækkes fra målingerne og de rå data er vist.
Mitokondrie superoxid i RAW 264.7 celler blev fundet ved hjælp af EPR spin sonde mito-TEMPO-H, der ophobes i mitochondia. (A) repræsentant EPR spectra til baseline mito-TEMPO-H signal i buffer, øget mito-TEMPO-H signalet i kontrol celler (Con), og den yderligere forbedret signal i celler stimuleret med den mitokondrielle hæmmer Antimycin A (AA). Stigning i signalet blev tilskrevet den mitokondrielle superoxid baseret på vores tidligere undersøgelse viser at SOD2 overekspression betydeligt svækket målinger med mito-TEMPO-H10. I figur 2Bbestemmes mitokondrie nitroxide koncentration ved at fratrække mito-TEMPO-H-signal i tid-matchede buffer fra celle målinger. CM. signal opnået ved lave temperaturer i RAW 264.7 celler efter stimulation med PMA i tilstedeværelse og fravær af SOD. (Figur 3A) CM. signalet blev dæmpet i overværelse af SOD, overensstemmelse med stuetemperatur data (figur 1). Figur 3B viser et fotografi af PTFE slanger med propper bruges til at indsamle data på 77 K til celler og i vivo prøver. Superoxid produktion blev fundet i blod og BALF ved hjælp af CMH spin sonde. Blod eller BALF prøver blev indsamlet fra PBS - og Bleo-behandlede mus og inkuberes straks med CMH. Prøverne blev overført til PTFE slanger og flash frosset, og EPR data blev indsamlet på 77 K. Koncentrationen af nitroxide (CM.) ophobes i blodet med CMH (0.2 mM) i varmeskab ved 37 grader i 10 min (figur 4A). Nitroxide (CM.) koncentration fra BALF inkuberes i 50 min (figur 4B). Nitroxide koncentration repræsenterer koncentrationen af (CM.) akkumuleret i mængden af blod eller BALF anvendes i forsøget.
Tre metoder er blevet testet for at evaluere flere offentliggjorte teknikker til væv bevarelse og forvaltning af spin sonder ex vivo vs. in vivo. For at udføre EPR målinger på lungevæv, vi først brugt flash frosset lungevæv fra kontrol eller skadet mus. Fig. 5A viser den samlede CM. signal i supernatanten af et lille stykke lungevæv inkuberes ved 37 ° C med CMH i PBS - og Bleo-behandlede mus, henholdsvis. På grund af heterogenitet af lunge skade efter Bleo behandling anbefales det at skære stykker fra forskellige områder af lungen og gennemsnitlig flere målinger til at skabe en mere repræsentativ værdi. Alternativt kan homogenisere hele lungen og bruge en prøve af denne homogenatet. Data indsamlet på 77 K ved hjælp af PTFE slanger og finger dewar. Figur 5B viser repræsentative spektre af nitroxide (CM.) signaler fra PBS - og Bleo-behandlede mus, henholdsvis.
En begrænsning til behandling af lunge væv ex vivo er, at det ikke er muligt at pålideligt skelne ekstracellulære fra intracellulære superoxid som følge af forarbejdning af væv, der forstyrrer cellemembraner. Hvis denne oplysning er vigtig på den eksperimentelle spørgsmål, kan det løses ved hjælp af i vivo CPH instillation metoden beskrevet nedenfor. Frossen væv kan ikke bruges til at evaluere mitokondrie superoxid; dog kan protokollen til denne måling skal tilpasses bruger mito-TEMPO-H i væv eller frisk isolerede mitochondrier.
Som en anden metode til EPR målinger i lungevæv, blev frisk væv homogeniseret i saccharose buffer. Lunge homogenatet blev inkuberet med CMH sonden i KHB buffer indeholdende DTPA. EPR målinger blev gennemført ud på RT. figur 6A viser stigningen i CM. med Bleo. Vi har fremlagt en supplerende test ved hjælp af forskellige hæmmere, der kan bruges til at bestemme de arter, der bidrager til fælles håndbog. signal. For at belyse oprindelsen af CM. signal genereret fra lungevæv, forbehandlet vi lunge homogeniseret med flere skraldemanden og enzymer hæmmere. Lunge homogeniseret blev inkuberet med CMH i fravær eller tilstedeværelse af SOD, deferoxamin (DFO) og diphenyliodonium chlorid (DIP) højde (henholdsvis) for bidrag fra superoxid, jern eller superoxid genereret fra flavin-holdige enzymer (figur 6B). Denne tilgang kan tilpasses til at vurdere de specifikke radikale arter genereret i et system eller belyse bidrag af andre enzymatiske kilder (fx., NOX, Enosh eller xanthin oxidase).
Mus blev sprøjtet med CPH spin sonder (20 mg/kg) via retroorbital ruten for at udføre EPR målinger in vivo. Det er uvist, hvorvidt CMH kan sikkert gives til dyr, mens CPH sonden er blevet rapporteret at være ikke-giftig; dermed, vi valgte CPH til i vivo forsøg. Lungevæv blev fældet og flash frosset i flydende nitrogen 1 h efter omsætning af CPH sonder. Mus kan behandles samtidig med specifikke antioxidanter til at differentiere de arter, der er ansvarlig for signalet. Figur 7A viser den højere CP. signal i Bleo-behandlede mus i forhold til kontrol mus. Repræsentative spektre af lungevæv fra kontrol og Bleo-behandlede mus er vist i figur 7B. En blandet EPR spektre af CP. og ascorbinsyre radikale blev observeret. De værdier, der er rapporteret i figur 7A er koncentrationerne af CP. komponenter. Data blev indsamlet på RT ved hjælp af cellen væv.
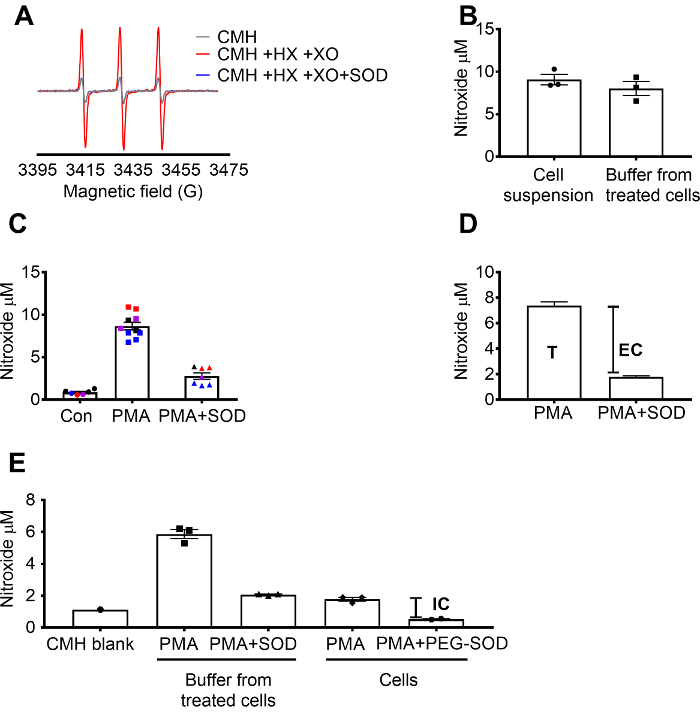
Figur 1: påvisning af superoxid i forskellige celle rum. (A) EPR spectra genereret af 0,25 mM CMH i 0,5 mM hypoxanthine/xanthin oxidase (8 mU/mL) med og uden SOD (30 U/mL). (B) RAW 264.7 celler (1 x 106 celler/brønd) blev stimuleret med 10 µM PMA i overværelse af CMH for 50 minutter ved 37 ° C og nitroxide koncentration (µM) opdaget i cellesuspension (buffer + celler) og buffer indsamlet fra behandlede celler. (C) RAW 264.7 celler blev stimuleret med PMA vs. køretøjet kontrol (Con). Et sæt af celler blev forbehandlet i 10 min med 30 U/mL celle-vandtætte SOD (PMA + SOD). Hver farve repræsenterer data fra forskellige eksperimentelle dage og hvert punkt repræsenterer celler fra et individ godt. Nitroxide signal i en tid-matchede Tom med CMH i KHB blev trukket fra hvert signal at få de endelige værdier. D beregningen af samlede og ekstracellulære superoxid i PMA stimuleret celler; T = total superoxid, EF = ekstracellulære superoxid (SOD inhibitable signal). (E) for at vurdere det intracellulære superoxid signal (IC), var signalet i buffer efter PMA + SOD i forhold til PMA-behandlede celler efter fjernelse af buffer. For at bekræfte, blev wells forbehandlet med 60 U/mL celle-gennemtrængelige PIND-SOD for 1,5 timer til at bestemme den intracellulære SOD inhibitable. Tid-matchede CMH blank er vist, og data afspejler absolutte nitroxide signal. Dataene udtrykt som gennemsnit ± SEM. venligst klik her for at se en større version af dette tal.

Figur 2: påvisning af mitokondrie superoxid i rå celler stimuleret med antimycin A. (A) repræsentative spektre af mitokondrie-specifikke EPR spin sonde, 0,25 mM mito-TEMPO-H i RAW 264.7 celler uden (Con) eller med 25 µM antimycin A (AA) i 50 min. ved 37 ° C. (B) CM. koncentration (µM) i celler behandles med AA i forhold til kontrol. Nitroxide signal i en tid-matchede mito-TEMPO-H Tom blev fratrukket samlede signal at få de endelige værdier. Dataene udtrykt som gennemsnit ± SEM. venligst klik her for at se en større version af dette tal.

Figur 3: påvisning af superoxid i RAW 264.7 celler på 77K. (A) RAW 264.7 celler stimuleret med 10 µM PMA og EPR spin sonde, CMH 0,25 mM (50 min ved 37 ° C) med (sort) eller uden (rød) forbehandling med 30 U/mL SOD. 100 µL af supernatanten blev indlæst i en 1-tommer i længden stykke af PTFE slanger, så flash frosset i flydende kvælstof. Propperne var fjernet, og frosne PTFE slanger var placeret i finger dewar for dataopsamling på 77 K. (B) en foto af PTFE slanger og propper. Venligst klik her for at se en større version af dette tal.

Figur 4: EPR målinger i blod og BALF fra kontrol og bleomycin-behandlede mus. Mus blev behandlet med en enkelt dosis af intratrakeal bleomycin (IT Bleo) (100 µL på 1 U/mL) eller PBS køretøj. På 7 dage, var mus bedøvede og aflivet. Blodet blev indsamlet via højre ventrikel punktering i en sprøjte, belagt med 1000 USP/mL heparin indeholdende 100 µM DTPA. Bronchoalveolar lavage væske (BALF) blev indsamlet af lavaging lunger med 1 mL 100 µM DTPA i PBS. Blod og BALF blev udruget for 10 eller 50 min, henholdsvis med 0,2 mM CMH ved 37 ° C. 150 µL af blod eller BALF blev indlæst i PTFE slanger flash frosset i flydende nitrogen og EPR data indsamlet på 77 K ved hjælp af en finger dewar. Data viser nitroxide koncentrationer i blodet (A) og (B) BALF fra PBS - og Bleo-behandlede mus (n = 4-6). Dataene udtrykt som betyder ± SEM. (C) Representative spektre af nitroxide i blodet fra PBS - og Bleo-behandlede mus. Venligst klik her for at se en større version af dette tal.

Figur 5: EPR målinger i flash frosset lungevæv. Mus blev behandlet med en enkelt dosis af intratrakeal bleomycin (IT bleo) (100 µL på 1 U/mL) eller PBS køretøj. På 7 dage, blev lungerne skyllet med koldt PBS til at fjerne blod og flash frosset i flydende kvælstof. 5-15 mg af flash-frosset lungevæv blev inkuberet med 0,2 mM CMH i KHB indeholdende 100 µM i 200 µL af samlede volumen i 1 timer ved 37° C. supernatanten blev indsamlet og anbragt i PTFE slanger og køre på 77 K i finger dewar. (A) Nitroxide koncentration (µM af nitroxide normaliseret til 1 mg af væv). Data repræsenterer gennemsnittet af 2-3 målinger for hver lunge. Dataene udtrykt som betyder ± SEM. (B) repræsentative spektre af nitroxide i lungevæv fra PBS - og Bleo-behandlede mus. Venligst klik her for at se en større version af dette tal.

Figur 6: EPR målinger i lungevæv bevaret i saccharose buffer. Mus blev behandlet med en enkelt dosis af intratrakeal bleomycin (100 µL på 1 U/mL). På 7 dage efter behandling, lungerne blev skyllet med koldt PBS til at fjerne blod og frisk lungevæv blev homogeniseret i Tris-EDTA buffer indeholdende 0,25 mM saccharose i forholdet 1:6 lunge vægt/buffer volumen (mg/µL). 50 µL af lunge homogenatet var forinkubereret med KHB med eller uden de følgende hæmmere i 20 min. på 37 ° C: SOD (100 U/mL), efterfulgt af inkubation med 0,2 mM CMH i KHB indeholdende 100 µM DTPA deferoxamin (DFO; 800 µM), og diphenyliodonium chlorid (DIP; 100 μM) i 20 min. ved 37 ° C. Data blev indhentet på RT bruger EPR kapillarrør. (A) Nitroxide koncentrationen i lungerne fra PBS - og Bleo-behandlede mus. (B) Nitroxide koncentration i Bleo lungerne i fravær eller tilstedeværelse af hæmmere (n = 3). Dataene udtrykt som gennemsnit ± SEM. venligst klik her for at se en større version af dette tal.

Figur 7: EPR målinger i lungevæv fra musene injiceret med CPH spin sonden. 100 µL af CPH blev administreret via retroorbital injektion til en endelig koncentration på 20 mg af CPH pr. kg kropsvægt. Efter 1 time af omsætning, mus blev aflivet, lungerne blev skylles med 10 mL af kolde PBS via højre ventrikel og lungevæv var flash frosset. 20 til 30 mg af lungevæv blev placeret i væv celle og EPR målinger udført på RT. A Data udtrykt spin / mg. (B) repræsentative spektre af nitroxide signal i PBS og Bleo lungevæv (* angiver overlapning med ascorbinsyre radikale). Dataene udtrykt som gennemsnit ± SEM. venligst klik her for at se en større version af dette tal.
| Hæmmere | Arter |
| Superoxiddismutase (SOD) | Ekstracellulære superoxid |
| Superoxid dismutase – polyethylenglycol (PEG-SOD) | Intracellulære superoxid |
| Katalase | Brintoverilte baseret radikaler |
| Urat | Peroxynitrate |
| Ethanol og DMSO | Hydroxyl radikale |
| Metal chelatorer | Metal-ioner (jern og kobber) |
Tabel 1. Fælles hæmmere bruges til at adskille arter ansvarlig for spin sonde oxidation.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Vurdering af frie radikaler produktion i biologiske indstillinger er vigtig i forståelsen redox reguleret signalering i sundhed og sygdom, men et mål for disse arter er meget udfordrende på grund af den korte half-life af frie radikaler arter og tekniske begrænsninger med almindeligt anvendte metoder. EPR er en værdifuld og kraftfulde værktøj i redox biologi, da det er den kun entydige metode til påvisning af frie radikaler. I dette projekt, vi vise praktiske EPR metoder til at designe eksperimenter og prøver at opdage ROS ved hjælp af spin sonder i forskellige cellulære rum i vitro og forskellige væv rum in vivo. Vi leverer også praktiske metoder til at håndtere biologiske prøver og gemme prøver for at forbedre effektiviteten.
Spin sonder reagere effektivt med ROS og producere en stabil nitroxide radikale, der kan detekteres med EPR. Flere derivater af spin sonde (cyklisk hydroxylamin) har været syntetiseret med forskellige permeabilitet karakteristika, som gør dem egnede til påvisning af frie radikaler produktion i forskellige cellulære rum10. Denne protokol udnyttet celle-gennemtrængelige spin sonde, CMH; dog kan uigennemtrængelige spin sonden 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chlorid HCl (CAT1H) bruges til at registrere ekstracellulære superoxid. Svarende til vores forudgående undersøgelse i menneskelige lymphoblast celle linjer18, vi var i stand til at validere anvendelsen af gennemtrængelig CMH spin sonden med impermeable SOD og celle gennemtrængelig PIND-SOD i RAW264.7 celler (en mus lunge makrofag cellelinje) stimuleres med PMA til skelne mellem ekstracellulære og intracellulære superoxid.
Vi også valideres den hurtige ækvilibrering af CMH mellem intra og ekstra cellular rum, og vi fandt også, at superoxid signal i celler falder betydeligt efter vask celler kun én gang med KHB (data ikke vist). Vi bekræftede nytte af mitokondrie specifikke spin sonde mito-TEMPO-H i RAW 264.7 celler til at måle den øget mitokondriel superoxid genereret ved stimulation med mitokondrie elektron transport kæde hæmmer antimycin A. Særlige bidrag af mitokondrie superoxid produktion til mito-TEMPO-Hansen har tidligere vist og kan valideres i eksperimenter ved hjælp af isolerede frisk mitokondrier eller systemer med mitokondrie superoxiddismutase MnSOD (SOD2) overekspression10.
Vurdering af ROS produktion i vivo er særligt udfordrende, men evnen til at opdage produktion af specifikke ROS giver vigtige oplysninger når spørgekriterierne rolle oxidativ stress eller redox reguleret signalering i biologiske indstillinger. Passende håndtering af væv ved brug af spin sonder og EPR er afgørende for at generere reproducerbare og meningsfulde resultater. Brugen af spin sonder med væv vil ikke sandsynligt foranstaltning superoxid radikaler stede samtidig med væv høst på grund af en kort halveringstid, men i stedet det registrerer superoxid produceret af enzymer såsom NAPDH oxidase, afkoblede endotelial nitrogenoxid syntase , eller xanthin oxidase når lungevæv eller homogeniseret inkuberes med spin sonden ved 37 ° C. Brugen af frossen væv vil ikke omfatte superoxid genereret af mitokondrier, siden nedfrysning skader mitokondrie elektron transport kæde aktivitet. For at teste mitokondrie superoxid, skal efterforskere isoleres frisk mitokondrier eller brug mitokondrie specifikke sonder i vivo eller i frisk væv.
Flere forskellige protokoller til at bevare vævet er blevet offentliggjort i litteratur14,15. Vi sammenlignede tre offentliggjort metoder for EPR målinger i lungevæv: 1) flash fryser væv i flydende kvælstof, 2) homogenisering væv i saccharose buffer og 3) behandling af musene i vivo med et spin sonde 1 time før væv høst. Vi sammenlignede kontrol mus til mus med alvorlige lungebetændelse og oxidativ stress induceret af bleomycin at teste hver metode evne til at vise konsekvente forskelle i nitroxide signaler i sårede lunger. Alle tre metoder viste en lignende relativ stigning i nitroxide signal i lungerne af bleomycin-behandlede mus. Brug af flash frossen væv ville sandsynligvis være den nemmeste tilgang til at indsamle væv for de fleste labs, bevirke, at behovet at behandle væv i saccharose buffer på tidspunktet for høsten. Injektion af CPH at fange frie radikaler i vivo er kraftfuld, men for at bekræfte den specifikke arter, dette kræver en behandling gruppen herunder passende antioxidant.
En udfordring ved hjælp af spin sonder er at oxidation af spin sonder til nitroxide genererer en tilsvarende tre-linjers EPR spektrum uanset de arter, der er ansvarlig for oxidation; således er skelner det ikke mellem forskellige ROS arter. Også, det er blevet rapporteret, at der er potentielle reaktioner af hydroxylamin sonder med fotosyntetiske elektron transport kæde og cytokrom c oxidase19,20. Disse bemærkninger bør overvejes ved fortolkningen af resultaterne. I denne protokol, den fotosyntetiske system er ikke til stede, og indlemmelsen af DTPA med bufferen hæmmer risikoen for kontaminering af gratis jern og acetatekstraktion ioner10 . Vi vist, hvordan du kan bruge en række specifikke enzymer eller chelatorer i lungevæv for at etablere bidrag af særlig ROS eller enzyminhibitorer at fastslå kilden til ROS. Denne tilgang har tidligere været anvendt med EPR for at bestemme bidrag af ROS på grund af afkoblede Enosh13,15. Vi leverer en liste over fælles hæmmere bruges til at adskille arter ansvarlig for spin sonde oxidation (tabel 1).
Vi viste også betydningen af at optimere inkubationstiden for hver eksperimentelle betingelse. Når man sammenligner spin sonder for at spinde fælder, generere spin traps unikke spektre afhængigt af reaktanter, som giver mulighed for specificitet af frie radikaler arter; men de også udstille langsom kinetik for superoxid spin diffusering og er udsat for bionedbrydning. Behandling af lungevæv med EPR sonde ex vivo er også begrænset af manglende evne til at skelne tilstrækkeligt mellem ekstracellulære fra intracellulære superoxid på grund af afbrydelse af cellemembraner under behandlingen af væv (frysning eller homogenisering). Brug af den injicerede spin sonden i vivo sammenholdt med SOD eller celle-gennemtrængelige PIND-SOD kan løse dette problem.
Ét mål var at etablere en protokol til effektivt at indsamle prøver og gemme dem på-80 ° C før EPR målinger. Vi har derfor udviklet en praktisk metode til at bruge PTFE slanger til at holde prøver. Denne slange er placeret direkte i fingeren dewar for EPR analyse på 77 K uden at skulle rengøre dewar mellem prøver. Dette er et alternativ til den nyligt offentliggjorte metode der omfatter indefrysning af prøver i 1 mL sprøjter. Målinger i frosne prøver opbevares i PTFE slanger kan blive gentaget over flere dage til at demonstrere stabilitets af signalet. Denne tilgang giver mulighed for vejeafmålings EPR målinger og letter overførsel af prøver mellem laboratorier så en remote EPR facilitet kan køre prøver.
Samlet, disse protokoller giver en ligetil tilgang til udarbejdelse af celler og væv for EPR målinger i biologiske systemer. Protokollerne kan tilpasses andre modeller, der er forbundet med oxidativ stress og anvendelse af andre spin sonder. Timing og koncentration af spin sonden skal være justeret for hver eksperimentelle betingelse. EPR evne til at bestemme tilstedeværelsen og produktion af frie radikaler arter utvetydigt giver stringens til eksperimenterende tilgange inden for redox biologi.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
Dette arbejde blev støttet af University of Colorado School of Medicine Deans strategiske forskningsinfrastruktur award, R01 HL086680-09 og 1R35HL139726-01, at E.N.G. og UCD CFReT fellowship award, (han). Forfatterne takke Dr. Sandra Eaton og Dr. Gareth Eaton (universitetet i Denver), Dr. Gerald Rosen og Dr. Joseph P. Kao (University of Maryland), og Dr. Sujatha Venkataraman (University of Colorado Denver) til nyttige diskussioner og Joanne Maltzahn, Ashley Trumpie og Ivy McDermott (University of Colorado Denver) for teknisk support.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



