Summary
Par spectroscopie de résonance paramagnétique (EPR) est une méthode non équivoque pour mesurer des radicaux libres. L’utilisation de sondes de spin sélectif permet une détection des radicaux libres dans les différents compartiments cellulaires. Nous présentons une méthode pratique et efficace pour collecter des échantillons biologiques qui facilitent le traitement, stockage et transfert des échantillons pour des mesures de l’EPR.
Abstract
La détection précise et spécifique des espèces réactives de l’oxygène (ROS) dans les différents compartiments cellulaires et tissulaires est essentielle à l’étude de l’oxydo-réduction réglementées de signalisation dans les milieux biologiques. Spectroscopie de résonance paramagnétique électronique (RPE) est la méthode directe d’évaluer sans ambiguïté les radicaux libres. Son avantage est qu’il détecte des niveaux physiologiques des espèces spécifiques avec une grande spécificité, mais elle requiert la technologie spécialisée, préparation minutieuse et des contrôles appropriés afin d’assurer une interprétation précise des données. Sondes de spin hydroxylamine cyclique réagissent sélectivement avec superoxyde ou autres radicaux pour générer un signal nitroxyde pouvant être quantifiées par spectroscopie RPE. Sondes de spin perméable à la cellule et sondes de spin conçus pour accumuler rapidement dans les mitochondries permettent la détermination de la concentration de superoxyde dans les différents compartiments cellulaires.
Dans les cellules cultivées, l’utilisation de 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine cellulaires perméables (CMH) avec et sans prétraitement de cellule-imperméable superoxyde dismutase (SOD) ou de cellules perméables PEG-SOD, permet la différenciation des extracellulaire de superoxyde cytosolique. Le 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido mitochondrial] pipéridinium dichlorure (mito-TEMPO-H) permet de mesurer des ROS mitochondriale (principalement le superoxyde).
Sondes de spin et spectroscopie RPE peuvent également être appliquées en vivo modèles. Superoxyde peut être détectée en fluides extracellulaires comme le sang et le liquide alvéolaire, ainsi que les tissus tels que les tissus pulmonaires. Plusieurs méthodes sont présentées pour traiter et stocker les tissus pour les mesures de l’EPR et livrer de sonde 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine en intraveineuse (CPH) spin in vivo. Tandis que les mesures peuvent être réalisées à température ambiante, échantillons obtenus à partir des modèles in vitro et in vivo peuvent également être stockées à-80 ° C et analysés par EPR à 77 K. Les échantillons peuvent être stockés dans l’écurie de tubes spécialisés à-80 ° C et exécutées à 77 K pour permettre une pratique, efficace et une méthode reproductible qui facilite le stockage et transfert des échantillons.
Introduction
Alors que les mesures du stress oxydatif et les espèces réactives de l’oxygène sont importants pour l’étude de diverses maladies à travers tous les systèmes organiques, la détection des espèces réactives de l’oxygène (ROS) est difficile en raison d’une courte demi-vie et forte réactivité. Une technique de résonance paramagnétique (RPE) des électrons est la méthode la plus claire pour la détection des radicaux libres. Sondes de spin ont des avantages sur des sondes fluorescentes plus couramment utilisés. Bien que des sondes fluorescentes sont relativement peu coûteux et facile à utiliser et offrant une détection rapide et sensible de ROS, ils ont de sérieuses limites à cause des signaux artéfactuelle, une incapacité à calculer les concentrations de ROS et un manque général de spécificité1 .
Pour faciliter l’utilisation de l’EPR pour des études biologiques, une variété de spin sondes ont été synthétisés qui permet de mesurer une gamme d’espèces radicalaires biologiquement pertinente ainsi que pO2, pH et redox indique2,3, 4,5,6,7. Pièges à spin ont également été développés pour capter les radicaux éphémères et forme longue durée de vie des adduits, qui facilite la détection par RPE8. Les deux classes (sondes de spin et pièges à spin) ont des avantages et des limites. Une classe couramment utilisée des sondes de spin sont des hydroxylamines cycliques, qui sont des EPR en silence et réagissent avec des radicaux pour former un nitroxyde stable de courte durée. Hydroxylamines cycliques réagissent avec le superoxyde 100 fois plus vite que les pièges à spin, ce qui leur permet de rivaliser avec les antioxydants cellulaires, mais ils manquent de spécificité et nécessitent l’utilisation de contrôles appropriés et les inhibiteurs d’identifier les espèces radicalaires ou source responsable pour le signal nitroxyde. Tandis que spin intercepte la spécificité de la pièce, avec distinctes spectrale que modèles selon l’espèce pris au piège, ils ont cinétique lente pour superoxyde spin piégeage et sont sujette à la biodégradation du radical adduits. Demandes de piégeage de spin ont été bien étudiées dans la recherche biomédicale9,10,11,12,13.
L’objectif de ce projet est de démontrer les méthodes pratiques d’EPR pour concevoir des expériences et préparation des échantillons pour détecter des superoxyde à l’aide de spin des sondes dans les différents compartiments cellulaires in vitro et dans des tissus différents compartiments in vivo. Plusieurs manuscrits ont publié les protocoles pertinents à atteindre ces objectifs, en utilisant des sondes de spin ciblées perméable à la cellule et cellule-imperméable mitochondriale au tissu de cible différents compartiments cellulaires in vitro et processus pour analyse dans des modèles murins 14 , 15. nous inspirer de ce corpus de textes en validant une approche pour mesurer la superoxyde en utilisant une sonde de spin (CMH) 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine dans différents compartiments cellulaires in vitro afin d’assurer la précision mesures, mettant en évidence les éventuels problèmes techniques qui peuvent biaiser les résultats. Nous fournissons également des méthodes permettant d’effectuer des mesures de l’EPR dans le sang, le liquide de lavage broncho-alvéolaire et du tissu pulmonaire à l’aide de la sonde de spin CMH. Ces études comparent différentes méthodes pour traiter les tissus ainsi que pour présenter une méthode pour injecter une autre sonde de spin, CPH, à des souris avant la récolte de tissus. Enfin, nous développons une méthode pratique pour stocker les échantillons dans un tube de polytétrafluoroéthylène (PTFE) pour permettre le stockage et le transfert des échantillons avant mesures EPR à 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Toutes les études animales ont été approuvés par l’Université du Colorado Denver institutionnels et animalier Comité d’urbanisme.
1. préparation des réactifs
-
Stock d’acide (DTPA) Diéthylènetriaminepentaacétique (150 mM)
- Ajouter 2,95 g de DTPA (393.35 g/mol) à 10 mL d’eau désionisée.
- Pour dissoudre le DTPA, 1 NaOH M, ajouter quelques gouttes et porter à un pH de 7.0.
- Porter le volume à 50 mL avec de l’eau pour une concentration finale de DTPA de 150 mM et conserver à 4 ° C.
-
Saline de tampon phosphate (PBS) (50 mM, pH 7,4)
- Préparer 5 M de chlorure de sodium (NaCl) (58.44 g/mol ; 29,22 g/100 mL).
- Préparer 1 M de potassium phosphate dibasique HK2PO4 (174.18 g/mol ; 17,42 g/100 mL)
- Préparer 1 M de potassium phosphate monobasique KH2PO4 (136,1 g/mol ; 13,61 g/100 mL). Mélanger 3 mL de 5 M de NaCl avec 4,24 de 1 M de phosphate de potassium dibasique et 0,760 mL de 1 M potassium phosphate monobasique. Vérifier le pH.
- Porter le volume à 100 mL avec de l’eau désionisée.
- Stocker à température ambiante (RT) de courte durée (jours) et à 4 ° C pour le stockage à long terme (semaines).
-
Tampon de Krebs-Henseleit (KHB) contenant 100 µM DTPA
- Dans le tube à centrifuger conique 50 mL, ajouter 33,3 µL de solution mère de DTPA 150 mM.
- Porter à un volume de 50 mL avec un tampon Krebs-Henseleit (KHB).
- Préparation du tampon frais de DTPA chaque jour et gardez-le à température ambiante.
-
Tampon tris-EDTA contenant du saccharose
- Préparation 0,5 M Tris stock : dissoudre 15,14 g de base Tris (121,14 g/mol) dans 150 mL d’eau désionisée. À l’aide de HCl, ajuster le pH à 7,8 et porter à un volume de 250 mL.
- Dissoudre 21,4 g de saccharose (342.29 g/mol ; concentration finale = 0,25 mM) dans 150 mL d’eau désionisée.
- Ajouter 5 mL de Tris stock de saccharose pour obtenir une concentration finale de Tris 10 mM.
- Ajouter 0,5 mL de stock EDTA 0,5 M à Tris-saccharose pour obtenir une concentration finale de 1 mM.
- Vérifier le pH et l’ajuster à 7,4.
- Porter à un volume de 250 mL avec de l’eau désionisée et conserver à 4 ° C.
-
Érythrocytaires bovines stock de Cu/Zn superoxyde dismutase (SOD) (30 000 U/mL)
- Reconstituer les 30 000 U de SOD dans 1 mL de PBS (environ 5,7 mg, selon l’activité de beaucoup de gazon).
- Bien mélanger, partie aliquote et conserver à-20 ° C à court terme (6 à 12 mois) et à-80 ° C pour le stockage à long terme.
-
Solution de travail SOD (1000 U/mL)
- Transférer une quantité de 30 µL de 30 000 actions SOD U/mL dans un 870 µL de PBS stérile.
- Conserver la solution sur la glace et l’utiliser fraîche.
-
Phorbol 12-myristate 13-acétate (PMA) stock (5 mM)
- Dissoudre 1 mg de PMA (616.83 g/mol) à 325 µL de DMSO (concentration finale = 5 mM).
- Aliquote une solution PMA de 5 mM et conserver à-20 ° C.
-
Solution de travail de PMA (125 µM)
- Diluer une aliquote de 10 µL de stock PMA 5 mM en 390 µL de PBS stérile.
- Conserver la solution sur la glace et l’utiliser fraîche.
- Pour un contrôle de véhicule pour la PMA, utiliser 10 µL de DMSO pour 390 µL de PBS.
-
Chlorure de Diphényliodonium (DIP) (2,5 mM)
- Dissoudre 3,2 mg de plonger (316.57 g/mol) dans 4 mL pour obtenir un stock de 2,5 mM.
- Préparer la solution et l’utiliser fraîche.
-
Déféroxamine mésylate sel (MPO) (20 mM)
- Dissoudre 4,5 mg du MPO (656,79 g / mol) à 340 µL d’obtenir un stock de 20 mM.
- Préparer la solution et l’utiliser fraîche.
-
Préparation de l’antimycine stock A (AA) (5 mM)
- Dissoudre 5,4 mg de AA (532 g/mol) dans 2 mL d’éthanol (concentration finale = 5 mM).
- Aliquote du stock en flacons en verre et conserver à-20 ° C.
-
Préparation des sondes de spin
- Tampon de phosphate 50 mM bulle contenant 100 µM DTPA avec de l’azote pendant 30 min enlever l’oxygène dissous dans la zone tampon.
- Retirer la sonde de spin du congélateur-20 ° C et laisser le conteneur à venir jusqu'à la RT (10-15 min).
- Peser à 2,4 mg de 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237,8 g/mol)
- Dissoudre le CMH dans 1 mL de tampon phosphate désoxygéné pour une concentration finale de 10 mM.
- Peser 5 mg de dichlorure de 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium (mito-TEMPO-H) (529.1 g/mol).
- Dissoudre le mito-TEMPO-H dans 1 mL de tampon phosphate désoxygéné pour une concentration finale de 9,5 mM.
- Peser de 4,9 mg de 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223,7 g/mol).
- Dissoudre le CPH dans 1 mL de tampon phosphate désoxygéné pour une concentration finale de 22 mM.
- Aliquote et conserver à-80 ° C (gel-dégel n’est pas recommandé).
2. détection de superoxyde in vitro
-
Détection du superoxyde total extracellulaire et intracellulaire en stimulée par la PMA 264.7 cellules crues à ta
- Suivant une technique aseptique appropriée, décongeler 264.7 cellules crues et leur passage dans le milieu DMEM avec 10 % BF (basse exempte d’endotoxine) et 1 % antimycosiques/ampicilline à 37 ° C dans un incubateur de CO2 .
- Semences 264.7 cellules crues à 1 x 106 cellules/puits dans les plaques 6 puits un jour avant le traitement.
- Retirez média doucement et laver les cellules une fois avec 1 mL de tampon KHB.
- Ajouter KHB contenant 100 µM DTPA à chaque puits et traiter un volume total de 500 µL par ce qui suit :
- Pour les puits prétraités avec SOD, ajouter 15 µL/puits de la solution de travail SOD (1000 U/mL ; concentration finale de SOD = 30 U/mL) et incuber pendant 10 min à 37 ° C avant l’addition du CMH et PMA.
- Ajouter 12,5 µL/puits de stock CMH 10 mM (concentration finale = 0,25 mM).
- Ajouter 40 µL/puits de la solution de travail de PMA 125 µM (concentration finale = 10 µM) ou 40 µL véhicule (stock de 10 µL de DMSO pour 390 µL de PBS).
- Incuber pendant 50 min à 37 ° C dans un incubateur à CO2 .
- Enlever les plaques de l’incubateur et placez-les immédiatement sur la glace.
- Recueillir des tampon de chaque puits en séparé, 1,5 mL étiqueté tubes. Rester sur la glace tout au long.
- Ajouter 100 µL de tampon KHB frais contenant 100 µM DTPA, délicatement racler les cellules et remettre en suspension en pipettant également monter et descendre plusieurs fois. Rester sur la glace tout au long de la remise en suspension cellulaire.
- Charge l’échantillon collectées lors des étapes 2.1.10 et 2.1.11 (50 µL) dans chacun des tubes capillaires. Sceller les extrémités, puis exécutez l’EPR.
NOTE : Toujours un tube d’essai ou bien (sans cellules) contenant la sonde dans un tampon (même concentration = 0,25 mM), traités dans les mêmes conditions que les cellules (même temps de l’incubation et la température) comme témoin, puisque l’intensité du fond de la sonde est température - et dépendant du temps. - Définir les paramètres d’acquisition EPR à ce qui suit : micro-ondes fréquence = 9,65 GHz ; champ centre = 3432 G ; modulation d’amplitude = 2,0 G ; largeur de balayage = 80 G ; four à micro-ondes puissance = 19,9 mW ; nombre total d’analyses = 10 ; temps de balayage = 12.11 s ; et la constante de temps = 20,48 ms.
-
Détection du superoxyde mitochondriale dans les 264.7 cellules crues
- Suivez les étapes 2.1.1 et 2.1.2 pour semences 264.7 cellules crues un jour avant l’expérience.
- Retirer et laver les cellules une fois avec 1 mL de tampon KHB.
- Ajouter 200 µL de KHB contenant 100 µM DTPA à chaque puits.
- Ajouter 5,3 µL/puits de stock mito-TEMPO-H 9,5 mM (concentration finale = 0,25 mM)
- Incuber pendant 10 min à température ambiante.
- Ajouter 1 µL/puits de l’antimycine A (AA), la solution mère de 5 mM dans l’éthanol (concentration finale = 25 µM).
- Incuber pendant 50 min à 37 ° C dans un incubateur à CO2 .
- Enlever les plaques de l’incubateur et placez-les immédiatement sur la glace.
- Doucement, gratter les cellules et remettre en suspension par pipetage de haut en bas. Rester sur la glace.
- Charger l’échantillon dans un tube capillaire. Sceller les extrémités.
- Consultez la section précédente pour REGL.
-
Détection de superoxyde dans les 264.7 cellules crues à 77 K
- Placer le tampon recueilli à l’étape 1.1.10 en PTFE préparé à l’avance 1-2 pouces de longueur (3/16" OD x 1/8" ID) de tubes. Assurez-vous que le tube PTFE est droit, donc il peut être facilement inséré et retiré du doigt dewar. Utilisez un bouchon en caoutchouc pour fermer une des extrémités du tube PTFE, pipeter le tampon ou la suspension de cellules (100 à 150 µL) dans le tube PTFE et scelle le tube avec un bouchon en deuxième.
- Flash gel l’échantillon dans l’azote liquide. L’échantillon peut être transférée dans un tube marqué cryoconservation pour stockage à-80 ° C ou exécuter immédiatement.
- Remplir le doigt dewar azote liquide et insérez le tube PTFE contenant l’échantillon dans le doigt dewar. Assurez-vous que l’échantillon est centré dans l’espace actif du résonateur et exécutez EPR à 77 K.
NOTE : Démarrer le flux de gaz d’azote à votre spectromètre de 15-30 min avant les mesures et continuer ce flux ensemble des mesures pour empêcher la condensation d’eau dans la caisse de résonance. - Définir les paramètres d’acquisition EPR à ce qui suit : micro-ondes fréquence = 9,65 GHz ; champ centre = 3438 G ; modulation d’amplitude = 4,0 G ; largeur de balayage = 150 G ; four à micro-ondes puissance = 0,316 mW ; nombre total d’analyses = 10 ; temps de balayage = 60 s ; et la constante de temps = 1,28 ms.
3. EPR mesures dans les fluides
-
Sang total
- Traiter des souris (âgés de 8 à 12 semaines) avec une dose unique de bléomycine intratrachéale (Bleo ; 100 µL à 1 U/mL) dissoute dans PBS ou PBS seul comme précédemment décrit16,17.
- Euthanasier souris par l’administration par inhalation isoflurane (1,5 à 4 %) suivi d’une exsanguination et dislocation cervicale. Aspirer une seringue enduite avec de l’héparine (1000 USP/mL) contenant 100 µM DTPA et transférez dans un tube de 1,5 mL de sang dans le ventricule droit.
- Dans un tube séparé de 1,5 mL, ajouter 15 µL de PBS contenant 100 µM DTPA et 3 µL du CMH (10 mM) à 132 µL de sang pour un volume total de 150 µL et concentration finale de CMH de 0,2 mM.
- Incuber le sang pendant 10 min à 37 ° C dans un bain d’eau.
- Retirer les tubes du bain-marie.
- Prélever une partie aliquote de sang dans un tube capillaire de chargement et d’exécuter des EPR à RT avec les paramètres d’acquisition EPR suivants : fréquence de micro-onde = 9,65 GHz ; champ centre = 3432 G ; modulation d’amplitude = 1,0 G ; largeur de balayage = 80 G ; four à micro-ondes puissance = 19,9 mW ; nombre total d’analyses = 3 ; temps de balayage = 12.11 s ; et la constante de temps = Mme 20,48 alternativement, les échantillons peuvent être flash congelés comme décrit dans étape 2.3 aux mensurations à 77 paramètres d’acquisition de K. EPR sont les suivantes : fréquence de micro-onde = 9,65 GHz ; champ centre = 3438 G ; modulation d’amplitude = 4,0 G ; largeur de balayage = 150 G ; four à micro-ondes puissance = 0,316 mW ; nombre total d’analyses = 2 ; temps de balayage = 60 s ; et la constante de temps = 1,28 ms.
-
Lavage bronchoalvéolaire (LBA)
- Après l’euthanasie (voir étape 3.1.2), recueillir BALF par instiller lentement et le retrait de 1 mL de PBS contenant 100 µM DTPA trois fois dans une seringue via une canule placée dans la trachée.
- Dans un tube de 1,5 mL, traiter 200 µL de BALF 4 µl de CMH (10 mM) pour obtenir une concentration finale de 0,2 mM.
- Incuber BALF pendant 50 min à 37 ° C dans un bain d’eau.
- Prenez les tubes hors de l’eau du bain et placez-les sur la glace.
- Charge BALF dans un tube capillaire et exécution EPR à RT avec les mêmes paramètres EPR tel qu’utilisé dans l’étape 1.1.13 ou flash congélation dans l’azote liquide comme indiqué au point 2.3.
-
Mesures de l’EPR dans le sang et BALF à 77 K
- Suivre le protocole ci-dessus pour recueillir le sang (étapes 3.1.1. à 3.1.4) et BALF (étapes 3.2.1 à 3.2.4).
- Place 150 µL de sang traité ou BALF en PTFE, tube (1 à 2 po). Utilisez un bouchon en caoutchouc pour fermer une extrémité du tube PTFE avant d’ajouter l’échantillon et un autre bouchon pour sceller le tuyau.
- Flash gel l’échantillon dans l’azote liquide.
- Voir la section 2.3 pour plus d’informations sur l’exécution des EPR dans les échantillons congelés en tuyau de PTFE à l’aide du doigt que Dewar à 77 K. exécuter surgelés CMH traités avec des échantillons de sang dans une semaine.
4. EPR mesures sur des tissus pulmonaires
-
Flash du tissu pulmonaire congelés
- Après avoir recueilli la BALF dans étape 3.2.1, le coffre est ouvert et poumons rincée avec 10 mL de PBS froid via le ventricule droit pour enlever le sang. Flash gel le tissu pulmonaire dans l’azote liquide. Les tissus pulmonaires congelés peuvent être stockées à-80 ° C pendant 6 mois jusqu'à l’utilisation pour les mesures de l’EPR.
- Stabiliser le tissu pulmonaire sur la glace sèche avec des pincettes et couper de multiples petits morceaux (5-15 mg) du tissu pulmonaire à l’aide d’une lame simple.
- Peser le tissu dans un tube de 1,5 mL, placer le tube sur la balance et tarer la balance, puis ajoutez les morceaux de tissu et enregistrer le poids.
- Dans le tissu dans le tube de 1,5 mL, ajouter 196 µL de KHB contenant DTPA et 4 µL de CMH (0,2 mM) pour obtenir un volume total de 200 µL.
- Incuber pendant 1 heure à 37 ° C dans un bain d’eau.
- Tournez vers le bas (pendant quelques secondes) dans une micro-centrifugeuse à 3 884 x g.
- Placer sur la glace et distribuer 150 µL de surnageant dans le tube PTFE et congeler pour les mesures de 77 K, tel que décrit à la section 2.3.
Remarque : Pour cette méthode, l’hétérogénéité de la lésion doit être examinée. Pour une lésion pulmonaire induite par la bléomycine, étant donné que c’est une blessure très hétérogène, il est recommandé de couper plusieurs morceaux de tissus de différentes parties du poumon de chacune des souris. Sinon, un gros morceau de tissu peut être homogénéisé dans un tampon KHB contenant 100 µM DTPA à un rapport de poids-volume 1:6 (mg/µL), tel que décrit ci-dessous.
-
Tissu de poumon frais conservé dans un tampon saccharose
- Rincez les poumons lavés avec du PBS froid pour enlever le sang fait à l’étape 3.1.2.
- Homogénéiser le tissu de poumon frais dans un tampon Tris-EDTA contenant 0,25 M de saccharose avec un ratio de poumon/tampon (mg/µL) de 1:6 en utilisant Dounce meuleuse de tissu avec un verre ou un pilon PTFE.
- Ajouter 50 µL de l’homogénat de poumon à 450 µL de KHB contenant 100 µM DTPA.
- Dans un tube de 1,5 mL (dans un volume total de 100 µL), à 98 µL d’homogénat de poumon dans KHB, ajoutez 2 µL de CMH du stock de 10 mM pour obtenir une concentration finale de 0,2 mM.
- Incuber pendant 20 min 37 ° C dans un bain d’eau.
- Placer les échantillons sur la glace et de les charger dans un tube capillaire. Exécution d’EPR à ta (paramètres utilisés à l’étape 2.1.13).
- Pour tester la contribution des espèces spécifiques et sources à l’aide de différents inhibiteurs, pré-traiter µL 88 d’homogénat de poumon +/-inhibiteur, ajustant avec KHB afin d’obtenir un volume final de 98 µL. Dans cette expérience, les inhibiteurs étaient 10 µL de SOD (100 U/mL), 4 µL de déféroxamine (MPO ; concentration finale = 800 µM), ou 4 µL du chlorure de diphényliodonium (DIP ; concentration finale = 100 µM). Incuber pendant 20 min à 37 ° C dans un bain d’eau.
- Ajouter 2 µL de CMH et incuber pendant 20 min à 37 ° C, suivie par des mesures de l’EPR comme décrit ci-dessus. Inclure un échantillon témoin apparié ponctuel avec CMH KHB contenant un tampon saccharose. Vous pouvez également stocker aliquotes des homogénats poumon restant (étape 3.1.2) à-80 ° C pour les mesures futures.
Remarque : Le volume total peut être adapté selon les besoins.
-
Mesures de l’EPR sur les tissus pulmonaires chez des souris injectées avec spin sondes in vivo (à la droite à l’aide de tissus de cellules)
- Préparer la solution mère de CPH en dissolvant 4,9 mg de CPH dans 1 mL de tampon phosphate filtré et désoxygéné 50 mM.
- Anesthésier souris avec inhalation isoflurane (1,5 à 4 %) pendant 20-30 secondes jusqu'à ce qu’il ne répond pas à l’orteil pincée. Injecter 100 µL de sonde essorage CPH pour un poids de 25 g souris souris via retroorbital route (dernière dose = 20 mg/kg) et permettre à la sonde faire circuler pendant 1 h. immédiatement après l’injection de retroorbital, ajouter une goutte de proparacaïne 0,5 % HCl sur le contour des yeux à la preve douleur oculaire NT et la sécheresse. Contrôler la souris pendant 1 h et procéder à la récolte de tissus.
- Récolter le tissu pulmonaire comme décrit ci-dessus et flash geler les poumons.
- Couper 20-30 mg de tissus congelés sur la glace sèche et consignez le poids exact.
- Essuyez délicatement le tissu avec lingettes pour absorber toute l’eau de surface de nettoyage.
- Placez le tissu intérieur de la fenêtre de la cellule de tissu (un accessoire permet des mesures d’EPR pour des échantillons de tissu) et exécutez EPR pour déterminer le total tourne. Les données peuvent être exprimées comme totales tours par mg de tissu.
5. analyse
- Simuler les spectres RPE à l’aide du module SpinFit intégré dans le logiciel de xénon du spectromètre EMXnano EPR-paillasse. Déterminer la concentration de nitroxyde par le module SpinCount. Sinon, on peut faire une courbe d’étalonnage d’un nitroxyde stable comme le 4-hydroxy-TEMPO ou TEMPOL, et la concentration peut être obtenue en comparant l’intensité du signal avec l’échantillon et de la norme.
- Pour les données collectées à 77 K, utiliser l’intégration double suivie de SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Détection de superoxyde par CMH a été validée à l’aide de le X / superoxyde XO centrale système de démontrer que le signal nitroxyde (CM.) est totalement inhibé par SOD, tandis que catalase n’a eu aucun effet (Figure 1 a). Le superoxyde total, extracellulaire était alors évaluée en 264.7 cellules crues par incubation des cellules avec la sonde de spin CMH perméable à la cellule +/-un prétraitement SOD. La concentration de nitroxyde a été mesurée dans la suspension cellulaire et la mémoire tampon, qui a démontré que les valeurs dans les deux types d’échantillon étaient similaires en raison de la nature perméable et l’équilibration rapide de la sonde de spin (Figure 1 b). Le signal de radical nitroxyde a augmenté en RAW 264.7 cellules stimulées avec PMA par rapport aux cellules contrôles. Ce signal a été considérablement atténué dans les cellules pré-traitées avec SOD imperméable au cellulaire (Figure 1). Chaque couleur représente puits testés sur des jours différents, ce qui démontre la cohérence des données recueillies sur certains jours et la reproductibilité des résultats au fil du temps. La concentration du superoxyde extracellulaire a été déterminée en soustrayant le signal dans les cellules PMA prétraités avec SOD du signal après PMA en l’absence de SOD (T). Le signal reste a été attribué à superoxyde intracellulaire (Figure 1). La figure 1 illustre le calcul du total et extracellulaire de superoxyde. (E) le signal intracellulaire a été confirmé dans les cellules traitées PMA après l’enlèvement des médias et par l’effet du PEG-SOD sur le signal. Dans ce graphique, contrairement à (C), le CMH vide ne était pas soustrait les mesures, et les données brutes sont affichées.
Mitochondrial superoxyde dans les 264.7 cellules crues a été détectée à l’aide de l’EPR spin sonde mito-TEMPO-H, qui s’accumule dans les mitochondia. (A) les spectres EPR représentant le signal de mito-TEMPO-H de base dans la mémoire tampon, l’intensification de la mito-TEMPO-H dans les cellules de contrôle (Con) et le signal le plus amélioré dans les cellules stimulées avec l’inhibiteur mitochondrial l’Antimycine A (AA). L’augmentation du signal a été attribuée à la superoxyde mitochondrial issu de notre précédente étude montrant que la surexpression de SOD2 mesures sensiblement atténués avec mito-TEMPO-H10. Dans la Figure 2 b, la concentration de nitroxyde mitochondriale a été déterminée en soustrayant le signal mito-TEMPO-H dans le tampon apparié dans le temps de la mesure de la cellule. Le signal de CM. obtenu à des températures basses dans les 264.7 cellules crues après stimulation par les PMA en présence et en absence de SOD. (Figure 3 a) Le signal de CM. a été atténué en présence de SOD, cohérente avec les données de température de la pièce (Figure 1). Figure 3 b montre la photo du tube PTFE avec les bouchons utilisés pour recueillir des données à 77 K pour les piles et in vivo des échantillons. Production de superoxyde a été détectée dans le sang et BALF à l’aide de la sonde de spin CMH. Les échantillons de sang ou BALF ont été prélevés sur PBS et Bleo-souris et incubées immédiatement avec CMH. Les échantillons ont été transférés à la tuyauterie de PTFE et le flash congelés et EPR données ont été recueillies à 77 K. La concentration de nitroxyde (CM.) s’accumulent dans le sang incubée avec CMH (0,2 mM) à 37 degrés pendant 10 min (Figure 4 a). Nitroxyde (CM.) concentration de BALF incubé pendant 50 min (Figure 4 b). Nitroxyde concentration représente la concentration de CM (.) accumulée dans le volume de sang ou BALF utilisées pour l’expérience.
Trois méthodes ont été testées pour évaluer plusieurs techniques publiées pour la préservation des tissus et l’administration de spin sondes ex vivo vs. in vivo. Pour effectuer des mesures de l’EPR sur les tissus pulmonaires, nous avons tout d’abord utilisé du tissu pulmonaire congelés flash de contrôle ou blessé souris. Figure 5 a montre le signal CM. dans le surnageant d’un petit morceau de tissu pulmonaire sont incubé à 37 ° C avec CMH chez les souris traitées PBS - et Bleo, respectivement. En raison de l’hétérogénéité de la lésion pulmonaire après traitement Bleo, il est recommandé de couper les morceaux de différentes régions du poumon et la moyenne de plusieurs mesures pour fournir une valeur plus représentative. Alternativement, on peut homogénéiser l’ensemble du poumon et utiliser un échantillon de cette homogénat. Les données recueillies à 77 K, utilisez un tuyau de PTFE et le doigt dewar. Figure 5 b montre les spectres représentatifs des signaux nitroxyde (CM.) de PBS et Bleo-souris, respectivement.
Une des limitations de traiter les tissus pulmonaires ex vivo est qu’il n’est pas possible de distinguer sûrement extracellulaire de superoxyde intracellulaire en raison de la transformation du tissu qui perturbe les membranes cellulaires. Si cette information est importante pour la question expérimentale, il peut être adressée par la méthode en vivo CPH instillation décrites ci-dessous. Gelées de tissu ne peuvent servir à évaluer le superoxyde mitochondrial ; Cependant, pour cette mesure, le protocole peut être adapté pour utiliser mito-TEMPO-H dans le tissu ou les mitochondries fraîchement isolées.
Comme une seconde méthode pour les mesures de l’EPR dans les tissus pulmonaires, tissu frais a été homogénéisé dans un tampon saccharose. L’homogénat de poumon est incubé avec sonde CMH dans un tampon KHB contenant DTPA. EPR mesures ont été prises out à RT. Figure 6 a montre l’augmentation de CM. avec Bleo. Nous avons présenté un test supplémentaire à l’aide de différents inhibiteurs qui peuvent être utilisées pour déterminer les espèces qui contribuent à la CM. signal. Afin d’élucider l’origine de CM. signal généré à partir du tissu pulmonaire, nous prétraités les homogénats de poumon avec plusieurs charognards et les inhibiteurs d’enzymes. Des homogénats de poumon ont été incubées avec CMH en l’absence ou la présence de chlorure SOD, déféroxamine (MPO) et diphényliodonium (DIP) pour tenir compte de (respectivement) pour les contributions de superoxyde, fer ou superoxyde générés de flavine enzymes (Figure 6 b). Cette approche peut être adaptée pour évaluer les espèces radicalaires spécifiques générées dans un système ou d’élucider la contribution des autres sources enzymatiques (e.g., NOX, eNOS ou xanthine oxydase).
Souris ont été injectés avec le CPH spin sondes (20 mg/kg) via la route retroorbital pour effectuer des EPR mesures in vivo. On ne sait pas si CMH peut être administré sans danger pour les animaux, alors que la sonde CPH a été signalée à être non toxique ; ainsi, nous avons choisi le CPH pour les expériences in vivo . Tissus pulmonaires ont été récoltés et flash congelés dans l’azote liquide 1 h après circulation des sondes CPH. Souris peuvent être traitées simultanément avec des antioxydants spécifiques pour différencier les espèces responsables par le signal. Figure 7 a montre le CP supérieure. signal chez les souris traitées Bleo par rapport aux souris témoins. Des spectres représentatifs du tissu pulmonaire de contrôle et de souris traitées Bleo sont indiquées dans la Figure 7 b. Spectres RPE un mixte de CP. et radical de l’acide ascorbique a été observée. Les valeurs indiquées dans la Figure 7 a sont les concentrations de CP. composants. Données ont été recueillies à la droite à l’aide de la cellule du tissu.
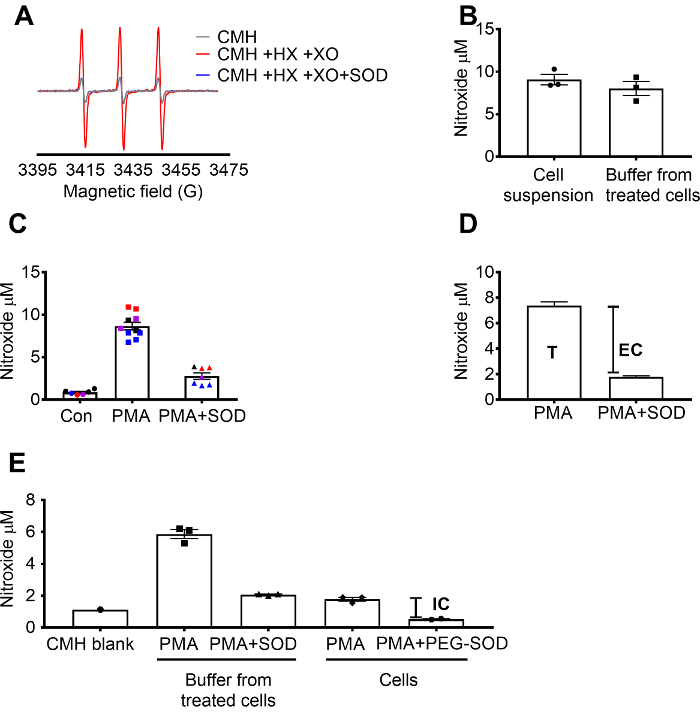
Figure 1 : détection de superoxyde dans les compartiments cellulaires différentes. (A) les spectres de RPE générés par 0,25 mM CMH de 0,5 mM l’hypoxanthine/xanthine oxydase (8 mU/mL) avec ou sans SOD (30 U/mL). (B) RAW 264.7 cellules (1 x 106 cellules/puits) ont été stimulées avec 10 µM PMA en présence de CMH pour 50 min à 37 ° C et nitroxyde concentration (µM) détectés en suspension de cellules (cellules + tampon) et tampon prélevés dans les cellules traitées. (C) RAW 264.7 cellules sont stimulées avec AGP vs. contrôle du véhicule (Con). Un ensemble de cellules ont été prétraités pendant 10 min avec SOD de cellule-imperméable de U/mL 30 (PMA + SOD). Chaque couleur représente les données de différents jours expérimentales, et chaque point représente les cellules d’un individu bien. Le signal de nitroxyde dans un blanc apparié dans le temps avec CMH dans KHB a été soustraite de chaque signal pour obtenir les valeurs finales. (D) calcul du superoxyde total et extracellulaire à la PMA stimule les cellules ; T = total superoxyde, EC = extracellulaire superoxyde (signal d’être inhibée par SOD). (E) pour évaluer le signal intracellulaire superoxyde (IC), le signal dans un tampon après PMA + SOD a été comparé aux cellules traitées PMA après l’enlèvement du tampon. Pour confirmer, les puits sont pré-traitées avec 60 U/mL perméable à la cellule PEG-SOD pour 1,5 heures pour déterminer la SOD intracellulaire être inhibée par. Le blank CMH apparié dans le temps est montré, et données reflètent absolute nitroxydes signal. Données exprimées en moyenne ± SEM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : détection de superoxyde mitochondriale en cellules stimulées avec l’antimycine A. (A) les spectres représentatifs de la rotation EPR mitochondrial spécifique probe, 0,25 mM mito-TEMPO-H en 264.7 cellules crues sans (Con) ou avec 25 µM l’antimycine A (AA) pendant 50 min à 37 ° C. B concentration de CM. (µM) dans les cellules traitées avec AA par rapport au témoin. Le signal de nitroxyde dans un blanc de mito-TEMPO-H apparié dans le temps a été soustraite de signal total pour obtenir les valeurs finales. Données exprimées en moyenne ± SEM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : détection de superoxyde dans RAW 264.7 cellules à 77K. (A) RAW 264.7 cellules stimulées avec 10 µM EGR et sonde de spin EPR, CMH 0,25 mM (50 min à 37 ° C) avec (noir) ou sans prétraitement (rouge) avec 30 U/mL SOD. 100 µL de liquide surnageant a été chargé dans un 1 pouce en morceau de la longueur du tube PTFE, puis flash congelés dans l’azote liquide. Les bouchons ont été retirés, et congelé tube PTFE a été placé dans le doigt dewar d’acquisition de données à 77 photo de K. (B) un tube PTFE et bouchons. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : mesures EPR dans le sang et BALF chez les souris traitées à la bléomycine et du contrôle. Souris ont été traitées avec une dose unique de bléomycine intratrachéale (IT Bleo) (100 µL à 1 U/mL) ou véhicule de PBS. À 7 jours, les souris ont été anesthésiés et euthanasiés. Sang a été recueillies via ventriculaire droite ponction dans une seringue recouverte de 1000 héparine USP/mL contenant 100 µM DTPA. Lavage bronchoalvéolaire (LBA) a été recueilli par lavaging les poumons avec 1 mL de 100µm DTPA dans du PBS. Sang et BALF ont été incubés pendant 10 ou 50 min, respectivement, avec 0,2 mM CMH à 37 ° C. 150 µL de sang ou de BALF a été chargé en flash d’un tube PTFE congelé dans l’azote liquide et des EPR données recueillies à 77 K en utilisant un doigt dewar. Les données montrent des concentrations de nitroxyde dans le sang (A) et (B) BALF de PBS et Bleo-souris (n = 4-6). Données exprimées en moyenne ± SEM. (C) Representative spectres de nitroxyde dans le sang de souris traités Bleo et PBS. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : mesures d’EPR dans les tissus pulmonaires congelés flash. Souris ont été traitées avec une dose unique de bléomycine intratrachéale (IT bleo) (100 µL à 1 U/mL) ou véhicule de PBS. À 7 jours, les poumons ont été rincées avec PBS froid pour enlever le sang et flash congelés dans l’azote liquide. 5-15 mg de tissu pulmonaire éclair gelé a été incubé avec 0,2 mM CMH dans KHB contenant 100 µM dans 200 µL de volume total pendant 1 h à 37° C. surnageant a été recueilli et placé dans un tube PTFE et courir à 77 K dans le doigt dewar. (A) nitroxyde concentration (µM de nitroxyde normalisé à 1 mg de tissu). Les données représentent la moyenne de 2-3 mesures pour chaque poumon. Données exprimées en moyenne ± spectres représentatifs SEM. (B) de nitroxyde dans les tissus pulmonaires chez des souris traités Bleo et PBS. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : mesures d’EPR dans les tissus pulmonaires conservé dans un tampon saccharose. Des souris ont été traitées avec une dose unique de bléomycine intratrachéale (100 µL à 1 U/mL). À 7 jours après le traitement, les poumons ont été rincées avec du PBS froid pour enlever le sang et les tissus pulmonaires fraîches a été homogénéisé dans un tampon Tris-EDTA contenant du saccharose de 0,25 mM à un ratio de 1:6 poumon poids/tampon volume (mg/µL). 50 µL de l’homogénat de poumon était préincubés avec KHB avec ou sans les inhibiteurs suivants pendant 20 min à 37 ° c : SOD (100 U/mL), déféroxamine (MPO ; 800 µM) et le chlorure de diphényliodonium (DIP ; 100 μM) suivie d’une incubation avec 0,2 mM CMH dans KHB contenant 100 µM DTPA pendant 20 min à 37 ° C. Données ont été obtenues à la droite à l’aide de tubes capillaires EPR. (A) nitroxyde concentration dans les poumons des souris traités Bleo et PBS. (B) nitroxyde concentration Bleo poumons en l’absence ou la présence d’inhibiteurs (n = 3). Données exprimées en moyenne ± SEM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 7 : mesures d’EPR dans les tissus pulmonaires chez des souris injectées avec sonde essorage CPH. 100 µL de CPH a été administrée via retroorbital injection pour une concentration finale de 20 mg de CPH par kg de poids corporel. Après 1 h de circulation, souris ont été euthanasiés, poumons ont été rincées avec 10 mL de froid PBS via le ventricule droit et du tissu pulmonaire était flash congelés. 20 à 30 mg de tissu pulmonaire a été placé en cellule de tissus et de mesures de l’EPR réalisées à température ambiante. (A) données exprimées en tours / mg. spectres (B) représentatifs de nitroxyde signalent dans les tissus pulmonaires de PBS et Bleo (* indique le chevauchement avec l’acide ascorbique radical). Données exprimées en moyenne ± SEM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Inhibiteurs de la | Espèces |
| Superoxyde dismutase (SOD) | Extracellulaire superoxyde |
| Superoxyde dismutase – polyéthylène glycol (PEG-SOD) | Superoxyde intracellulaire |
| Catalase | Base de peroxyde d’hydrogène radicaux |
| Urate | Peroxynitrate |
| L’éthanol et le DMSO | Radical hydroxyle |
| Chélateurs de métaux | Ions métalliques (fer et cuivre) |
Le tableau 1. Inhibiteurs communs utilisés pour distinguer les espèces responsables de l’oxydation de sonde de spin.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
L’évaluation de la production de radicaux libres dans les milieux biologiques est importante redox compréhension réglementés de signalisation de santé et la maladie, mais la mesure de ces espèces est très difficile en raison de la courte demi-vie des radicaux libres et technique limites avec les méthodes couramment utilisées. RPE est un outil précieux et puissant en biologie de l’oxydo-réduction, comme c’est la méthode seulement sans ambiguïté pour la détection des radicaux libres. Dans ce projet, nous démontrons des méthodes pratiques d’EPR pour la conception d’expériences et de préparation des échantillons pour détecter des sondes ROS à l’aide de spin dans les différents compartiments cellulaires in vitro et tissus différents compartiments in vivo. Nous fournissons également des méthodes pratiques pour gérer les échantillons biologiques et de conserver les échantillons pour améliorer l’efficacité.
Sondes de spin réagissent efficacement avec ROS et produisent un radical nitroxyde stable qui peut être détectée avec l’EPR. Plusieurs dérivés de la sonde de spin (cyclique hydroxylamine) ont été synthétisés avec caractéristiques de perméabilité différente, ce qui les rend appropriés pour détecter la production de radicaux libres dans les différents compartiments cellulaires10. Ce protocole utilise la sonde essorage perméable à la cellule, CMH ; Cependant, le chlorure de 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium de sonde de spin imperméable HCl (CAT1H) peut être utilisé pour détecter le superoxyde extracellulaire. Semblable à notre étude préalable lymphoblastique humain cellules lignes18, nous avons pu valider l’utilisation de la sonde de spin CMH perméable avec SOD imperméable et perméable PEG-SOD dans les cellules RAW264.7 (une lignée de cellules de le macrophage de poumon souris) stimulées avec de la PMA à des cellules la différence entre superoxyde extracellulaire et intracellulaire.
Nous avons également validé l’équilibration rapide de CMH entre les compartiments intra - et extra-cellulaires, et nous avons également constaté que le signal de superoxyde dans cellules gouttes significativement après lavage les cellules en une seule fois avec KHB (données non présentées). Nous avons confirmé l’utilité de la sonde mitochondrial spécifique spin mito-TEMPO-H en 264.7 cellules crues pour mesurer le superoxyde mitochondriale accrue générée lors de la stimulation avec inhibiteur de chaîne mitochondriale de transport d’électrons l’antimycine A. L’apport spécifique de la production de superoxyde mitochondriale au TEMPO-mito-H a été démontrée précédemment et peut être validée dans des expériences utilisant des systèmes ou des mitochondries isolées de frais avec la superoxyde dismutase mitochondriale MnSOD (SOD2) surexpression10.
L’évaluation de ROS production in vivo est particulièrement difficile, mais la capacité à détecter la production de ROS spécifique fournit d’importants renseignements lorsque interroger le rôle du stress oxydatif ou redox réglementée signalisation biologique Paramètres. La gestion appropriée des tissus lors de l’utilisation de spin les sondes et les EPR est essentiel pour produire des résultats significatifs et reproductibles. L’utilisation de sondes de spin avec le tissu ne sera pas radicaux superoxydes mesure susceptible de se présentent au moment de la récolte de tissus en raison d’une demi-vie courte, mais au contraire il détecte superoxyde produite par les enzymes telles que l’oxydase de NADPH, dételle monoxyde d’azote synthase endothéliale , ou de xanthine oxydase lorsque les tissus pulmonaires ou homogénats sont incubées avec la sonde de spin à 37 ° C. L’utilisation de tissus congelés n’inclura pas superoxyde généré par les mitochondries, depuis le gel activité dommages-intérêts de la chaîne mitochondriale de transport d’électrons. Pour tester le superoxyde mitochondriale, enquêteurs besoin d’isolat mitochondries fraîches ou utilisation des sondes spécifiques mitochondriale en vivo ou dans les tissus frais.
Plusieurs protocoles différents afin de préserver les tissus ont été publiés dans la littérature14,15. Nous avons comparé trois méthodes publiées pour les mesures de l’EPR dans les tissus pulmonaires : flash 1) tissu de congélation dans l’azote liquide et 3) traitement de souris in vivo avec un spin 2) homogénéisation des tissus dans un tampon saccharose sonde 1 heure avant la récolte de tissus. Nous avons comparé les souris témoins à des souris avec une inflammation pulmonaire grave et stress oxydatif induit par la bléomycine pour tester la capacité de chaque méthode pour montrer les différences cohérentes en signaux nitroxyde dans poumons blessés. Les trois méthodes ont montré une augmentation relative similaire nitroxyde signal dans les poumons des souris traitées à la bléomycine. L’utilisation de tissus congelés flash serait probablement la meilleure approche pour recueillir des tissus destinés à la plupart des laboratoires, niant la nécessité de traiter les tissus dans la mémoire tampon saccharose au moment de la récolte. L’injection de CPH à capturer des radicaux libres en vivo est puissante, mais pour confirmer ces espèces particulières, pour cela, un groupe de traitement, y compris l’antioxydant approprié.
Un des défis de l’utilisation de sondes de spin, c’est que l’oxydation des sondes de spin pour nitroxyde génère un spectre de RPE trois lignes similaire quelle que soit l’espèce responsable de l’oxydation ; ainsi, il ne distingue pas entre les différentes espèces ROS. En outre, on a signalé qu’il y a des réactions possibles des sondes de l’hydroxylamine avec transport d’électrons photosynthétiques chaîne et cytochrome c oxydase19,20. Ces observations devraient considérer lors de l’interprétation des résultats. Dans ce protocole, le système photosynthétique n’est pas présent, et l’inclusion de DTPA avec le tampon inhibe la contamination potentielle des ions ferreux et cuivreux libres10 . Nous avons montré comment utiliser une série d’enzymes spécifiques ou des chélateurs dans les tissus pulmonaires pour établir la contribution de ROS particulière ou inhibiteurs de l’enzyme pour déterminer l’origine de ROS. Cette approche a été précédemment utilisée RPE pour déterminer la contribution de ROS par eNOS dételé13,15. Nous fournissons une liste des inhibiteurs communs utilisé pour distinguer les espèces responsables de l’oxydation de sonde de spin (tableau 1).
Nous avons aussi démontré l’importance d’optimiser le temps d’incubation pour chaque condition expérimentale. Lorsque comparant spin sondes pour filer des pièges, pièges à spin génèrent un spectre unique selon le réactif qui permet pour la spécificité de l’espèce radicalaire ; Cependant, ils présentent cinétique lente pour superoxyde spin trapping et sont sujettes à la biodégradation. Le traitement du tissu pulmonaire avec l’EPR sonde ex vivo est également limité par l’incapacité de bien distinguer extracellulaire de superoxyde intracellulaire dû à la rupture des membranes cellulaires au cours du traitement du tissu (gel ou l’homogénéisation). Utilisation du spin injecté sonde in vivo avec SOD ou perméable à la cellule PEG-SOD peut résoudre ce problème.
Un seul but était d’établir un protocole pour efficacement prélever des échantillons et les stocker à-80 ° C avant les mesures de l’EPR. Nous avons donc mis au point une méthode pratique pour utiliser des tubes PTFE pour tenir les échantillons. Ce tube est placé directement dans le doigt dewar pour l’analyse des EPR à 77 K sans avoir à nettoyer le dewar entre les échantillons. Il s’agit d’une alternative à la méthode récemment publiée portant sur le gel des échantillons dans des seringues de 1 mL. Mesurées dans des échantillons congelés, stockés dans un tube PTFE peuvent être répétées sur plusieurs jours pour démontrer la stabilité du signal. Cette approche permet le traitement par lots les mensurations de l’EPR et facilite le transfert des échantillons entre laboratoires pour une installation distante de EPR peut exécuter les exemples.
Dans l’ensemble, ces protocoles prévoient une approche simple pour la préparation des cellules et des tissus pour les mesures de l’EPR dans les systèmes biologiques. Les protocoles peuvent être adaptées à d’autres modèles associée au stress oxydatif et l’utilisation d’autres sondes de spin. Le calendrier et la concentration de la sonde de spin devra être ajustée pour chaque condition expérimentale. La capacité de l’EPR pour déterminer la présence et la production de radicaux libres sans ambiguïté offre rigueur à des approches expérimentales dans le domaine de la biologie de l’oxydo-réduction.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Ce travail a été soutenu par la faculté de l’Université du Colorado de médecine Dean award de l’Infrastructure de recherche stratégique, R01 HL086680-09 et 1R35HL139726-01, à la bourse E.N.G. et UCD CFReT (HE). Les auteurs remercient Dr Sandra Eaton et Dr. Gareth Eaton (Université de Denver), Dr Gerald Rosen et Dr. Joseph P. Kao (Université du Maryland) et Dr Sujatha Venkataraman (Université du Colorado, Denver) pour des discussions utiles et Joanne Maltzahn, Ashley Trumpie et Ivy McDermott (Université du Colorado, Denver) pour le support technique.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



