Summary
Spettroscopia di risonanza paramagnetica elettronica (EPR) è un metodo univoco per misurare i radicali liberi. L'utilizzo di sonde di spin selettiva permette per la rilevazione dei radicali liberi in diversi compartimenti cellulari. Presentiamo un metodo pratico, efficiente per raccogliere campioni biologici che facilitano il trattamento, l'archiviazione e trasferire campioni per misure di EPR.
Abstract
La rilevazione accurata e specifica delle specie reattive dell'ossigeno (ROS) in diversi compartimenti cellulari e tessutali è essenziale per lo studio di redox-regolati segnalazione in impostazioni biologiche. Spettroscopia di risonanza paramagnetica elettronica (EPR) è il metodo solo diretto per valutare in modo non ambiguo i radicali liberi. Il suo vantaggio è che rileva i livelli fisiologici di specifiche specie con un'alta specificità, ma richiede tecnologia specializzata, preparazione del campione attento e controlli appropriati per garantire la corretta interpretazione dei dati. Sonde di spin ciclico idrossilammina reagiscono selettivamente con superossido o altri radicali per generare un segnale di nitrossidi che possa essere quantificato mediante spettroscopia EPR. Sonde di spin cellula-permeabile e sonde di spin progettati per accumulare rapidamente nei mitocondri consentono la determinazione della concentrazione di superossido in diversi compartimenti cellulari.
In cellule coltivate, l'uso di 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine permeabili delle cellule (CMH) lungo con e senza pretrattamento di cella-impermeabile superossido dismutasi (SOD) o uso di PEG-SOD cellula-permeabile, consente la differenziazione di extracellulare da superossido citosolico. Il 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido mitocondriale] piperidinium dicloruro (mito-TEMPO-H) permette la misura di ROS mitocondriale (principalmente superossido).
Sonde di spin e spettroscopia EPR possono essere applicati anche ai modelli in vivo . Superossido può essere rilevato in fluidi extracellulari quali il sangue e liquido alveolare, così come tessuti, come tessuto polmonare. Diversi metodi sono presentati per elaborare e conservare il tessuto per misurazioni di EPR e consegnare endovenosa 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) rotazione sonda in vivo. Mentre le misure possono essere eseguite a temperatura ambiente, campioni ottenuti da modelli in vitro e in vivo possono essere conservati a-80 ° C e analizzati da EPR a 77 K. I campioni possono essere memorizzati in stalla tubi specializzati a-80 ° C ed eseguiti a 77 K per consentire un pratico, efficiente e metodo riproducibile che facilita la memorizzazione e trasferimento di campioni.
Introduction
Mentre misure dello sforzo ossidativo e specie reattive dell'ossigeno sono importanti per lo studio di diverse malattie attraverso tutti i sistemi dell'organo, la rilevazione di specie reattive dell'ossigeno (ROS) è difficile a causa di una breve emivita e alta reattività. Una tecnica di risonanza paramagnetica elettronica (EPR) dell'elettrone è il metodo più inequivocabile per la rilevazione dei radicali liberi. Sonde di spin hanno vantaggi rispetto le sonde fluorescenti più comunemente utilizzati. Se sonde fluorescenti sono relativamente poco costoso e facile da usare e fornire rilevamento rapido, sensibile di ROS, hanno gravi limitazioni a causa di segnali artifactual, un'incapacità di calcolare le concentrazioni di ROS e una generale mancanza di specificità1 .
Per facilitare l'uso di EPR per gli studi biologici, una varietà di sonde sono stati sintetizzati di spin che può misurare una gamma di specie del radicale libero biologicamente rilevanti nonché pO2, pH e redox afferma2,3, 4,5,6,7. Trappole di spin sono stati sviluppati anche per catturare i radicali di breve durati e durata di vita-forma addotti, che facilita la rilevazione di EPR8. Entrambe le classi (sonde di spin e spin traps) hanno vantaggi e limitazioni. Una classe comunemente usata di sonde di spin sono idrossilammine ciclici, che sono EPR-silent e reagiscono con i radicali di breve durati per formare un nitrossidi stabile. Ciclici idrossilammine reagiscono con superossido 100 volte più veloce di spin trappole, consentendo loro di competere con gli antiossidanti cellulari, ma manca di specificità e richiedono l'uso di adeguati controlli e inibitori per identificare l'origine o specie radicaliche responsabile per il segnale di nitrossidi. Mentre spin intrappola espositivo specificità, con distinte spettrale che modelli a seconda della specie intrappolata, hanno cinetica lenta per spin trapping e sono incline a biodegradazione del radicale del superossido addotti. Applicazioni per il trapping spin sono state ben documentate nella ricerca biomedica9,10,11,12,13.
L'obiettivo di questo progetto è quello di dimostrare metodi EPR pratici per la progettazione di esperimenti e preparazione dei campioni per rilevare superossido utilizzando spin sonde in diversi compartimenti cellulari in vitro e nei compartimenti differenti del tessuto in vivo. Alcuni manoscritti sono pubblicati protocolli pertinenti a questi obiettivi, usando sonde di cellula-permeabile, impermeabile cellulare e mitocondriale spin mirati al tessuto bersaglio diversi compartimenti cellulari in vitro e processo per l'analisi in modelli murini 14 , 15. costruiamo su questo corpo di letteratura convalidando un approccio per misurare superossido utilizzando una sonda di spin (CMH) 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine in diversi compartimenti cellulari in vitro per garantire accurata misurazioni, evidenziando potenziali problemi tecnici che possono falsare i risultati. Forniamo anche metodi per effettuare misurazioni di EPR in sangue, fluido di lavaggio broncoalveolare e tessuto polmonare utilizzando la sonda di spin CMH. Questi studi confrontare diversi metodi per elaborare i tessuti, nonché di presentare un metodo per iniettare un'altra sonda di spin, CPH, topi prima della raccolta del tessuto. Infine, sviluppare un metodo pratico per conservare i campioni in tubi di politetrafluoroetilene (PTFE) per consentire l'archiviazione e il trasferimento dei campioni prima di misurazioni EPR a 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tutti gli studi sugli animali sono stati approvati dalla University of Colorado Denver istituzionale Animal Care e Comitato di uso.
1. preparazione dei reagenti
-
Stock di diethylenetriaminepentaacetic acido (DTPA) (150 mM)
- Aggiungere 2,95 g di DTPA (393.35 g/mol) a 10 mL di acqua deionizzata.
- Per dissolvere DTPA, aggiungere 1 M NaOH goccia a goccia e portare ad un pH di 7.0.
- Portare il volume a 50 mL con acqua per una concentrazione finale di DTPA di 150 mM e conservare a 4 ° C.
-
Soluzione salina tampone fosfato (PBS) (50 mM, pH 7.4)
- Preparare 5 M di cloruro di sodio (NaCl) (58.44 g/mol; 29,22 g/100 mL).
- Preparare 1 M di potassio fosfato bibasico HK2PO4 (174.18 g/mol; 17,42 g/100 mL)
- Preparare 1 M di potassio fosfato monobasico KH2PO4 (136,1 g/mol; 13,61 g/100 mL). Mescolare 3 mL di 5 M di NaCl con 4,24 mL di 1 M di fosfato di potassio dibasico e 0,760 mL di 1 M potassio fosfato monobasico. Controllare il pH.
- Portare il volume a 100 mL con acqua deionizzata.
- Conservare a temperatura ambiente (TA) per breve periodo (giorni) e a 4 ° C per la conservazione a lungo termine (settimane).
-
Tampone di Krebs-Henseleit (KHB) contenente 100 µM DTPA
- Nella provetta conica per centrifuga da 50 mL, aggiungere 33,3 µ l di soluzione madre di DTPA 150 mM.
- Portare a un volume di 50 mL con buffer di Krebs-Henseleit (KHB).
- Preparare il tampone di fresco con DTPA ogni giorno e tenerlo a TA.
-
Tampone Tris-EDTA contenente saccarosio
- Preparare brodo di 0.5 M Tris: sciogliere 15,14 g di Tris base (121.14 g/mol) in 150 mL di acqua deionizzata. Utilizzando HCl, regolare il pH a 7,8 e portare ad un volume finale di 250 mL.
- Sciogliere 21,4 g di saccarosio (342.29 g/mol; concentrazione finale = 0.25 mM) in 150 mL di acqua deionizzata.
- Aggiungere 5 mL di Tris stock di saccarosio per ottenere una concentrazione di Tris finale di 10 mM.
- Aggiungere 0,5 mL di brodo di EDTA 0.5 M Tris-saccarosio per ottenere una concentrazione finale di 1 mM.
- Controllare il pH e regolarlo a 7,4.
- Portare ad un volume finale di 250 mL con acqua deionizzata e conservare a 4 ° C.
-
Eritrociti di origine bovina stock di Cu/Zn superossido dismutasi (SOD) (30.000 U/mL)
- Ricostituire 30.000 U di SOD in 1 mL di PBS (circa 5,7 mg, a seconda dell'attività del lotto SOD).
- Mescolare bene, aliquotare e conservare a-20 ° C per a breve termine (6-12 mesi) e a-80 ° C per la conservazione a lungo termine.
-
Soluzione di lavoro di SOD (1000 U/mL)
- Trasferire un'aliquota di 30 µ l di 30.000 stock SOD U/mL in un 870 µ l di PBS sterile.
- Mantenere la soluzione sul ghiaccio e usarlo fresco.
-
Stock di phorbol 12-myristate 13-acetato (PMA) (5 mM)
- Sciogliere 1 mg di PMA (616.83 g/mol) in µ l 325 di DMSO (concentrazione finale = 5 mM).
- Aliquota di una soluzione PMA di 5 mM e conservare a-20 ° C.
-
Soluzione di lavoro di PMA (125 µM)
- Diluire un'aliquota di 10 µ l di Stock in PMA di 5 mM in 390 µ l di PBS sterile.
- Mantenere la soluzione sul ghiaccio e usarlo fresco.
- Per un controllo del veicolo per PMA, utilizzare 10 µ l di DMSO in 390 µ l di PBS.
-
Cloruro di diphenyliodonium (DIP) (2,5 mM)
- Sciogliere 3,2 mg di tuffo (316.57 g/mol) in 4 mL per ottenere uno stock di 2,5 mM.
- Preparare la soluzione e usarlo fresco.
-
Deferoxamina mesilato sale (DFO) (20 mM)
- Sciogliere 4,5 mg di DFO (656,79 g / mol) in µ l 340 per ottenere uno stock di 20 mM.
- Preparare la soluzione e usarlo fresco.
-
Preparazione di antimycin stock A (AA) (5 mM)
- Sciogliere 5,4 mg di AA (532 g/mol) in 2 mL di etanolo (concentrazione finale = 5 mM).
- Aliquota del titolo in fiale di vetro e conservare a-20 ° C.
-
Preparazione delle sonde di spin
- Bolla 50mm fosfato tampone contenente 100 µM DTPA con azoto per 30 min per rimuovere l'ossigeno disciolto dal buffer.
- Rimuovere la sonda di spin dal congelatore a-20 ° C e lasciare il contenitore di venire a RT (10-15 min).
- Pesare 2,4 mg di 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237,8 g/mol)
- Sciogliere CMH in 1 mL di tampone fosfato deossigenato per una concentrazione finale di 10 mM.
- Pesare 5 mg di dicloruro di 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium (mito-TEMPO-H) (529.1 g/mol).
- Sciogliere mito-TEMPO-H in 1 mL di tampone fosfato deossigenato per una concentrazione finale di 9,5 mM.
- Pesare 4,9 mg di 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223.7 g/mol).
- Sciogliere CPH in 1 mL di tampone fosfato deossigenato per una concentrazione finale di 22 mM.
- Aliquotare e conservare a-80 ° C (gelo-disgelo non è raccomandato).
2. rilevamento di superossido in vitro
-
Rilevamento di totale, extracellulare e intracellulare superossido in PMA-stimolato 264.7 celle grezze a RT
- A seguito di un'adeguata tecnica asettica, scongelare 264.7 celle grezze e loro passaggio nei media DMEM completati con 10% FBS (bassa endotossina-libera) e 1% antimicotico/ampicillina a 37 ° C in incubatore a CO2 .
- Seme 264.7 celle grezze a 1 x 106 cellule/pozzetto in piastre da 6 pozzetti un giorno prima del trattamento.
- Delicatamente rimuovere e lavare le cellule una volta con 1 mL di tampone KHB.
- Aggiungere KHB contenente 100 µM DTPA in ciascun pozzetto e trattare in un volume totale di 500 µ l con il seguente:
- Per pozzi pretrattati con SOD, aggiungere 15 µ l/pozzetto di soluzione di lavoro di SOD (1000 U/mL; concentrazione finale di SOD = 30 U/mL) e incubare per 10 min a 37 ° C prima dell'aggiunta di CMH e PMA.
- Aggiungere 12,5 µ l/pozzetto di stock CMH 10mm (concentrazione finale = 0,25 mM).
- Aggiungere 40 µ l/pozzetto di soluzione di lavoro 125 µM PMA (concentrazione finale = 10 µM) o 40 µ l veicolo (magazzino 10 µ l di DMSO in 390 µ l di PBS).
- Incubare per 50 min a 37 ° C in un incubatore a CO2 .
- Rimuovere le piastre dall'incubatrice e metterli immediatamente in ghiaccio.
- Raccogliere buffer da ogni pozzetto in separata, 1,5 mL, provette. Tenere il ghiaccio in tutto.
- Aggiungere 100 µ l di tampone KHB fresco contenente 100 µM DTPA, delicatamente raschiare le cellule e risospendere pipettando su e giù più volte. Tenere il ghiaccio in tutta risospensione delle cellule.
- Carico del campione raccolto nei passaggi 2.1.10 e 2.1.11 (50 µ l) in ciascuna delle provette capillari. Entrambe le estremità della guarnizione ed eseguire l'EPR.
Nota: Sempre una provetta o bene (senza cellule) contenente la sonda nel buffer (stessa concentrazione = 0,25 mM), trattati alle stesse condizioni come le cellule (stesso tempo di incubazione e temperatura) come un controllo, poiché la priorità bassa intensità della sonda è temperatura - e tempo-dipendente. - Impostare i parametri di acquisizione EPR seguenti: frequenza di microonda = 9,65 GHz; centro campo = 3432 G; ampiezza di modulazione = 2,0 G; larghezza di spazzata = 80 G; Potenza microonde = 19,9 mW; numero totale di scansioni = 10; tempo di spazzata = 12.11 s; e costante di tempo = 20,48 ms.
-
Rilevamento di superossido mitocondriale in 264.7 celle grezze
- Seguire i passaggi 2.1.1 e 2.1.2 per seme 264.7 celle grezze un giorno prima dell'esperimento.
- Rimuovere i supporti e lavare le cellule una volta con 1 mL di tampone KHB.
- Aggiungere 200 µ l di KHB contenente 100 µM DTPA in ciascun pozzetto.
- Aggiungere 5,3 µ l/pozzetto di stock di mito-TEMPO-H 9,5 mM (concentrazione finale = 0,25 mM)
- Incubare per 10 min a RT.
- Aggiungere 1 µ l/pozzetto di antimycin A (AA), soluzione di riserva di 5 mM in etanolo (concentrazione finale = 25 µM).
- Incubare per 50 min a 37 ° C in un incubatore a CO2 .
- Rimuovere le piastre dall'incubatrice e metterli immediatamente in ghiaccio.
- Delicatamente le cellule di raschiare e risospendere pipettando su e giù. Tenere il ghiaccio.
- Caricare il campione in un tubo capillare. Entrambe le estremità della guarnizione.
- Vedere la sezione precedente per impostazione di EPR.
-
Rilevamento di superossido in 264.7 celle grezze a 77 K
- Posto il buffer raccolte al passo 1.1.10 pre-preparati PTFE tubi 1-2 pollici di lunghezza (3/16" diametro x 1/8" ID). Assicurarsi che la tubazione di PTFE è dritta, quindi può essere facilmente inserito e rimosso dal dito dewar. Utilizzare un tappo di gomma per chiudere un'estremità del tubo di PTFE, pipettare il buffer o sospensione cellulare (100-150 µ l) nella tubazione di PTFE e sigillare il tubo con un tappo di secondo.
- Freeze Flash il campione in azoto liquido. Il campione può essere trasferito in una provetta con etichetta crioconservazione per conservazione a-80 ° C o eseguire immediatamente.
- Riempire il dito dewar con azoto liquido e inserire il tubo di PTFE contenente il campione nella barretta dewar. Assicurarsi che il campione sia centrato nello spazio attivo del risonatore ed eseguire EPR a 77 K.
Nota: Avviare il flusso di gas di azoto a tuo spettrometro 15-30 min prima le misurazioni e continuare questo flusso in tutto le misure per impedire la condensazione di acqua nel risonatore. - Impostare i parametri di acquisizione EPR seguenti: frequenza di microonda = 9,65 GHz; centro campo = 3438 G; ampiezza di modulazione = 4,0 G; spazzare larghezza = 150 G; Potenza microonde = 0.316 mW; numero totale di scansioni = 10; tempo di spazzata = 60 s; e costante di tempo = ms 1,28.
3. EPR misure in liquidi
-
Sangue intero
- Trattamento di topi (8-12 settimane) con una singola dose di bleomicina endotracheale (Bleo; 100 µ l a 1 U/mL) disciolto in PBS o PBS da solo come descritto in precedenza16,17.
- Eutanasia topi somministrando per via inalatoria isoflurano (1.5-4%) seguito da dissanguamento e dislocazione cervicale. Aspirare il sangue attraverso il ventricolo di destra in una siringa rivestita con eparina (1000 USP/mL) contenenti 100 µM DTPA e trasferirlo in una provetta da 1,5 mL.
- In un tubo separato da 1,5 mL, aggiungere 15 µ l di PBS contenente 100 µM DTPA e 3 µ l di CMH (10 mM) a 132 µ l di sangue per un volume totale di 150 µ l e concentrazione di CMH finale di 0,2 mM.
- Incubare il sangue per 10 min a 37 ° C in un bagno d'acqua.
- Togliere le provette dal bagnomaria.
- Prendere un'aliquota di sangue in un tubo capillare di carico ed eseguire EPR a RT con i seguenti parametri di acquisizione EPR: microonde frequenza = 9,65 GHz; centro campo = 3432 G; ampiezza di modulazione = 1,0 G; larghezza di spazzata = 80 G; Potenza microonde = 19,9 mW; numero totale di scansioni = 3; tempo di spazzata = 12.11 s; e costante di tempo = 20.48 ms. in alternativa, i campioni possono essere flash congelati come descritto nel passo 2.3 per misurazioni a 77 parametri di acquisizione di K. EPR sono i seguenti: frequenza di microonda = 9,65 GHz; centro campo = 3438 G; ampiezza di modulazione = 4,0 G; spazzare larghezza = 150 G; Potenza microonde = 0.316 mW; numero totale di scansioni = 2; tempo di spazzata = 60 s; e costante di tempo = ms 1,28.
-
Fluido di lavaggio broncoalveolare (BALF)
- Dopo l'eutanasia (Vedi punto 3.1.2), raccogliere BALF lentamente instillando e prelevare 1 mL di PBS contenente 100 µM DTPA tre volte in una siringa tramite una cannula inserita nella trachea.
- In una provetta da 1,5 mL, trattare 200 µ l di BALF con 4 µ l di CMH (10 mM) per ottenere una concentrazione finale di 0,2 mM.
- Incubare BALF per 50 min a 37 ° C in un bagno d'acqua.
- Prendete i tubi dal bagno di acqua e metterli sul ghiaccio.
- Carico BALF in un tubo capillare ed esecuzione EPR a RT con le stesse impostazioni di EPR come utilizzato nel passo 1.1.13, o flash congelato in azoto liquido, come descritto al punto 2.3.
-
Misure EPR in sangue e BALF a 77 K
- Seguire il protocollo di cui sopra per raccogliere il sangue (punti 3.1.1. a 3.1.4) e BALF (passaggi 3.2.1 a 3.2.4).
- Posto 150 µ l di sangue trattato o BALF in PTFE tubi (in 1-2). Utilizzare un tappo di gomma per chiudere un'estremità del tubo di PTFE prima dell'aggiunta del campione e un altro tappo per sigillare il tubo.
- Freeze Flash il campione in azoto liquido.
- Vedere la sezione 2.3 per dettagli sull'esecuzione di EPR in campioni congelati in tubazione di PTFE usando il dito che Dewar a 77 K. Run congelati CMH trattati con i campioni di sangue in una settimana.
4. EPR misurazioni sul tessuto polmonare
-
Flash del tessuto polmonare congelati
- Dopo aver raccolto il BALF al punto 3.2.1, viene aperto il torace e polmoni lavata con 10 mL di PBS freddo tramite ventricolo destro per rimuovere il sangue. Freeze Flash il tessuto polmonare in azoto liquido. Tessuto polmonare congelati sono memorizzabili a-80 ° C fino a 6 mesi fino all'utilizzo per misure di EPR.
- Stabilizzare il tessuto polmonare su ghiaccio secco con una pinzetta e tagliare i pezzi più piccoli (5-15 mg) del tessuto polmonare con una lama tagliente.
- Pesare il tessuto in una provetta da 1,5 mL, collocare la provetta sulla scala e tarare la bilancia, quindi aggiungere i pezzi di tessuto e registrare il peso.
- Il tessuto nel tubo da 1,5 mL, aggiungere µ l 196 di KHB contenenti DTPA e 4 µ l di CMH (0,2 mM) per ottenere un volume totale di 200 µ l.
- Incubare per 1h a 37 ° C in un bagno d'acqua.
- Rotazione verso il basso (per pochi secondi) in una microcentrifuga a 3.884 x g.
- Mettere sul ghiaccio e dispensare 150 µ l del surnatante nella tubazione di PTFE e congelare per le misurazioni di 77 K, come descritto nella sezione 2.3.
Nota: Per questo metodo, l'eterogeneità della ferita deve essere considerata. Per una lesione polmonare indotta da bleomicina, dato che è una lesione altamente eterogenea, è consigliabile tagliare diversi pezzi di tessuto provenienti da diverse parti del polmone da ogni mouse. In alternativa, un pezzo più grande del tessuto può essere omogeneizzato in tampone KHB 100 µM DTPA con un rapporto di 1:6 peso / volume (mg / µ l) come descritto di seguito.
-
Tessuto polmonare fresco conservato nel buffer di saccarosio
- Svuotare i polmoni lavati con PBS freddo per rimuovere il sangue come fatto al punto 3.1.2.
- Omogeneizzare il tessuto polmonare fresco in tampone Tris-EDTA contenente saccarosio 0,25 M con un rapporto polmone/buffer (mg / µ l) di 1:6 lisata tessuto macinino con un vetro o un pestello PTFE.
- Aggiungere 50 µ l dell'omogeneato del polmone a 450 µ l di KHB contenente 100 µM DTPA.
- In una provetta da 1,5 mL (in un volume totale di 100 µ l), a 98 µ l di omogenato di polmone in KHB, aggiungere 2 µ l di CMH di stock di 10 mM per ottenere una concentrazione finale di 0,2 mM.
- Incubare per 20 min a 37 ° C in un bagno d'acqua.
- I campioni su ghiaccio e caricarli in un tubo capillare. Eseguire EPR al RT (impostazioni utilizzate nel passaggio 2.1.13).
- Per verificare il contributo di specie specifiche e fonti utilizzando diversi inibitori, pretrattare 88 µ l di omogenato di polmone + /-inibitore, regolazione con KHB per ottenere un volume finale di 98 µ l. In questo esperimento, gli inibitori incluso 10 µ l di SOD (100 U/mL), 4 µ l di deferoxamina (DFO; concentrazione finale = 800 µM), o 4 µ l di cloruro di diphenyliodonium (DIP; concentrazione finale = 100 µM). Incubare per 20 min a 37 ° C in un bagno d'acqua.
- Aggiungere 2 µ l di CMH ed incubare per un altro 20 min a 37 ° C, seguita da misure EPR come descritto sopra. Includere un campione in bianco abbinato una tantum con CMH KHB contenente saccarosio tampone. In alternativa, conservare le aliquote degli omogeneati del polmone rimanente (punto 3.1.2) a-80 ° C per le misurazioni successive.
Nota: Il volume totale può essere scalato come necessario.
-
Misure EPR il tessuto polmonare da topi iniettati con filare sonde in vivo (a RT utilizzando delle cellule del tessuto)
- Preparare soluzione stock CPH sciogliendo 4,9 mg di CPH in 1 mL di tampone fosfato filtrato e deossigenato 50 mM.
- Anestetizzare topi con isoflurano inalato (1.5-4%) per 20-30 secondi fino a quando non risponde alla punta pizzico. Iniettare la rotta di topi tramite retroorbital con 100 µ l di sonda spin CPH per un peso corporeo di 25 g del mouse (dose finale = 20 mg/kg) e permettere alla sonda di circolare per 1 h. immediatamente dopo l'iniezione retroorbital, aggiungere una goccia di 0.5% proparacaine HCl sulla zona del contorno occhi per preve dolore oculare NT e secchezza. Monitorare i topi per 1 h e procedere alla raccolta del tessuto.
- Raccogliere il tessuto polmonare, come descritto in precedenza e flash congelare i polmoni.
- Tagliare 20-30 mg di tessuto congelato su ghiaccio secco e registrare il peso esatto.
- Pulire delicatamente il tessuto con salviettine per assorbire l'acqua superficiale.
- Posizionare il tessuto all'interno della finestra della cella del tessuto (un accessorio permette misurazioni EPR per campioni di tessuto) ed eseguire EPR per determinare il totale giri. I dati possono essere espresso come totali giri per mg di tessuto.
5. analisi dei dati
- Simulare gli spettri EPR utilizzando SpinFit modulo incorporato nel software Xenon dello spettrometro EPR EMXnano banco. Determinare la concentrazione di nitrossidi dal modulo SpinCount. In alternativa, può essere fatta una curva di calibrazione di una stabile nitrossidi come 4-idrossi-TEMPO o TEMPOL e la concentrazione può essere ottenuta confrontando l'intensità del segnale con il campione e standard.
- Per i dati raccolti a 77 K, utilizzare doppia integrazione seguita da SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Rilevamento di superossido utilizzando CMH è stata convalidata utilizzando la X / superossido XO generando sistema per dimostrare che il segnale di nitrossidi (CM..) completamente è stato inibito da SOD, mentre catalasi non ha avuto effetto (Figura 1A). Il superossido totale, extracellulare è stata quindi valutato in 264.7 celle grezze di incubazione le cellule con la sonda di spin CMH cellula-permeabile + /-pretrattamento di SOD. La concentrazione di nitrossidi è stata misurata nella sospensione cellulare e buffer, che ha dimostrato che i valori nei due tipi di campione erano simili a causa della natura permeabile e rapida equilibrazione della sonda spin (Figura 1B). Il segnale di radicali nitrossidi aumentato in cellule RAW 264.7 stimolate con PMA rispetto alle cellule di controllo. Questo segnale è stato attenuato significativamente in cellule pretrattate con cella-impermeabile SOD (Figura 1). Ogni colore rappresenta pozzi testati su diversi giorni, dimostrando la coerenza dei dati raccolti in giorni specifici e riproducibilità dei risultati nel tempo. La concentrazione di superossido extracellulare è stata determinata sottraendo il segnale in PMA cellule pretrattate con SOD dal segnale dopo PMA in assenza di SOD (T). Il segnale rimanente è stato attribuito a superossido intracellulare (Figura 1). Figura 1 illustra il calcolo del totale ed extracellulare del superossido. (E) il segnale intracellulare è stato confermato in cellule trattate con PMA dopo la rimozione dei mezzi di comunicazione e dall'effetto di PEG-SOD sul segnale. In questo grafico, in contrasto con (C), il vuoto CMH non è stato sottratto le misurazioni e i dati grezzi sono mostrati.
Mitocondriale del superossido in 264.7 celle grezze è stato rilevato usando l'EPR spin sonda mito-TEMPO-H, che si accumula nel mitocondriale. (A) spettri EPR rappresentante per il segnale di mito-TEMPO-H della linea di base nel buffer, il mito-TEMPO-H aumentata del segnale in cellule di controllo (Con) e l'ulteriore avanzata del segnale in cellule stimolate con l'inibitore mitocondriale Antimycin A (AA). L'aumento del segnale è stato attribuito per il superossido mitocondriale basato sul nostro studio precedente, mostrando che la sovraespressione SOD2 significativamente attenuati misurazioni con mito-TEMPO-H10. In Figura 2B, la concentrazione di nitrossidi mitocondriale è stata determinata sottraendo il segnale di mito-TEMPO-H nel buffer pari tempo dalle misure di cella. Il segnale di CM. ottenuto a bassa temperatura in 264.7 celle grezze dopo stimolazione con PMA in presenza ed assenza di zolla. (Figura 3A) Il segnale di CM. è stato attenuato in presenza di SOD, coerenti con i dati di temperatura (Figura 1). Figura 3B Mostra la fotografia della tubazione di PTFE con i tappi utilizzati per raccogliere dati a 77 K per le cellule e campioni in vivo . Produzione del superossido è stata rilevata nel sangue e BALF usando la sonda di spin CMH. Campioni di sangue o BALF sono stati raccolti da topi trattati con PBS e Bleo e incubati immediatamente con CMH. I campioni sono stati trasferiti alla tubazione di PTFE e flash congelate, ed EPR sono stati raccolti a 77 K. La concentrazione di nitrossidi (CM.) accumulato nel sangue incubate con CMH (0,2 mM) a 37 gradi per 10 min (Figura 4A). Concentrazione di nitrossidi (CM.) da BALF incubate per 50 min (Figura 4B). Concentrazione di nitrossidi rappresenta la concentrazione di (CM..) accumulata in volume di sangue o BALF usato nell'esperimento.
Tre metodi sono stati testati per valutare pubblicati diverse tecniche per la conservazione dei tessuti e amministrazione di spin sonde ex vivo vs. in vivo. Per eseguire misurazioni di EPR il tessuto polmonare, abbiamo in primo luogo usato del tessuto polmonare congelato flash dal controllo o feriti topi. Figura 5A Mostra il segnale di CM. totale nel surnatante di un piccolo pezzo di tessuto polmonare incubato a 37 ° C con CMH nei topi trattati con PBS e Bleo, rispettivamente. A causa della eterogeneità della ferita polmonare dopo trattamento di Bleo, si consiglia di tagliare pezzi provenienti da diverse regioni del polmone e la media di diverse misurazioni per fornire un valore più rappresentativo. In alternativa, si può omogeneizzare l'intero polmone e usare un campione di questo omogeneato. I dati raccolti a 77 K utilizzando tubi di PTFE e dito dewar. Figura 5B Mostra spettri rappresentativi di nitrossidi (CM..) segnali dai topi trattati con PBS e Bleo, rispettivamente.
Una limitazione per il trattamento del tessuto del polmone ex vivo è che non è possibile distinguere attendibilmente extracellulare da superossido intracellulare grazie alla lavorazione del tessuto che sconvolge le membrane cellulari. Se questa informazione è importante per la questione sperimentale, può essere affrontato utilizzando il in vivo CPH instillazione metodo descritto di seguito. Tessuto congelato non può essere utilizzato per valutare il superossido mitocondriale; però, per questa misura, il protocollo può essere adattato per usare mito-TEMPO-H nel tessuto o mitocondri appena isolati.
Come un secondo metodo per misure EPR nel tessuto polmonare, tessuto fresco è stato omogeneizzato nel buffer di saccarosio. Omogeneato del polmone è stato incubato con sonda CMH nel buffer KHB contenenti DTPA. Le misurazioni di EPR erano fuori a RT. 6A figura viene illustrato l'aumento di CM. con Bleo. Abbiamo presentato un ulteriori test utilizzando diversi inibitori che possono essere utilizzati per determinare la specie che contribuiscono a CM. segnale. Per delucidare l'origine del segnale di CM. generato dal tessuto polmonare, abbiamo pretrattati omogenati di polmone con diversi organismi saprofagi e inibitori di enzimi. Omogenati di polmone sono stati incubati con CMH in assenza o la presenza di cloruro di SOD, deferoxamina (DFO) e diphenyliodonium (DIP) per tenere conto (rispettivamente) per i contributi da superossido, Ferro da stiro o superossido generato da flavin-contenente enzimi (Figura 6B). Questo approccio può essere adattato per valutare le specifiche specie radicale generate in un sistema o chiarire il contributo delle altre fonti enzimatiche (ad es., NOX, eNOS o xantina ossidasi).
Topi sono stati iniettati con CPH spin sonde (20 mg/kg) tramite l'itinerario retroorbital per eseguire misurazioni di EPR in vivo. Non è noto se CMH può essere somministrata agli animali, mentre la sonda CPH è stata segnalata per essere non-tossici; così, abbiamo selezionato CPH per gli esperimenti in vivo . Tessuti polmonari sono state raccolte e flash congelati in azoto liquido 1 h dopo la circolazione delle sonde CPH. Topi possono essere contemporaneamente trattati con antiossidanti specifici per distinguere le specie responsabili del segnale. Figura 7A Mostra il maggiore CP. segnale in topi Bleo-trattati rispetto ai topi di controllo. Spettri rappresentativi del tessuto polmonare da topi Bleo-trattati e di controllo sono mostrati in figura 7B. Un misto spettri EPR di CP. e radicale di acido ascorbico è stato osservato. I valori riportati in figura 7A sono le concentrazioni di CP. componenti. I dati sono stati raccolti a RT utilizzando la cella di tessuto.
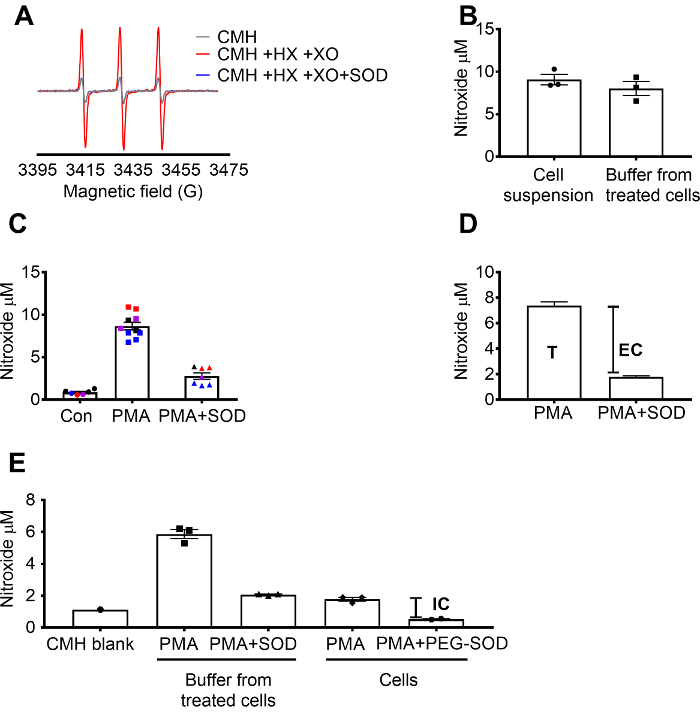
Figura 1: rilevamento di superossido in diversi compartimenti cellulari. (A) gli spettri EPR generati da 0,25 mM CMH in ipoxantina/xantina ossidasi di 0,5 mM (8 mU/mL) con e senza SOD (30 U/mL). (B) RAW 264.7 cellule (1 x 106 cellule/pozzetto) sono state stimolate con 10 µM PMA in presenza di CMH per 50 min a 37 ° C e nitrossidi concentrazione (µM) rilevato in sospensione di cellule (cellule + buffer) e buffer raccolti da cellule trattate. (C) RAW 264,7 cellule sono state stimolate con PMA vs. controllo del veicolo (Con). Una serie di celle sono stati pretrattati per 10 min con 30 U/mL cella-impermeabile SOD (PMA + SOD). Ogni colore rappresenta i dati da diversi giorni sperimentale e ogni punto rappresenta le cellule da un individuo bene. Il segnale di nitrossidi in un vuoto di tempo-abbinato con CMH in KHB è stato sottratto da ogni segnale per ottenere valori finali. (D) calcolo del totale ed extracellulare superossido in PMA hanno stimolato le cellule; T = totale superossido, CE = extracellulare superossido (segnale inhibitable SOD). (E) per valutare il segnale intracellulare superossido (IC), il segnale nel buffer dopo PMA + SOD è stato confrontato cellule trattate con PMA dopo la rimozione del buffer. Per confermare, i pozzi sono stati pretrattati con 60 U/mL cellula-permeabile PEG-SOD per 1,5 ore per determinare la SOD intracellulare inhibitable. Il vuoto CMH tempo-abbinato è mostrato, e dati riflettono nitrossidi assoluta segnale. I dati espressi come media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: rilevamento di superossido mitocondriale in RAW cellule stimolate con antimycin r. (A) rappresentante spettri dello spin EPR mitocondriale specifico sonda, 0,25 mM mito-TEMPO-H in 264.7 celle grezze senza (Con) o con 25 µM antimycin A (AA) per 50 min a 37 ° C. (B) concentrazione CM. (µM) in cellule trattate con AA rispetto al controllo. Il segnale di nitrossidi in un vuoto di mito-TEMPO-H tempo-abbinato è stato sottratto dalla totale segnale per ottenere valori finali. I dati espressi come media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: rilevamento di superossido in RAW 264.7 celle a 77K. (A) cruda 264,7 cellule stimolate con 10 µM PMA ed EPR spin sonda, CMH 0,25 mM (50 min a 37 ° C) con il (nero) o senza pretrattamento (rosso) con 30 U/mL SOD. 100 µ l del surnatante è stato caricato in un 1-pollice nel pezzo di lunghezza di tubazione di PTFE, quindi flash congelati in azoto liquido. I tappi sono stati rimossi, e congelata tubazione di PTFE è stato disposto nel dito dewar per l'acquisizione di dati alle 77 foto di K. (B) una tubazione di PTFE e tappi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: misure EPR in sangue e BALF da topi trattati con bleomicina e controllo. Topi sono stati trattati con una singola dose di bleomicina endotracheale (IT Bleo) (100 µ l a 1 U/mL) o veicolo di PBS. A 7 giorni, i topi sono stati anestetizzati ed eutanasia. Sangue è stato raccolto tramite puntura ventricolare di destra in una siringa rivestita con 1000 eparina USP/mL contenente 100 µM DTPA. Fluido di lavaggio broncoalveolare (BALF) è stato raccolto da lavaging i polmoni con 1 mL di 100 µM DTPA in PBS. Sangue e BALF sono state incubate per 10 o 50 min, rispettivamente, con 0,2 mM CMH a 37 ° C. 150 µ l di sangue o di BALF è stato caricato in flash tubi PTFE congelati in azoto liquido ed EPR i dati raccolti a 77 K utilizzando un dito dewar. I dati mostrano nitrossidi concentrazioni nel sangue (A) e (B) BALF dai topi trattati con PBS e Bleo (n = 4-6). Dati espressi come media ± SEM. (C) Representative spettri di nitrossidi nel sangue dai topi trattati con PBS e Bleo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: misure EPR nel tessuto polmonare congelato flash. Topi sono stati trattati con una singola dose di bleomicina endotracheale (IT bleo) (100 µ l a 1 U/mL) o veicolo di PBS. A 7 giorni, i polmoni sono stati scaricati con PBS freddo per rimuovere sangue e flash congelati in azoto liquido. 5-15 mg di tessuto polmonare flash-congelato è stato incubato con 0,2 mM CMH in KHB contenente 100 µM a 200 µ l di volume totale per 1 h a 37° C. surnatante è stato raccolte e collocate in tubazione di PTFE ed eseguire a 77 K nel dito dewar. (A) nitrossidi concentrazione (µM di nitrossidi normalizzato a 1 mg di tessuto). I dati rappresentano la media delle misurazioni di 2-3 per ciascun polmone. Dati espressi come media ± di nitrossidi nel tessuto polmonare da topi trattati con PBS e Bleo gli spettri rappresentativi SEM. (B). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: misure EPR nel tessuto polmonare conservato nel buffer di saccarosio. Topi sono stati trattati con una singola dose di bleomicina endotracheale (100 µ l a 1 U/mL). Al 7 giorni post-trattamento, i polmoni sono stati scaricati con PBS freddo per rimuovere il sangue e tessuto polmonare fresco è stato omogeneizzato in tampone Tris-EDTA contenente saccarosio di 0,25 mM a un rapporto di volume (mg / µ l) 1:6 peso/buffer del polmone. 50 µ l di omogeneato del polmone è stato preincubato con KHB con o senza i seguenti inibitori per 20 min a 37 ° c: SOD (100 U/mL), deferoxamina (DFO; 800 µM) e cloruro di diphenyliodonium (DIP; 100 μM) seguita da incubazione con 0,2 mM CMH in KHB contenente 100 µM DTPA per 20 min a 37 ° C. Dati è stati ottenuti a RT utilizzando tubi capillari EPR. (A) nitrossidi concentrazione nei polmoni di topi trattati con PBS e Bleo. (B) nitrossidi concentrazione nei polmoni di Bleo in assenza o presenza di inibitori (n = 3). I dati espressi come media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: misure EPR nel tessuto polmonare da topi iniettati con sonda spin CPH. 100 µ l di CPH è stato amministrato tramite retroorbital iniezione per una concentrazione finale di 20 mg di CPH per kg di peso corporeo. Dopo 1 h di circolazione, topi sono stati sacrificati, i polmoni sono stati scaricati con 10 mL di freddo PBS tramite ventricolo destro e tessuto polmonare era flash congelati. 20-30 mg di tessuto polmonare è stato inserito nella cella di tessuto ed EPR le misure effettuate allo RT. (A) dati espressi in giri / mg. spettri (B) rappresentante di nitrossidi segnale nei tessuti polmonari PBS e Bleo (* indica la sovrapposizione con acido ascorbico radicale). I dati espressi come media ± SEM. Clicca qui per visualizzare una versione più grande di questa figura.
| Inibitori | Specie |
| Superossido dismutasi (SOD) | Extracellulare superossido |
| Superossido dismutasi – polietilene glicole (PEG-SOD) | Intracellulare superossido |
| Catalasi | Radicali perossido di idrogeno basato |
| Urato | Perossinitrito |
| Etanolo e DMSO | Radicale ossidrile |
| Chelatori del metalli | Ioni metallici (ferro e rame) |
Tabella 1. Inibitori comuni utilizzati per distinguere le specie responsabili spin sonda ossidazione.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La valutazione della produzione di radicali liberi nelle impostazioni biologiche è importante nella comprensione regolato segnalazione redox in salute e malattia, ma la misura di queste specie è estremamente impegnativo a causa della breve emivita di specie del radicale libero e tecnici limitazioni con metodi comunemente utilizzati. L'EPR è uno strumento prezioso e potente in biologia redox, poichè è il metodo solo non ambiguo per la rilevazione dei radicali liberi. In questo progetto, dimostriamo metodi EPR pratici per la progettazione di esperimenti e preparazione dei campioni per rilevare ROS usare spin sonde in diversi compartimenti cellulari in vitro e diversi compartimenti in vivo. Forniamo anche metodi pratici per gestire campioni biologici e conservare i campioni per migliorare l'efficienza.
Sonde di spin reagiscono in modo efficiente con ROS e producono una stabile nitrossidi radicali che possono essere rilevati con EPR. Diversi derivati della sonda spin (ciclico idrossilammina) sono stati sintetizzati con caratteristiche di permeabilità differenti, che li rendono adatti per la rilevazione di produzione di radicali liberi in diversi compartimenti cellulari10. Questo protocollo utilizzato la sonda spin cellula-permeabile, CMH; però, il cloruro di 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium spin impermeabile sonda HCl (CAT1H) consente di rilevare extracellulare del superossido. Simile al nostro precedente studio umano linfoblasto cella linee18, siamo stati in grado di convalidare l'uso della sonda spin CMH permeabile con SOD impermeabili e cellulari permeabili PEG-SOD in cellule RAW 264.7 (una topo polmone linea cellulare del macrofago) stimolate con PMA per distinguere tra superossido extracellulare ed intracellulare.
Abbiamo inoltre validato l'equilibrazione rapida di CMH tra i compartimenti intra - ed extracellulari, e abbiamo anche trovato che il segnale di superossido in cellule gocce significativamente una volta lavate le celle in una sola volta con KHB (dati non mostrati). Abbiamo confermato l'utilità del mitocondriale specifico spin sonda mito-TEMPO-H in 264.7 celle grezze per misurare l'aumento mitocondriale del superossido generato al momento della stimolazione con trasporto mitocondriale dell'elettrone catena inibitore antimycin A. Il contributo specifico della produzione mitocondriale del superossido-mito-ritmo-H è stato dimostrato in precedenza e possa essere convalidato in esperimenti usando i mitocondri isolati freschi o sistemi con superossidodismutasi mitocondriale di MnSOD (SOD2) sovraespressione di10.
La valutazione del ROS produzione in vivo è particolarmente impegnativa, ma la capacità di rilevare la produzione di ROS specifico fornisce informazioni importanti quando interrogando il ruolo dello sforzo ossidativo o redox regolato segnalazione in biologico Impostazioni. La gestione adeguata del tessuto quando si utilizza spin sonde ed EPR è essenziale per generare risultati riproducibili e significativi. L'uso di sonde di spin con tessuto non sarà radicali superossido probabile misura presentano al momento della raccolta dei tessuti a causa di una breve emivita, ma invece rileva superossido prodotto da enzimi come ossidasi NAPDH, disgiunto endoteliale di ossido nitrico sintasi , o xantina ossidasi quando tessuto polmonare o omogeneati sono incubati con la sonda di spin a 37 ° C. L'uso del tessuto congelato non includerà superossido generato dai mitocondri, dall'attività della catena di trasporto mitocondriale dell'elettrone danni congelamento. Per testare mitocondriale del superossido, i ricercatori hanno bisogno per isolare i mitocondri freschi o uso sonde specifiche mitocondriale in vivo o in tessuto fresco.
Diversi protocolli per preservare il tessuto sono apparse nella letteratura14,15. Abbiamo confrontato tre metodi pubblicati per misure EPR nel tessuto polmonare: 1) flash del tessuto di congelamento in azoto liquido, 2) omogeneizzazione del tessuto nel buffer di saccarosio e 3) il trattamento topi in vivo con una rotazione della sonda 1 ora prima della raccolta del tessuto. Abbiamo confrontato i topi di controllo ai topi con polmonare grave infiammazione e stress ossidativo indotto da bleomicina per testare la capacità di ciascun metodo di mostrare differenze consistenti in nitrossidi segnali nei polmoni feriti. Tutti e tre i metodi hanno mostrati un simile aumento relativo nel segnale di nitrossidi nei polmoni dei topi trattati con bleomicina. L'uso del tessuto congelato flash sarebbe probabilmente l'approccio più semplice per raccogliere il tessuto per la maggior parte dei laboratori, negando la necessità di elaborare del tessuto nel buffer di saccarosio al momento della raccolta. L'iniezione di CPH a catturare i radicali liberi in vivo è potente, ma per confermare la specie specifica, ciò richiede un gruppo di trattamento compreso l'antiossidante appropriato.
Una sfida di usando sonde di spin è che l'ossidazione di sonde di spin di nitrossidi genera uno spettro EPR tre righe simile indipendentemente dalla specie responsabili dell'ossidazione; Pertanto, non viene fatta distinzione tra le diverse specie ROS. Inoltre, è stato segnalato che ci sono potenziali reazioni di idrossilammina sonde con trasporto degli elettroni fotosintetici catena e citocromo c ossidasi19,20. Queste osservazioni dovrebbero essere considerate nell'interpretazione dei risultati. In questo protocollo, il sistema fotosintetico non è presente, e l'inclusione di DTPA con il buffer inibisce la potenziale contaminazione degli ioni ferrici e rameosi liberi10 . Abbiamo dimostrato come utilizzare una serie di enzimi specifici o chelanti nel tessuto polmonare per stabilire il contributo di particolare ROS o inibitori enzimatici per determinare l'origine del ROS. Questo approccio è stato utilizzato in precedenza con EPR per determinare il contributo di ROS dovuto disgiunto eNOS13,15. Forniamo un elenco degli inibitori comuni utilizzati per distinguere le specie responsabili spin sonda ossidazione (tabella 1).
Abbiamo anche dimostrato l'importanza di ottimizzare il tempo di incubazione per ogni condizione sperimentale. Quando confrontando spin sonde di spin trappole, trappole di spin generano unici spettri a seconda del reagente che consente per la specificità della specie del radicale libero; Tuttavia, essi inoltre esibiscono la cinetica lenta per superossido spin trapping e sono inclini alla biodegradazione. Il trattamento del tessuto polmonare con l'EPR sonda ex vivo è limitato anche da un'incapacità di distinguere adeguatamente extracellulare da superossido intracellulare dovuto la rottura delle membrane cellulari durante l'elaborazione del tessuto (congelamento o omogeneizzazione). Uso dello spin iniettato sonda in vivo in combinazione con zolle o cellula-permeabile PEG-SOD può affrontare questo problema.
Un unico obiettivo era di stabilire un protocollo per raccogliere campioni e conservarli a-80 ° C prima di misure EPR efficacemente. Abbiamo pertanto sviluppato un metodo pratico per l'utilizzo di tubi in PTFE per i campioni della tenuta. Questo tubo viene inserito direttamente nella barretta dewar per analisi EPR a 77 K senza la necessità di pulire il dewar tra campioni. Si tratta di un'alternativa al metodo recentemente pubblicato che coinvolgono il congelamento dei campioni in siringhe da 1 mL. Le misurazioni in campioni congelati memorizzati nella tubazione di PTFE possono essere ripetute per diversi giorni per dimostrare la stabilità del segnale. Questo approccio consente per le misurazioni di EPR di betonaggio e facilita il trasferimento dei campioni tra laboratori così un impianto EPR remoto può eseguire campioni.
Nel complesso, questi protocolli forniscono un approccio diretto alla preparazione di cellule e tessuti per la misurazione di EPR nei sistemi biologici. I protocolli possono essere adattati ad altri modelli connessi con lo sforzo ossidativo e con l'uso di altre sonde di spin. La temporizzazione e la concentrazione della sonda spin dovrà essere regolato per ogni condizione sperimentale. La capacità di determinare la presenza e la produzione di radicali liberi specie senza ambiguità EPR fornisce rigore di approcci sperimentali nel campo della biologia redox.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla a rivelare.
Acknowledgments
Questo lavoro è stato supportato dalla University of Colorado at Scuola di medicina Dean di infrastrutture di ricerca strategiche award, R01 HL086680-09 e 1R35HL139726-01, al E.N.G e UCD CFReT premio fellowship (lui). Gli autori ringraziano il Dr. Sandra Eaton e Dr. Gareth Eaton (Università di Denver), Dr. Gerald Rosen e Dr. Joseph P. Kao (Università del Maryland), Dr. Sujatha Venkataraman (University of Colorado Denver) per utili discussioni e Joanne Maltzahn, Ashley Trumpie e Ivy McDermott (University of Colorado Denver) per il supporto tecnico.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



