Summary
전자 상자성 공명 (EPR) 분광학은 자유 래 디 칼을 측정 하는 명확한 방법입니다. 선택적 스핀 프로브를 사용 하 여 다른 세포질 격실에서 자유 래 디 칼의 검출에 대 한 수 있습니다. 우리는 치료, 저장 및 전송 EPR 측정용 샘플을 용이 하 게 하는 생물 학적 샘플을 수집 하는 실용적이 고 효율적인 방법을 제시.
Abstract
다른 세포와 조직 구획에서 반응성 산소 종 (선생님)의 정확 하 고 구체적인 검색 생물 설정에서 신호 redox 규제의 연구에 필수적 이다. 전자 상자성 공명 분광학 (EPR) 자유 래 디 칼을 명확 하 게 평가 하는 유일한 직접적인 방법입니다. 그것의 장점은 특정 종의 생리 수준 높은 특이성을 감지 하지만 전문된 기술, 주의 샘플 준비, 그리고 적절 한 컨트롤 데이터의 정확한 해석을 보장 하기 위해 필요. 주기적 hydroxylamine 스핀 프로브 superoxide 또는 EPR 분광학에 의해 양이 정해질 수 있다 nitroxide 신호를 생성 하기 위해 다른 래 디 칼과 선택적으로 반응 합니다. 세포 투과성 스핀 프로브와 스핀 프로브는 미토 콘 드리 아에서 급속 하 게 축적 하도록 설계 된 다른 세포질 격실에서 초과 농도의 결정에 대 한 수 있습니다.
배양된 세포, 세포 투과성 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH)와 함께 고 셀 불 침투성 superoxide dismutase (잔디) 전처리 없이 사용 또는 세포 침투성 페그-잔디의 사용에 대 한 수는 cytosolic superoxide에서 세포 외의 차별화입니다. 미토 콘 드리 아 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] piperidinium dichloride (미토-템포-H) 측정 가능 미토 콘 드리 아 데 선생님 (주로 초과)
스핀 프로브 및 EPR 분광학 vivo에서 모델에 적용할 수 있습니다. Superoxide는 extracellular 체액 혈액과 치경 유체 등 폐 조직 같은 조직에서 검색할 수 있습니다. 여러 가지 방법은 처리 및 저장 EPR 측정에 대 한 조직 정 맥 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) 스핀 프로브 비보를 전달 하 되 게 됩니다. 실 온에서 측정을 수행할 수 있습니다, 하는 동안 생체 외에서 그리고 vivo에서 모델에서 얻은 샘플 또한-80 ° C에 저장 고 수 77 공화국에서 EPR에 의해 분석 샘플 특수 튜브 안정-80 ° c에 저장 고 실용적, 효율적 있도록 77 K 및 저장 및 전송 샘플을 용이 하 게 재현할 수 방법에서 실행 될 수 있습니다.
Introduction
모든 기관 시스템 산화 스트레스와 반응성 산소 종의 다양 한 질병의 연구에 중요 한 동안, 반응성 산소 종 (선생님)의 검출 짧은 반감기와 높은 반응성 도전 이다. 전자 상자성 공명 (EPR) 기법 자유 래 디 칼을 탐지 하기 위한 가장 명확한 방법입니다. 스핀 프로브는 더 일반적으로 사용 되는 형광 프로브 이점이 있다. 형광 프로브는 상대적으로 저렴 하 고 쉽게 사용 하 고 선생님의 빠른, 민감한 감지를 제공, 비록 그들은 artifactual 신호, 선생님 농도, 그리고 특이성1의 일반적인 부족을 계산 하는 무 능력 때문에 심각한 제한을 하지 않아도 .
생물 학적 연구에 대 한 EPR의 사용을 촉진 하기 위하여 다양 한 생물학 관련 자유 래 디 칼 종으로 포2, pH, 그리고 산화의 범위를 측정할 수 있는 프로브 합성 된 스핀 상태2,3, 4,5,,67. 스핀 트랩 또한 단명 래 디 칼을 잡으려고 개발 되었습니다 그리고 양식을 오래-생활 adducts, EPR8탐지를 용이 하 게. (스핀 프로브와 스핀 트랩) 두 클래스는 장점과 제한 사항이 있습니다. 스핀 프로브에의 한 일반적으로 사용 되 클래스는 EPR 침묵 되 고 안정적인 nitroxide를 짧은 기 반응 순환 hydroxylamines. 순환 hydroxylamines 반응 초과 100 배 빠른 스핀 트랩, 세포질 산화 방지 제와 경쟁 하기 위해 그들을 활성화 보다 하지만 그들은 특이성 부족 하 고 적절 한 컨트롤 및 과격 한 종 또는 소스를 식별 하는 억제제의 사용을 필요로 nitroxide 신호를 담당 합니다. 스핀 트랩 전시 특이성, 하는 동안 함께 독특한 패턴 갇혀 종에 따라, 그들은 있다 느린 속도 초과 트랩을 회전 하 고 급진적인의 생 분해 하는 경향이 있다 스펙트럼 adducts. 스핀 트랩 응용 프로그램은 생물 의학 연구9,,1011,,1213에 문서화 되었습니다.
이 프로젝트의 목표는 실험 설계를 위한 실용적인 EPR 방법을 설명 하 고 다른 세포질 격실 생체 외 에서 그리고 다른 조직 구획에서 vivo에서프로브 superoxide 스핀을 사용 하 여 검색 하는 샘플을 준비. 몇몇 원고는 출판 프로토콜 마우스 모델에서 분석을 위한 대상 다른 세포질 구획 시험관 및 프로세스 조직 세포 투과성, 세포-스며들 지 않는, 미토 콘 드 리아 타겟된 스핀 프로브를 사용 하 여 이러한 목표에 관련 된 14 , 15. 우리 문학이 몸 시 정확한 보장 하기 위해 체 외에 다른 세포질 격실에서 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) 스핀 프로브를 사용 하는 superoxide를 측정 하는 방법을 확인 하 여 구축 측량, 결과 왜곡 수 있는 잠재적인 기술 문제를 강조. 우리는 또한 혈액, bronchoalveolar 게 액체, 및 폐 조직 CMH 스핀 프로브를 사용 하 여 EPR 측정을 수행 하는 메서드를 제공 합니다. 이러한 연구는 조직 처리 조직 수확 전에 마우스 다른 스핀 프로브, CPH, 주입 하는 방법을 제시 하는 다른 메서드를 비교 합니다. 마지막으로, 우리는 저장 및 77 공화국에서 EPR 측정 하기 전에 샘플의 전송에 대 한 있도록 소계 (PTFE) 튜브에서 샘플을 저장 하는 실용적인 방법을 개발합니다
Subscription Required. Please recommend JoVE to your librarian.
Protocol
모든 동물 연구 대학 콜로라도 덴버 기관 동물 관리 및 사용 위원회에 의해 승인 되었다.
1입니다. 시 약의 준비
-
Diethylenetriaminepentaacetic 산 (DTPA) 주식 (150 mM)
- DTPA의 2.95 g를 추가 (393.35 g/mol)의 이온된 수 10 ml.
- DTPA 해산 dropwise 1 M NaOH 추가 7.0의 pH.
- 150 m m의 최종 DTPA 농도 대 한 물 50 mL에 볼륨을 가져오고 4 ° c.에 저장
-
인산 염 버퍼 식 염 수 (PBS) (50 m m, pH 7.4)
- 염화 나트륨 (NaCl) (58.44 g/mol; 29.22 g/100 mL)의 5 M를 준비 합니다.
- 칼륨 인산 염 염기 홍콩2포4 (174.18 g/mol; 17.42 g/100 mL)의 1m 준비
- 칼륨 인산 이수소 KH2포4 (136.1 g/mol; 13.61 g/100 mL)의 1m를 준비 합니다. 인산 이수소 4.24 mL의 1 M 칼륨 인산 염 염기와 1 M 칼륨의 0.760 mL 5 M NaCl의 3 mL을 믹스. PH를 확인 하십시오.
- 이온을 제거 된 물 100 mL에 볼륨을 가져와.
- 단기 (일)에 대 한 상 온 (RT) 및 장기 (주) 스토리지에 대 한 4 ° C에서 저장 합니다.
-
Krebs Henseleit 버퍼 (KHB) 100 µ M DTPA를 포함 하
- 50 mL 원뿔 원심 분리기 튜브에서 150mm DTPA 재고 솔루션의 33.3 µ L를 추가 합니다.
- Krebs Henseleit 버퍼 (KHB) 50 mL 볼륨을가지고.
- DTPA와 신선한 버퍼 매일 준비 하 고 실시간에 그것을 유지합니다
-
자당을 포함 하는 트리 스-EDTA 버퍼
- 0.5 M Tris 재고 준비: 15.14 g 150ml의 이온을 제거 된 물에서 트리 스 자료 (121.14 g/mol)의 해산. HCl을 사용 하 여, 7.8에 pH를 조정 하 고 250 mL의 최종 볼륨을.
- 자당의 21.4 g 해산 (342.29 g/mol; 최종 농도 = 0.25 m m) 이온 물 150ml에.
- 자당 10 mM 최종 트리 스 농도 달성 하기 위해 트리 스 증권의 5 mL를 추가 합니다.
- 트리 스-자당 1 mM 최종 농도 달성 하기 위해 0.5 M EDTA 재고의 0.5 mL를 추가 합니다.
- 산도 확인 하 고 7.4에 조정.
- 이온을 제거 된 물 250 mL의 최종 볼륨을 가져오고 4 ° c.에 저장
-
소 적혈구 Cu/Zn superoxide dismutase (잔디) 주식 (30000 U/mL)
- 1 mL의 PBS (약 5.7 m g, 잔디의 활동에 따라)에 잔디의 30000 U reconstitute
- 음, 약 수, 혼합 하 고 단기 (6-12 개월) 동안-20 ° C에서 및 장기 저장을 위한-80 ° C에서 저장.
-
잔디 작업 솔루션 (1000 U/mL)
- 살 균 PBS의 870 µ L에 30000 U/mL 잔디 주식의 30 µ L 약 수를 전송 합니다.
- 얼음, 솔루션을 유지 하 고 신선한 사용.
-
Phorbol myristate 12 13-아세테이트 (PMA) 주식 (5 mM)
- PMA의 1 마그네슘을 해산 (616.83 g/mol) DMSO의 325 µ L에서 (최종 농도 = 5 mM).
- 약 5mm PMA 솔루션 수-20 ° c.에 그것을 저장 하 고
-
PMA 작업 솔루션 (125 µ M)
- 5mm PMA 주식의 10 µ L 약 수 살 균 PBS의 390 µ L로 희석.
- 얼음에 솔루션을 유지 하 고 신선한 사용.
- PMA에 대 한 차량 제어에 대 한 PBS의 390 µ L에서 DMSO의 10 µ L을 사용 합니다.
-
Diphenyliodonium 염화 (DIP) (2.5 m m)
- 3.2 밀리 그램의 분해를 2.5 m m 재고 4 ml (316.57 g/mol)를 찍어.
- 솔루션을 준비 하 고 신선한 사용.
-
Deferoxamine mesylate 소금 (DFO) (20mm)
- 돌연 사 했을까의 4.5 mg 해산 (656.79 g / mol) 20 m m 재고를 340 µ L에서.
- 솔루션을 준비 하 고 신선한 사용.
-
Antimycin A (AA) 주식 (5 mM)의 준비
- AA의 5.4 mg 해산 (532 g/mol) 에탄올의 2 ml에서 (최종 농도 = 5 mM).
- 약 유리 튜브에-20 ° c.에 게 주식 수
-
스핀 프로브의 준비
- 버퍼에서 용 존된 산소를 제거 하 50 m m 인산 염 버퍼 포함 100 µ M DTPA 30 분에 대 한 질소와 거품.
- -20 ° C 냉동 고에서 스핀 프로브를 제거 하 고 RT (10-15 분)에 서 컨테이너를 허용.
- 2.4 mg 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine·의 밖으로 무게 HCl (CMH) (237.8 g/mol)
- 10 m m의 최종 농도 deoxygenated 인산 염 버퍼의 1 mL에 CMH를 분해.
- 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride (미토-템포-H) (529.1 g/mol)의 5 밀리 그램을 무게.
- 9.5 m m의 최종 농도 deoxygenated 인산 염 버퍼의 1 mL에 미토-템포-H를 해산.
- 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine·의 4.9 m g으로 무게 HCl (CPH) (223.7 g/mol).
- CPH 22 m m의 최종 농도 deoxygenated 인산 염 버퍼의 1 mL에 녹.
- 약 수 및 저장소-80 ° c (동결-해 동 권장 하지 않음).
2. 초과 체 외 의 탐지
-
RT에서 PMA 자극 RAW 264.7 세포에서 세포 외, 총 및 세포내 초과 검출
- 다음 적절 한 무 균 기술을, RAW 264.7 세포를 해 동 하 고 10 %FBS (낮은 내 무료)와 암 피 실린 1 %antimycotic / CO2 배양 기에서 37 ° C에서 보충 DMEM 미디어에서 그들을 통과.
- 1 x 106 셀/잘 6 잘 플레이트 한 전날 치료에 씨앗 RAW 264.7 세포.
- 부드럽게 미디어를 제거 하 고 셀 KHB 버퍼의 1 mL을 한 번 씻어.
- KHB 100 µ M DTPA 각 음에 포함 된 추가 하 고 다음으로 500 µ L의 총 볼륨에서 치료.
- 웰 스, 잔디와 청소용된 추가 15 µ L/잘 떼 작업 솔루션의 (1000 U/mL; 잔디의 최종 농도 = 30 U/mL)와 CMH와 PMA의 추가 전에 37 ° C에서 10 분 동안 품 어.
- 12.5 µ L/10 m m CMH 주식 잘 추가 (최종 농도 = 0.25 m m).
- 40 µ L/잘 125 µ M PMA 작업 솔루션의 추가 (최종 농도 = 10 µ M) 또는 40 µ L 차량 (주식 10 µ L DMSO의 PBS의 390 µ L에서).
- CO2 배양 기에서 37 ° C에서 50 분 동안 품 어.
- 인큐베이터에서 플레이트를 제거 하 고 즉시 얼음에 그들을 배치.
- 튜브를 표시 하는 별도, 1.5 mL에 각 우물에서 버퍼를 수집 합니다. 전체 얼음에 계속.
- 100 µ M DTPA를 포함 하는 신선한 KHB 버퍼의 100 µ L 추가, 부드럽게 긁어 셀, 하 고 몇 번 위아래로 pipetting으로 resuspend. 셀 물의 resuspension 내내 얼음에 계속.
- 부하는 샘플 수집 단계 2.1.10 2.1.11 (50 µ L)에서 모 세관 튜브의 각. 양쪽 끝을 밀봉 하 고는 EPR를 실행 합니다.
참고: 항상 테스트 튜브 또는 잘 (셀) 하지 않고 버퍼에 프로브를 포함 된 (같은 농도 = 0.25 m m), 조사의 배경 강도 이므로 온도-제어로 셀 (동일한 보육 시간 및 온도)로 서 동일한 조건 하에서 치료 그리고 시간에 따라 다릅니다. - 다음에 EPR 수집 매개 변수를 설정: 마이크로파 주파수 = 9.65 g h z; 센터 필드 = 3432 G; 진폭 변조 = 2.0 G; 청소 폭 = 80 G; 전력 전자 레인지 = 19.9 mW; 검사의 총 수 = 10; 청소 시간 = 12.11 s; 그리고 시간 상수 = 20.48 석사.
-
RAW 264.7 세포에서 미토 콘 드리 아 초과 검출
- 단계 2.1.1, 2.1.2 씨앗 RAW 264.7 세포 실험에 앞서 1 일.
- 미디어를 제거 하 고 셀 KHB 버퍼의 1 mL을 한 번 씻어.
- 100 µ M DTPA 각 우물에 포함 된 KHB의 200 µ L를 추가 합니다.
- 5.3 µ L/9.5 m m 미토-템포-H 주식의 잘 추가 (최종 농도 = 0.25 m m)
- 실시간에서 10 분 동안 품 어
- Antimycin A (AA), 에탄올에 5 m m 재고 솔루션의 1 µ L/잘 추가 (최종 농도 = 25 µ M).
- CO2 배양 기에서 37 ° C에서 50 분 동안 품 어.
- 인큐베이터에서 플레이트를 제거 하 고 즉시 얼음에 그들을 배치.
- 부드럽게 긁어 셀과 아래로 pipetting으로 resuspend. 얼음에 계속.
- 모 세관 튜브에서 샘플을 로드 합니다. 양쪽 끝을 밀봉 하십시오.
- EPR 설정에 대 한 이전 섹션을 참조.
-
77 K에서 RAW 264.7 세포에서 초과 검출
- 1.1.10 사전 준비 PTFE 튜브 길이 (3/16"x 1/8" ID OD)에 1-2 인치에에서 단계에서 수집 된 버퍼를 놓습니다. PTFE 튜브는 바로 그래서 그것은 쉽게 삽입 될 수 있습니다 및 손가락에서 제거 되었는지 확인 dewar. PTFE 튜브의 한쪽 끝, 닫고, PTFE 튜빙에 버퍼 또는 세포 현 탁 액 (100 ~ 150 µ L) 플라스틱 두 번째 스 토퍼와 배관 밀봉 고무 마 개를 사용 합니다.
- 플래시 동결 액체 질소에 샘플입니다. 샘플-80 ° C에서 스토리지에 대 한 레이블이 cryopreservation 튜브로 전송 하거나 즉시 실행 될 수 있습니다.
- 손가락을 채우기 액체 질소와 삽입 손가락으로 샘플을 포함 하는 PTFE 튜빙 dewar dewar. 샘플 공의 활성 공간에서 중심 이며 77 K. EPR 실행 있는지 확인
참고: 당신의 분석기에 질소 가스 흐름을 시작 15-30 분을 측정 하기 전에 측정 공에 물 응축을 방지 하 고 전체이 흐름을 계속 하 고. - 다음에 EPR 수집 매개 변수를 설정: 마이크로파 주파수 = 9.65 g h z; 센터 필드 = 3438 G; 진폭 변조 = 4.0 G; 청소 폭 = 150 G; 전력 전자 레인지 = 0.316 mW; 검사의 총 수 = 10; 청소 시간 = 60 s; 그리고 시간 상수 = 1.28 석사.
3. EPR 측정 유체에
-
전 혈
- 마우스 (8-12 주 이전) PBS 또는 앞에서 설명한16,17로 혼자 PBS에 녹아 있는 intratracheal bleomycin (Bleo; 1 U/mL에서 100 µ L)의 단 하나의 복용량으로 취급 합니다.
- Exsanguination 및 자 궁 경부 전위 흡입된 isoflurane (1.5-4%)을 투여 하 여 쥐를 안락사. 우 심 실을 통해 혈액으로 헤 파 린 (USP/1000ml) 100 µ M DTPA 및 1.5 mL 튜브에 들어 있는 주사기로 발음.
- 별도 1.5 mL 튜브에 100 µ M DTPA를 포함 하는 PBS의 15 µ L을 추가 하 고 150 µ L의 총 볼륨 및 0.2 m m의 최종 CMH 농도 대 한 혈액의 132 µ L CMH (10 m m)의 3 µ L.
- 물 욕조에 37 ° C에서 10 분에 대 한 혈액을 품 어.
- 물 탕에서 튜브를 제거 합니다.
- 모 세관 튜브에 혈액을 로드 하 여 한 약 수를가지고 고 RT에 다음 EPR 인수 매개 변수와 함께 실행 하는 EPR: 마이크로파 주파수 = 9.65 g h z; 센터 필드 = 3432 G; 진폭 변조 = 1.0 G; 청소 폭 = 80 G; 전력 전자 레인지 = 19.9 mW; 검사의 총 수 = 3; 청소 시간 = 12.11 s; 그리고 시간 상수 = 20.48 양 또는 샘플에 설명 된 단계 2.3 냉동 플래시 수 있습니다 측정 77 K. EPR 인수 매개 변수는 다음: 전자 레인지 주파수 = 9.65 g h z; 센터 필드 = 3438 G; 진폭 변조 = 4.0 G; 청소 폭 = 150 G; 전력 전자 레인지 = 0.316 mW; 검사의 총 수 = 2; 청소 시간 = 60 s; 그리고 시간 상수 = 1.28 석사.
-
Bronchoalveolar 게 액체 (BALF)
- 안락사 후 (단계 3.1.2 참조) 천천히 주입 하 고 철수 1 mL의 PBS는 주사기를 통해 기도에 정 위치에 3 번 100 µ M DTPA를 포함 하 여 BALF 수집.
- 1.5 mL 튜브에 0.2 m m의 최종 농도를 CMH (10 m m)의 4 µ L로 BALF의 200 µ L를 취급 합니다.
- 물 욕조에 37 ° C에서 50 분 BALF를 품 어.
- 물 탕에서 튜브를가지고 고 얼음에 그들을 배치.
- 동일한 EPR 설정으로 모 세관 튜브와 RT에 실행된 EPR BALF 부하에 사용 단계 1.1.13, 또는 플래시 동결 액체 질소에 2.3 단계에서 설명한 대로.
-
77 K에서 혈액과 BALF EPR 측정
- 혈액 수집 위의 프로토콜에 따라 (3.1.1 단계. 3.1.4에) 및 BALF (3.2.1 3.2.4 단계).
- 치료 혈액 또는 PTFE (1-2에서) 튜브에 BALF 장소 150 µ L. 고무 마 개를 사용 하 여 샘플 및 튜브를 봉인 하기 위해 다른 스 토퍼 추가 이전 PTFE 튜빙의 한쪽 끝을.
- 플래시 동결 액체 질소에 샘플입니다.
- PTFE 튜빙 dewar 77 K. 실행 냉동 CMH에서 일주일에 혈액 샘플을 처리 하는 손가락을 사용 하 여 냉동된 샘플에 EPR를 실행에 대 한 자세한 내용은 섹션 2.3를 참조.
4. EPR 측정 폐 조직에
-
플래시 동결된 폐 조직
- 3.2.1 단계에서 BALF 수집 후 가슴 열리고 폐 플러시 차가운 PBS 를 통해 의 10 mL와 함께 혈액을 제거 하는 우 심 실. 플래시 동결 액체 질소에 폐 조직입니다. 냉동된 폐 조직-80 ° C에서 최대 6 개월 사용까지 EPR 측정 저장할 수 있습니다.
- 핀셋으로 드라이 아이스에 폐 조직 안정화와 폐 조직의 단일에 지 블레이드를 사용 하 여 여러 개의 작은 조각 (5-15 mg)를 잘라.
- 1.5 mL 튜브에 조직 무게, 튜브 규모와 규모, 포장용 다음 조직 조각 추가 놓고 무게를 기록 합니다.
- 1.5 mL 튜브에 조직에 KHB DTPA와 CMH (0.2 m m)의 4 µ L 200 µ L 총 볼륨을 달성 하기 위해 포함의 196 µ L를 추가 합니다.
- 물 욕조에 37 ° C에서 1 시간에 품 어.
- (몇 초간) 3,884 x g에서 microcentrifuge에 아래로 회전.
- 얼음에 및 PTFE 튜빙에는 상쾌한의 150 µ L 플라스틱 놓고 섹션 2.3에에서 설명 된 대로 77 K 측정에 대 한 동결 합니다.
참고:이 방법에 대 한 상해의이 간주 해야 합니다. Bleomycin 유도 폐 상해에 대 한 매우 이질적인 부상, 그에 주어진이 좋습니다 각 마우스에서 폐의 다른 부분에서 여러 가지 조직 조각을 잘라. 또는 조직의 더 큰 조각은 KHB 버퍼 아래 설명 된 대로 1:6 볼륨에 무게 비율로 (mg / µ L) 100 µ M DTPA를 포함 하는 무 균 수 있습니다.
-
신선한 폐 조직 자당 버퍼에 보존
- Lavaged 폐 단계 3.1.2에서에서 다 혈액을 제거 하는 차가운 PBS 가진 플러시.
- 유리 또는 PTFE 유 봉 Dounce 조직 분쇄기를 사용 하 여 1:6 폐/버퍼 (mg / µ L) 비율 0.25 M 자당을 포함 하는 트리 스-EDTA 버퍼에 신선한 폐 조직 균질
- 100 µ M DTPA를 포함 KHB의 450 µ L를 폐 homogenate의 50 µ L를 추가 합니다.
- 1.5 mL 튜브 (에 100 µ L의 총 볼륨), KHB에 폐 homogenate의 98 µ L, 0.2 m m의 최종 농도를 10 m m 재고의 CMH의 2 µ L를 추가 합니다.
- 20 분 물 욕조에 37 ° C를 품 어.
- 얼음에 샘플을 놓고 모 세관 튜브에 그들을 로드 합니다. RT (2.1.13 단계에서 사용 되는 설정)에서 EPR를 실행 합니다.
- 특정 종 및 다른 억제제를 사용 하 여 소스의 기여를 테스트 하려면 미리 KHB 98 µ L의 최종 볼륨을 달성 하기 위해 조정 억제제 + 폐 homogenate의 88 µ L 처리 합니다. 이 실험에는 억제제 잔디의 10 µ L를 포함 (100 U/mL), deferoxamine의 4 µ L (돌연 사 했을까; 최종 농도 = 800 µ M), 또는 diphenyliodonium 염화의 4 µ L (DIP; 최종 농도 = 100 µ M). 물 욕조에 37 ° C에서 20 분 동안 품 어.
- CMH의 2 µ L을 추가 하 고 위에서 설명한 대로 EPR 측정 뒤 37 ° C에서 또 다른 20 분 동안 품 어. CMH KHB 자당 버퍼를 포함 하는 일회성 일치 빈 샘플 포함 됩니다. 또는, 나머지 폐 homogenates (단계 3.1.2) 미래 측정-80 ° C에서의 aliquots를 저장 합니다.
참고: 필요에 따라 총 볼륨 확장할 수 있습니다.
-
EPR 측정 스핀 프로브에서 vivo에서 (RT 조직 세포를 사용 하 여)에 주입 하는 쥐에서 폐 조직에
- 4.9의 밀리 그램 CPH 필터링 하 고 deoxygenated 50 m m 인산 염 버퍼의 1 mL에 용 해 하 여 CPH 재고 솔루션을 준비 합니다.
- 핀치를 발 끝까지 응답 될 때까지 20-30 초에 대 한 흡입된 isoflurane (1.5-4%)와 쥐를 anesthetize. CPH 스핀 프로브의 25 g 마우스 몸 무게에 대 한 100 µ L retroorbital 경로 통해 마우스 주입 (마지막 복용량 = 20 mg/kg), 프로브 retroorbital 주입 직후 1 헤에 대 한 순환, 추가할 0.5% proparacaine HCl 한 방울 눈에 띄지를 허용 nt 안구 통증 고 건조입니다. 1 시간에 대 한 마우스를 모니터 하 고 수확 하는 조직으로 진행.
- 위에서 설명한 대로 폐 조직 수확 및 플래시 동결 폐.
- 드라이 아이스에 냉동된 조직의 20-30 mg을 잘라내어 정확한 무게를 기록.
- 부드럽게 닦아 청소 어떤 표면에 물 흡수 하는 물티슈와 티슈.
- (액세서리 조직 샘플에 대 한 EPR 측정 가능) 조직 세포의 창 내에서 조직을 놓고 총 회전을 결정 하는 EPR를 실행 합니다. 데이터는 조직의 mg 당 총 스핀으로 표현할 수 있습니다.
5. 데이터 분석
- 벤치 탑 EMXnano EPR 계의 제 논 소프트웨어에 통합 하는 SpinFit 모듈을 사용 하 여 EPR 스펙트럼을 시뮬레이션 합니다. Nitroxide 농도 SpinCount 모듈에 의해 결정 합니다. 또는 4-hydroxy-템포 나 TEMPOL 같은 안정적인 nitroxide의 교정 곡선을 만들 수 있습니다, 고 농도의 샘플 및 표준 신호 강도 비교 하 여 얻을 수 있습니다.
- 77 K에서 수집 된 데이터에 대 한 이중 통합 뒤에 SpinCount를 사용 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
초과 검출 CMH을 사용 하 여 X를 사용 하 여 확인 했다 / XO superoxide catalase 했다 영향을 주지 않습니다 (그림 1A) nitroxide (.CM) 신호 잔디에 의해 저해 완벽 하 게 했다을 설명 하기 위해 시스템 생성. 총, extracellular superoxide 다음 잔디 전처리 + 세포 투과성 CMH 스핀 프로브 RAW 264.7 세포 배양 세포에 의해 평가 되었습니다. Nitroxide 농도 세포 현 탁 액 및 버퍼를 두 가지 샘플 유형에서 값 투과 특성 및 스핀 프로브 (그림 1B)의 빠른 평형 유사 했다 시연에서 측정 했다. Nitroxide 급진적인 신호 제어 셀에 비해 PMA RAW 264.7 세포 자극된에 증가. 이 신호는 크게 셀 셀 스며들 지 않는 잔디 (그림 1C)와 청소용 감쇠 됩니다. 각 색상 웰 스를 다른 일에 시간에 걸쳐 특정 일에 수집 된 데이터의 일관성과 결과의 재현성을 보여주는 테스트를 나타냅니다. Extracellular superoxide의 농도 PMA 셀 청소용된 잔디와 신호에서 PMA 후 잔디 (T)의 부재에 있는 신호를 빼서 결정 했다. 나머지 신호는 세포내 superoxide (그림 1C)에 기인 했다. 그림 1D 는 총 및 extracellular superoxide의 계산을 보여 줍니다. (E)는 세포내 신호 제거의 미디어 및 신호에 말뚝-잔디의 효과 의해 후 PMA 처리 셀에서 확인 됐다. 이 그래프에서 (C), 달리 CMH 빈 했다 측정에서 공제 하지 하 고 원시 데이터 표시 됩니다.
RAW 264.7 세포에서 미토 콘 드리 아 superoxide는 EPR 스핀 프로브 미토-템포-H, mitochondia에서 누적을 사용 하 여 검색 되었습니다. (버퍼, 증가 미토-템포-H 신호 제어 셀 (콘), 및 세포 미토 콘 드 리아 억제제 Antimycin A (AA)와 자극된에 더욱 향상 된 신호에서 기준선 미토-템포-H 신호 A) 대표 EPR 스펙트럼. 신호에 증가 우리의 이전 연구는 그 SOD2 overexpression 미토-템포-H10크게 감쇠 측정에 따라 미토 콘 드리 아 superoxide에 기인 했다. 그림 2B에서 미토 콘 드리 아 nitroxide 농도 셀 측정에서 시간 일치 하는 버퍼에 미토-템포-H 신호를 빼서 결정 되었다. CM. 신호 존재 및 잔디의 부재에 PMA와 자극 후 RAW 264.7 세포에서 낮은 온도에서 얻은. (그림 3A) CM. 신호는 잔디, 실내 온도 데이터 (그림 1)와 일치의 감쇠 했다. 그림 3B stoppers 전지와 vivo에서 샘플에 대 한 77 K에서 데이터를 수집 하는 데 사용 된 PTFE 튜빙의 사진을 보여줍니다. 초과 생산 혈액과 BALF CMH 스핀 프로브를 사용 하 여 검색 되었습니다. 혈액 또는 BALF 샘플 PBS 및 Bleo 처리 마우스에서 수집 되었고 즉시 CMH와 인 큐베이 팅. PTFE 튜브와 플래시 냉동, 샘플 전송 및 EPR 데이터 77 공화국에서 수집 된 Nitroxide (CM.)의 농도 10 분 (그림 4A) 37도에서 incubated CMH (0.2 m m)와 혈액에 축적. Nitroxide (CM.) 농도 BALF에서 incubated 50 분 (그림 4B). BALF 실험에 사용 또는 Nitroxide 농도 혈액의 볼륨에 축적 (CM.)의 농도 나타냅니다.
세 가지 방법 조직 보존을 위한 여러 게시 된 기술 평가를 테스트 하 고 스핀의 ex vivo vs프로브. vivo에서. 폐 조직에 EPR 측정을 수행, 우리가 처음 플래시 냉동된 폐 조직 제어에서 사용 하거나 마우스를 부상 합니다. 그림 5A 는 PBS 및 Bleo 처리 쥐에 있는 CMH 37 ° C에서 각각 incubated 폐 조직의 작은 조각의 상쾌한에 총 CM. 신호를 보여준다. Bleo 처리 후 폐 상해의이 성분으로 인해 폐의 다른 지구에서 조각을 잘라 더 대표 값을 제공 하는 여러 측정을 평균 하는 것이 좋습니다. 또는, 전체 폐를 균질 하 고이 homogenate의 한 샘플을 사용 하 여 수 있습니다 하나. PTFE 튜브를 사용 하 여 77 K에서 수집 된 데이터 및 dewar 손가락. 그림 5B 각각 PBS 및 Bleo 처리 쥐에서 nitroxide (.CM) 신호의 대표 스펙트럼 표시 됩니다.
폐 조직 비보 전 치료 한 제한은 안정적으로 세포 막 방해 조직의 처리 인해 세포내 superoxide에서 extracellular 구별 하는 것입니다. 이 정보는 실험적인 질문에 중요 하다, vivo에서 CPH 주입 방법을 아래에 설명 된 사용 하 여 해결할 수 있습니다. 냉동된 조직 미토 콘 드 리아 superoxide;을 평가 하기 위해 사용할 수 없습니다. 하지만,이 측정에 대 한 프로토콜 조직 또는 갓 고립 된 미토 콘 드리 아에서 미토-템포-H를 사용 하 여 적용할 수 있습니다.
EPR 측정 폐 조직에 대 한 두 번째 방법으로 신선한 조직 자당 버퍼에서 무 균 했다. 폐 homogenate CMH 프로브 KHB 버퍼 DTPA를 포함에서 알을 품는. EPR 측정 실시 했다 실시간 그림 6A 에서 CM. 의 증가 보여 Bleo와. 우리는 추가 테스트 종 CM. 에 기여 하는 결정 하는 데 사용할 수 있는 다른 억제제를 사용 하 여 제시 신호입니다. CM. 신호 폐 조직에서 발생의 기원, 명료 하 우리는 여러 청소부와 효소 억제제 폐 homogenates pretreated. 폐 homogenates 플 라빈 포함 하는 부재 또는 잔디, deferoxamine (DFO), 및 diphenyliodonium 염화 물 (각각) 초과, 철, 또는 초과 생성에서 기부금에 대 한 계정 (DIP)의 존재에 CMH와 incubated 했다 효소 (그림 6B)입니다. 이 방법은 시스템에서 생성 된 특정 과격 한 종 평가 또는 다른 효소 근원의 기여를 명료 하 게 적용할 수 있습니다 (예., NOX, 노스, 또는 세 산화 효소).
마우스는 EPR 측정 비보를 수행 하는 retroorbital 경로 CPH 스핀 프로브 (20 mg/kg) 를 통해 함께 주입 했다. 그것은 여부 CMH 안전 하 게 관리 될 수 동물, CPH 프로브는 비 독성;을 것으로 보고 되었습니다 동안 알려져 따라서, 우리는 vivo에서 실험 CPH를 선택. 폐 조직 수확 및 플래시 CPH 프로브 순환 후 액체 질소 1 h에서에서 동결 했다. 마우스는 특정 항 산화 종 신호에 대 한 책임을 차별화 하는 동시에 처리할 수 있습니다. 그림 7A 보여줍니다 높은 CP. Bleo 치료 쥐 통제 쥐에 비해 신호. 폐 조직 제어 및 Bleo 처리 생쥐에서의 대표적인 스펙트럼 그림 7B에 표시 됩니다. CP. 의 혼합된 EPR 스펙트럼 그리고 의약품 기 관찰 되었다. 그림 7A 에 보고 하는 값은 CP. 의 농도 구성 요소입니다. 데이터는 실시간 조직 세포를 사용 하 여에서 수집 했다.
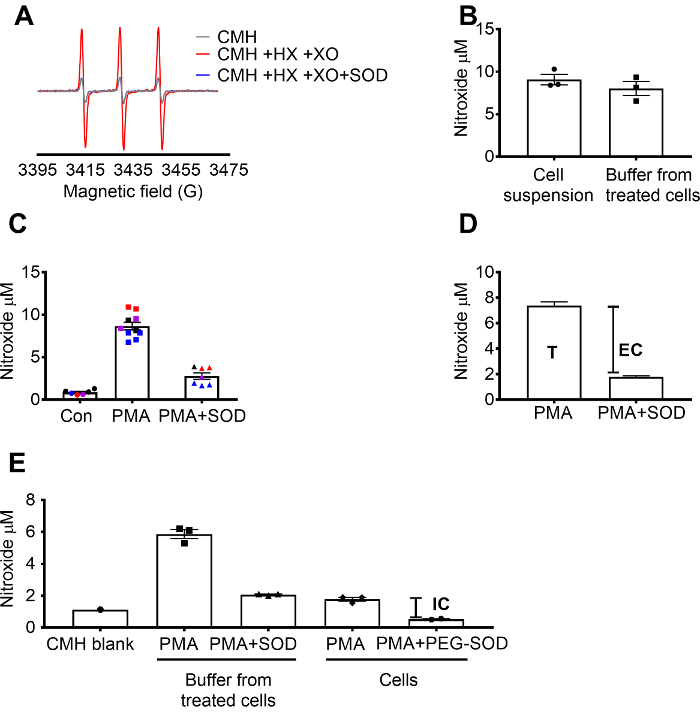
그림 1: 다른 세포 격실에 superoxide의 탐지. (0.25 m m에서 0.5 m m hypoxanthine/세 산화 효소 (8 mU/mL)와 잔디 없이 CMH에서 생성 하는 A) EPR 스펙트럼 (30 U/mL). (B) RAW 264.7 세포 (1 x 106 셀/잘) 세포 현 탁 액 (셀 + 버퍼)에서 발견 하는 37 ° C와 nitroxide 농도 (µ M)에서 50 분 및 치료 셀에서 수집 하는 버퍼에 대 한 10 µ M CMH의 PMA와 자극 했다. (C) RAW 264.7 세포 PMA vs자극 했다. 차량 제어 (콘)입니다. 한 일련의 셀의 했다 청소용 30 U/mL 셀 스며들 지 않는 잔디 (PMA + 잔디)로 10 분. 각 색상은 다른 실험적인 일에서 데이터 나타내고 각 개인에서 잘 셀을 나타냅니다. CMH KHB에와 시간 일치 하는 빈에서 nitroxide 신호는 최종 값을 얻기 위해 각 신호에서 뺍니다. (D) 계산 PMA에 총 및 extracellular superoxide의 자극 세포; T = 총 초과, EC = extracellular superoxide (잔디 inhibitable 신호). (E) 세포내 superoxide 신호 (IC)를 평가 하려면 PMA + 잔디 후 버퍼에 신호 버퍼의 제거 후 PMA 처리 셀에 비교 되었다. 확인 하 고, 우물은 청소용 60 U/mL 세포 투과성 못-떼 1.5 시간 동안 세포내 잔디 inhibitable 결정 하와. 시간 일치 CMH 공백 표시 되 고 데이터 반영 절대 nitroxide 신호. 데이터 평균 ± SEM.로 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: 원시 셀 antimycin A.와 자극된에 미토 콘 드리 아 superoxide의 (미토 콘 드 리아-관련 EPR 스핀의 A) 대표 스펙트럼 조사, RAW 264.7 세포 (콘) 없이 0.25 m m 미토-템포-H 또는 25 µ M antimycin A (AA) 37 ° c.에 50 분 (B) CM. 셀 AA 제어에 비해 치료에 농도 (µ M). 시간 일치 미토-템포-H 빈에서 nitroxide 신호는 최종 값을 얻기 위해 총 신호에서 뺍니다. 데이터 평균 ± SEM.로 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3: 77 K에서 세포 RAW 264.7에 superoxide의. (A) RAW 264.7 세포 자극된 10 µ M PMA와 EPR 스핀 프로브, CMH (블랙) 0.25 m m (37 ° C에서 50 분) 또는 30 U/mL 잔디와 (빨간) 전처리 없이. 100 µ L의 상쾌한 PTFE 튜빙, 다음 액체 질소에서 냉동 플래시의 길이가 조각에 1 인치에 로드 되었습니다. stoppers, 제거 하 고 냉동된 PTFE 튜빙 손가락에 배치 했다 PTFE 튜빙 및 stoppers의 77 K. (B) 사진에서 데이터 수집을 위한 dewar. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: 제어 및 bleomycin 취급 쥐에서 혈액과 BALF EPR 측정. 마우스 intratracheal bleomycin (IT Bleo)의 단일 투여로 치료 했다 (1 U/mL에서 100 µ L) 또는 PBS 차량. 7 일, 쥐 취 되었고 안락사. 혈액은 수집 을 통해 오른쪽 심 실 빵 꾸 1000으로 주사기에 USP/mL 헤 파 린 100 µ M DTPA를 포함. Bronchoalveolar 게 액체 (BALF) lavaging에 의해 수집 된 100 µ M PBS에 DTPA의 1 mL와 함께 폐. 혈액과 BALF 했다 incubated 10 또는 50 분, 각각, 37 ° c.에 0.2 m m CMH 150 µ L의 혈액 또는 BALF PTFE 튜빙 플래시 동결 액체 질소에는 손가락을 사용 하 여 77 K에서 수집 된 EPR 데이터 로드 dewar. 데이터는 PBS 및 Bleo 처리 쥐에서 혈액 (A)와 (B) BALF nitroxide 농도 표시 (n = 4-6). 데이터 의미 ± PBS 및 Bleo 처리 쥐에서 혈액에서 nitroxide의 SEM. (C) 대표 스펙트럼을 표현. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5: 플래시 냉동된 폐 조직에 EPR 측정. 마우스 intratracheal bleomycin (IT bleo)의 단일 투여로 치료 했다 (1 U/mL에서 100 µ L) 또는 PBS 차량. 7 일에 폐 했다 혈액과 액체 질소에서 냉동 플래시 제거를 차가운 PBS와 플러시됩니다. 플래시 동결 폐 조직의 5-15 mg 0.2 m m KHB 포함 하는 1 h 37 ° C. 상쾌한 수집 되었고 PTFE 튜빙에 배치에 대 한 전체 볼륨의 200 µ L에서 100 µ M에에서 CMH incubated 되었고 손가락에 77 K에서 실행 dewar. (A) Nitroxide 농도 (nitroxide 조직의 1 mg으로 정규화의 µ M). 데이터는 각 폐에 대 한 2-3 측정의 평균을 나타냅니다. 로 데이터 ± PBS 및 Bleo 처리 쥐에서 폐 조직에서 nitroxide의 SEM. (B) 대표 스펙트럼을 의미 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 6: 자당 버퍼에 보존 하는 폐 조직에 EPR 측정. 마우스는 intratracheal bleomycin (1 U/mL에서 100 µ L)의 단 하나의 복용량으로 치료 했다. 7 일 후 처리, 폐 혈액, 제거 차가운 PBS와 플러시 했다 그리고 신선한 폐 조직 1:6 폐 무게/버퍼 볼륨 (mg / µ L) 비율 0.25 m m 자당을 포함 하는 트리 스-EDTA 버퍼에서 무 균 했다. 37에 20 분에 대 한 다음 억제제 없이 폐 homogenate의 50 µ L KHB와 preincubated는 ° c: 잔디 (100 U/mL), 0.2 m m KHB 100 µ M DTPA를 포함에 있는 CMH 가진 외피 다음 deferoxamine (돌연 사 했을까; 800 µ M), 및 diphenyliodonium 염화 (DIP; 100 μ M) 37 ° c.에 20 분에 대 한 데이터는 RT에 EPR 모 세관 튜브를 사용 하 여 얻은 했다. (PBS 및 Bleo 처리 쥐에서 폐에 Nitroxide A) 농도. (B) Nitroxide Bleo 폐 억제제의 존재 또는 부재에에서 농도 (n = 3). 데이터 평균 ± SEM.로 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 7: EPR 측정 CPH 스핀 프로브를 주입 하는 쥐에서 폐 조직에서. 100 µ L CPH의 관리 를 통해 retroorbital 20 밀리 그램의 최종 농도 주입 CPH 체중의 킬로그램 당 이었다. 순환의 1 시간 후 쥐 했다 안락사 하 고 폐의 차가운 PBS를 통해 우 심 실, 10 mL와 플러시 했다 폐 조직 냉동 플래시 했다. EPR 측정 수행 실시간 회전으로 (A) 데이터와 폐 조직의 20 ~ 30 mg 조직 세포에 배치 되었다 PBS와 Bleo 폐 조직에 밀리 그램. (B) 대표 스펙트럼 nitroxide의 신호 / (* ascorbic 산 급진적인 오버랩을 나타냅니다). 데이터 평균 ± SEM.로 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 억제제 | 종 |
| Superoxide dismutase (잔디) | 세포 외 초과 |
| Superoxide dismutase-폴 리 에틸렌 글리콜 (PEG-잔디) | 세포내 초과 |
| 카 탈 라 제 | 과산화 수소 기반 기 |
| Urate | Peroxynitrate |
| 에탄올과 DMSO | 수 산 기 과격 한 |
| 금속 chelators | 금속 이온 (철과 구리) |
표 1입니다. 일반적인 억제제 종 스핀 프로브 산화에 대 한 책임을 구분 하는 데 사용.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
생물 학적 설정에서 자유 래 디 칼 생산의 평가 이해 redox 규제 건강과 질병, 신호에 중요 하지만 이러한 종류의 측정은 매우 자유 래 디 칼의 짧은 반감기 때문에 도전적이 고 기술 일반적으로 사용 되는 방법으로 제한입니다. 그것은 자유 래 디 칼을 탐지 하기 위한 유일한 명백한 방법으로 EPR는 산화 환 원 생물학, 귀중 한 하 고 강력한 도구입니다. 이 프로젝트에서 실험을 디자인 하 고 선생님 스핀을 사용 하 여 체 외에 다른 세포질 구획 및 다른 조직 구획에 프로브를 감지 하는 샘플을 준비 하는 실용적인 EPR 방법을 설명 vivo에서. 우리는 또한 생물 학적 샘플을 처리 하 고 효율성을 개선 하기 위해 샘플을 저장 하는 실용적인 방법을 제공 합니다.
스핀 프로브 선생님과 효율적으로 반응 하 고 안정적인 nitroxide 급진적인 EPR로 검출 될 수 있는 생산. 스핀 프로브 (주기적 hydroxylamine)의 여러 파생 그들을 다른 세포질 구획10자유 래 디 칼 생산을 감지 적합 하 게 만드는 서로 다른 투과율 특성을 가진 합성 되어 있다. 이 프로토콜 활용 세포 투과성 스핀 프로브, CMH; 하지만, 스며들 지 않는 스핀 프로브 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium 염화 HCl (CAT1H) extracellular 초과 검출에 사용할 수 있습니다. 인간 lymphoblast 셀 라인18에 우리의 이전 연구와 마찬가지로, 우리는 스며들 지 않는 잔디와 투과 CMH 스핀 프로브를 사용 하 여 유효성을 검사 하 고 침투성 페그-잔디 RAW264.7 세포 (마우스 폐 대 식 세포 세포 선) 자극을 PMA와 셀 수 세포 외 및 세포내 superoxide를 구분 하십시오.
우리는 또한 내부 및 여분 cellular 구획, 사이 CMH의 급속 한 평형 검증 그리고 우리는 또한에서 초과 신호 방울 크게 KHB (데이터 표시 되지 않음)와 함께 한 번만 셀을 세척 후 세포 발견. 우리는 미토 콘 드 리아 특정 스핀 프로브 미토-템포-H의 RAW 264.7 세포 미토 콘 드리 아 전자 수송 체인 억제제 antimycin 대답으로 자극 시 생성 증가 미토 콘 드 리아 superoxide를 측정 하는 유틸리티 확인 미토-템포-H를 미토 콘 드 리아 초과 생산의 구체적인 기여 이전 입증 되었습니다 하 고 실험 미토 콘 드 리아 superoxide dismutase MnSOD (SOD2)와 격리 된 신선한 미토 콘 드리 아 또는 시스템을 사용 하 여 유효성을 검사할 수 있습니다. overexpression10.
선생님 생산에서 vivo에서 의 평가 특히 도전 하지만 생물에 신호 통제 산화 환 원 또는 산화 긴장의 역할을 심문 하는 때 중요 한 정보를 제공 하는 특정 선생님의 생산을 감지 하는 능력 설정. 때 스핀을 사용 하 여 조직의 적절 한 처리 조사 고 EPR 재현 하 고 의미 있는 결과 생성에 필수적 이다. 조직으로 스핀 프로브를 사용 하 여 가능성이 측정 superoxide 급진 파 조직 짧은 반감기로 인해 수확의 시간에 존재 하지만 대신 NAPDH 산화 효소, uncoupled 내 피 산화 질소 synthase와 같은 효소에 의해 생산 하는 superoxide 감지 하지 않습니다. 또는 세 산화 효소 폐 조직 또는 homogenates는 37 ° c.에 스핀 프로브와 인 큐베이 팅 하는 경우 냉동된 조직 사용 초과 냉동 손해 미토 콘 드리 아 전자 수송 체인 활동부터 미토 콘 드리 아에 의해 생성 된 포함 되지 않습니다. 미토 콘 드 리아 superoxide를 테스트 하려면 조사 격리 신선한 미토 콘 드리 아 또는 사용 미토 콘 드 리아 특정 프로브에 vivo에서 또는 신선한 조직에 필요 합니다.
조직을 유지 하기 위해 여러 다른 프로토콜 문학14,15에 출판 되었습니다. 우리는 EPR 측정 폐 조직에 대 한 세 가지 게시 방법 비교: 1) 플래시 조직 액체 질소에서 냉동, 2) 자당 버퍼에서 조직 조직 및 마우스에서 vivo에서 회전 급강하 3) 치료 조사 조직 수확 하기 전에 1 시간. 우리는 심각한 폐 염증 및 산화 스트레스 부상된 폐에서 nitroxide 신호에 일관 된 차이 표시 하는 각 방법의 기능을 테스트 하려면 bleomycin에 의해 유도 된 마우스 컨트롤 마우스 비교. 모든 세 가지 방법 bleomycin 취급 쥐의 폐에서 nitroxide 신호에 비슷한 상대적 증가 보였다. 플래시 동결된 조직 사용 가능성이 대부분의 실험실, 수확의 때에 조직 자당 버퍼에서 처리 하는 필요를 부정에 대 한 조직 수집 하는 가장 쉬운 방법 것입니다. Vivo에서 자유 래 디 칼을 잡으려고 CPH의 주입은 강력한, 하지만 확인 하 고 특정 종,이 적절 한 산화 방지 제를 포함 한 치료 그룹을 필요 합니다.
스핀 프로브를 사용 하 여 하나의 도전이 이다 nitroxide 스핀 프로브 산화 산화;에 대 한 책임 종에 비슷한 3 라인 EPR 스펙트럼 생성 따라서, 그것은 종 선생님 구분 하지 않습니다. 또한, 그것은 잠재적인 반응 광합성 전자 수송 사슬 및 시 토 크롬 c 산화 효소19,20hydroxylamine 프로브는 보고 되었다. 이러한 관측 결과 해석할 때 고려 되어야 한다. 이 프로토콜에서 광합성 시스템은 존재 하 고 버퍼와 DTPA의 포함 무료 제 2 철과 구리 이온10 의 잠재적인 오염 억제. 우리는 폐 조직에 특정 효소 또는 chelators의 일련을 사용 하 여 특정 선생님의 기여 또는 효소 억제제 선생님의 소스를 확인 하기 위해 설정 하는 방법을 시연 했다. 이 접근은 이전 사용 되었습니다 EPR와 uncoupled 노스13,15인 선생님의 기여를 확인 하. 우리 종 스핀 프로브 산화 (표 1)에 대 한 책임을 구분 하는 데 사용 하는 일반적인 억제제의 목록을 제공 합니다.
우리는 또한 각 실험 조건에 대 한 보육 시간 최적화의 중요성을 설명 했다. 스핀 트랩 조사 비교 스핀 스핀 트랩 자유 래 디 칼 종;의 특이성에 대 한 수 있는 반응에 따라 고유한 스펙트럼 생성 그러나, 그들은 또한 superoxide 스핀 트래핑에 대 한 느린 속도 전시 하 고 생 분해 하는 경향이 있다. EPR 프로브 ex vivo와 폐 조직의 치료도 적절 하 게 조직 처리 하는 동안 세포 막 인 세포내 superoxide에서 extracellular 구별 하는 무 능력에 의해 제한 됩니다 (동결 또는 조직). 사용 하 여 주입 된 스핀 프로브에는 비보에 잔디 또는 세포 침투성 페그-잔디와 함께에서이 문제를 해결할 수 있습니다.
하나의 목표는 효율적으로 샘플을 수집 하 고 EPR 측정 전에-80 ° C에서 그들을 저장 하는 프로토콜을 설정 했다. 우리는 따라서 PTFE 튜빙 샘플을 들고 사용 하는 실용적인 방법을 개발 했다. 이 튜브는 손가락에 직접 배치 됩니다 샘플 사이의 dewar 청소 하지 않아도 77 K에서 EPR 분석을 위한 dewar. 이것은 최근에 출판 된 메서드에 포함 1 mL 주사기에 샘플의 대안 이다. PTFE 튜브에 저장 냉동된 샘플에서 측정 신호의 안정성을 설명 하기 위해 몇 일 동안 반복할 수 있습니다. 이 방법은 EPR 측정을 일괄 처리에 대 한 허용 하 고 원격 EPR 시설 샘플을 실행할 수 있도록 실험실 사이 샘플의 전송 용이.
전반적으로,이 프로토콜에는 생물 학적 시스템에 EPR 측정에 대 한 세포와 조직 준비 하는 간단한 접근 방식을 제공 합니다. 프로토콜은 다른 스핀 프로브를 사용 하 여 산화 스트레스와 관련 된 다른 모델에 적용할 수 있습니다. 타이밍 및 스핀 프로브의 농도 각 실험 조건에 대 한 조정 필요 합니다. 명확 하 게 존재 하 고 자유 래 디 칼의 생산을 결정 하는 EPR의 기능 경직을 redox 생물학의 분야에서 실험적 접근을 제공 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 공개 없다.
Acknowledgments
이 작품은 의학 학장의 전략적 연구 인프라 상, R01 HL086680-09 1R35HL139726-01, E.N.G. 및 UCD CFReT 화목 상 (그)의 콜로라도 대학 학교에 의해 지원 되었다. 저자는 박사 산드라 이튼 박사가 레 스 이튼 (덴버 대학교), 박사 제럴드 로젠 박사 조셉 P. Kao (메릴랜드 대학), 그리고 박사 Sujatha Venkataraman (대학의 콜로라도 덴버) 유용한 토론, 그리고 조 앤 Maltzahn, 애슐리 감사 합니다. Trumpie와 기술 지원에 대 한 아이비 맥 더 못 (덴버 콜로라도의 대학).
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



