Summary
Elektron spinn resonans (EPR) spektroskopi er en entydig metode for å måle frie radikaler. Bruk av selektiv spinn sonder tillater påvisning av frie radikaler i forskjellige mobilnettet avdelinger. Vi presenterer en praktisk, effektiv metode for å samle biologiske prøver som forenkler behandling, lagring og overføring av prøver for EPR målinger.
Abstract
Nøyaktig og bestemt påvisning av reaktive oksygen arter (ROS) i ulike cellular og vev rom er viktig å studere redoks regulert signalering i biologiske innstillinger. Elektron spinn resonans spektroskopi (EPR) er bare direkte metode å vurdere frie radikaler entydig. Dens fordel er at den oppdager fysiologiske nivåer av bestemte arter med en høy spesifisitet, men det krever spesialisert teknologi, forsiktig utvalg forberedelse og egnede kontroller å sikre nøyaktig tolkning av data. Syklisk hydroksylamin spinn sonder reagere selektivt superoxide eller andre radikale generere et nitroxide signal som kan kvantifiseres av EPR spektroskopi. Celle-permeable spinn sonder og spinn sonder utformet for å akkumulere raskt i mitokondrier tillate fastsettelse av superoxide konsentrasjon i forskjellige mobilnettet avdelinger.
I kulturperler celler, bruk av cellen permeable 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) sammen med og uten celle-ugjennomtrengelig superoxide dismutase (TORV) forbehandling, eller bruk av celle-permeable PEG-TORV, gir den differensiering av ekstracellulære fra cytosolic superoxide. Mitokondrielt 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] piperidinium dichloride (mito-TEMPO-H) tillater for måling av Mitokondrielt ROS (hovedsakelig superoxide).
Spin sonder og EPR spektroskopi kan også brukes i vivo modeller. Superoxide kan oppdages ekstracellulære væsker som blodet og alveolar væske, som vev som lungevev. Flere metoder er presentert for å lagre vev for EPR målinger og leverer intravenøs 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) spinn sonde i vivo. Mens målinger kan utføres ved romtemperatur, kan prøver innhentet fra i vitro og vivo modeller også lagres ved-80 ° C og analyseres av EPR på 77 K. Eksemplene kan lagres i spesialiserte rør stall ved-80 ° C og kjøre på 77 K å aktivere en praktisk, effektiv, og reproduserbar metode som muliggjør lagring og overføring.
Introduction
Mens tiltak av oksidativt stress og reaktive oksygen arter er viktig å studere ulike sykdommer over alle organsystemer, er gjenkjenning av reaktive oksygen arter (ROS) utfordrende en kort halveringstid og høy reaktivitet. Et elektron spinn resonans (EPR) teknikk er den mest entydig metoden for påvisning av frie radikaler. Spin sonder har fordeler fremfor de vanlige lysrør sonder. Fluorescerende sonder er relativt billig og enkel å bruke og gir rask, følsom påvisning av ROS, har de alvorlige begrensninger på grunn av artifactual signaler, en manglende evne til å beregne ROS konsentrasjoner, og en generell mangel på spesifisitet1 .
For å lette bruken av EPR for biologiske studier, en rekke spinn sonder har blitt syntetisert som kan måle en rekke biologisk relevante frie radikaler arter som pO2, pH og redoks sier2,3, 4,5,6,7. Spinn feller har også blitt utviklet for å fange kortvarig radikaler og skjemaet lang-levende addukter, noe som letter oppdagelsen av EPR8. Begge klassene (spin sonder og spinn feller) har fordeler og begrensninger. En vanlig klasse av spin sonder er syklisk hydroxylamines, som EPR stillegående og reagere med kortvarig radikaler å danne en stabil nitroxide. Syklisk hydroxylamines reagere med superoxide 100 ganger raskere enn spinn feller, slik at de kan konkurrere med mobilnettet antioksidanter, men de mangler spesifisitet og krever bruk av egnede kontroller og hemmere å identifisere radikale arter eller kilde ansvarlig for nitroxide signalet. Mens spinn feller utstillingen spesifisitet, med forskjellige spectral mønstre avhengig fanget arter, de har langsom kinetics for superoxide spinne overlapping og er utsatt for biologisk nedbrytning av addukter. Programmer for spin overlapping er godt dokumentert i biomedisinsk forskning,9,,10,,11,,12,,13.
Målet med dette prosjektet er å demonstrere praktiske EPR metoder for å designe eksperimenter og forbereder prøver å finne superoxide bruker spinn sonder i forskjellige mobilnettet avdelinger i vitro og i ulike vev avdelinger i vivo. Flere manuskripter har publisert protokoller relevant for disse målene, celle-gjennomtrengelig, celle-ugjennomtrengelig og mitokondrie målrettet spinn sonder til forskjellige mobilnettet avdelinger i vitro og prosessen vevet i analyse i musen modeller 14 , 15. vi bygge på denne mengde litteratur ved å validere en tilnærming for å måle superoxide bruker en 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) spinn sonde i forskjellige mobilnettet avdelinger i vitro for å sikre nøyaktig målinger, utheving potensielle tekniske problemer som kan forskyve resultatene. Vi tilbyr også metoder for å utføre EPR målinger i blod, bronchoalveolar lavage væske og lungevev ved hjelp av CMH spinn sonden. Disse studiene sammenligne ulike metoder for å behandle vev, samt presentere en metode for å injisere en annen spinn sonde, CPH, i mus før høsting vev. Til slutt, vi utvikle en praktisk metode for å lagre prøver i polytetrafluoroethylene (PTFE) rør for lagring og overføring av prøver før EPR målinger på 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle dyrestudier ble godkjent av University of Colorado Denver institusjonelle Animal Care og bruk komiteen.
1. forberedelse av reagenser
-
Diethylenetriaminepentaacetic syre (DTPA) lager (150 mM)
- Legge 2,95 g av DTPA (393.35 g/mol) til 10 mL deionisert vann.
- Oppløse DTPA, legge til 1 M NaOH dropwise og bringe til en pH på 7.0.
- Bringe volumet til 50 mL med vann til en endelig DTPA konsentrasjon av 150 mM, og lagre på 4 ° C.
-
Fosfat buffer saltvann (PBS) (50 mM, pH 7.4)
- Forberede 5 M natriumklorid (NaCl) (58.44 g/mol, 29.22 g/100 mL).
- Forberede 1 M av kalium fosfat dibasic HK2PO4 (174.18 g/mol, 17.42 g/100 mL)
- Forberede 1 M av kalium fosfat monobasic KH2PO4 (136.1 g/mol, 13.61 g/100 mL). Bland 3 mL 5 M NaCl med 4.24 mL 1 M kalium fosfat dibasic og 0.760 mL 1 M kalium fosfat monobasic. Sjekk pH.
- Bringe volumet til 100 mL med deionisert vann.
- Lagre ved romtemperatur (RT) for kortsiktige (dager) og 4 ° C for langsiktig (uker) lagring.
-
Krebs-Henseleit buffer (KHB) inneholder 100 µM DTPA
- I 50 mL konisk sentrifuge tube, Legg 33.3 µL av 150 mM DTPA lager løsning.
- Bring til en 50 mL volum med Krebs-Henseleit buffer (KHB).
- Forberede frisk buffer med DTPA hver dag og holde det ved RT.
-
Tris-EDTA bufferen som inneholder sukrose
- Forberede 0,5 M Tris lager: oppløse 15.14 g Tris base (121.14 g/mol) i 150 mL deionisert vann. Bruker HCl, justere pH til 7,8 og føre til et endelig antall 250 mL.
- Oppløse 21.4 g av sukrose (342.29 g/mol, siste konsentrasjon = 0,25 mM) i 150 mL deionisert vann.
- Legge til 5 mL Tris lager sukrose å oppnå en 10 mM endelige Tris konsentrasjon.
- Legg til 0,5 mL 0,5 M EDTA lager Tris-sukrose å oppnå en 1 mM endelige konsentrasjon.
- Når pH og Juster den 7,4.
- Bring til en siste bind i 250 mL med deionisert vann og lagre på 4 ° C.
-
Storfe røde blodlegemer Cu/Zn superoxide dismutase (TORV) lager (30.000 U/mL)
- Rekonstituer 30.000 U av TORV i 1 mL av PBS (ca 5.7 mg, avhengig av aktiviteten av TORV mye).
- Bland godt, aliquot, og lagre på 20 ° C for kortsiktige (6-12 måneder) og-80 ° C for langtidslagring.
-
TORV fungerende løsning (1000 U/mL)
- Overføre en 30 µL aliquot av 30.000 U/mL TORV aksjer til en 870 µL av sterile PBS.
- Holde løsningen på is, og bruke den frisk.
-
Phorbol 12-myristate 13-acetate (PMA) lager (5 mM)
- Oppløse 1 mg av PMA (616.83 g/mol) i 325 µL av DMSO (siste konsentrasjon = 5 mM).
- Aliquot en 5 mM PMA løsning og lagre den på 20 ° C.
-
PMA fungerende løsning (125 µM)
- Fortynne en 10 µL aliquot 5 mM PMA aksjer i 390 µL av sterile PBS.
- Holde løsningen på is og bruke den frisk.
- Et kjøretøy kontroll for PMA, bruke 10 µL av DMSO i 390 µL av PBS.
-
Diphenyliodonium chloride (DIP) (2,5)
- Oppløse 3,2 mg DUKKERT (316.57 g/mol) i 4 mL å få en 2,5 lager.
- Forberede løsningen og bruke den frisk.
-
Deferoxamine mesylate salt (DFO) (20 mM)
- Oppløse 4,5 mg DFO (656.79 g / mol) i 340 µL å få en 20 mM lager.
- Forberede løsningen og bruke den frisk.
-
Utarbeidelse av antimycin A (AA) lager (5 mM)
- Oppløse 5.4 mg AA (532 g/mol) i 2 mL av etanol (siste konsentrasjon = 5 mM).
- Aliquot lager i hetteglass og butikk på 20 ° C.
-
Utarbeidelse av spin sonder
- Boble 50 mM fosfat bufferen som inneholder 100 µM DTPA med nitrogen i 30 min fjerne oppløst oksygen fra bufferen.
- Fjerne spinn sonden fra 20 ° C fryseren og la beholderen å komme til RT (10-15 min).
- Veie ut 2,4 mg av 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237.8 g/mol)
- Oppløses CMH i 1 mL av deoxygenated fosfat bufferen for en siste konsentrasjon av 10 mM.
- Veie ut 5 mg 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride (mito-TEMPO-H) (529.1 g/mol).
- Oppløses mito-TEMPO-H i 1 mL av deoxygenated fosfat bufferen for en siste konsentrasjon av 9.5 mM.
- Veie ut 4,9 mg av 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223.7 g/mol).
- Oppløses CPH i 1 mL av deoxygenated fosfat bufferen for en siste konsentrasjon av 22 mM.
- Aliquot og butikk på-80 ° C (fryse-Tin anbefales ikke).
2. påvisning av Superoxide i vitro
-
Påvisning av totale ekstracellulære og intracellulær superoxide i PMA-stimulert rå 264.7 celler på RT
- Følgende riktig steril teknikk, tine rå 264.7 celler og passasje dem i DMEM medier med 10% FBS (lav endotoxin-fri) og 1% antimycotic/ampicillin på 37 ° C i CO2 inkubator.
- Frø rå 264.7 celler på 1 x 106 celler/godt i 6-vel platene én dag før behandling.
- Forsiktig fjerne media og vask cellene gang med 1 mL av KHB buffer.
- Legge til KHB som inneholder 100 µM DTPA i hver brønn og behandle i et totalt volum på 500 µL med følgende:
- For brønner forbehandlet med TORV, legge 15 µL/godt av TORV fungerende løsning (1000 U/mL, siste konsentrasjon av TORV = 30 U/mL) og Inkuber i 10 min på 37 ° C før tillegg av CMH og PMA.
- Legge til 12,5 µL/vel av 10 mM CMH lager (siste konsentrasjon = 0,25 mM).
- Legge til 40 µL/vel 125 µM PMA arbeider løsning (siste konsentrasjon = 10 µM) eller 40 µL kjøretøy (lager 10 µL av DMSO i 390 µL av PBS).
- Inkuber for 50 min på 37 ° C i en CO2 inkubator.
- Fjern platene settefiskanlegg og plassere dem umiddelbart på is.
- Samle buffer fra hver brønn i separate, 1,5 mL, merket rør. Hold på is gjennom.
- Legg 100 µL av fersk KHB buffer som inneholder 100 µM DTPA, forsiktig skrape cellene, og resuspend av pipettering opp og ned flere ganger. Hold på is hele cellen rørets.
- Last prøven samlet i trinn 2.1.10 og 2.1.11 (50 µL) i hver av kapillær rørene. Seal begge ender og kjøre EPR.
Merk: Alltid teste et rør eller bra (uten celler) inneholder sonden i bufferen (samme konsentrasjon = 0,25 mM), behandlet under samme vilkår som cellene (samme inkubasjon tid og temperatur) som en kontroll, siden bakgrunnen intensiteten av sonden er temperatur - og tidsavhengige. - Angi EPR oppkjøpet parametere til følgende: mikrobølgeovn frekvens = 9.65 GHz; feltet = 3432 G; modulasjon amplituden = 2.0 G; feie bredde = 80 G; mikrobølgeovn makt = 19,9 mW; Totalt antall skanninger = 10; feie tid = 12.11 s; og tidskonstant = 20.48 ms.
-
Påvisning av mitokondrie superoxide i rå 264.7 celler
- Følg trinn 2.1.1 og 2.1.2 frø rå 264.7 celler én dag før eksperimentet.
- Fjerne media og vask cellene gang med 1 mL av KHB buffer.
- Legge til 200 µL av KHB som inneholder 100 µM DTPA i hver brønn.
- Legge til 5,3 µL/vel 9.5 mM mito-TEMPO-H aksjer (siste konsentrasjon = 0,25 mM)
- Inkuber i 10 min på RT.
- Legge 1 µL/godt av antimycin A (AA), 5 mM lagerløsning i etanol (siste konsentrasjon = 25 µM).
- Inkuber for 50 min på 37 ° C i en CO2 inkubator.
- Fjern platene settefiskanlegg og plassere dem umiddelbart på is.
- Forsiktig skrape cellene og resuspend av pipettering opp og ned. Hold på is.
- Laste inn eksemplet i en kapillarrør. Forsegle begge ender.
- Se forrige avsnitt for EPR innstillingen.
-
Påvisning av superoxide i rå 264.7 celler på 77 K
- Sted bufferen samlet i trinn 1.1.10 i pre-forberedt PTFE rør 1-2 inches i lengde (3/16" OD x 1/8†ID). Kontroller PTFE slangen er rett slik at det lett kan settes inn og fjernes fra fingeren dewar. Bruk en gummipropp til å lukke en ende av PTFE slangen, Pipetter buffer eller cellen suspensjon (100-150 µL) i PTFE slangen og forsegle slangen med en andre stopper.
- Flash fryse eksemplet i flytende nitrogen. Prøven kan overføres til en merket kryonisk bevaring tube for lagring på-80 ° C eller kjøre umiddelbart.
- Fylle fingeren dewar med flytende nitrogen og sett inn PTFE slangen som inneholder utvalget i fingeren dewar. Kontroller at prøven er sentrert i aktive løpet av resonator og kjøre EPR 77 K.
Merk: Starte nitrogen gasstrømmen til din spectrometer 15-30 min før målingene, og fortsette denne flyten gjennom målene å hindre vann kondens i resonator. - Angi EPR oppkjøpet parametere til følgende: mikrobølgeovn frekvens = 9.65 GHz; feltet = 3438 G; modulasjon amplituden = 4.0 G; feie bredde = 150 G; mikrobølgeovn makt = 0.316 mW; Totalt antall skanninger = 10; feie tid = 60 s; og tidskonstant = 1.28 ms.
3. EPR målinger i væsker
-
Fullblod
- Behandle mus (8-12 uker gamle) med en enkelt dose av intratracheal bleomycin (Bleo, 100 µL på 1 U/mL) oppløst i PBS eller PBS alene som beskrevet tidligere16,17.
- Euthanize mus ved å tilsette inhalert isoflurane (1.5-4%) etterfulgt av exsanguination og cervical forvridning. Sug opp blod gjennom høyre ventrikkel sprøyter belagt med heparin (1000 USP/mL) som inneholder 100 µM DTPA og overføre til en 1,5 mL tube til.
- I en separat 1,5 mL tube, legger 15 µL av PBS som inneholder 100 µM DTPA og 3 µL av CMH (10 mM) til 132 µL av blod for et totalt volum på 150 µL og endelige CMH konsentrasjon av 0.2 mM.
- Inkuber blod for 10 min på 37 ° C i et vannbad.
- Fjern rørene fra vannbad.
- Ta en aliquot ved å laste blod i et kapillær rør og kjøre EPR på RT med følgende EPR oppkjøpet parametere: mikrobølgeovn frekvens = 9.65 GHz; feltet = 3432 G; modulasjon amplituden = 1.0 G; feie bredde = 80 G; mikrobølgeovn makt = 19,9 mW; Totalt antall skanninger = 3; feie tid = 12.11 s; og tidskonstant = 20.48 ms. eventuelt prøver kan bli flash frossen som beskrevet i trinn 2.3 for målinger på 77 K. EPR oppkjøpet parametere er følgende: mikrobølgeovn frekvens = 9.65 GHz; feltet = 3438 G; modulasjon amplituden = 4.0 G; feie bredde = 150 G; mikrobølgeovn makt = 0.316 mW; Totalt antall skanninger = 2; feie tid = 60 s; og tidskonstant = 1.28 ms.
-
Bronchoalveolar lavage væske (BALF)
- Etter euthanasia (se trinn 3.1.2), samle BALF ved sakte instilling og uttak 1 mL av PBS som inneholder 100 µM DTPA tre ganger i en sprøyte via en kanyle plassert i luftrøret.
- I en 1,5 mL tube, behandle 200 µL av BALF med 4 µL av CMH (10 mM) å få en endelig konsentrasjon av 0.2 mM.
- Inkuber BALF for 50 min på 37 ° C i et vannbad.
- Ta rør av vannbad og plassere dem på isen.
- Last BALF kapillarrør og kjøre EPR på RT med samme EPR innstillingene i trinn 1.1.13, eller flash fryse i flytende nitrogen som beskrevet i trinn 2.3.
-
EPR målinger i blod og BALF på 77 K
- Følger protokollen ovenfor for å samle blod (trinn 3.1.1. for 3.1.4) og BALF (trinn 3.2.1 til 3.2.4).
- Sted 150 µL av behandlet blod eller BALF i PTFE rør (1-2 in). Bruk en gummipropp lukke en ende av PTFE slangen før du legger prøven og en annen plugg å forsegle slangen.
- Flash fryse eksemplet i flytende nitrogen.
- Se avsnitt 2.3 for detaljer på kjører EPR i frosne prøvene i PTFE rør med fingeren dewar 77 K. kjøre frosset CMH behandlet blodprøver med i en uke.
4. EPR målene på lungevev
-
Flash frossen lungevev
- Etter samle BALF i trinn 3.2.1, brystet er åpnet og lungene rødmer med 10 mL kaldt PBS via høyre ventrikkel for å fjerne blod. Flash fryse lungevev i flytende nitrogen. Frosne lungevev kan lagres ved-80 ° C i opptil 6 måneder til bruk for EPR målinger.
- Stabilisere lungevev på tørris med pinsett og kutte flere små biter (5-15 mg) av lungevev med et enkelt-kanten blad.
- Veie vevet i en 1,5 mL tube, sett røret på skala og Tara skalaen, så Legg vev bitene og ta vekten.
- Vevet i 1,5 mL tube, legge 196 µL av KHB som inneholder DTPA og 4 µL av CMH (0.2 mM) for å oppnå en 200 µL totalt volum.
- Inkuber 1t på 37 ° C i et vannbad.
- Nedspinning (for noen få sekunder) i en microcentrifuge 3,884 x g.
- Plasser på is og Pipetter 150 µL nedbryting av i PTFE slangen og fryse for 77 K målingene som beskrevet i Seksjon 2.3.
Merk: For denne metoden heterogenitet skaden må vurderes. For en bleomycin-indusert lungen skade, gitt at det er en svært heterogen skade, anbefales å kutte flere vev stykker fra ulike deler av lunge fra hver musen. Alternativt kan en større del av være homogenisert KHB buffer som inneholder 100 µM DTPA i 1:6 vekt-til-volum forholdet (mg/µL) som beskrevet nedenfor.
-
Frisk lungevev bevart i sukrose buffer
- Tømme lavaged lungene med kaldt PBS å fjerne blod som gjort i trinn 3.1.2.
- Homogenize frisk lungevev Tris-EDTA buffer med 0,25 M sukrose 1:6 lunge/buffer (mg/µL) forholdet med Dounce vev jeksel med et glass eller PTFE pistil.
- Legge til 50 µL av lunge homogenate 450 µL av KHB som inneholder 100 µM DTPA.
- I en 1,5 mL tube (i et totalt volum på 100 µL), til 98 µL av lunge homogenate i KHB, legge 2 µL av CMH 10 mM aksjer å få en endelig konsentrasjon av 0.2 mM.
- Inkuber for 20 min 37 ° C i et vannbad.
- Plasser prøvene på is og laste dem på en kapillarrør. Kjøre EPR på RT (innstillinger brukt i trinn 2.1.13).
- For å teste bidrag av bestemte arter og bruke forskjellige hemmere, pre-spandere 88 µL av lunge homogenate +/-inhibitor, justere med KHB å oppnå et endelig antall 98 µL. I dette eksperimentet, inkludert hemmere 10 µL av TORV (100 U/mL), 4 µL av deferoxamine (DFO; siste konsentrasjon = 800 µM), eller 4 µL av diphenyliodonium klorid (DIP; siste konsentrasjon = 100 µM). Inkuber etter 20 min på 37 ° C i et vannbad.
- Legg 2 µL av CMH og ruge for en annen 20 min på 37 ° C, etterfulgt av EPR målinger som beskrevet ovenfor. Ta en engangs tilpasset tom utvalg CMH KHB som inneholder sukrose buffer. Du kan også lagre dele de resterende lunge homogenates (trinn 3.1.2) ved-80 ° C for fremtidige mål.
Merk: Det totale volumet kan skaleres etter behov.
-
EPR målene på lungevev fra mus injisert med spin sonder i vivo (RT med vev cellen)
- Klargjør CPH lagerløsning ved oppløsning 4,9 mg CPH i 1 mL av filtrert og deoxygenated 50 mM fosfatbuffer.
- Bedøve mus med inhalert isoflurane (1.5-4%) i 20-30 sekunder til ikke svarer til tå knipe. Injisere mus via retroorbital rute med 100 µL av CPH spinn probe for en 25 g musen kroppsvekt (siste dose = 20 mg/kg), og la sonden å sirkulere for 1 h. umiddelbart etter retroorbital injeksjon, legge en dråpe 0,5% proparacaine HCl på øyet området til preve NT øye smerte og tørrhet. Overvåke mus 1t og videre til vev høsting.
- Høste lungevev som beskrevet ovenfor og flash fryse lungene.
- Klipp 20-30 mg av frossent på tørris og registrere nøyaktig vekt.
- Tørk forsiktig av vevet med rengjøring kluter å absorbere noe vann.
- Plasser vevet i vinduet vev cellen (ekstrautstyr lar EPR mål for vevsprøver) og kjøre EPR for å finne totalt spinner. Dataene kan uttrykkes som totalt spinner per mg av vev.
5. analyse
- Simulere til EPR spectra med SpinFit modulen i Xenon programvare benk-toppen EMXnano EPR spectrometer. Bestemme nitroxide konsentrasjonen av SpinCount-modulen. Alternativt en kalibreringskurven av en stabil nitroxide som 4-hydroxy-TEMPO eller TEMPOL kan gjøres, og konsentrasjonen kan fås ved å sammenligne intensiteten av signalet med eksempler og standard.
- Dataene som samles inn på 77 K, bruk dobbel integrering etterfulgt av SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Superoxide detection bruke CMH ble validert ved hjelp av X / XO superoxide genererer systemet å demonstrere at nitroxide (CM.) signalet var fullt hemmet av TORV, mens catalase hadde ingen effekt (figur 1A). Den totale, ekstracellulære superoxide ble deretter evalueres i rå 264.7 celler av rugende celler med celle-permeable CMH spinn sonden +/-TORV forbehandling. Nitroxide konsentrasjonen ble målt i både celle suspensjon og buffer, som viste at verdiene i de to sample typene var lik permeable natur og rask balanse av spin sonden (figur 1B). Nitroxide radikale signal økte i rå 264.7 celler stimulert med PMA sammenlignet kontroll celler. Signalet var betydelig svekket i celler forbehandlet med celle-ugjennomtrengelig TORV (figur 1 c). Hver farge representerer brønner testet på ulike dager, demonstrerer konsistensen av data på bestemte dager og reproduserbarhet av resultater over tid. Konsentrasjonen av ekstracellulære superoxide ble bestemt ved å trekke signalet i PMA celler forbehandlet med TORV fra signalet etter PMA i fravær av TORV (T). Gjenværende signalet ble tilskrevet intracellulær superoxide (figur 1 c). Figur 1 d illustrerer beregningen av totalt og ekstracellulære superoxide. (E) intracellulær signalet ble bekreftet i PMA-behandlet celler etter fjerning av media og av effekten av PEG-TORV på signalet. I denne grafen, i motsetning til (C), det CMH tomt var ikke trekkes fra målinger og rådata vises.
Mitokondrielt superoxide i rå 264.7 celler ble oppdaget bruker EPR spinn sonde mito-TEMPO-H, som akkumuleres i mitochondia. (A) representant EPR spectra for planlagte mito-TEMPO-H signalet i bufferen, økt mito-TEMPO-H signalet i kontroll celler (Con) og ytterligere forbedret signalet i celler stimulert med den mitokondrie inhibitor Antimycin A (AA). Økningen i signalet ble tilskrevet mitokondrie superoxide basert på våre tidligere studie viser at SOD2 overuttrykte betydelig dempes målinger med mito-TEMPO-H10. I figur 2B, ble mitokondrie nitroxide konsentrasjonen bestemt ved å trekke mito-TEMPO-H signalet i tid-matchet buffer fra cellen målinger. CM. signalet oppnådd ved lave temperaturer i rå 264.7 celler etter stimulering med PMA i tilstedeværelse og fravær av TORV. (Figur 3A) CM. signalet var svekket i nærvær av TORV, samsvarer med datatypen romtemperatur (figur 1). Figur 3B viser fotografiet av PTFE rør med stoppers brukes til å samle inn data på 77 K for celler og i vivo prøver. Superoxide produksjon ble oppdaget i blod og BALF ved hjelp av CMH spinn sonden. Blod-eller BALF ble samlet fra PBS - og Bleo-behandlet mus og inkubert umiddelbart med CMH. Prøvene ble overført til PTFE rør og flash frossen og EPR dataene ble samlet inn på 77 K. Konsentrasjonen av nitroxide (CM.) akkumulert i blod inkubert med CMH (0.2 mM) på 37 grader i 10 min (figur 4A). Nitroxide (CM.) konsentrasjonen fra BALF ruget for 50 min (figur 4B). Nitroxide konsentrasjon representerer konsentrasjonen av (CM.) akkumulert i volum av blod eller BALF brukt i eksperimentet.
Tre metoder har blitt testet for å evaluere flere publiserte teknikker for vev bevaring og administrasjon av spin sonder ex vivo vs. i vivo. For å utføre EPR målinger av lungevev, vi først brukt flash frossen lungevev fra kontroll eller skadet mus. Figur 5A viser totalt CM. signalet i nedbryting av et lite stykke lungevev ruges på 37 ° C med CMH i PBS - og Bleo-behandlet mus, henholdsvis. På grunn av heterogenitet lunge skaden etter Bleo behandling anbefales det å klippe brikkene fra forskjellige regioner i lungene og gjennomsnittlig flere målinger for å gi en mer representativt verdi. Alternativt kan homogenize hele lungene og bruke en prøve av denne homogenate. Data samlet inn på 77 K med PTFE rør og finger dewar. Figur 5B viser representant spektra av nitroxide (CM.) signaler fra PBS - og Bleo-behandlet mus, henholdsvis.
En begrensning å behandle lunge vev ex vivo er at det ikke er mulig å pålitelig skille ekstracellulære fra intracellulær superoxide på grunn av behandlingen av vev som forstyrrer cellemembraner. Hvis denne informasjonen er viktig på eksperimentell spørsmålet, kan det rettes ved å bruke i vivo CPH instillasjon metoden beskrevet nedenfor. Frossent kan ikke brukes til å vurdere mitokondrie superoxide; men for denne målingen, kan protokollen være tilpasset til bruk mito-TEMPO-H i vev eller ferske isolert mitokondrier.
Som en annen metode for EPR målinger i lungevev, ble ferskt vev homogenisert sukrose buffer. Lunge-homogenate ble inkubert med CMH sonde i KHB buffer som inneholder DTPA. EPR målinger ble båret ut på RT. figur 6A viser økningen i CM. med Bleo. Vi presenterte en ytterligere testing med forskjellige hemmere som kan brukes til å bestemme arten som bidrar til CM. signal. For å belyse opprinnelsen til CM. signalet fra lungevev, forbehandlet vi lunge-homogenates med flere renovasjonsarbeider og enzym-hemmere. Lunge homogenates ble inkubert med CMH i fraværet eller tilstedeværelse av TORV, deferoxamine (DFO) og diphenyliodonium chloride (DIP) konto (henholdsvis) bidrag fra superoxide, jern eller superoxide generert fra flavin inneholder enzymer (figur 6B). Denne tilnærmingen kan tilpasses til å vurdere den bestemte radikale arten generert i et system eller belyse bidrag av andre enzymatisk kilder (f.eks., NOX, eNOS eller xantin oksidase).
Musene ble injisert med CPH spinn sonder (20 mg/kg) via retroorbital-ruten for å utføre EPR målinger i vivo. Det er ukjent om CMH kan trygt gis til dyr, mens CPH sonden er rapportert å være ikke-giftig; Derfor har vi valgt CPH for eksperimenter i vivo . Lunge vev ble høstet og flash frosset i flytende nitrogen 1t etter sirkulasjon av CPH sonder. Mus kan behandles samtidig med bestemte antioksidanter å skille arten ansvarlig for signalet. Figur 7A viser høyere CP. signalet i Bleo-behandlet mus sammenlignet kontroll mus. Representant spektra av lungevev av kontroll og Bleo-behandlet mus er vist i figur 7B. En blandet EPR spektra av CP. og askorbinsyre radikale ble observert. Verdiene i figur 7A er konsentrasjonen av CP. komponenter. Dataene ble samlet på RT med vev-cellen.
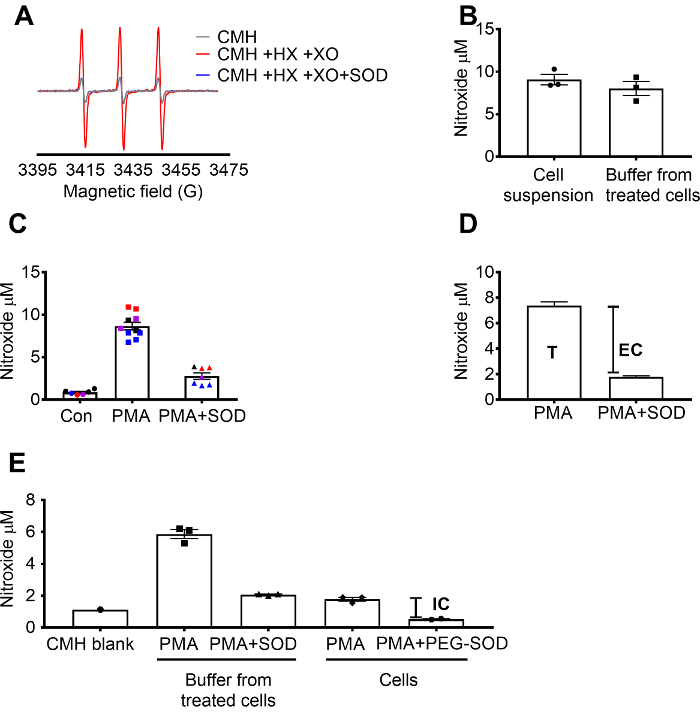
Figur 1: påvisning av superoxide i ulike celle avdelinger. (A) EPR spectra generert av 0,25 mM CMH i 0,5 mM hypoxanthine/xantin oxidase (8 mU/mL) med og uten TORV (30 U/mL). (B) RAW 264.7 celler (1 x 106 celler/vel) ble stimulert med 10 µM PMA i nærvær av CMH for 50 min på 37 ° C og nitroxide konsentrasjon (µM) oppdaget i cellen suspensjon (celler + buffer) og buffer fra behandlet celler. (C) RAW 264.7 celler ble stimulert med PMA vs. kjøretøy kontroll (Con). Ett sett av celler ble forbehandlet for 10 min med 30 U/mL celle-ugjennomtrengelig TORV (PMA + TORV). Hver farge representerer data fra annerledes eksperimentell dager og hvert punkt representerer celler fra et individ som godt. Nitroxide signalet i en tid-matchet tom med CMH i KHB ble trukket fra hver signal å få siste verdier. (D) beregning av total og ekstracellulære superoxide i PMA stimulert celler. T = totalt superoxide, EF = ekstracellulære superoxide (TORV inhibitable signal). (E) for å evaluere intracellulær superoxide signalet (IC), ble signalet i bufferen etter PMA + TORV sammenlignet PMA-behandlet celler etter fjerning av bufferen. For å bekrefte, var brønner forbehandlet med 60 U/mL celle-permeable PEG-TORV 1,5 timer å finne intracellulær TORV inhibitable. Det tid-matchet CMH tomt vises, og gjenspeiler dataene absolutt nitroxide signal. Data uttrykt som gjennomsnittlig ± SEM. Klikk her for å se en større versjon av dette tallet.

Figur 2: påvisning av mitokondrie superoxide i rå celler stimulert med antimycin A. (A) representant spektra av mitokondrie-spesifikke EPR spinn sondere, 0,25 mM mito-TEMPO-H i rå 264.7 celler uten (Con) eller med 25 µM antimycin A (AA) for 50 min på 37 ° C. (B) CM. konsentrasjon (µM) i cellene behandlet med AA sammenlignet med kontrollen. Nitroxide signalet i en tid-matchet mito-TEMPO-H tom ble trukket fra totale signalet å få siste verdier. Data uttrykt som gjennomsnittlig ± SEM. Klikk her for å se en større versjon av dette tallet.

Figur 3: påvisning av superoxide i rå 264.7 celler på 77K. (A) rå 264.7 celler stimulert med 10 µM PMA og EPR spinn sonde, CMH 0,25 mM (50 min på 37 ° C) med (svart) eller uten (rød) forbehandling med 30 U/mL TORV. 100 µL av nedbryting ble lastet fra en 1-tommer i lengde stykke PTFE rør og flash frossen i flytende nitrogen. Stoppers ble fjernet, og frosne PTFE rør ble plassert i fingeren dewar for datainnsamling på 77 K. (B) en bilde av PTFE rør og stoppere. Klikk her for å se en større versjon av dette tallet.

Figur 4: EPR mål i blod og BALF av kontroll og bleomycin-behandlet mus. Mus ble behandlet med en enkelt dose av intratracheal bleomycin (IT Bleo) (100 µL på 1 U/mL) eller PBS kjøretøy. På 7 dager, var mus anesthetized og euthanized. Blod var samlet via høyre ventrikkel punktering sprøyter belagt med 1000 til USP/mL heparin som inneholder 100 µM DTPA. Bronchoalveolar lavage væske (BALF) ble samlet inn av lavaging lungene med 1 mL av 100 µM DTPA i PBS. Blod og BALF ble inkubert for 10 eller 50 min, henholdsvis med 0.2 mM CMH på 37 ° C. 150 µL av blod eller BALF ble lastet inne PTFE rør flash frossen i flytende nitrogen og EPR data innsamlet på 77 K å bruke en finger dewar. Dataene viser nitroxide konsentrasjoner i (A) blod og (B) BALF fra PBS - og Bleo-behandlet mus (n = 4-6). Data uttrykt som betyr ± SEM. (C) Representative spektra av nitroxide i blodet fra PBS - og Bleo-behandlet mus. Klikk her for å se en større versjon av dette tallet.

Figur 5: EPR mål i flash frossen lungevev. Mus ble behandlet med en enkelt dose av intratracheal bleomycin (IT bleo) (100 µL på 1 U/mL) eller PBS kjøretøy. På 7 dager, ble lungene tømt med kaldt PBS å fjerne blod og flash frossen i flytende nitrogen. 5-15 mg av flash-frosne lungevev ble inkubert med 0.2 mM CMH i KHB som inneholder 100 µM i 200 µL av totalvolumet 1t på 37° C. nedbryting var samlet og plassert i PTFE rør og kjøre på 77 K i fingeren dewar. (A) Nitroxide konsentrasjon (µM av nitroxide normalisert til 1 mg av vev). Dataene representerer gjennomsnittet av 2-3 mål for hver lunge. Data uttrykt som mener ± SEM. (B) representant spektra av nitroxide i lungevev fra PBS - og Bleo-behandlet mus. Klikk her for å se en større versjon av dette tallet.

Figur 6: EPR mål i lungevev bevart i sukrose buffer. Mus ble behandlet med en enkelt dose av intratracheal bleomycin (100 µL på 1 U/mL). 7 dager etter behandling, lungene ble spylt med kaldt PBS å fjerne blod og frisk lungevev ble homogenisert Tris-EDTA buffer med 0,25 mM sukrose i 1:6 lunge vekt/buffer volum (mg/µL) forholdet. 50 µL av lunge homogenate var preincubated med KHB med eller uten det følgende hemmere for 20 min på 37 ° C: SOD (100 U/mL), deferoxamine (DFO, 800 µM), og diphenyliodonium fra (DUKKERT, 100 μM) etterfulgt av inkubasjon med 0.2 mM CMH i KHB som inneholder 100 µM DTPA etter 20 min på 37 ° C. Dataene ble oppnådd på RT bruker EPR kapillær rør. (A) Nitroxide konsentrasjon i lungene fra PBS - og Bleo-behandlet mus. (B) Nitroxide konsentrasjon i Bleo lungene i fraværet eller tilstedeværelse av hemmere (n = 3). Data uttrykt som gjennomsnittlig ± SEM. Klikk her for å se en større versjon av dette tallet.

Figur 7: EPR mål i lungevev fra mus injisert med CPH spinn sonde. 100 µL av CPH var administrert via retroorbital injeksjon for en siste konsentrasjon på 20 mg av CPH per kg kroppsvekt. Etter 1 h av sirkulasjon, mus var euthanized, lungene ble spylt med 10 mL kaldt PBS via høyre ventrikkel og lungevev var flash frossen. 20 til 30 mg av lungevev ble plassert i vev cellen og EPR målinger utført på RT. (A) Data uttrykt som spinner / mg. (B) representant spektra av nitroxide signal i PBS og Bleo lunge vev (* angir overlapping med askorbinsyre radikale). Data uttrykt som gjennomsnittlig ± SEM. Klikk her for å se en større versjon av dette tallet.
| Hemmere | Arter |
| Superoxide dismutase (TORV) | Ekstracellulære superoxide |
| Dismutase-polyetylenglykol med superoxide (PEG-TORV) | Intracellulær superoxide |
| Catalase | Hydrogenperoksid basert radikaler |
| Urate | Peroxynitrate |
| Etanol og DMSO | Hydroksyl radikale |
| Metall chelater | Metall ioner (jern og kobber) |
Tabell 1. Vanlige hemmere brukes til å skille arter ansvarlig for spin sonde oksidering.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Vurdering av frie radikaler produksjon biologiske innstillinger er viktig i forståelse redoks regulert signalering i helse og sykdom, men mål av disse artene er svært utfordrende grunnet den korte halveringstiden av frie radikaler arter og teknisk begrensninger med vanlige metoder. EPR er en verdifull og kraftig verktøy i redoks biologi, som det er den bare entydige metoden for påvisning av frie radikaler. Dette prosjektet, vi viser praktiske EPR metoder for å designe eksperimenter og forbereder prøver å oppdage ROS bruker spinn sonder i forskjellige mobilnettet avdelinger i vitro og ulike vev rom i vivo. Vi tilbyr også praktiske metoder for å håndtere biologiske prøver og lagre prøver å forbedre effektivitet.
Spin sonder reagere effektivt med ROS og produsere en stabil nitroxide radikale som kan oppdages med EPR. Flere derivater av spin sonden (syklisk hydroksylamin) har blitt syntetisert med forskjellige permeabilitet egenskaper, som gjør dem egnet for å oppdage frie radikaler produksjon i ulike mobilnettet rom10. Denne protokollen brukes cellen-permeable spinn sonden, CMH; men kan ugjennomtrengelig spinn sonde 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium klorid HCl (CAT1H) brukes til å oppdage ekstracellulære superoxide. Lik vår tidligere studie i menneskelig lymphoblast cellen linjer18, vi klarte å godkjenne bruk av permeable CMH spinn sonde med ugjennomtrengelig TORV og celle permeable PEG-TORV i RAW264.7 celler (en mus lunge macrophage cellen linje) stimulert med PMA til skille mellom ekstracellulære og intracellulære superoxide.
Vi også godkjent rask balanse av CMH mellom de intra - og ekstra cellular avdelinger, og vi fant også at superoxide signalet i celler drops betydelig etter vask cellene bare én gang med KHB (data ikke vist). Vi bekreftet nytte av mitokondrie bestemt spinn sonde mito-TEMPO-H i rå 264.7 celler å måle den økte mitokondrie superoxide generert ved stimulering med mitokondrie elektronet transport kjeden hemmer antimycin A. Bidraget av mitokondrie superoxide produksjon å mito-TEMPO-H har vist tidligere og kan valideres i eksperimenter med isolert frisk mitokondrier eller systemer med mitokondrie superoxide dismutase MnSOD (SOD2) overuttrykte10.
Vurdering av ROS produksjon i vivo er spesielt utfordrende, men evnen til å oppdage produksjon av bestemte ROS gir viktig informasjon når avhør rollen oksidativt stress eller redox regulert signalering i biologisk innstillinger. Riktig håndtering av vev ved spin sonder EPR er avgjørende for å generere reproduserbare og meningsfulle resultater. Bruk av spin sonder med vev vil ikke sannsynlig mål superoxide radikale presentere ved vev høsting på grunn av kort halveringstid, men i stedet den oppdager superoxide produsert av enzymer som NAPDH oksidase, montert endothelial nitrogenoksid syntase , eller xantin oksidase når lungevev eller homogenates er ruges med spin sonde på 37 ° C. Bruk av frossent vil ikke inneholde superoxide generert av mitokondriene, siden frysing skader mitokondrie elektronet transport kjeden aktivitet. For å teste mitokondrie superoxide, må etterforskere isolere frisk mitokondrier eller bruk mitokondrie bestemt sonder i vivo eller i friskt vev.
Flere forskjellige protokoller å bevare vev er publisert i litteratur14,15. Vi sammenlignet tre publiserte metoder for EPR målinger i lungevev: 1) flash fryse vev i flytende nitrogen, 2) homogenisere vev i sukrose buffer, og 3) behandle mus i vivo med en spin sonde 1 time før vev høsting. Vi sammenlignet kontroll mus til mus med alvorlig lungebetennelse og oksidativt stress indusert av bleomycin teste hver metode evne til å vise konsekvent forskjeller i nitroxide signaler i skadet lungene. Alle tre metoder viste en lignende økningen i nitroxide signalet i lungene til bleomycin-behandlet mus. Bruk av flash frossent ville trolig være den enkleste måten å samle vev for de fleste laboratorier, benektende behovet for vev i sukrose bufferen på tidspunktet for høsting. Injeksjon av CPH å fange frie radikaler i vivo er kraftig, men for å bekrefte bestemt arter, dette krever en behandlingsgruppe inkludert passende antioksidant.
En utfordring med å bruke spinn sonder er at oksidasjonen av spin sonder til nitroxide genererer en lignende tre-line EPR spektrum uavhengig av arten ansvarlig for oksidasjon; dermed skiller den ikke mellom ulike ROS arter. Det er også rapportert at det er potensielle reaksjoner av hydroksylamin sonder med fotosynteseaktiviteten elektronet transport kjeden og cytochrome c oksidase19,20. Disse observasjonene bør vurderes når tolke resultatene. Fotosynteseaktiviteten systemet finnes ikke i denne protokollen, og inkludering av DTPA med bufferen hemmer potensielle forurensning av gratis ferric og cuprous ioner10 . Vi viste hvordan du bruker en rekke spesielle enzymer eller chelater i lungevev for å etablere bidrag av bestemt ROS eller hemmere å finne kilden til ROS. Denne tilnærmingen er brukt tidligere med EPR for å avgjøre hvor mye ROS på grunn av montert eNOS13,15. Vi gir en liste over vanlige hemmere brukes til å skille arter ansvarlig for spin sonde oksidasjon (tabell 1).
Vi viste også viktigheten av optimalisere inkubasjon tiden for hver eksperimentelle tilstand. Når sammenligne spinn sonder for å spinne feller, genererer spinn feller unike spectra avhengig av reactant som tillater spesifisitet av frie radikaler arter; men de også viser langsom kinetics for superoxide spinne fangst og er utsatt for biologisk nedbrytning. Behandling av lungevev med den EPR sonde ex vivo er også begrenset av manglende evne til å tilstrekkelig skille ekstracellulære fra intracellulær superoxide på grunn av avbrudd i cellemembranene under behandlingen av vev (frysing eller homogenisere). Bruk av injisert spinn sonde i vivo sammen med TORV eller cellen-permeable PEG-TORV kan løse dette problemet.
Ett mål var å etablere en protokoll for å effektivt samle inn eksempler og lagre dem på-80 ° C før EPR målinger. Derfor utviklet vi en praktisk metode for å bruke PTFE rør for å holde prøvene. Denne slangen blir plassert direkte inn fingeren dewar for EPR analyse på 77 K uten behovet for å rengjøre dewar mellom eksempler. Dette er et alternativ til den nylig publiserte metoden involverer frysing av prøver i 1 mL sprøyter. Målene på frosne prøvene lagret i PTFE slangen kan gjentas over flere dager å demonstrere stabilitet av signalet. Denne tilnærmingen gir batching EPR målinger og muliggjør overføring av prøvene mellom laboratorier slik en ekstern EPR anlegget kan kjøre prøver.
Samlet gir disse protokollene en enkel tilnærming til forbereder celler og vev EPR målinger i biologiske systemer. Protokollene kan tilpasses til andre modeller forbundet med oksidativt stress og bruk av andre spin sonder. Tidsberegningen og konsentrasjonen av spin proben må justeres for hver eksperimentelle tilstand. Evne til EPR å bestemme tilstedeværelse og produksjon av frie radikaler arter utvetydig gir fasthet til eksperimentelle tilnærminger innen redoks biologi.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Dette arbeidet ble støttet av University of Colorado skolen av medisin Dekanus strategisk forskningsinfrastruktur award, R01 HL086680-09 og 1R35HL139726-01, E.N.G. og UCD CFReT fellowship-prisen (han). Forfatterne takker Dr. Sandra Eaton og Dr. Gareth Eaton (University of Denver), Dr. Gerald Rosen Dr. Joseph P. Kao (University of Maryland), og Dr. Sujatha Venkataraman (University of Colorado Denver) for nyttig diskusjoner og Joanne Maltzahn, Ashley Trumpie og Ivy McDermott (University of Colorado Denver) for kundestøtte.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



