Summary
Espectroscopia de ressonância paramagnética (EPR) de elétrons é um método inequívoco para medir radicais livre. A utilização de sondas de rotação seletiva permite detecção de radicais livres em diferentes compartimentos celulares. Apresentamos um método prático e eficiente para coletar amostras biológicas que facilitam a tratar, armazenar e transferir amostras para medições de EPR.
Abstract
A detecção precisa e específica de espécies reativas de oxigênio (ROS) em diferentes compartimentos celulares e tecidos é essencial para o estudo de redox-regulado sinalização nas configurações biológicas. Espectroscopia de ressonância paramagnética de electrões (EPR) é o método direto apenas para avaliar os radicais livres de forma inequívoca. Sua vantagem é que ele detecta níveis fisiológicos das espécies específicas com uma elevada especificidade, mas requer tecnologia especializada, preparação cuidadosa da amostra e controlos adequados para garantir a exata interpretação dos dados. Sondas de rotação cíclica de hidroxilamina reagem seletivamente com superóxido ou outros radicais para gerar um sinal de nitroxide que pode ser quantificado por espectroscopia de EPR. Sondas de rotação célula-permeável e sondas de rotação projetadas para acumular rapidamente nas mitocôndrias permitem a determinação da concentração de superóxido em diferentes compartimentos celulares.
Em culturas de células, o uso de célula permeável 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) junto com e sem pré-tratamento de célula-impermeável superóxido dismutase (SOD) ou uso de célula-permeável PEG-SOD, permite a diferenciação de extracelular de superóxido citosólico. O 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido mitocondrial] piperidínico dicloreto (mito-ritmo-H) permite a medição de ROS mitocondrial (predominantemente superóxido).
Sondas de rotação e espectroscopia EPR também podem ser aplicados aos modelos na vivo . Superóxido pode ser detectado em líquidos extracelulares como o sangue e fluido alveolar, bem como os tecidos como o tecido pulmonar. Vários métodos são apresentados para processar e armazenar tecido para medições de EPR e entregar intravenosa 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) rotação sonda em vivo. Enquanto as medições podem ser executadas em temperatura ambiente, as amostras obtidas de modelos in vitro e in vivo também podem ser armazenadas a-80 ° C e analisadas pelo EPR em 77 K. As amostras podem ser armazenadas no estábulo de tubos especializados a-80 ° C e executadas em 77 K para habilitar um prático, eficiente e o método reprodutível que facilita o armazenamento e transferência de amostras.
Introduction
Enquanto medidas de estresse oxidativo e espécies reativas de oxigênio são importantes para o estudo de diversas doenças em todos os sistemas do órgão, a detecção de espécies reativas de oxigênio (ROS) é um desafio devido a uma meia-vida curta e alta reatividade. Uma técnica de ressonância paramagnética (EPR) do elétron é o método mais inequívoco para a detecção de radicais livres. Sondas de rotação têm vantagens sobre as sondas fluorescentes mais comumente usadas. Apesar de sondas fluorescentes são relativamente baratos e fáceis de usar e fornecer detecção rápida e sensível de ROS, têm sérias limitações devido a sinais diferente, a incapacidade de se calcular as concentrações de ROS e uma falta geral de especificidade1 .
Para facilitar o uso de EPR para estudos biológicos, uma variedade de spin sondas foram sintetizadas que pode medir uma gama de espécies radicalares biologicamente relevantes, bem como pO2, pH e redox afirma2,3, 4,5,6,7. Armadilhas de rotação também foram desenvolvidas para capturar radicais de curta duração e vida longa forma adutos, que proporciona a detecção por EPR8. Ambas as classes (sondas de girar e girar armadilhas) têm vantagens e limitações. Uma classe comumente usado de sondas de rotação são hidroxilaminas cíclicas, que são o EPR-silencioso e reagem com os radicais de curta duração para formar um nitroxide estável. Hidroxilaminas cíclicas reagem com superóxido 100 vezes mais rápido do que as armadilhas de rotação, permitindo-lhes competir com antioxidantes celulares, mas eles carecem de especificidade e requerem o uso de controles apropriados e inibidores para identificar a espécie radical ou fonte responsável pelo sinal nitroxide. Enquanto a rotação armadilhas especificidade de exposição, com distintas espectral de que padrões, dependendo da espécie presa, eles têm cinética lenta para superóxido spin trapping e são propenso a biodegradação do radical adutos. Pedidos de interceptação de rotação foram bem documentados em investigação biomédica9,10,11,12,13.
O objetivo deste projeto é demonstrar métodos práticos de EPR para projetar experiências e preparação de amostras para detectar superóxido, usando a rotação sondas em diferentes compartimentos celulares in vitro e em tecidos diferentes compartimentos na vivo. Diversos manuscritos publicaram protocolos relevantes para esses objetivos, utilizando sondas de rotação alvo permeável ao celular, celular-impermeáveis e mitocondrial ao tecido alvo diferentes compartimentos celulares in vitro e processo para análise em modelos do rato 14 , 15. vamos construir sobre este corpo de literatura, Validando uma abordagem para medir superóxido usando uma sonda de rotação (CMH) 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine em diferentes compartimentos celulares em vitro para garantir precisão medições, destacando possíveis problemas técnicos que podem distorcer os resultados. Nós também fornecemos métodos para realizar medições de EPR em sangue, líquido de lavagem broncoalveolar e tecido pulmonar usando a sonda de rotação CMH. Estes estudos podem comparar diferentes métodos para processar os tecidos, bem como apresentar um método para injetar outra sonda de rotação, CPH, em ratos antes da colheita de tecidos. Finalmente, nós desenvolvemos um método prático para armazenar as amostras em tubos de politetrafluoretileno (PTFE) para permitir o armazenamento e transferência de amostras antes de medições de EPR em 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Todos os estudos em animais foram aprovados pela Universidade de Colorado Denver institucional Cuidado Animal e Comissão de utilização.
1. preparação dos reagentes
-
Diethylenetriaminepentaacetic estoque de ácido (DTPA) (150 mM)
- Adicionar 2,95 g de DTPA (393.35 g/mol) a 10 mL de água desionizada.
- Para dissolver DTPA, adicionar 1 M de NaOH, gota a gota e levar a um pH de 7,0.
- Trazer o volume para 50 mL com água para uma concentração final de DTPA de 150mm e armazenar a 4 ° C.
-
Solução salina tampão de fosfato (PBS) (50 mM, pH 7,4)
- Prepare-se 5 M de cloreto de sódio (NaCl) (58.44 g/mol; 29,22 g/100 mL).
- Prepare-se 1 M de potássio Fosfato dibásico HK2PO4 (174.18 g/mol; 17,42 g/100 mL)
- Prepare-se 1 M de potássio fosfato monobásico KH2PO4 (136.1 g/mol; 13,61 g/100 mL). Misture 3 mL de 5 M de NaCl com 4,24 mL de 1 M de fosfato de potássio dibásico e 0,760 mL de 1m potássio fosfato monobásico. Verifica o pH.
- Levar o volume a 100 mL com água desionizada.
- Armazenar em temperatura ambiente (RT) por curto prazo (dias) e a 4 ° C para armazenamento a longo prazo (semanas).
-
Tampão Krebs-Henseleit (KHB) contendo 100 µM DTPA
- Tubo de centrifuga conico de 50 mL, adicione 33,3 µ l de solução-mãe de DTPA 150 mM.
- Trazer um volume de 50 mL com tampão Krebs-Henseleit (KHB).
- Preparar o buffer fresco com DTPA cada dia e mantém-na RT
-
Tampão Tris-EDTA com sacarose
- Preparar o estoque de Tris 0,5 M: dissolver 15,14 g de base de Tris (121.14 g/mol) em 150 mL de água desionizada. Usando HCl, ajustar o pH a 7,8 e trazer até um volume final de 250 mL.
- Dissolver 21,4 g de sacarose (g/mol 342.29; concentração final = 0,25 milímetros) em 150 mL de água desionizada.
- Adicione 5 mL de Tris estoque de sacarose para atingir uma concentração de Tris final de 10 mM.
- Adicione 0,5 mL de estoque de EDTA 0,5 M Tris-sacarose a obter uma concentração final de 1 mM.
- Verificar o pH e ajustá-lo para 7,4.
- Trazer para um volume final de 250 mL com água desionizada e armazenar a 4 ° C.
-
Eritrócitos de bovinos estoque de dismutase (SOD) Cu/Zn superóxido (30.000 U/mL)
- Reconstitua a 30.000 U de SOD em 1 mL de PBS (aproximadamente 5,7 mg, dependendo da atividade de SOD monte).
- Misture bem, alíquota e armazenar a-20 ° C para curto prazo (6-12 meses) e a-80 ° C para armazenamento a longo prazo.
-
Solução de trabalho de SOD (1000 U/mL)
- Transferi uma alíquota de 30 µ l de 30.000 estoque SOD U/mL para um 870 µ l de PBS estéril.
- Manter a solução no gelo e usá-lo fresco.
-
Estoque de (PMA) do phorbol myristate 12 13-acetato (5 mM)
- Dissolver 1 mg de PMA (616.83 g/mol) em 325 µ l de DMSO (concentração final = 5 mM).
- Alíquota de uma solução PMA 5 mM e armazená-lo a-20 ° C.
-
Solução de trabalho de PMA (125 µM)
- Dilua uma alíquota de 10 µ l do estoque PMA 5 mM em 390 µ l de PBS estéril.
- Manter a solução no gelo e usá-lo fresco.
- Para um controle de veículo para PMA, use 10 µ l de DMSO em 390 µ l de PBS.
-
Cloreto de Diphenyliodonium (DIP) (2,5 mM)
- Dissolver 3,2 mg de DIP (316.57 g/mol) em 4 mL de obter um estoque de 2,5 mM.
- Preparar a solução e usá-lo fresco.
-
Sal mesilato de deferoxamina (DFO) (20 mM)
- Dissolver 4,5 mg de DFO (656,79 g / mol) em 340 µ l para obter um estoque de 20 mM.
- Preparar a solução e usá-lo fresco.
-
Preparação de antimycin ações A (AA) (5 mM)
- Dissolver 5,4 mg de AA (532 g/mol) em 2 mL de etanol (concentração final = 5 mM).
- Alíquota o estoque em frascos de vidro e em-20 ° C.
-
Preparação de sondas de rotação
- Bolha 50 milímetros de fosfato contendo 100 µM DTPA com nitrogênio por 30 min remover o oxigênio dissolvido de buffer de buffer.
- Retire a sonda de rotação do freezer-20 ° C e permitir que o contêiner vir para RT (10-15 min).
- Pesar 2,4 mg de 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237.8 g/mol)
- Dissolva CMH em 1 mL de tampão de fosfato venoso para uma concentração final de 10 mM.
- Pese 5 mg de dicloreto de 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium (H-ritmo-mito) (529.1 g/mol).
- Dissolva o mito-ritmo-H em 1 mL de tampão de fosfato venoso para uma concentração final de 9,5 mM.
- Pesar 4,9 mg de 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223.7 g/mol).
- Dissolva o CPH em 1 mL de tampão de fosfato venoso para uma concentração final de 22 mM.
- Alíquota e loja a-80 ° C (gelo-degelo não é recomendado).
2. detecção de superóxido in vitro
-
Deteção de superóxido total, extracelular e intracelular na PMA-estimulada de 264.7 pilhas no RT
- Seguir a técnica asséptica apropriada, descongelar 264.7 pilhas e passagem-los em mídia DMEM suplementada com 10% FBS (baixa livre de endotoxinas) e 1% antimicótico/ampicilina a 37 ° C numa incubadora de CO2 .
- Semente 264.7 pilhas a 1 x 106 células/poço em placas de 6 boas um dia antes do tratamento.
- Gentilmente remover mídia e lavar as células uma vez com 1 mL de tampão KHB.
- Adicionar KHB contendo 100 µM DTPA a cada poço e tratar em um volume total de 500 µ l, com o seguinte:
- Para poços pré-tratados com SOD, adicione 15 µ l/poço de solução de trabalho de SOD (1000 U/mL; concentração final de SOD = 30 U/mL) e incubar durante 10 minutos a 37 ° C antes da adição de CMH e PMA.
- Adicionar 12,5 µ l/poço de estoque CMH 10mm (concentração final = 0,25 mM).
- Adicionar 40 µ l/poço 125 µM PMA da solução de trabalho (concentração final = 10 µM) ou veículo de 40 µ l (estoque 10 µ l de DMSO em 390 µ l de PBS).
- Incube durante 50 min a 37 ° C numa incubadora de CO2 .
- Retire as placas da incubadora e colocá-los imediatamente no gelo.
- Recolha reserva de cada poço em separado, 1,5 mL, rotulado de tubos. Manter-se no gelo ao longo.
- Adicione 100 µ l de tampão KHB fresco contendo 100 µM DTPA, delicadamente raspar as células e ressuspender pipetando subindo e descendo várias vezes. Manter-se no gelo ao longo de ressuspensão de célula.
- Carga da amostra recolhida em etapas 2.1.10 e 2.1.11 (50 μL) em cada um dos tubos capilares. Ambas as extremidades do selo e executar o EPR.
Nota: Sempre um tubo de teste ou bem (sem pilhas) contendo a sonda no buffer (mesma concentração = 0,25 mM), tratados sob as mesmas condições que as células (mesmo tempo de incubação e temperatura), como um controle, desde que a intensidade do fundo da sonda é temperatura... e dependente do tempo. - Definir os parâmetros de aquisição de EPR para o seguinte: frequência de microondas = 9,65 GHz; centro do campo = 3432 G; amplitude de modulação = 2,0 G; varrer a largura = 80 G; energia de microondas = 19,9 mW; número total de exames = 10; tempo de varredura = 12.11 s; e constante de tempo = 20,48 ms.
-
Deteção de superóxido mitocondrial em 264.7 pilhas
- Siga os passos 2.1.1 e 2.1.2 para 264.7 pilhas de semente um dia antes do experimento.
- Remova a mídia e lave as células uma vez com 1 mL de tampão KHB.
- Adicione 200 µ l de KHB contendo 100 µM DTPA para cada poço.
- Adicionar 5,3 µ l/poço de estoque de mito-ritmo-H de 9,5 mM (concentração final = 0,25 mM)
- Incubar durante 10 minutos a RT.
- Adicionar 1 µ l/poço de antimycin A (AA), solução etanólica de 5mm (concentração final = 25 µM).
- Incube durante 50 min a 37 ° C numa incubadora de CO2 .
- Retire as placas da incubadora e colocá-los imediatamente no gelo.
- Delicadamente, raspe as células e ressuspender pipetando para cima e para baixo. Manter-se no gelo.
- Carrega a amostra em um tubo capilar. Ambas as extremidades do selo.
- Consulte a seção anterior para APE.
-
Deteção de superóxido em 264.7 pilhas a 77 K
- Coloque o buffer coletado na etapa 1.1.10 pré-preparadas PTFE tubo 1-2 polegadas de comprimento (3/16" OD x 1/8" ID). Certifique-se de que o tubo de PTFE é reto, então pode ser facilmente inserido e removido do dedo dewar. Use uma rolha de borracha para fechar uma das extremidades do tubo de PTFE, pipetar o buffer ou suspensão de células (100 a 150 µ l) para o tubo de PTFE e selar o tubo com uma rolha de segunda.
- Flash congelar a amostra em nitrogénio líquido. A amostra pode ser transferida para um tubo de criopreservação etiquetados para armazenamento a-80 ° C ou executar imediatamente.
- Preencher o dedo dewar com nitrogênio líquido e inserir o tubo de PTFE que contém a amostra para o dedo dewar. Verifique se a amostra é centralizada no espaço ativo do ressonador e EPR em 77 K.
Nota: Iniciar o fluxo de gás nitrogênio para seu espectrômetro de 15-30 min antes das medições e continuar este fluxo durante as medições para impedir a condensação de água no ressonador. - Definir parâmetros de aquisição de EPR para o seguinte: frequência de microondas = 9,65 GHz; centro do campo = G 3438; amplitude de modulação = 4,0 G; varrer a largura = 150 G; energia de microondas = 0,316 mW; número total de exames = 10; varrer o tempo = 60 s; e constante de tempo = 1,28 ms.
3. EPR medições em fluidos
-
Sangue total
- Trate ratos (8-12 semanas de idade), com uma dose única de bleomicina intratraqueal (Bleo; 100 µ l a 1 U/mL) dissolvida em PBS ou PBS sozinho como descrito anteriormente,16,17.
- Eutanásia em ratos através da administração de isoflurano inalado (1,5-4%) seguido de sangria e deslocamento cervical. Aspire o sangue do ventrículo direito através de uma seringa revestido com heparina (USP de 1000/mL) contendo 100 µM DTPA e transferir para um tubo de 1,5 mL.
- Em um tubo separado 1,5 mL, adicionar 15 µ l de PBS contendo 100 µM DTPA e 3 µ l de CMH (10 mM) para 132 µ l de sangue para um volume total de 150 µ l e concentração de CMH final de 0,2 mM.
- Incube o sangue por 10 min a 37 ° C em banho-maria.
- Retire os tubos do banho-maria.
- Tomar uma alíquota carregando sangue em um tubo capilar e execute o EPR em RT com os seguintes parâmetros de aquisição de EPR: frequência de microondas = 9,65 GHz; centro do campo = 3432 G; amplitude de modulação = 1,0 G; varrer a largura = 80 G; energia de microondas = 19,9 mW; número total de exames = 3; tempo de varredura = 12.11 s; e constante de tempo = 20.48 MS. Alternativamente, as amostras podem ser congelada como descrito no passo 2.3 para medições em 77 parâmetros de aquisição de K. EPR são os seguintes: frequência de microondas = 9,65 GHz; centro do campo = G 3438; amplitude de modulação = 4,0 G; varrer a largura = 150 G; energia de microondas = 0,316 mW; número total de exames = 2; varrer o tempo = 60 s; e constante de tempo = 1,28 ms.
-
Líquido de lavagem broncoalveolar (LBA)
- Após eutanásia (ver passo 3.1.2), recolher BALF lentamente incutir e retirada de 1 mL de PBS contendo 100 µM DTPA três vezes em uma seringa através de uma cânula colocada na traqueia.
- Em um tubo de 1,5 mL, trate a 200 µ l de LBA com 4 µ l de CMH (10 mM) para obter uma concentração final de 0,2 mM.
- Incube BALF 50 min a 37 ° C em banho-maria.
- Tome tubos de sair do banho de água e colocá-los no gelo.
- BALF de carga em um tubo capilar e execução EPR na RT com as mesmas configurações de EPR como usado no passo 1.1.13, ou flash congelamento em nitrogênio líquido, conforme descrito na etapa 2.3.
-
Medições de EPR em sangue e LBA a 77 K
- Siga o protocolo acima para coletar sangue (etapas 3.1.1. a 3.1.4) e LBA (etapas 3.2.1 a 3.2.4).
- Lugar de 150 µ l de sangue tratada ou LBA em PTFE tubo (dentro de 1-2). Use uma rolha de borracha para fechar uma das extremidades do tubo de PTFE antes da adição da amostra e outra rolha para fechar o tubo.
- Flash congelar a amostra em nitrogénio líquido.
- Ver secção 2.3 para obter detalhes sobre a execução de EPR em amostras congeladas, no tubo de PTFE, usando o dedo que Dewar em 77 K. Run congelados CMH tratados com as amostras de sangue em uma semana.
4. EPR medições no tecido pulmonar
-
Flash do tecido pulmonar congelados
- Depois de coletar a LBA na etapa 3.2.1, o peito é aberto e pulmões liberadas com 10 mL de PBS frio através do ventrículo direito para remover o sangue. Flash congelar o tecido pulmonar em nitrogênio líquido. Tecido pulmonar congelado pode ser armazenado a-80 ° C por até 6 meses até o uso para medições de EPR.
- Estabilizar o tecido pulmonar em gelo seco com uma pinça e cortar vários pedaços pequenos (5-15 mg) do tecido pulmonar, usando uma lâmina de borda única.
- Pesar o tecido em um tubo de 1,5 mL, colocar o tubo na escala e tare a balança, em seguida, adicione os pedaços de tecido e registar a sua massa.
- No tecido no tubo de 1,5 mL, adicione µ l 196 de KHB contendo DTPA e 4 µ l de CMH (0,2 mM) para alcançar um volume total de 200 µ l.
- Incube durante 1 h a 37 ° C em banho-maria.
- Spin para baixo (por alguns segundos) numa microcentrifuga a 3.884 x g.
- Coloque no gelo e pipetar 150 µ l do sobrenadante para o tubo de PTFE e congelar para as medições de 77 K, conforme descrito na seção 2.3.
Nota: Para este método, a heterogeneidade da lesão precisa ser considerado. Para uma lesão pulmonar induzida por bleomicina, dado que é uma lesão muito heterogênea, é aconselhável cortar vários pedaços de tecido de diferentes partes do pulmão de cada rato. Alternativamente, um pedaço maior de tecido pode ser homogeneizado em tampão KHB contendo 100 µM DTPA em uma relação de peso-para-volume 1:6 (mg / µ l), conforme descrito abaixo.
-
Tecido de pulmão fresco preservado no buffer de sacarose
- Lave os pulmões lavaged com PBS fria para remover sangue como feito no passo 3.1.2.
- Homogeneizar o tecido de pulmão fresco em tampão Tris-EDTA com 0,25 M de sacarose com um rácio de 1:6 pulmão/tampão (mg / µ l) usando homogenizacao moedor de tecido com um vidro ou pilão PTFE.
- Adicione 50 µ l de homogeneizado o pulmão a 450 µ l de KHB contendo 100 µM DTPA.
- Em um tubo de 1,5 mL (em um volume total de 100 µ l), para µ l 98 de pulmão homogeneizado em KHB, adicione 2 µ l de CMH de estoque de 10 mM para obter uma concentração final de 0,2 mM.
- Incube durante 20 min 37 ° C em banho-maria.
- Colocar as amostras no gelo e carregá-los em um tubo capilar. Execute o EPR na RT (configurações usadas na etapa 2.1.13).
- Para testar a contribuição de determinadas espécies e fontes usando diferentes inibidores, pré-tratamento 88 µ l de pulmão homogenate + /-inibidor, ajustando com KHB para atingir um volume final de 98 µ l. Neste experimento, os inibidores incluíam 10 µ l de SOD (100 U/mL), 4 µ l de deferoxamina (DFO; concentração final = 800 µM), ou 4 µ l de cloreto de diphenyliodonium (DIP; concentração final = 100 µM). Incube durante 20 min a 37 ° C em banho-maria.
- Adicionar 2 µ l de CMH e incubar durante mais 20 minutos a 37 ° C, seguido por medições de EPR, como descrito acima. Inclua uma única amostra em branco combinada com CMH KHB contendo tampão de sacarose. Alternativamente, armazene alíquotas dos restantes homogenates de pulmão (passo 3.1.2) a-80 ° C para medições futuras.
Nota: O volume total pode ser dimensionado conforme necessário.
-
Medições de EPR em tecido pulmonar de ratos injetados com rotação sondas na vivo (no RT usando tecido celular)
- Prepare a solução-mãe CPH dissolvendo 4,9 mg de CPH em 1 mL de tampão de fosfato 50mm filtrada e pobre em oxigênio.
- ANESTHETIZE ratos com isoflurano inalado (1,5-4%) por 20-30 segundos até que não respondem aos pés pitada. Injetar camundongos através de retroorbital rota com 100 µ l de sonda de rotação CPH para um peso de corpo do mouse 25g (dose final = 20 mg/kg) e permitir que a sonda circular por 1 h. imediatamente após a injeção de retroorbital, adicione uma gota de proparacaine 0,5% HCl na área dos olhos para preve dor nos olhos NT e ressecamento. Monitorar os ratos por 1h e proceder à colheita de tecidos.
- Colheita do tecido pulmonar, como descrito acima e flash congelar os pulmões.
- Corte de 20-30 mg de tecido congelado em gelo seco e registrar o peso exato.
- Limpe cuidadosamente o tecido com limpeza toalhetes para absorver qualquer água de superfície.
- Coloque o tecido dentro da janela da célula de tecido (um acessório permite medições de EPR para amostras de tecido) e executar o EPR para determinar o total de rodadas. Os dados podem ser expressas como total de rodadas por mg de tecido.
5. análise de dados
- Simule os espectros EPR usando o módulo SpinFit incorporado no software Xenon do espectrómetro bancada EMXnano EPR. Determine a concentração de nitroxide pelo módulo SpinCount. Como alternativa, pode efectuar-se uma curva de calibração de um nitroxide estável como 4-hidroxi-TEMPO ou TEMPOL, e a concentração pode ser obtida comparando a intensidade do sinal com a amostra e padrão.
- Para os dados coletados em 77 K, use integração dupla, seguida por SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Deteção de superóxido usando CMH foi validada usando o X / geração de superóxido XO sistema para demonstrar que o sinal nitroxide (CM.) foi totalmente inibido pela SOD, enquanto catalase não teve nenhum efeito (figura 1A). O superóxido total, extracelular então foi avaliado em 264.7 pilhas por pilhas de incubação com a sonda de rotação CMH célula-permeável + /-pré-tratamento da SOD. A concentração de nitroxide foi medida na suspensão de células e o buffer, o que demonstra que os valores em dois tipos de amostra semelhantes, devido à natureza permeável e equilibração rápida da sonda rotação (figura 1B). O sinal de radicais nitroxide aumentou em 264.7 pilhas estimuladas com a PMA, em comparação com células de controle. Este sinal foi atenuado significativamente nas células pré-tratados com célula-impermeável SOD (Figura 1). Cada cor representa poços testados em dias diferentes, demonstrando a consistência dos dados coletados em dias específicos e reprodutibilidade dos resultados ao longo do tempo. A concentração de superóxido extracelular foi determinada subtraindo-se o sinal em células PMA pré-tratados com SOD do sinal após a PMA na ausência de SOD (T). O sinal restante foi atribuído a superóxido intracelular (Figura 1). A Figura 1 ilustra o cálculo do total e extracelular superóxido. (E) o sinal intracelular foi confirmado na PMA-tratados células após a remoção dos meios de comunicação e pelo efeito de PEG-SOD sobre o sinal. Neste gráfico, em contraste com (C), o espaço em branco da CMH não foi subtraído as medições e os dados brutos são mostrados.
Superóxido mitocondrial em 264.7 pilhas foi detectado usando o EPR rotação sonda mito-ritmo-H, que acumula-se no mitochondia. (A) espectros de EPR representante para o sinal de mito-ritmo-H de linha de base no buffer, o maior sinal de mito-ritmo-H nas células de controle (Con) e o sinal ainda mais reforçado nas células estimuladas com o inibidor mitocondrial Antimycin A (AA). O aumento do sinal foi atribuído para o superóxido mitocondrial com base em nosso estudo anterior, mostrando que SOD2 superexpressão significativamente atenuadas medições com mito-ritmo-H10. Na Figura 2B, a concentração de nitroxide mitocondrial foi determinada subtraindo-se o sinal de mito-ritmo-H no buffer de tempo-combinadas de medições da célula. O sinal de CM. obtido a baixas temperaturas em 264.7 pilhas após estimulação com a PMA, na presença e na ausência de SOD. (Figura 3A) O sinal CM. foi atenuado na presença de SOD, consistente com os dados de temperatura (Figura 1). Figura 3B mostra a fotografia do tubo de PTFE com as rolhas usadas para coletar dados a 77 K para as células e na vivo amostras. Produção de superóxido foi detectada no sangue e BALF utilizando a sonda de rotação CMH. Amostras de sangue ou LBA foram coletadas de PBS e Bleo-tratados com ratos e incubadas imediatamente com CMH. As amostras foram transferidas para o tubo de PTFE e flash congelado, e dados EPR foi coletados em 77 K. A concentração de nitroxide (CM.) acumulado no sangue incubado com CMH (0,2 mM) a 37 graus por 10 min (Figura 4A). Nitroxide (CM.) concentração de BALF incubadas durante 50 min (Figura 4B). Concentração Nitroxide representa a concentração de (CM.) acumulada no volume de sangue ou BALF usado no experimento.
Três métodos foram testados para avaliar várias técnicas publicadas para preservação de tecido e administração de spin sondas ex vivo vs. in vivo. Para realizar medições de EPR no tecido pulmonar, nós primeiro utilizado tecido de pulmão congelados flash de controle ou feridas de ratos. Figura 5A mostra o total de sinal CM. no sobrenadante de um pequeno pedaço de tecido pulmonar, incubado a 37 ° C com CMH em PBS e Bleo-tratados com ratos, respectivamente. Devido à heterogeneidade da lesão pulmonar após tratamento Bleo, recomenda-se cortar pedaços de diferentes regiões do pulmão e a média de várias medições para fornecer um valor mais representativo. Alternativamente, um pode homogeneizar o pulmão inteiro e uma amostra deste homogeneizado. Dados coletados em 77 K usando tubo de PTFE e dedo dewar. Figura 5B mostra representativos espectros de nitroxide (CM.) sinais de PBS e Bleo-tratados com ratos, respectivamente.
Uma limitação para o tratamento de pulmão tecido ex vivo é que não é possível distinguir confiavelmente extracelular de superóxido intracelular devido ao processamento do tecido que rompe as membranas celulares. Se esta informação é importante para a questão experimental, que pode ser abordados usando na vivo CPH instilação método descrito abaixo. Tecido congelado não pode ser usado para avaliar superóxido mitocondrial; Porém, para esta medida, o protocolo pode ser adaptado para usar o mito-ritmo-H no tecido ou mitocôndrias isoladas recentemente.
Como um segundo método para medições de EPR no tecido pulmonar, tecido fresco foi homogeneizado em buffer de sacarose. O homogeneizado pulmonar foi incubado com sonda CMH em tampão KHB contendo DTPA. Foram realizadas medições de EPR se no RT. figura 6A demonstra o aumento CM. com o Bleo. Apresentamos um teste adicional usando inibidores diferentes que podem ser usados para determinar a espécie que contribuem para a CM. sinal. Para elucidar a origem do sinal CM. , gerado a partir do tecido pulmonar, nós pré-tratados homogenates o pulmão com vários catadores e inibidores de enzimas. Homogenates de pulmão foram incubadas com CMH na ausência ou a presença de cloreto de SOD, deferoxamina (DFO) e diphenyliodonium (DIP), a conta (respectivamente) para as contribuições do superóxido, ferro ou superóxido gerados de flavin, contendo enzimas (Figura 6B). Esta abordagem pode ser adaptada para avaliar as espécies radicais específicas geradas em um sistema ou elucidar a contribuição de outras fontes enzimáticas (ex., NOX, eNOS ou xantina oxidase).
Os ratos foram injetados com CPH rotação sondas (20 mg/kg) via rota retroorbital para realizar medições de EPR em vivo. É desconhecido se CMH pode ser administrada com segurança para animais, enquanto a sonda CPH foi relatada para ser não-tóxico; assim, nós selecionamos CPH para os experimentos na vivo . Tecidos de pulmão foram colhidos e flash congelado em nitrogênio líquido 1h após circulação de sondas CPH. Os ratos podem ser tratados simultaneamente com antioxidantes específicos para diferenciar a espécie responsável pelo sinal. Figura 7A mostra o maior CP. sinal em camundongos tratados com Bleo comparados aos ratos controle. Espectros representativos do tecido pulmonar de ratos tratados com Bleo de controle e são mostrados na Figura 7B. Um misto espectros EPR de CP. e observou-se radical de ácido ascórbico. Os valores relatados na Figura 7A são as concentrações de CP. componentes. Os dados foram coletados em RT usando a célula do tecido.
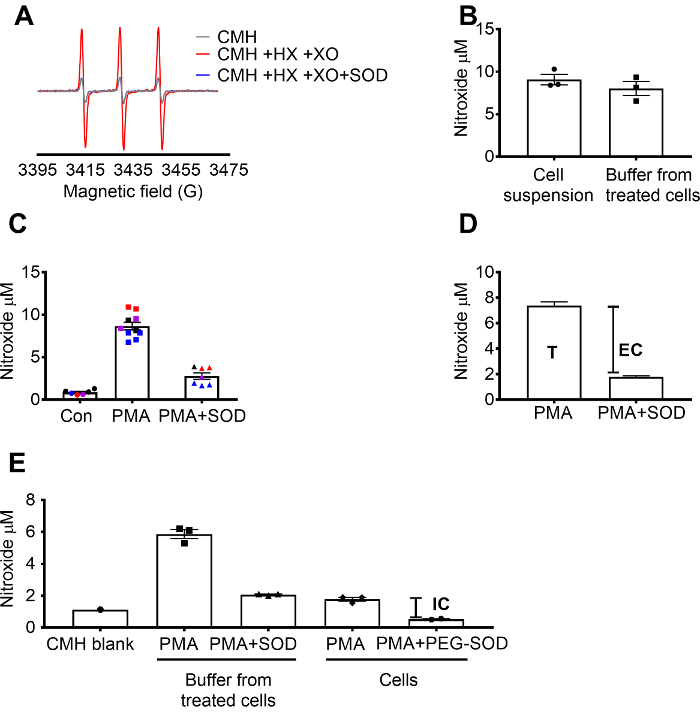
Figura 1: deteção de superóxido em compartimentos de célula diferente. (A) espectros EPR gerados por 0,25 mM CMH em hipoxantina/xantina oxidase 0,5 mM (8 mU/mL) com e sem SOD (30 U/mL). (B) RAW 264.7 cells (1 x 106 células/poço) foram estimulados com 10 µM PMA na presença de CMH para buffer coletadas células tratadas e 50 min a 37 ° C e nitroxide concentração (µM) detectado em suspensão de células (células + buffer). (C) RAW 264,7 células foram estimuladas com PMA vs. controle do veículo (Con). Um conjunto de células foram pré-tratados por 10 min com 30 U/mL celular-impermeável SOD (PMA + SOD). Cada cor representa dados de dias experimentais diferentes, e cada ponto representa as células de um indivíduo bem. O sinal de nitroxide em um espaço em branco do tempo-combinadas com CMH em KHB foi subtraído de cada sinal para obter valores finais. (D) cálculo do superóxido total e extracelular em PMA estimulou as células; T = total superóxido, CE = superóxido extracelular (sinal de inhibitable SOD). (E) para avaliar o sinal de superóxido intracelular (IC), o sinal no buffer após PMA + SOD foi comparado a PMA-tratados células após a remoção do buffer. Para confirmar, poços foram pré-tratados com 60 U/mL celular-permeável PEG-SOD por 1,5 horas para determinar a SOD intracelular inhibitable. O espaço em branco CMH tempo correspondente é mostrado, e dados refletem o sinal nitroxide absoluta. Dados expressados em média ± SEM. clique aqui para ver uma versão maior desta figura.

Figura 2: deteção de superóxido mitocondrial em RAW células estimuladas com antimycin r. (A) espectros representante do spin EPR específicos mitocondrial de sonda, 0,25 mM mito-ritmo-H em 264.7 pilhas sem (Con) ou com 25 µM antimycin A (AA) para 50 min a 37 ° C. (B) concentração CM. (µM) em células tratadas com AA em relação ao controle. O sinal nitroxide em um tempo de correspondência mito-ritmo-H branco foi subtraído do total de sinal para obter valores finais. Dados expressados em média ± SEM. clique aqui para ver uma versão maior desta figura.

Figura 3: deteção de superóxido em RAW 264.7 cells a 77K. (A) cru 264,7 células estimuladas com 10 µM PMA e sonda de rotação EPR, CMH 0,25 mM (50 min a 37 ° C) com (preto) ou sem pré-tratamento (vermelho) com 30 U/mL SOD. 100 µ l do sobrenadante foi carregado em uma 1 polegada no pedaço de comprimento de tubo de PTFE e, em seguida, flash congelado em nitrogênio líquido. As rolhas foram removidas, e tubo de PTFE congelado foi colocado no dedo dewar para aquisição de dados em 77 foto de K. (B) uma das rolhas e tubo de PTFE. Clique aqui para ver uma versão maior desta figura.

Figura 4: medições de EPR em sangue e LBA de ratos tratados com bleomicina de controle e. Os ratos foram tratados com uma dose única de bleomicina intratraqueal (IT Bleo) (100 µ l a 1 U/mL) ou veículo de PBS. Em 7 dias, os ratos foram anestesiados e sacrificados. Sangue foi coletado através de punção ventrículo direito uma seringa revestido com 1000 heparina USP/mL contendo 100 µM DTPA. Líquido de lavagem broncoalveolar (LBA) foi coletado por lavaging os pulmões com 1 mL de 100 µM DTPA em PBS. Sangue e LBA foram incubados durante 10 ou 50 min, respectivamente, com 0,2 mM CMH a 37 ° C. 150 µ l de sangue ou LBA foi carregado no flash de tubo de PTFE congelado em nitrogênio líquido e EPR de dados coletados em 77 K usando um dedo dewar. Dados mostram nitroxide concentrações no sangue (A) e (B) LBA de PBS e Bleo-tratados com ratos (n = 4-6). Dados expressados como média ± SEM. (C) Representative espectros de nitroxide no sangue de PBS e Bleo-tratados com ratos. Clique aqui para ver uma versão maior desta figura.

Figura 5: medições de EPR no tecido pulmonar congelados flash. Os ratos foram tratados com uma dose única de bleomicina intratraqueal (IT bleo) (100 µ l a 1 U/mL) ou veículo de PBS. Em 7 dias, os pulmões foram lavados com PBS fria para remover sangue e flash congelado em nitrogênio líquido. 5-15 mg de tecido pulmonar congelado foi incubado com 0,2 mM CMH em KHB contendo 100 µM em 200 µ l de volume total para 1 h a 37° C. líquido sobrenadante foi coletado e colocado no tubo de PTFE e executar a 77 K no dedo dewar. (A) Nitroxide concentração (µM de nitroxide normalizada a 1 mg de tecido). Dados representam a média de 2-3 medições para cada pulmão. Dados expressados em média ± espectros representante nitroxide no tecido pulmonar de ratos tratados de PBS e Bleo SEM. (B). Clique aqui para ver uma versão maior desta figura.

Figura 6: medições de EPR no tecido pulmonar preservada no buffer de sacarose. Os ratos foram tratados com uma dose única de bleomicina intratraqueal (100 µ l a 1 U/mL). No pós-tratamento de 7 dias, os pulmões foram liberados com PBS fria para remover sangue e tecido pulmonar fresco foi homogeneizado em tampão Tris-EDTA com 0,25 mM de sacarose em uma relação de volume (mg / µ l) de peso/tampão de pulmão 1:6. 50 µ l de pulmão homogeneizado foi pré-incubada com KHB com ou sem os seguintes inibidores por 20 min a 37 ° c: SOD (100 U/mL), deferoxamina (DFO; 800 µM) e cloreto de diphenyliodonium (DIP; 100 μM), seguido de incubação com 0,2 mM CMH em KHB contendo 100 µM DTPA por 20 min a 37 ° C. Dados foi obtidos no RT usando tubos capilares de EPR. (A) Nitroxide concentração nos pulmões de ratos tratados de PBS e Bleo. (B) Nitroxide concentração nos pulmões Bleo na ausência ou presença de inibidores (n = 3). Dados expressados em média ± SEM. clique aqui para ver uma versão maior desta figura.

Figura 7: medições de EPR no tecido pulmonar de ratos injetados com sonda de rotação CPH. 100 µ l de CPH foi administrado via retroorbital injeção para uma concentração final de 20 mg de CPH por kg de peso corporal. Após 1 h de circulação, os ratos foram sacrificados, os pulmões foram liberados com 10 mL de frio PBS através do ventrículo direito e tecido pulmonar foi congelada. 20 a 30 mg de tecido pulmonar foi colocado na cela de tecido e EPR medições realizadas em RT. (A) os dados expressados em rotações / mg. (B) representante espectros de nitroxide sinal em PBS e Bleo tecidos do pulmão (* indica a sobreposição com ácido ascórbico radical). Dados expressados em média ± SEM. clique aqui para ver uma versão maior desta figura.
| Inibidores da | Espécies |
| Superóxido dismutase (SOD) | Superóxido extracelular |
| Superóxido dismutase – polietilenoglicol (PEG-SOD) | Superóxido intracelular |
| Catalase | Radicais de peróxido de hidrogênio com base |
| Urato | Peroxynitrate |
| Etanol e DMSO | Radical hidroxila |
| Quelantes de metal | Íons metálicos (ferro e cobre) |
Tabela 1. Inibidores comuns usados para distinguir a espécie responsável pela oxidação de sonda de rotação.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
A avaliação da produção de radicais livres em configurações biológicas é importante em redox de compreensão regulamentada a sinalização na saúde e na doença, mas a medida destas espécies é altamente desafiadora devido a meia-vida curta de espécies radicalares e técnica limitações com métodos comumente usados. EPR é uma ferramenta poderosa e valiosa em biologia redox, como é o método somente inequívoco para a detecção de radicais livres. Neste projeto, demonstramos métodos práticos de EPR para projetar experiências e preparação de amostras para detectar ROS usando rotação sondas em diferentes compartimentos celulares in vitro e compartimentos de diferentes tecidos in vivo. Nós também fornecemos métodos práticos para lidar com amostras biológicas e armazenar amostras para melhorar a eficiência.
Sondas de rotação reagem eficientemente com ROS e produzem um nitroxide estável radical que pode ser detectado com EPR. Foram sintetizados vários derivados da sonda girar (hidroxilamina cíclica) com características de permeabilidade diferentes, que os tornam adequados para detectar a produção de radicais livres em diferentes compartimentos celulares10. Este protocolo utilizado a sonda de rotação célula-permeável, CMH; no entanto, o cloreto de 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium rotação impermeable sonda HCl (CAT1H) pode ser usado para detectar superóxido extracelular. Semelhante ao nosso estudo prévio em humanos linfoblasto célula linhas18, fomos capazes de validar o uso da sonda permeável rotação CMH com SOD impermeável e célula permeável PEG-SOD em células RAW264.7 (uma rato pulmão macrófago célula linha) estimuladas com PMA para Diferencie entre superóxido extracelular e intracelular.
Nós também validada a equilibração rápida de CMH entre os compartimentos intra e extra cellular, e nós também achamos que o sinal de superóxido em células gotas significativamente após lavar as células de uma só vez com KHB (dados não mostrados). Confirmamos a utilidade da rotação específica mitocondrial sonda mito-ritmo-H em 264.7 pilhas para medir o aumento superóxido mitocondrial gerado após estimulação com a cadeia de transporte de elétrons mitocondrial inibidor antimycin A. A contribuição específica da produção de superóxido mitocondrial para o mito-ritmo-H foi demonstrada anteriormente e pode ser validada em experimentos usando mitocôndrias isoladas frescas ou sistemas com mitocondrial superóxido dismutase AMBROSONE (SOD2) superexpressão10.
A avaliação do ROS produção na vivo é particularmente desafiadora, mas a capacidade de detectar a produção de ROS específicos fornece informação importante quando interrogar o papel do estresse oxidativo ou redox regulamentada a sinalização no biológico Configurações. A manipulação adequada de tecido quando utilizar spin sondas e EPR é essencial para gerar resultados reprodutíveis e significativos. A utilização de sondas de rotação com tecido não serão radicais superóxido de medida provavelmente presentes no momento da colheita de tecidos devido a uma meia-vida curta, mas em vez disso, ele detecta superóxido produzido por enzimas como oxidase NAPDH, desacopladas endotelial de óxido nítrico sintase , ou xantina oxidase quando o tecido pulmonar ou homogenates são incubados com a sonda de volta a 37 ° C. O uso de tecido congelado não incluirá superóxido gerado pela mitocôndria, desde congelamento atividade de cadeia de transporte de elétrons mitocondrial de danos. Para testar o superóxido mitocondrial, investigadores precisam isoladas mitocôndrias frescas ou uso sondas específicas mitocondrial na vivo ou em tecido fresco.
Vários protocolos diferentes para preservar o tecido têm sido publicados na literatura14,15. Comparamos três métodos publicados para medições de EPR no tecido pulmonar: 1) flash congelamento de tecido em nitrogênio líquido, 2) homogeneização de tecidos no buffer de sacarose e 3) tratamento de ratos na vivo com um giro sonda 1 hora antes da colheita de tecidos. Comparamos o controle de ratos para ratos com inflamação pulmonar severa e estresse oxidativo induzido por bleomicina para testar a capacidade de cada método para mostrar diferenças consistentes em nitroxide sinais nos pulmões feridos. Todos os três métodos mostraram um aumento relativo semelhante em nitroxide sinal nos pulmões de ratos tratados com bleomicina. O uso de flash tecido congelado provavelmente seria a abordagem mais fácil para coletar o tecido para a maioria dos laboratórios, eliminando a necessidade de processar o tecido no buffer de sacarose na época da colheita. A injeção de CPH para capturar radicais livres na vivo é poderosa, mas para confirmar a espécie específica, isto requer um grupo de tratamento, incluindo o antioxidante apropriado.
Um desafio de usar sondas de rotação é que a oxidação de sondas de rotação para nitroxide gera um espectro EPR três linhas semelhante independentemente da espécie responsável pela oxidação; assim, ele não faz distinção entre as diferentes espécies ROS. Além disso, foi relatado que existem potenciais reacções de hidroxilamina sondas com transporte fotossintético de elétrons da cadeia e citocromo c oxidase19,20. Estas observações devem ser consideradas ao interpretar os resultados. Neste protocolo, o sistema fotossintético não está presente, e a inclusão de DTPA com buffer inibe o potencial de contaminação de Íons férricos e cuproso livres10 . Demonstramos como usar uma série de enzimas específicas ou quelantes no tecido pulmonar para estabelecer a contribuição da ROS particular ou inibidores da enzima para determinar a origem de ROS. Esta abordagem tem sido usada anteriormente com EPR para determinar a contribuição da ROS devido eNOS desacoplada13,15. Nós fornecemos uma lista de inibidores comuns usado para distinguir a espécie responsável pela oxidação de sonda de rotação (tabela 1).
Nós também demonstrou a importância de otimizar o tempo de incubação para cada condição experimental. Quando comparando a rotação sondas para girar as armadilhas, armadilhas de rotação geram espectros originais dependendo do reagente que permite a especificidade das espécies de radicais livres; no entanto, eles também apresentam cinética lenta para superóxido spin trapping e são propensos a biodegradação. O tratamento do tecido pulmonar com o EPR sonda ex vivo também é limitado pela incapacidade de distinguir adequadamente extracelular de superóxido intracelular devido o rompimento das membranas celulares durante o processamento do tecido (congelamento ou homogeneização). Uso do giro injetado sonda na vivo em conjunto com SOD ou célula-permeável PEG-SOD pode resolver este problema.
Um objetivo era estabelecer um protocolo para eficientemente coletar amostras e armazená-los a-80 ° C antes de medições de EPR. Portanto, desenvolvemos um método prático para usar tubo de PTFE para segurar as amostras. Este tubo é colocado diretamente no dedo dewar para análise EPR a 77 K sem a necessidade de limpar o dewar entre amostras. Esta é uma alternativa ao método publicado recentemente envolvendo o congelamento das amostras em seringas de 1ml. As medições em amostras congeladas armazenadas em tubos de PTFE podem ser repetidas ao longo de vários dias para demonstrar a estabilidade do sinal. Esta abordagem permite o processamento em lotes as medições de EPR e facilita a transferência das amostras entre laboratórios para que uma instalação remota do EPR possa executar amostras.
Em geral, esses protocolos fornecem uma abordagem simples para a preparação de células e tecidos para medições de EPR em sistemas biológicos. Os protocolos podem ser adaptados a outros modelos associados com estresse oxidativo e com o uso de outras sondas de rotação. O sincronismo e concentração da sonda girar precisará ser ajustada para cada condição experimental. A capacidade de EPR para determinar a presença e a produção de radicais livres espécies inequivocamente fornece rigor para abordagens experimentais no campo da biologia redox.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Este trabalho foi financiado pela escola de medicina do reitor award de infra-estrutura de pesquisa estratégica, R01 HL086680-09 e 1R35HL139726-01, a E.N.G. e UCD CFReT prêmio de fellowship (ele) Universidade do Colorado. Os autores graças a Dr. Sandra Eaton e Dr. Gareth Eaton (Universidade de Denver), Dr. Gerald Rosen e Dr. Joseph P. Kao (Universidade de Maryland) e Dr. Sujatha Venkataraman (Universidade de Colorado Denver) para discussões úteis e Joanne Maltzahn, Ashley Trumpie e Ivy McDermott (Universidade de Colorado Denver) para suporte técnico.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



