Summary
Espectroscopia de resonancia paramagnética (EPR) del electrón es un método inequívoco para medir a los radicales libres. El uso de puntas de prueba de giro selectivo permite la detección de radicales libres en diferentes compartimentos celulares. Se presenta un método práctico y eficiente para recolectar muestras biológicas que facilitan el tratamiento, almacenamiento y transferencia de muestras para mediciones de EPR.
Abstract
La detección precisa y específica de especies reactivas del oxígeno (ROS) en diferentes compartimentos celulares y tejido es esencial para el estudio de la regulación de redox señalización en configuración biológica. Espectroscopia de resonancia paramagnética electrónica (EPR) es el método directo sólo para evaluar inequívocamente los radicales libres. Su ventaja es que detecta los niveles fisiológicos de especies específicas con una alta especificidad, pero que requiere de tecnología especializada, preparación de la muestra cuidado y controles adecuados para asegurar la correcta interpretación de los datos. Sondas de vuelta cíclica hidroxilamina reaccionan selectivamente con superóxido u otros radicales para generar una señal de nitróxido que puede cuantificarse por espectroscopia de EPR. Permeable a la célula spin sondas y puntas de prueba de giro diseñados para acumular rápidamente en la mitocondria permiten la determinación de la concentración de superóxido en diferentes compartimentos celulares.
En cultivos de células, el uso de 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine permeable de la célula (CMH) a lo largo de con y sin pretratamiento de células impermeables de la superóxido dismutasa (SOD) o uso de PEG-SOD permeable a la célula, permite el diferenciación de extracelular de citosólica superóxido. La 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido mitocondrial] piperidinium dicloruro (mito-TEMPO-H) permite la medición de ROS mitocondriales (predominante superóxido).
Puntas de prueba de giro y espectroscopia del EPR pueden aplicarse también a los modelos en vivo . Superóxido puede detectarse en los fluidos extracelulares como la sangre y el líquido alveolar, así como los tejidos como el tejido pulmonar. Se presentan varios métodos para procesar y almacenar el tejido para las mediciones del APE y entregar 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine intravenosa (CPH) spin sonda en vivo. Mientras que las mediciones pueden realizarse a temperatura ambiente, muestras obtenidas de modelos in vitro e in vivo también pueden ser almacenadas a-80 ° C y analizadas por EPR en 77 K. Las muestras pueden almacenarse en el establo de tubería especializada a-80 ° C y corren de 77 K para permitir un práctico, eficiente y el método reproducible que facilita el almacenamiento y transferencia de muestras.
Introduction
Mientras que las medidas de estrés oxidativo y especies reactivas del oxígeno son importantes para el estudio de diversas enfermedades a través de todos los sistemas del órgano, la detección de especies de oxígeno reactivo (ROS) es un reto debido a la corta vida media y alta reactividad. Una técnica de resonancia paramagnética (EPR) del electrón es el método más claro para la detección de radicales libres. Puntas de prueba de giro tienen ventajas sobre las sondas fluorescentes más comúnmente utilizadas. Aunque sondas fluorescentes son relativamente baratas y fáciles de usar y proporcionar una detección rápida, sensible de ROS, tienen serias limitaciones debido a señales artifactual, la incapacidad para calcular concentraciones de ROS y una falta general de especificidad1 .
Para facilitar el uso de EPR para estudios biológicos, una variedad de sondas se han sintetizado de la vuelta que puede medir una gama de especies de radicales libres biológicamente relevantes como pO2, pH y redox indica2,3, 4,5,6,7. Las trampas de la vuelta también se han desarrollado para capturar a los radicales de breve duración y larga vida forma aductos, que facilita la detección por APE8. Ambas clases (sondas de spin y spin trampas) tienen ventajas y limitaciones. Una clase comúnmente usada de puntas de prueba de giro son hydroxylamines cíclicas, EPR-silencioso y reaccionan con los radicales de breve duración para formar un nitróxido estable. Hydroxylamines cíclicos reaccionan con el superóxido 100 veces más rápido que las trampas de la vuelta, permitiéndoles competir con antioxidantes celulares, pero carecen de especificidad y requiere el uso de controles apropiados y los inhibidores para identificar la especie radical o fuente responsable de la señal de nitróxido. Mientras que spin trampas exhiben especificidad, con distintas espectral patrones dependiendo de la especie atrapada, tienen cinética lenta para superóxido spin reventado y son susceptibles a la biodegradación de la radical aductos. Aplicaciones para la captura de vuelta han sido bien documentados en la investigación biomédica9,10,11,12,13.
El objetivo de este proyecto es demostrar métodos prácticos de EPR para el diseño de experimentos y preparación de muestras para detectar superóxido usando puntas de prueba en diferentes compartimentos celulares in vitro y en compartimientos de tejido diferente en vivo. Varios manuscritos han publicado protocolos pertinentes a estos objetivos, usando puntas de prueba de giro objetivo permeable a la célula, célula impermeable y mitocondrial al tejido distintos compartimentos celulares in vitro y proceso para el análisis en modelos de ratón 14 , 15. construir sobre este cuerpo de literatura mediante la validación de un método para medir superóxido usando una sonda de spin 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) en diferentes compartimentos celulares en vitro para asegurar precisa medidas, destacando posibles problemas técnicos que pueden sesgar los resultados. También ofrecemos métodos para realizar mediciones de APE en sangre, lavado broncoalveolar y tejido pulmonar utilizando la punta de prueba de giro CMH. Estos estudios comparan diferentes métodos para procesar los tejidos, así como presentar un método para inyectar otra sonda de spin, CPH, en ratones antes de la cosecha de tejido. Finalmente, desarrollamos un método práctico para almacenar las muestras en tubos de politetrafluoretileno (PTFE) para permitir el almacenamiento y transferencia de muestras antes de las mediciones de EPR a 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Todos los estudios en animales fueron aprobados por la Universidad de Colorado Denver Animal cuidado institucional y Comité de uso.
1. preparación de reactivos
-
Stock de Diethylenetriaminepentaacetic ácido (DTPA) (150 mM)
- Añadir 2,95 g de DTPA (393.35 g/mol) a 10 mL de agua desionizada.
- Para disolver el DTPA, añadir 1 M NaOH gota a gota y a un pH de 7.0.
- Llevar el volumen a 50 mL con agua a una concentración final de DTPA de 150 mM y almacenar a 4 ° C.
-
Solución salina buffer fosfato (PBS) (50 mM, pH 7.4)
- Preparar 5 M de cloruro de sodio (NaCl) (58.44 g/mol; 29,22 g/100 mL).
- Preparar 1 M de potasio Fosfato dibásico HK2PO4 (174.18 g/mol; 17,42 g/100 mL)
- Preparar 1 M de potasio fosfato monobásico KH2PO4 (136,1 g/mol; 13,61 g/100 mL). Mezclar 3 mL de 5 M NaCl con 4,24 de 1 M de fosfato de potasio dibásico y 0,760 mL de potasio de 1 M fosfato monobásico. Compruebe el pH.
- Llevar el volumen a 100 mL con agua desionizada.
- Almacenar a temperatura ambiente (RT) para a corto plazo (días) y a 4 ° C para almacenamiento a largo plazo (semanas).
-
Tampón de Krebs-Henseleit (KHB) que contiene 100 μm DTPA
- En tubo de centrífuga cónico de 50 mL, añadir 33,3 μl de solución stock de 150 m m DTPA.
- Llevar a un volumen de 50 mL con tampón Krebs-Henseleit (KHB).
- Preparación buffer fresca con DTPA cada día y mantener a TA.
-
Tampón Tris-EDTA que contiene sacarosa
- Preparar acciones de Tris de 0,5 M: disolver 15,14 g de Tris base (121.14 g/mol) en 150 mL de agua desionizada. Con ácido clorhídrico, ajustar el pH a 7.8 y llevar a un volumen final de 250 mL.
- Disolver 21,4 g de sacarosa (g/mol 342.29; concentración final = 0.25 mM) en 150 mL de agua desionizada.
- Añadir 5 mL de Tris acción a sacarosa para lograr una concentración final de Tris 10 mM.
- Añada 0,5 mL de caldo de EDTA de 0.5 M de Tris sacarosa para lograr una concentración final de 1 mM.
- Compruebe el pH y ajústelo a 7,4.
- Llevar a un volumen final de 250 mL con agua desionizada y almacenar a 4 ° C.
-
Eritrocito bovino stock de Cu/Zn superóxido dismutasa (SOD) (30.000 U/mL)
- Reconstituir 30.000 U de SOD en 1 mL de PBS (aproximadamente 5,7 mg, dependiendo de la actividad de gran cantidad SOD).
- Mezcla bien, alícuota y almacenar a-20 ° C a corto plazo (6-12 meses) y a-80 ° C para almacenamiento a largo plazo.
-
Solución de trabajo de SOD (1000 U/mL)
- Transferir una alícuota de 30 μl de 30.000 acciones de césped U/mL en un 870 μl de PBS estéril.
- Mantener la solución en el hielo y usar fresco.
-
Stock de forbol 12-miristato 13-acetato (PMA) (5 mM)
- Disolver 1 mg de PMA (616.83 g/mol) en 325 μl de DMSO (concentración final = 5 mM).
- Parte alícuota de una solución de 5 mM PMA y almacenar a-20 ° C.
-
Solución de trabajo PMA (125 μm)
- Diluir una alícuota de 10 μl del stock PMA de 5 mM en 390 μl de PBS estéril.
- Mantener la solución en el hielo y usar fresco.
- Para un control de vehículos de PMA, utilice 10 μl de DMSO en 390 μl de PBS.
-
Cloruro de Diphenyliodonium (DIP) (2,5 mM)
- Disolver 3,2 mg de inmersión (316.57 g/mol) en 4 mL para obtener un stock de 2, 5 mM.
- Preparar la solución y utilizarla fresca.
-
Sal de mesilato de deferoxamina (DFO) (20 mM)
- Disolver 4,5 mg de DFO (656,79 g / mol) en 340 μL para obtener un stock de 20 mM.
- Preparar la solución y utilizarla fresca.
-
Preparación de antimicina stock A (AA) (5 mM)
- Disolver 5,4 mg de AA (532 g/mol) en 2 mL de etanol (concentración final = 5 mM).
- Alícuota del material en frascos de cristal y almacenar a-20 ° C.
-
Preparación de puntas de prueba de giro
- La burbuja 50 mM fosfato buffer que contiene 100 μm DTPA con nitrógeno durante 30 min para eliminar el oxígeno disuelto de la solución tampón.
- Retire la sonda de spin del congelador de-20 ° C y deje el recipiente a RT (10-15 min).
- Pesar 2,4 mg de 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· Ácido clorhídrico (CMH) (237.8 g/mol)
- CMH se disuelven en 1 mL del buffer fosfato sin oxígeno para una concentración final de 10 mM.
- Pesar 5 mg de dicloruro de 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium (mito-TEMPO-H) (529.1 g/mol).
- Mito-TEMPO-H se disuelven en 1 mL del buffer fosfato desoxigenada hasta una concentración final de 9,5 mM.
- Pesar 4,9 mg de 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· Ácido clorhídrico (CPH) (223.7 g/mol).
- CPH se disuelven en 1 mL del buffer fosfato sin oxígeno para una concentración final de 22 mM.
- Alícuota y conservar a-80 ° C (congelación y descongelación no se recomienda).
2. detección de superóxido en vitro
-
Detección de superóxido intracelular, extracelular y total en estimulada por PMA RAW 264.7 células en RT
- Siguiendo una técnica aséptica adecuada, descongelar las células RAW 264.7 y paso en medio DMEM suplementado con 10% FBS (libre de endotoxinas bajo) y 1% antimicótico/ampicilina a 37 ° C en incubadora de CO2 .
- Las células RAW 264.7 de semilla en 1 x 106 células/pozo en placas de 6 pocillos un día antes del tratamiento.
- Suavemente Retire media y lavar las células una vez con 1 mL de tampón KHB.
- Añadir KHB conteniendo 100 μm DTPA a cada pocillo y tratar en un volumen total de 500 μl con los siguientes:
- Para pocillos pretratados con el césped, añadir 15 μL/pocillo de solución de trabajo de SOD (1000 U/mL, concentración final de SOD = 30 U/mL) e incubar 10 min a 37 ° C antes de la adición de CMH y PMA.
- Añadir 12.5 μL/pocillo de la acción CMH de 10 mM (concentración final = 0.25 mM).
- Agregar 40 μL/pocillo de solución de trabajo de PMA de 125 μm (concentración final = 10 μm) o 40 μl (stock 10 μl de DMSO en 390 μl de PBS).
- Incubar durante 50 min a 37 ° C en un incubador de CO2 .
- Retire las placas de la incubadora y coloque inmediatamente en hielo.
- Recoger el buffer de cada pozo en separado, 1.5 mL, etiquetado tubos. Mantener el hielo a lo largo.
- Añadir 100 μl de buffer KHB fresco que contiene 100 μm DTPA, suavemente raspar las células y resuspender mediante pipeteo arriba y abajo varias veces. Mantener el hielo a lo largo de resuspensión de células.
- Carga la muestra recogida en los pasos 2.1.10 y 2.1.11 (50 μL) en cada uno de los tubos capilares. Selle ambos extremos y ejecute el EPR.
Nota: Siempre probar un tubo o bien (sin células) que contiene la sonda en solución tampón (misma concentración = 0.25 mM), tratada bajo las mismas condiciones que las células (mismo tiempo de incubación y temperatura) como control, ya que es la intensidad de fondo de la sonda de temperatura - y dependiente del tiempo. - Establecer los parámetros de adquisición de EPR a lo siguiente: frecuencia de microondas = 9,65 GHz; campo de centro = 3432 G; amplitud de modulación = 2.0 G; anchura de barrido = 80 G; potencia de microondas = 19,9 mW; número total de exploraciones = 10; tiempo de barrido = 12.11 s; y constante de tiempo = 20,48 ms.
-
Detección de superóxido mitocondrial en células RAW 264.7
- Siga los pasos 2.1.1 y 2.1.2 células RAW 264.7 de semilla un día antes del experimento.
- Los medios de quitar y lavar las células una vez con 1 mL de tampón KHB.
- Añadir 200 μL de KHB conteniendo 100 μm DTPA a cada pocillo.
- Añadir 5.3 μL/pocillo de stock de mito-TEMPO-H 9.5m m (concentración final = 0.25 mM)
- Incubar por 10 min a TA.
- Añadir 1 μL/pocillo de antimicina A (AA), solución madre 5 mM en etanol (concentración final = 25 μm).
- Incubar durante 50 min a 37 ° C en un incubador de CO2 .
- Retire las placas de la incubadora y coloque inmediatamente en hielo.
- Suavemente raspar las células y resuspender mediante pipeteo arriba y abajo. Mantener en hielo.
- Cargar la muestra en un tubo capilar. Selle ambos extremos.
- Consulte la sección anterior para el valor de APE.
-
Detección de superóxido en las células RAW 264.7 en 77 K
- Colocar el tampón recogido en el paso 1.1.10 preparado PTFE tubo 1-2 pulgadas de largo (3/16" OD x 1/8" ID). Asegúrese de que la tubería de PTFE es recta por lo que puede ser fácilmente insertado y removido del dedo dewar. Use un tapón de caucho para cerrar un extremo de la tubería de PTFE, pipetear el tampón o la suspensión de la célula (100 a 150 μL) en el tubo de PTFE y sellar el tubo con un tapón de segunda.
- Flash congelar la muestra en nitrógeno líquido. La muestra se transfirió a un tubo etiquetado criopreservación para almacenamiento a-80 ° C o ejecutar inmediatamente.
- Llenar el dedo dewar con nitrógeno líquido y coloque la tubería de PTFE que contiene la muestra en el dedo dewar. Asegúrese de que la muestra está centrada en el espacio activo del resonador y ejecutar EPR a 77 K.
Nota: Iniciar el flujo de gas nitrógeno a su espectrómetro de 15-30 min antes de las mediciones y continuar este flujo a lo largo de las medidas para evitar la condensación de agua en el resonador. - Definir los parámetros de adquisición de EPR a lo siguiente: frecuencia de microondas = 9,65 GHz; campo de centro = 3438 G; amplitud de modulación = 4,0 G; anchura de barrido = 150 G; potencia de microondas = 0.316 mW; número total de exploraciones = 10; tiempo de barrido = 60 s; y constante de tiempo = 1,28 ms.
3. EPR mediciones en líquidos
-
Sangre entera
- Tratamiento de ratones (8-12 semanas) con una sola dosis de bleomicina intratraqueal (Bleo; 100 μL en 1 U/mL) disuelta en PBS o PBS solo como se describió anteriormente16,17.
- Eutanasia a ratones mediante la administración de isoflurano inhalado (1.5-4%) seguido de exsanguinación y la dislocación cervical. Aspirar sangre a través del ventrículo derecho en una jeringa con heparina (1000 USP/mL) conteniendo 100 μm DTPA y transfiéralo a un tubo de 1,5 mL.
- En un tubo separado 1,5 mL, añadir 15 μl de PBS con DTPA de 100 μm y 3 μl de CMH (10 mM) a 132 μl de sangre para un volumen total de 150 μL y concentración final de CMH de 0,2 mM.
- Incubar sangre 10 min a 37 ° C en un baño de agua.
- Retirar los tubos del baño de agua.
- Tomar una alícuota por la carga de sangre en un tubo capilar y corren EPR RT con los siguientes parámetros de adquisición de EPR: frecuencia de microondas = 9,65 GHz; campo de centro = 3432 G; amplitud de modulación = 1,0 G; anchura de barrido = 80 G; potencia de microondas = 19,9 mW; número total de exploraciones = 3; tiempo de barrido = 12.11 s; y constante de tiempo = 20.48 Sra. alternativamente, las muestras pueden ser flash congelado como se describe en el paso 2.3 para las mediciones de parámetros de adquisición de 77 K. EPR son los siguientes: frecuencia de microondas = 9,65 GHz; campo de centro = 3438 G; amplitud de modulación = 4,0 G; anchura de barrido = 150 G; potencia de microondas = 0.316 mW; número total de análisis = 2; tiempo de barrido = 60 s; y constante de tiempo = 1,28 ms.
-
Lavado broncoalveolar (BALF)
- Después de la eutanasia (ver paso 3.1.2), recoger BALF por infundir lentamente y retirar 1 mL de PBS con 100 μm DTPA tres veces en una jeringa a través de una cánula colocada en la tráquea.
- En un tubo de 1,5 mL, tratar 200 μL de BALF con 4 μL de CMH (10 mM) para obtener una concentración final de 0,2 mM.
- Incubar BALF durante 50 min a 37 ° C en un baño de agua.
- Tome los tubos en el baño de agua y coloque en hielo.
- Carga BALF en un tubo capilar y EPR funcionamiento a temperatura ambiente con la misma configuración de EPR en paso 1.1.13 o flash congelar en nitrógeno líquido como se describe en el paso 2.3.
-
Medición de APE en sangre BALF en 77 K
- Seguir el protocolo para recoger la sangre (pasos 3.1.1. a 3.1.4) y BALF (pasos 3.2.1 a 3.2.4).
- Lugar 150 μL de sangre tratada o BALF en PTFE (1-2 in) de la tubería. Use un tapón de caucho para cerrar un extremo de la tubería de PTFE antes de añadir la muestra y otro tapón para sellar el tubo.
- Flash congelar la muestra en nitrógeno líquido.
- Ver punto 2.3 para detalles sobre la ejecución de EPR en muestras congeladas en tubería de PTFE con el dedo que Dewar en 77 K. funcionamiento congelados CMH había tratado muestras de sangre con en una semana.
4. EPR medidas en tejido pulmonar
-
Flash tejido pulmonar congelados
- Después de recoger el BALF en paso 3.2.1, se abre el pecho y pulmones enjuagarse con 10 mL de PBS frío a través del ventrículo derecho para quitar la sangre. Flash congelar el tejido pulmonar en nitrógeno líquido. Tejido pulmonar congelados puede almacenarse a-80 ° C hasta 6 meses hasta su uso para la medición de APE.
- Estabilizar el tejido pulmonar en hielo seco con unas pinzas y corte varios trozos pequeños (5-15 mg) de tejido pulmonar con un solo filo.
- Pese el tejido en un tubo de 1,5 mL, coloque el tubo en la balanza y Tarar la balanza, entonces añadir las piezas de tejido y registrar el peso.
- A los tejidos en el tubo de 1,5 mL, añadir 196 μl de KHB conteniendo DTPA y 4 μL de CMH (0,2 mM) para lograr un volumen total de 200 μl.
- Incubar durante 1 h a 37 ° C en un baño de agua.
- Desactivación (durante unos segundos) en una microcentrífuga a 3.884 x g.
- Coloque en hielo y Pipetear 150 μL del sobrenadante en el tubo de PTFE y congele para las mediciones de 77 K, como se describe en la sección 2.3.
Nota: Para este método, debe considerarse la heterogeneidad de la lesión. Por una lesión pulmonar inducida por bleomicina, dado que es una lesión altamente heterogénea, se recomienda cortar varias piezas de tejido de diferentes partes del pulmón de cada ratón. Alternativamente, un pedazo más grande de tejido puede ser homogeneizado en tampón KHB que contiene 100 μm DTPA con una relación peso a volumen de 1:6 (mg/μL) como se describe a continuación.
-
Tejido pulmonar fresco conservado en tampón de sacarosa
- Limpie los pulmones lavaged con PBS frío para extraer sangre como hecho en el paso 3.1.2.
- Homogeneizar el tejido pulmonar fresco en tampón Tris-EDTA que contiene sacarosa de 0,25 M con una relación de 1:6 pulmón tampón (mg/μL) Dounce tejido molinillo con un vaso o mortero PTFE.
- Añadir 50 μl del homogeneizado de pulmón a 450 μl de KHB conteniendo 100 μm DTPA.
- En un tubo de 1.5 mL (en un volumen total de 100 μL), a 98 μl de homogenado de pulmón en KHB, añadir 2 μl de CMH de stock de 10 mM para obtener una concentración final de 0,2 mM.
- Incubar por 20 min 37 ° C en un baño de agua.
- Coloque las muestras en hielo y cargarlos en un tubo capilar. Ejecute el EPR en RT (ajustes de utilizado en paso 2.1.13).
- Para comprobar la contribución de fuentes utilizando diferentes inhibidores y especie específica, tratamiento previo 88 μl de homogenado de pulmón +-inhibidor, ajustar con KHB para alcanzar un volumen final de 98 μl. En este experimento, los inhibidores incluyen 10 μl de SOD (100 U/mL), 4 μL de deferoxamina (DFO; concentración final = 800 μm), o 4 μL de cloruro de diphenyliodonium (DIP; concentración final = 100 μm). Incubar por 20 min a 37 ° C en un baño de agua.
- Añadir 2 μl de CMH e incubar durante otros 20 minutos a 37 ° C, seguido por medidas de EPR como se describió anteriormente. Incluyen una única muestra en blanco emparejada con CMH KHB con tampón de sacarosa. Como alternativa, guardar alícuotas de los homogenados de pulmón restante (paso 3.1.2) a-80 ° C para futuras mediciones.
Nota: El volumen total puede adaptarse según sea necesario.
-
Mediciones de EPR en tejido pulmonar de los ratones inyectados con spin sondas en vivo (a temperatura ambiente utilizando células de tejido)
- Preparar solución stock CPH disolviendo 4,9 mg de CPH en 1 mL de filtrado y desoxigenada 50 mM de tampón fosfato.
- Anestesiar ratones con isoflurano inhalado (1.5-4%) durante 20-30 segundos hasta que no responde al dedo del pie sujetador. Inyectar 100 μl de la sonda de spin CPH para un peso de 25 g ratón ruta de ratones vía retroorbital (dosis final = 20 mg/kg) y permitir que la sonda se circule durante 1 h. inmediatamente después de la inyección de retroorbital, añadir una gota de 0.5% proparacaine HCl en el área del ojo para preve sequedad y dolor en los ojos NT. Ratones por 1 h de monitor y proceda a tejidos.
- Cosechar el tejido pulmonar como se describió anteriormente y la congelación de flash los pulmones.
- Cortar 20-30 mg de tejido congelado en hielo seco y registrar el peso exacto.
- Limpie suavemente el tejido con paños para absorber cualquier agua superficial.
- Coloque el tejido dentro de la ventana de la célula de tejido (un accesorio permite realizar mediciones de EPR para muestras de tejido) y ejecute el EPR para determinar el total de giros. Los datos se pueden expresar como total giros por mg de tejido.
5. Análisis de datos
- Simulación de los espectros EPR con SpinFit módulo incorporado en el software de xenón del espectrómetro EPR EMXnano de mesa. Determinar la concentración de nitróxido por el módulo de SpinCount. Alternativamente, puede realizarse una curva de calibración de un nitróxido estable como TEMPOL 4-hidroxi-TEMPO y la concentración puede obtenerse comparando la intensidad de la señal con la muestra y el patrón.
- Para los datos recogidos a 77 K, utilizar doble integración seguida por SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Detección de superóxido con CMH fue validada utilizando la X / superóxido XO genera el sistema para demostrar que la señal nitróxido (CM.) fue completamente inhibida por césped, mientras que la catalasa no tuvo ningún efecto (figura 1A). El superóxido extracelular, total luego fue evaluado en células RAW 264.7 células de incubación con la sonda de spin CMH permeable a la célula +-pretratamiento de SOD. Se midió la concentración de nitróxido en la suspensión celular y el buffer, el cual demostró que los valores de los dos tipos de muestra fueron similares debido a la naturaleza permeable y equilibrado rápido de la sonda de spin (figura 1B). La señal radical nitróxido aumentó en células RAW 264.7 estimuladas con PMA en comparación con las células del control. Esta señal se atenúa significativamente en las células pretratadas con SOD celular impermeable (figura 1). Cada color representa pozos probados en diferentes días, demostrando la consistencia de los datos recolectados en días específicos y reproducibilidad de los resultados a través del tiempo. La concentración de superóxido extracelular se determinó restando la señal en células PMA pretratados con el césped de la señal después de PMA en ausencia de SOD (T). La señal restante fue atribuida a superóxido intracelular (figura 1). Figura 1 ilustra el cálculo del total y extracelular superóxido. (E) la señal intracelular fue confirmada en células tratadas con PMA después de la eliminación de los medios de comunicación y por el efecto del PEG-SOD en la señal. En este gráfico, en contraste con (C), el espacio en blanco CMH no se restó de las mediciones y muestran los datos en bruto.
Superóxido mitocondrial en células RAW 264.7 fue detectada usando el EPR spin sonda mito-TEMPO-H, que se acumula en, mitocondria. (A) espectros de EPR representante de la señal de mito-TEMPO-H de línea de base en tampón, el creciente mito-TEMPO-H de la señal en las células control (Con) y la señal mejorada aún más en las células estimuladas con el inhibidor mitocondrial antimicina A (AA). El aumento de la señal fue atribuido a la superóxido mitocondrial basado en nuestro estudio anterior mostrando esa sobreexpresión de SOD2 medidas significativamente atenuadas con mito-TEMPO-H10. En la figura 2B, se determinó la concentración mitocondrial nitróxido restando la señal del mito-TEMPO-H en buffer de tiempo comparable de las mediciones de la célula. La señal de CM. obtenida a bajas temperaturas en células RAW 264.7 tras estimulación con PMA en presencia y ausencia de césped. (Figura 3A) La señal de CM. se atenúa en presencia de la SOD, consistente con los datos de temperatura (figura 1). Figura 3B muestra la fotografía de la tubería de PTFE con los tapones utilizados para recopilar datos en 77 K para las células y muestras en vivo . Producción de superóxido se detectó en la sangre y BALF usando la punta de prueba de giro CMH. Sangre o BALF muestras fueron colectadas de los ratones tratados con PBS y Bleo y se incubaron inmediatamente con CMH. Las muestras se transfirieron a la tubería de PTFE y el flash congelado, y recogieron datos EPR a 77 K. La concentración de nitróxido (CM.) acumulado en la sangre que se incubó con CMH (0,2 mM) a 37 grados durante 10 minutos (Figura 4A). Nitróxido (CM.) concentración de BALF incuba durante 50 min (Figura 4B). Nitróxido concentración representa la concentración de (CM.) acumulada en el volumen de sangre o BALF utilizados en el experimento.
Tres métodos han sido probados para evaluar diversas técnicas publicadas para la preservación de tejidos y la administración de vuelta las puntas de prueba ex vivo vs. en vivo. Para realizar mediciones de EPR en tejido pulmonar, primero había utilizado flash pulmón congelado tejido de control o lesionado de ratones. Figura 5A muestra el total de la señal CM. en el sobrenadante de un pedazo pequeño de tejido pulmonar que se incubó a 37 ° C con CMH en los ratones tratados con PBS y Bleo, respectivamente. Debido a la heterogeneidad de la lesión de pulmón después del tratamiento de Bleo, es aconsejable cortar las piezas de diferentes regiones del pulmón y el promedio de varias mediciones para proporcionar un valor más representativo. Alternativamente, uno puede homogeneizar el pulmón entero y utilizar una muestra de este homogeneizado. Los datos recogidos en 77 K usando tubería de PTFE y dewar de los dedos. Figura 5B muestra representativos espectros de señales nitróxido (CM.) de los ratones tratados con PBS y Bleo, respectivamente.
Una limitación para el tratamiento de tejido pulmonar ex vivo es que no es posible distinguir confiablemente extracelular de superóxido intracelular debido a la transformación del tejido que altera las membranas celulares. Si esta información es importante para la cuestión experimental, puede ser abordado por el método en vivo CPH instilación que se describe a continuación. Tejido congelado no puede utilizarse para evaluar superóxido mitocondrial; sin embargo, para esta medida, el protocolo puede adaptarse con mito-TEMPO-H en el tejido o las mitocondrias recién aisladas.
Como un segundo método para la medición del APE en tejido pulmonar, tejido fresco se homogeneizó en tampón de sacarosa. El homogeneizado de pulmón se incubó con sonda CMH en búfer KHB que contienen DTPA. Medidas del EPR fueron llevadas hacia fuera en RT. figura 6A muestra el incremento en CM. con Bleo. Presentamos una prueba adicional usando los diferentes inhibidores que pueden utilizarse para determinar las especies que contribuyen a la CM. señal. Para aclarar el origen de la señal de CM. generado a partir de tejido pulmonar, nos pretratada los homogenados del pulmón con varias aves carroñeras y los inhibidores de enzimas. Homogenados del pulmón se incubaron con CMH en la ausencia o la presencia de cloruro de SOD, deferoxamina (DFO) y diphenyliodonium (DIP) para tener en cuenta las contribuciones de superóxido, hierro o superóxido generado (respectivamente) de flavin-que contiene enzimas (Figura 6B). Este enfoque puede ser adaptado para evaluar la especie radical generada en un sistema o dilucidar la contribución de otras fuentes enzimáticas (e.g., NOX, eNOS o xantina oxidasa).
Ratones fueron inyectados con CPH spin sondas (20 mg/kg) vía la ruta retroorbital para realizar mediciones de EPR en vivo. Se desconoce si CMH puede ser con seguridad administrada a los animales, mientras que la sonda CPH se ha divulgado para ser no tóxico; así, seleccionamos CPH para los experimentos en vivo . Tejidos pulmonares fueron cosechadas y flash congelados en nitrógeno líquido 1 h después de la circulación de las sondas CPH. Ratones pueden tratarse simultáneamente con antioxidantes específicos para diferenciar la especie responsable de la señal. La Figura 7A muestra la mayor CP. señal en ratones tratados con Bleo en comparación con ratones control. Espectros representativos del tejido pulmonar de los ratones tratados con Bleo y control se muestran en la figura 7B. Un mixto espectros EPR de CP. y radical de ácido ascórbico. Los valores reportados en la Figura 7A son las concentraciones de CP. componentes. Datos se obtuvieron a temperatura ambiente con la célula del tejido.
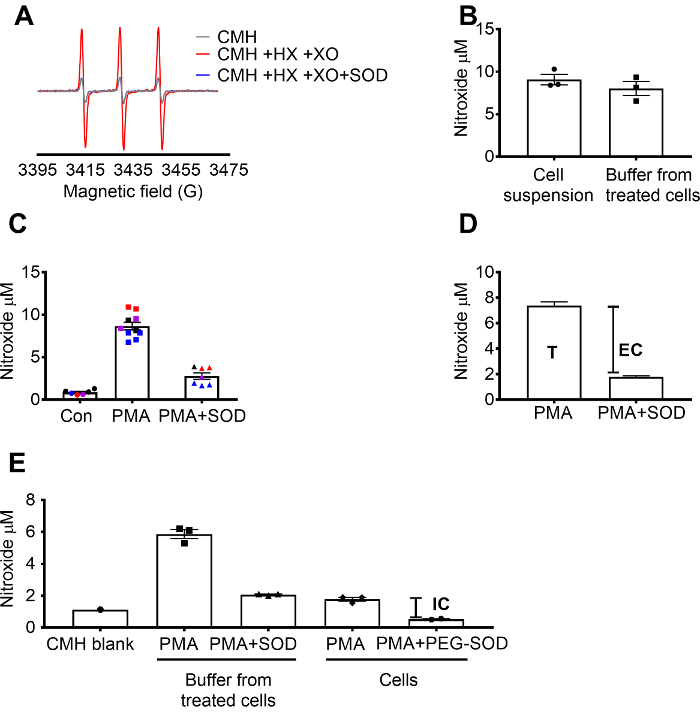
Figura 1: detección de superóxido en compartimentos celulares diferentes. (A) espectros EPR generados por 0.25 mM CMH en hipoxantina/xantina oxidasa 0,5 mM (8 mU/mL) con y sin SOD (30 U/mL). (B) primas 264.7 células (1 x 106 células/pocillo) fueron estimuladas con el μm 10 PMA en presencia de CMH por 50 min a 37 ° C y nitróxido concentración (μm) en suspensión de células (células + buffer) y tampón de células tratadas. (C) primas 264,7 células fueron estimuladas con PMA vs. control del vehículo (Con). Un conjunto de células fueron pretratados durante 10 min con 30 U/mL células impermeables SOD (PMA + SOD). Cada color representa datos de diferentes días experimentales y cada punto representa las células de un individuo bien. La señal de nitróxido en un espacio de tiempo-emparejado con CMH en KHB se restó de cada señal para obtener los valores finales. (D) cálculo del total y extracelular superóxido en PMA estimula las células; T = total superóxido, CE = superóxido extracelular (señal inhibitable SOD). (E) para evaluar la señal de superóxido intracelular (IC), la señal de búfer después de PMA + SOD se comparó con células tratadas con PMA después del retiro de búfer. Para confirmar, los pozos fueron pretratados con 60 U/mL permeable a la célula PEG-SOD durante 1,5 horas para determinar la SOD intracelular inhibitable. Se muestra el renglón CMH emparejado de tiempo y datos reflejan nitróxido absoluta señal. Datos expresados como media ± SEM. haga clic aquí para ver una versión más grande de esta figura.

Figura 2: detección de superóxido mitocondrial en células RAW estimuladas con antimicina A. (A) espectros representantes de la vuelta EPR mitocondrial específico sonda, 0.25 m m mito-TEMPO-H en células RAW 264.7 sin (Con) o con 25 μm antimicina A (AA) durante 50 minutos a 37 ° C. (B) concentración CM. (μm) en células tratadas con AA en comparación con el control. La señal de nitróxido en un mismo tiempo mito-TEMPO-H blanco se restó del total de la señal para obtener los valores finales. Datos expresados como media ± SEM. haga clic aquí para ver una versión más grande de esta figura.

Figura 3: detección de superóxido en RAW 264.7 células en 77K. (A) RAW 264,7 las células estimuladas con 10 μm PMA y la sonda de spin EPR, CMH 0.25 mM (50 min a 37 ° C) (negro) o sin tratamiento previo (rojo) con 30 U/mL de sodio. 100 μl del sobrenadante fue cargado en una 1-pulgada en pieza de longitud de tubería de PTFE, entonces flash congelado en nitrógeno líquido. Los tapones se retiraron y congeladora tubería de PTFE se colocó en el dedo dewar para adquisición de datos en foto K. (B) A 77 de PTFE tubos y tapones. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: medición de APE en sangre BALF de control y los ratones tratados con bleomicina y. Ratones fueron tratados con una sola dosis de bleomicina intratraqueal (IT Bleo) (100 μL en 1 U/mL) o vehículo de PBS. En 7 días, los ratones fueron anestesiados y sacrificados. Sangre era recogida mediante punción ventricular derecha en una jeringa con 1000 heparina USP/mL que contienen 100 μm DTPA. Lavado broncoalveolar (BALF) fue recogido por doble-lumen los pulmones con 1 mL de 100 μm de DTPA en PBS. Sangre y BALF se incubaron por 10 o 50 min, respectivamente, con 0,2 mM CMH a 37 ° C. 150 μL de sangre o BALF era cargado en flash de tubo PTFE congelado en nitrógeno líquido y datos EPR en 77 K con un dedo dewar. Datos muestran nitróxido concentraciones en sangre (A) y (B) BALF de ratones tratados con PBS y Bleo (n = 4-6). Datos expresados como promedio ± SEM. (C) Representative espectros de nitróxido en sangre de ratones tratados con PBS y Bleo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: mediciones de EPR en tejido pulmonar congelados flash. Ratones fueron tratados con una sola dosis de bleomicina intratraqueal (IT bleo) (100 μL en 1 U/mL) o vehículo de PBS. En 7 días, los pulmones se lava con PBS frío para eliminar sangre y flash congelado en nitrógeno líquido. 5-15 mg de tejido pulmonar flash-congeladas fue incubada con 0,2 mM CMH en KHB conteniendo 100 μm en 200 μL de volumen total por 1 h a 37° C. sobrenadante fue recogido y colocado en la tubería de PTFE y correr a 77 K en el dedo dewar. (A) nitróxido concentración (μm de nitróxido normalizada a 1 mg de tejido). Los datos representan el promedio de 2-3 mediciones para cada pulmón. Datos expresados como promedio ± espectros representativos SEM. (B) de nitróxido en tejido pulmonar de los ratones tratados con PBS y Bleo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: mediciones de EPR en tejido pulmonar conservado en buffer sucrosa. Ratones fueron tratados con una sola dosis de bleomicina intratraqueal (100 μL en 1 U/mL). Tratamiento después de 7 días, los pulmones se lava con PBS frío para eliminar sangre y tejido pulmonar fresco se homogeneizó en tampón Tris-EDTA que contiene sucrosa 0.25 m m en una proporción de 1:6 pulmón tampón peso volumen (mg/μL). 50 μl de homogenado de pulmón se incuba con KHB con o sin los siguientes inhibidores por 20 min a 37 ° C: SOD (100 U/mL), deferoxamina (DFO; 800 μm) y cloruro de diphenyliodonium (DIP; 100 μM) seguido por la incubación con 0,2 mM CMH en KHB conteniendo 100 μm DTPA por 20 min a 37 ° C. Se obtuvieron datos en RT utilizando tubos capilares de EPR. (A) nitróxido concentración en pulmones de ratones tratados con PBS y Bleo. (B) nitróxido concentración en Bleo pulmones en la ausencia o la presencia de inhibidores (n = 3). Datos expresados como media ± SEM. haga clic aquí para ver una versión más grande de esta figura.

Figura 7: mediciones de EPR en tejido pulmonar de los ratones inyectados con la punta de prueba de giro CPH. 100 μl de CPH fue administrado vía retroorbital inyección hasta una concentración final de 20 mg de CPH por kg de peso corporal. Después de 1 h de la circulación, ratones fueron sacrificados, los pulmones se lava con 10 mL de frío PBS a través del ventrículo derecho y tejido pulmonar fue flash congelados. 20 a 30 mg de tejido pulmonar se colocó en la célula del tejido y EPR mediciones en RT. (A) datos expresados como giros mg. espectros (B) representación de nitróxido señal en tejidos pulmonares de PBS y Bleo (* indica la superposición con el radical del ácido ascórbico). Datos expresados como media ± SEM. haga clic aquí para ver una versión más grande de esta figura.
| Inhibidores de la | Especies |
| Superóxido dismutasa (SOD) | Superóxido extracelular |
| Superóxido dismutasa – polietilenglicol (PEG-SOD) | Superóxido intracelular |
| Catalasa | Radicales de peróxido de hidrógeno basado |
| Ácido úrico | Peroxinitrato |
| Etanol y DMSO | Radical hidroxilo |
| Quelantes de metal | Iones metálicos (hierro y cobre) |
Tabla 1. Inhibidores comunes utilizados para distinguir especies responsables de la oxidación de sonda de spin.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La evaluación de la producción de radicales libres en entornos biológicos es importante en redox entendimiento reglamentado en salud y la enfermedad, pero la medida de estas especies es muy difícil debido a la corta vida media de las especies de radicales libres y técnicas limitaciones de los métodos comúnmente utilizados. EPR es una herramienta valiosa y poderosa en biología redox, ya que es el método sólo inequívoco para detectar radicales libres. En este proyecto demostramos métodos prácticos de EPR para diseñar experimentos y preparación de muestras para detectar ROS usando las sondas en diferentes compartimentos celulares en vitro y tejido diferentes compartimentos en vivo. También ofrecemos métodos prácticos para manejar las muestras biológicas y almacenar muestras para mejorar la eficiencia.
Puntas de prueba de giro reaccionan eficientemente con ROS y producen un radical de nitróxido estable que puede ser detectada con el EPR. Se han sintetizado varios derivados de la sonda de spin (hidroxilamina cíclico) con las características de permeabilidad diferentes, que hacen conveniente para detectar la producción de radicales libres en diferentes compartimentos celulares10. Este protocolo utiliza la sonda de spin permeable a la célula, CMH; sin embargo, el cloruro de la 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium de la sonda impermeable spin HCl (CAT1H) puede utilizarse para detectar superóxido extracelular. Similar a nuestro estudio previo en linfoblasto humano célula líneas18, hemos sido capaces de validar el uso de la sonda de spin CMH permeable con sintetico impermeable y permeable al PEG-SOD en 264.7 células (un ratón pulmón macrófago célula línea) estimuladas con PMA a la célula diferenciar entre superóxido extracelular e intracelular.
También validamos el rápido equilibrio de CMH entre los compartimientos intra y extra cellular, y también se encontró que la señal de superóxido en las células gotas significativamente tras lavar las células de una sola vez con KHB (datos no mostrados). Se confirmó la utilidad del giro específico mitocondrial sonda mito-TEMPO-H en células RAW 264.7 para medir el aumento superóxido mitocondrial generada sobre el estímulo con la cadena de transporte de electrones mitocondrial inhibidor antimicina A. La contribución específica de la producción de superóxido mitocondrial a la mito-TEMPO-H ha sido previamente demostrada y puede ser validada en experimentos con mitocondrias frescas aisladas o sistemas, dismutasa del superóxido mitocondrial MnSOD (SOD2) sobreexpresión de10.
La evaluación de la producción de ROS en vivo es particularmente desafiante, pero la capacidad para detectar la producción de ROS específico proporciona información importante al cuestionar el papel del estrés oxidativo o redox regulados señalización biológica Configuración. El manejo adecuado del tejido cuando usando sondas y EPR es esencial para generar resultados reproducibles y significativos. El uso de puntas de prueba de giro con el tejido no será radicales superóxido de probable medida presentan en el momento de la cosecha de tejido debido a una corta vida media, pero en cambio detecta superóxido producido por enzimas como la oxidasa NAPDH, desacoplado óxido nítrico sintasa endotelial , o xantina oxidasa al tejido pulmonar u homogenados se incuban con la sonda de spin a 37 ° C. El uso de tejido congelado no incluirá superóxido generado por las mitocondrias, desde actividad de cadena de transporte de electrones mitocondrial de daños heladas. Para probar el superóxido mitocondrial, los investigadores necesitan aisladas mitocondrias frescas o uso sondas específicas mitocondrial en vivo o en tejido fresco.
Varios protocolos diferentes para preservar el tejido han sido publicados en la literatura14,15. Se compararon tres métodos publicados para la medición del APE en tejido pulmonar: 1) flash congelación tejido en nitrógeno líquido, 2) Homogeneizar tejidos en buffer sucrosa y 3) tratamiento de ratones en vivo con una vuelta probe 1 hora antes de la cosecha de tejido. Nos en comparación con ratones control a ratones con inflamación pulmonar severa y estrés oxidativo inducido por bleomicina para probar la capacidad de cada método de diferencias consistentes en señales nitróxido en pulmones lesionados. Los tres métodos mostraron un incremento relativo similar en señal de nitróxido en los pulmones de los ratones tratados con bleomicina. El uso de tejido congelado flash sería probablemente el enfoque más fácil para recoger tejidos de más laboratorios, negando la necesidad de procesamiento del tejido en el búfer de sacarosa en la época de recolección. La inyección de CPH para capturar los radicales libres en vivo es potente, pero para confirmar la especie, esto requiere de un grupo de tratamiento incluyendo el antioxidante adecuado.
Uno de los desafíos de la utilización de puntas de prueba de giro es que la oxidación de spin sondas nitróxido genera un espectro EPR de tres líneas similar independientemente de la especie responsable de la oxidación; por lo tanto, no distingue entre las distintas especies ROS. También, se ha divulgado que hay reacciones potenciales de las sondas de la hidroxilamina con transporte fotosintético de electrones cadena y citocromo c oxidasa19,20. Estas observaciones deben considerarse al interpretar los resultados. En este protocolo, el sistema fotosintético no está presente, y la inclusión de DTPA con el tampón inhibe el potencial de contaminación de iones férricos y cuproso libre10 . Hemos demostrado cómo utilizar una serie de enzimas específicas o quelantes en tejido pulmonar para establecer la contribución de ROS particular o inhibidores de la enzima para determinar la fuente de ROS. Este enfoque se ha utilizado previamente con EPR para determinar la contribución de ROS por eNOS desacoplada13,15. Le ofrecemos una lista de inhibidores comunes utilizados para distinguir especies responsables de la oxidación de la sonda de spin (tabla 1).
También demostramos la importancia de optimizar el tiempo de incubación para cada condición experimental. Al comparar la vuelta las sondas a las trampas de la vuelta, giro trampas generan únicos espectros dependiendo del reactivo que permite la especificidad de las especies de radicales libres; sin embargo, también exhiben cinética lenta de superóxido spin reventado y son susceptibles a la biodegradación. El tratamiento del tejido pulmonar con la sonda la EPR ex vivo también está limitado por la incapacidad de distinguir adecuadamente de superóxido intracelular debido a la interrupción de las membranas celulares durante el procesamiento del tejido extracelular (congelación o de homogeneización). Uso de la vuelta inyectado sonda en vivo junto con tepe o TEPES de PEG permeable a la célula puede solucionar este problema.
Uno de los objetivos fue establecer un protocolo para eficientemente recoger muestras y almacenar a-80 ° C antes de las mediciones de EPR. Por lo tanto hemos desarrollado un método práctico para utilizar tubería de PTFE para la celebración de las muestras. Esta tubería se coloca directamente en el dedo dewar para análisis EPR en 77 K sin la necesidad de limpiar el dewar entre muestras. Esta es una alternativa al método publicado recientemente que implica la congelación de las muestras en jeringas de 1 mL. Las mediciones en las muestras congeladas almacenadas en tubería de PTFE pueden repetirse durante varios días para demostrar la estabilidad de la señal. Este enfoque permite la dosificación de las mediciones del APE y facilita la transferencia de las muestras entre laboratorios que una instalación remota de EPR puede ejecutar muestras.
En general, estos protocolos proporcionan un enfoque sencillo para preparar las células y tejidos para la medición de APE en los sistemas biológicos. Los protocolos pueden adaptados a otros modelos asociados a estrés oxidativo y el uso de otros sondeos de vuelta. El tiempo y la concentración de la sonda de spin tendrá que ser ajustado para cada condición experimental. La capacidad de EPR para determinar la presencia y la producción de radicales libres especies inequívocamente proporciona rigor para aproximaciones experimentales en el campo de la biología redox.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Este trabajo fue financiado por la Universidad de Colorado escuela de medicina Decano concesión de infraestructura de investigación estratégica, R01 HL086680-09 y 1R35HL139726-01, al Premio de beca E.N.G. y UCD CFReT (él). Los autores agradecen a Dr. Sandra Eaton y el Dr. Gareth Eaton (Universidad de Denver), Dr. Gerald Rosen y Dr. Joseph P. Kao (Universidad de Maryland) y Dr. Sujatha Venkataraman (Universidad de Colorado Denver) para discusiones útiles y Joanne Maltzahn, Ashley Trumpie y Ivy McDermott (Universidad de Colorado Denver) para el soporte técnico.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



