Summary
Elektronspektroskopi paramagnetiska resonans (EPR) är en entydig metod för att mäta fria radikaler. Användningen av selektiva spin sonder möjliggör detektering av fria radikaler i olika cellulära fack. Vi presenterar en praktisk och effektiv metod för att samla in biologiska prov som underlättar att behandla, lagra och överföra prover för EPR mätningar.
Abstract
Den korrekta och specifikt påvisande av reaktiva syreradikaler (ROS) i olika cellulära och vävnad fack är avgörande för studien av redox-reglerade signalering i biologiska inställningar. Paramagnetiska resonans elektronspektroskopi (EPR) är den enda direkta metoden att bedöma fria radikaler otvetydigt. Dess fördel är att det identifierar fysiologiska nivåer av specifika arter med en hög specificitet, men det kräver specialiserad teknik, försiktig provberedning och lämpliga kontroller för att säkerställa korrekt tolkning av data. Cyklisk hydroxylamin spin sonder reagerar selektivt med superoxid eller andra radikaler för att generera en nitroxide signal som kan kvantifieras av EPR-spektroskopi. Cell-permeable spin sonder och spin sonder utformad ansamlas snabbt i mitokondrierna möjliggör bestämning av superoxid koncentration i olika cellulära fack.
I odlade celler, användning av cell genomsläppliga 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) längs med och utan cell-impermeable superoxid dismutase (SOD) förbehandling eller användning av cell-permeable PEG-SOD, möjliggör den differentiering av extracellulära från cytosoliska superoxid. Den mitokondriella 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] piperidinium-diklorid (mito-TEMPO-H) möjliggör mätning av mitokondriell ROS (främst superoxid).
Spin sonder och EPR-spektroskopi kan också tillämpas i vivo modeller. Superoxid kan upptäckas i extracellulära vätskan som blod och alveolär vätska, liksom vävnader såsom lungvävnad. Flera metoder presenteras för att bearbeta och lagra vävnad för EPR mätningar och leverera intravenös 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) spin sonden i vivo. Medan mätningar kan utföras vid rumstemperatur, kan prover som erhållits från in vitro- och in-vivo modeller också lagras vid-80 ° C och analyseras av EPR på 77 K. Proverna kan lagras i specialiserade slangar stabil vid-80 ° C och kör på 77 K för att aktivera en praktisk, effektiv, och reproducerbar metod som underlättar lagring och överföra prover.
Introduction
Medan åtgärder av oxidativ stress och reaktiva syreradikaler är viktiga att studera olika sjukdomar över alla organsystem, är detektion av reaktiva syreradikaler (ROS) utmanande på grund av en kort halveringstid och höga reaktivitet. En elektron paramagnetiska resonans (EPR) teknik är mest otvetydiga metoden för att påvisa fria radikaler. Spin sonder har fördelar jämfört med vanliga fluorescerande sonderna. Även fluorescerande sonder är relativt billig och lätt att använda och ger snabb och känslig detektion av ROS, har de allvarliga begränsningar på grund av artefaktiska signaler, en oförmåga att beräkna ROS koncentrationer, och en allmän brist på specificitet1 .
För att underlätta användningen av EPR för biologiska studier, en mängd spin sonder har syntetiserats som kan mäta en rad biologiskt relevanta fri radikal arter samt pO2, pH och redox påstår2,3, 4,5,6,7. Spin fällor har också utvecklats för att fånga kortlivade radikaler och form long-levande addukter, vilket underlättar upptäckt av EPR8. Båda klasserna (spin sonder och spin fällor) har fördelar och begränsningar. Ett vanligt förekommande aktieslag spin sonder är cykliska hydroxylamines, som är EPR-tyst och reagera med kortlivade radikaler att bilda en stabil nitroxide. Cyklisk hydroxylamines reagerar med superoxid 100 gånger snabbare än spin fällor, gör det möjligt för dem att konkurrera med cellulära antioxidanter, men de saknar specificitet och kräver användning av lämpliga kontroller och hämmare att identifiera den radikala arter eller källan ansvarig för nitroxide signalen. Medan spin fällor utställning specificitet, med distinkta spektrala mönster beroende på de fångade arterna, de har långsam kinetik för superoxid snurra svällning och är benägna att biologisk nedbrytning av radikalen addukter. Ansökningar om spin svällning har varit väldokumenterade i biomedicinsk forskning9,10,11,12,13.
Målet med detta projekt är att demonstrera praktiska EPR metoder för att utforma experiment och förbereda prover att upptäcka superoxid använder spin sonder i olika cellulära fack in vitro och i olika vävnader fack in-vivo. Flera manuskript har publicerat protokoll som är relevant för dessa mål, med hjälp av cell-permeable, cell-impermeable och mitokondrie riktade spin sonder till olika cellulära fack in vitro- och process målvävnaden för analys i musmodeller 14 , 15. vi bygga på denna mängd litteratur genom att verifiera en metod för att mäta superoxid med en 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) spin sond i olika cellulära fack in vitro- för att säkerställa korrekt mätningar, belysa eventuella tekniska problem som kan förvränga resultaten. Vi erbjuder även metoder för att utföra EPR mätningar i blodet, bronkoalveolär lavage vätska och lungvävnad använder CMH spin sonden. Dessa studier jämför olika metoder för att bearbeta vävnader samt presentera en metod för att injicera en annan spin probe, CPH, i möss före skörd vävnad. Slutligen, vi utveckla en praktisk metod för att lagra prover i polytetrafluoreten (PTFE) slangar för lagring och överföring av prover innan EPR mätningar vid 77 K.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alla djurstudier godkändes av University of Colorado Denver institutionella djur vård och användning kommittén.
1. beredning av reagens
-
Diethylenetriaminepentaacetic syra (DTPA) lager (150 mM)
- Tillsätt 2,95 g DTPA (393.35 g/mol) till 10 mL avjoniserat vatten.
- För att upplösa DTPA, tillsätt 1 M NaOH droppvis och ett pH på 7,0.
- Ta volymen till 50 mL med vatten för DTPA koncentration på 150 mM och lagra vid 4 ° C.
-
Fosfat buffert saltlösning (PBS) (50 mM, pH 7,4)
- Förbereda 5 M natriumklorid (NaCl) (58.44 g/mol; 29.22 g/100 mL).
- Förbereda 1 M av kalium fosfat dibasiskt HK2PO4 (174.18 g/mol; 17.42 g/100 mL)
- Laga 1 M av kalium fosfat monobasiskt KH2PO4 (136,1 g/mol; 13.61 g/100 mL). Blanda 3 mL 5 M NaCl med 4.24 mL 1 M kaliumfosfat dibasiskt och 0.760 mL 1 M kalium fosfat monobasiskt. Kontrollera pH-värdet.
- Med volymen till 100 mL med avjoniserat vatten.
- Förvara vid rumstemperatur (RT) för kortvarig (dagar) och vid 4 ° C för långsiktiga (veckor) lagring.
-
Krebs-Henseleit buffert (KHB) innehållande 100 µM DTPA
- I 50 mL koniskt centrifugrör, tillsätt 33,3 µL av 150 mM DTPA stamlösning.
- Ta till en 50 mL volym med Krebs-Henseleit buffert (KHB).
- Förbereda färska buffert med DTPA varje dag och hålla det på RT.
-
Tris-EDTA buffert som innehåller sackaros
- Förbereda 0,5 M Tris lager: Lös 15.14 g Tris base (121.14 g/mol) i 150 mL avjoniserat vatten. Använder HCl, justera pH till 7,8 och föra till en slutlig volym på 250 mL.
- Lös 21,4 g sackaros (342.29 g/mol; slutlig koncentration = 0,25 mM) i 150 mL avjoniserat vatten.
- Tillsätt 5 mL av Tris lager till sackaros att uppnå 10 mM Tris koncentration.
- Lägga till 0,5 mL 0,5 M EDTA lager i Tris-sackaros att uppnå en slutlig koncentration på 1 mM.
- Kontrollera pH och justera det till 7,4.
- Ta till en slutlig volym 250 ml med avjoniserat vatten och förvaras vid 4 ° C.
-
Bovin erytrocyt Cu/Zn superoxid dismutase (SOD) lager (30 000 U/mL)
- Beredes 30.000 U av SOD i 1 mL PBS (cirka 5,7 mg, beroende på aktiviteten av SOD hel).
- Blanda väl, delprov och förvaras vid-20 ° C för kortsiktiga (6-12 månader) och vid-80 ° C för långsiktig lagring.
-
SOD arbetslösning (1000 U/mL)
- Över en 30 µL alikvot av 30.000 U/mL SOD lager till en 870 µL sterilt PBS.
- Förvara lösningen på is, och använda den färska.
-
Phorbol 12-isopropylmyristat 13-acetat (PMA) lager (5 mM)
- Lös 1 mg PMA (616.83 g/mol) i 325 µL av DMSO (slutlig koncentration = 5 mM).
- Alikvot en 5 mM PMA lösning och lagra den på-20 ° C.
-
PMA arbetslösning (125 µM)
- Späd en 10 µL alikvot av 5 mM PMA lager till 390 µL sterilt PBS.
- Förvara lösningen på is och använda den färska.
- För en fordonskontroll för PMA, använda 10 µL av DMSO i 390 µL av PBS.
-
Diphenyliodonium klorid (DIP) (2,5 mM)
- Lös 3,2 mg DOPPA (316.57 g/mol) i 4 mL att erhålla en 2,5 mM-lager.
- Förbereda lösningen och använda den färska.
-
Deferoxamin mesylat salt (DFO) (20 mM)
- Lös upp 4,5 mg DFO (656.79 g / mol) i 340 µL till skaffa en 20 mM-lager.
- Förbereda lösningen och använda den färska.
-
Beredning av antimycin A (AA) lager (5 mM)
- Lös 5,4 mg AA (532 g/mol) i 2 mL etanol (slutlig koncentration = 5 mM).
- Alikvot beståndet i glasampuller och förvaras vid-20 ° C.
-
Beredning av spin sonder
- Bubbla 50 mM fosfat buffert innehållande 100 µM DTPA med kväve i 30 min för att ta bort löst syre från bufferten.
- Ta bort sonden spin från-20 ° C frysen och låt behållaren att komma till RT (10-15 min).
- Väg upp 2,4 mg av 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· HCl (CMH) (237,8 g/mol)
- Lös upp CMH i 1 mL av den syrefattigt fosfatbuffert för en slutlig koncentration på 10 mM.
- Väg upp 5 mg 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium diklorid (mito-TEMPO-H) (529.1 g/mol).
- Lös upp mito-TEMPO-H i 1 mL av den syrefattigt fosfatbuffert för en slutlig koncentration på 9,5 mM.
- Väg upp 4,9 mg 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· HCl (CPH) (223,7 g/mol).
- Lös upp CPH i 1 mL av den syrefattigt fosfatbuffert för en slutlig koncentration på 22 mM.
- Delprov och förvaras vid-80 ° C (frysning-tining rekommenderas inte).
2. detektion av superoxid in vitro
-
Påvisande av totalt, extracellulära och intracellulära superoxid i PMA-stimulerad RAW 264,7 celler på RT
- Följande korrekt aseptisk teknik, Tina RAW 264,7 celler och passage dem i DMEM media kompletteras med 10% FBS (låg endotoxinfria) och 1% antimycotic/ampicillin vid 37 ° C i CO2 inkubator.
- Utsäde RAW 264,7 celler på 1 x 106 celler per brunn i 6-väl plattor en dag före behandling.
- Försiktigt ta bort media och tvätta cellerna en gång med 1 mL av KHB buffert.
- Lägg till KHB innehållande 100 µM DTPA till varje brunn och behandla i en total volym av 500 µL med följande:
- För brunnar som förbehandlats med SOD, lägga 15 µL per brunn SOD arbetslösning (1000 U/mL; slutlig koncentration av SOD = 30 U/mL) och inkubera i 10 minuter vid 37 ° C före tillsats av CMH och PMA.
- Lägg till 12,5 µL per brunn av 10 mM CMH lager (slutlig koncentration = 0,25 mM).
- Lägga till 40 µL per brunn 125 µM PMA arbetslösning (slutlig koncentration = 10 µM) eller 40 µL fordon (lager 10 µL av DMSO i 390 µL av PBS).
- Inkubera i 50 min vid 37 ° C i en CO2 inkubator.
- Ta bort plattorna från inkubatorn och placera dem direkt på is.
- Samla in buffert från varje brunn i separata, 1,5 mL, märkt rör. Hålla på is i hela.
- Tillsätt 100 µL av färska KHB buffert innehållande 100 µM DTPA, försiktigt skrapa cellerna och resuspendera genom pipettering upp och ner flera gånger. Hålla på is i hela cellen resuspension.
- Load provet samlas i steg 2.1.10 och 2.1.11 (50 µL) i alla kapillärrör. Försegla båda ändar och kör EPR.
Obs: Alltid testa ett rör eller brunn (utan celler) som innehåller sonden i buffert (samma koncentration = 0,25 mM), behandlade på samma villkor som cellerna (samma inkubationstid och temperatur) som en kontroll, eftersom bakgrunden intensitet sonden är temperatur - och tidsberoende. - Ange parametrarna EPR förvärv av följande: mikrovågsugn frekvens = 9.65 GHz; Center field = 3432 G; modulering amplitud = 2,0 G; sopa bredd = 80 G; mikrovågsugn effekt = 19,9 mW; Totalt antal skanningar = 10; sopa tid = 12.11 s; och tidskonstant = 20.48 ms.
-
Påvisande av mitokondriell superoxid i RAW 264,7 celler
- Följ steg 2.1.1 och 2.1.2 till utsäde RAW 264,7 celler en dag före experimentet.
- Ta bort media och tvätta cellerna en gång med 1 mL av KHB buffert.
- Tillsätt 200 µL av KHB innehållande 100 µM DTPA till varje brunn.
- Lägg till 5,3 µL per brunn av 9.5 mM mito-TEMPO-H lager (slutlig koncentration = 0,25 mM)
- Inkubera i 10 min vid RT.
- Lägg till 1 µL per brunn av antimycin A (AA), 5 mM stamlösning i etanol (slutlig koncentration = 25 µM).
- Inkubera i 50 min vid 37 ° C i en CO2 inkubator.
- Ta bort plattorna från inkubatorn och placera dem direkt på is.
- Försiktigt skrapa cellerna och resuspendera genom pipettering upp och ner. Hålla på is.
- Lägg provet i ett kapillärrör. Försegla båda ändar.
- Se avsnittet ovan för EPR inställning.
-
Påvisande av superoxid i RAW 264,7 celler på 77 K
- Placera den buffert som samlats in i steg 1.1.10 i färdiga PTFE slangar 1-2 inches i längd (3/16 ”OD x 1/8”-ID). Kontrollera att PTFE-slangen är raka så det enkelt kan införas och avlägsnas från finger dewar. Använd en gummipropp att stänga ena änden av PTFE-slangen, pipett den buffert eller cellsuspension (100 till 150 µL) i PTFE-slangen och försegla slangen med andra propp.
- Flash frysa provet i flytande kväve. Provet kan överföras till en märkt frysförvaring tub för lagring vid-80 ° C eller köras direkt.
- Fyll finger dewar med flytande kväve och infoga PTFE-slangen som innehåller provet i fingret dewar. Kontrollera att provet är centrerad i det aktiva utrymmet av resonator och köra EPR på 77 K.
Obs: Starta kväve gasflödet till din spektrometer 15-30 min innan mätningarna, och fortsätta detta flöde under mätningarna av att förhindra vattenkondensering i resonator. - EPR förvärv parametrarna följande: mikrovågsugn frekvens = 9.65 GHz; Center field = 3438 G; modulering amplitud = 4,0 G; sopa bredd = 150 G; mikrovågsugn effekt = 0,316 mW; Totalt antal skanningar = 10; sopa tid = 60 s; och tidskonstant = 1,28 ms.
3. EPR mätningar i vätskor
-
Helblod
- Behandla möss (8-12 veckor gamla) med en engångsdos av intratrakeal bleomycin (Bleo; 100 µL 1 U/ml) upplöst i PBS eller PBS ensam som tidigare beskrivits16,17.
- Euthanize möss genom att administrera inhalerade isofluran (1,5-4%) följt av exsanguination och cervikal dislokation. Aspirera blod genom höger kammare i en spruta belagd med heparin (1000 USP/mL) som innehåller 100 µM DTPA och överföring till en 1,5 mL tub.
- I en separat 1,5 mL tub, tillsätt 15 µL av PBS som innehåller 100 µM DTPA och 3 µL av CMH (10 mM) till 132 µL blod för en total volym på 150 µL och slutlig CMH koncentration av 0,2 mM.
- Inkubera blod under 10 minuter vid 37 ° C i ett vattenbad.
- Ta bort rören från vattenbadet.
- Ta en alikvot genom att läsa in blod i ett kapillärrör och kör EPR på RT med följande EPR förvärv parametrar: mikrovågsugn frekvens = 9.65 GHz; Center field = 3432 G; modulering amplitud = 1,0 G; sopa bredd = 80 G; mikrovågsugn effekt = 19,9 mW; Totalt antal skanningar = 3; sopa tid = 12.11 s; och tidskonstant = 20.48 ms. alternativt prover kan vara flash frysta som beskrivs i steg 2.3 för mätningar på 77 K. EPR förvärv parametrar är följande: mikrovågsugn frekvens = 9.65 GHz; Center field = 3438 G; modulering amplitud = 4,0 G; sopa bredd = 150 G; mikrovågsugn effekt = 0,316 mW; Totalt antal skanningar = 2; sopa tid = 60 s; och tidskonstant = 1,28 ms.
-
Bronkoalveolär lavage vätska (BALF)
- Efter dödshjälp (se punkt 3.1.2), samla in BALF genom att långsamt ingjuta och dra 1 mL PBS som innehåller 100 µM DTPA tre gånger i en spruta via en kanyl placeras i luftstrupen.
- I en 1,5 mL tub, behandla 200 µL BALF med 4 µL av CMH (10 mM) att erhålla en slutlig koncentration av 0,2 mM.
- Inkubera BALF i 50 min vid 37 ° C i ett vattenbad.
- Ta rör ur vattenbadet och placera dem på isen.
- Load BALF i ett kapillärrör och kör EPR på RT med samma EPR inställningar som används i steg 1.1.13 eller flash frysa i flytande kväve som beskrivs i steg 2,3.
-
EPR mätningar i blod och BALF på 77 K
- Följa protokollet ovan för att samla blod (steg 3.1.1. till 3.1.4) och BALF (steg 3.2.1 till 3.2.4).
- Plats 150 µL av behandlade blod eller BALF i PTFE slangar (1-2 tum). Använda en gummipropp för att stänga ena änden av PTFE-slangen innan du lägger till provet och en annan propp att försegla slangen.
- Flash frysa provet i flytande kväve.
- Se avsnitt 2.3 för detaljer om kör EPR i frysta prover i PTFE slangar med fingret dewar på 77 K. kör frysta CMH behandlas blodprov med i veckan.
4. EPR mätningar på lungvävnad
-
Blixt fryst lungvävnad
- Efter att samla BALF i steg 3.2.1, bröstkorgen öppnas och lungorna spolas med 10 mL kall PBS via höger kammare för att ta bort blod. Blixt frysa lungvävnad i flytande kväve. Fryst lungvävnad kan lagras vid-80 ° C i upp till 6 månader fram till användning för EPR mätningar.
- Stabilisera lungvävnaden på torris med pincett och skär flera små bitar (5-15 mg) i lungvävnad använder ett enda-kant blad.
- Väga vävnaden i en 1,5 mL tub, placera röret på skalan och Taravikt skalan, och sedan lägga till vävnad bitar och vikten.
- Vävnaden i 1,5 mL röret, tillsätt 196 µL av KHB som innehåller DTPA och 4 µL av CMH (0,2 mM) för att uppnå en 200 µL totala volym.
- Inkubera i 1 timme vid 37 ° C i ett vattenbad.
- Snurra ner (för några sekunder) i en mikrocentrifug vid 3,884 x g.
- Plats på isen och Pipettera 150 µL av supernatanten i PTFE-slangen och frysa för 77 K mätningar som beskrivs i avsnitt 2.3.
Obs: Denna metod, heterogenitet skadan måste övervägas. För en bleomycin-inducerad lungskada, med tanke på att det är en ytterst heterogen skada, rekommenderas det att skära flera vävnad bitar från olika delar av lungan från varje mus. Alternativt kan en större bit vävnad homogeniseras i KHB buffert innehållande 100 µM DTPA i förhållandet 1:6 vikt till volym (mg/µL) som beskrivs nedan.
-
Frisk lungvävnad bevarade i sackaros buffert
- Spola lavaged lungorna med kall PBS ta bort blod som gjort steg 3.1.2.
- Homogenisera frisk lungvävnad i Tris-EDTA buffert innehållande 0,25 M sackaros med förhållandet 1:6 lung/buffer (mg/µL) med Dounce vävnad kvarnen med ett glas eller PTFE mortelstöt.
- Tillsätt 50 µL av lung Homogenatet till 450 µL av KHB innehållande 100 µM DTPA.
- I ett 1,5 mL rör (i en total volym av 100 µL), 98 µL av lung Homogenatet i KHB, tillsätt 2 µL av CMH av 10 mM lager att erhålla en slutlig koncentration av 0,2 mM.
- Inkubera i 20 min 37 ° C i ett vattenbad.
- Placera proverna på is och ladda dem i ett kapillärrör. Kör EPR på RT (inställningar används i steg 2.1.13).
- För att testa specifika arter och källor med hjälp av olika hämmare bidrag, förbehandla 88 µL av lung Homogenatet +/-hämmare, justera med KHB att uppnå en slutlig volym av 98 µL. I detta experiment, hämmare ingår 10 µL av SOD (100 U/mL), 4 µL av deferoxamin (DFO; slutlig koncentration = 800 µM), eller 4 µL diphenyliodonium klorid (dopp; slutlig koncentration = 100 µM). Inkubera i 20 min vid 37 ° C i ett vattenbad.
- Tillsätt 2 µL av CMH och inkubera i en annan 20 min vid 37 ° C, följt av EPR mätningar som beskrivs ovan. Inkludera en engångs matchade blindprov med CMH KHB som innehåller sackaros buffert. Du kan också lagra alikvoter av den återstående lung-homogenates (steg 3.1.2) vid-80 ° C för framtida mätningar.
Obs: Den totala volymen kan skalas efter behov.
-
EPR mätningar på lungvävnad från möss som injicerats med spin sonder i vivo (på RT använder vävnad cell)
- Förbereda CPH stamlösning av upplösning CPH 4,9 mg i 1 mL filtrerad och syrefattigt 50 mM fosfatbuffert.
- Söva möss med inhalerade isofluran (1,5-4%) i 20-30 sekunder tills svarar inte på tå nypa. Injicera möss via retroorbital rutt med 100 µL av CPH spin probe för en 25 g mus kroppsvikt (sista dos = 20 mg/kg), och låta sonden cirkulera för 1 h. omedelbart efter retroorbital injektion, Lägg till en droppe 0,5% proparacaine HCl på ögonområdet och preve NT ögonsmärta och torrhet. Övervaka möss för 1 h och vidare till vävnad skörd.
- Skörda lungvävnaden som beskrivs ovan och flash frysa lungorna.
- Skär 20-30 mg fryst vävnad på torris och den exakta vikten.
- Torka försiktigt vävnaden med rengöringsdukar för att absorbera alla ytvatten.
- Placera vävnaden inom fönstret i cellen vävnad (tillbehör tillåter EPR mätningar för vävnadsprover) och kör EPR för att fastställa totalt spins. Data kan uttryckas som totala spins per mg vävnad.
5. dataanalys
- Simulera EPR spektra SpinFit modulen ingår i bänk EMXnano EPR spektrometern Xenon programvara. Bestämma nitroxide koncentration av modulen SpinCount. Alternativt en stabil nitroxide såsom 4-hydroxi-TEMPO eller TEMPOL kalibreringskurvan kan göras, och koncentrationen kan erhållas genom att jämföra intensiteten i signalen med provet och standard.
- För de insamlade på 77 K, Använd dubbla integration följt av SpinCount.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Superoxid detektering med CMH validerades med X / XO superoxid genererar systemet att visa att nitroxide (.CM) signalen hämmades fullt av SOD, medan katalas hade ingen effekt (figur 1A). Den totala, extracellulär superoxid utvärderades sedan hos RAW 264,7 celler av ruvande celler med cell-permeable CMH spin sonden +/-SOD förbehandling. Nitroxide koncentrationen mättes både cellsuspension och bufferten, vilket visade att värdena i de två typerna av prov var liknande på grund av genomsläpplig art och snabba Jämviktstiden spin sondens (figur 1B). Nitroxide radikala signalen ökade i RAW 264,7 celler stimuleras med PMA jämfört med kontroll celler. Denna signal var betydligt försvagade i celler som förbehandlats med cell-impermeable SOD (figur 1 c). Varje färg representerar brunnar testade på olika dagar, visar konsekvens av uppgifter som samlats in på specifika dagar och reproducerbarheten för resultaten över tid. Koncentrationen av extracellulära superoxid bestämdes genom att subtrahera signalen i PMA celler förbehandlats med SOD från signalen efter PMA i avsaknad av SOD (T). Återstående signalen tillskrevs intracellulära superoxid (figur 1 c). Figur 1 d illustrerar beräkningen av total- och extracellulära superoxid. (E) den intracellulära signalen bekräftades i PMA-behandlade celler efter borttagande av medierna och av effekten av PEG-SOD på signalen. CMH blindtestet var inte subtraheras från mätningarna i denna graf, i motsats till (C), och raw-data visas.
Mitokondriell superoxid i RAW 264,7 celler upptäcktes använda EPR spin sonden mito-TEMPO-H, som ackumuleras i mitochondia. (A) representant EPR spectra för baslinjen mito-TEMPO-H signalen i buffert, ökad mito-TEMPO-H signalen i kontroll celler (Con) och ytterligare förstärkt signal i celler stimuleras med mitokondrie-hämmaren Antimycin A (AA). Ökningen av signalen tillskrevs den mitokondriella superoxid baserat på våra tidigare studie visar att SOD2 överuttryck betydligt försvagat mätningar med mito-TEMPO-H10. I figur 2Bbestämdes mitokondriella nitroxide koncentrationen genom att subtrahera mito-TEMPO-H signalen i tidsmatchade buffert från cell mätningarna. CM. signal erhålls vid låga temperaturer i RAW 264,7 celler efter stimulering med PMA i närvaro och frånvaro av SOD. (Figur 3A) CM. signalen var försvagade i närvaro av SOD, konsekvent med rumstemperatur data (figur 1). Figur 3B visar ett fotografi av PTFE slangar med proppar används för att samla in data på 77 K för celler och i vivo prover. Superoxid produktion har påvisats i blod och BALF använder CMH spin sonden. Blod eller BALF prover samlades från PBS - och Bleo-behandlade möss och inkuberas omedelbart med CMH. Proven flyttades till PTFE slangar och blixt fryst och EPR data samlades på 77 K. Koncentrationen av nitroxide (CM.) ackumuleras i blod inkuberas med CMH (0,2 mM) vid 37 grader i 10 min (figur 4A). Nitroxide (CM.) koncentration från BALF inkuberas i 50 min (figur 4B). Nitroxide koncentration representerar koncentration (.CM) ackumuleras i volymen av blod eller BALF används i experimentet.
Tre metoder har testats för att utvärdera flera publicerade tekniker för vävnad bevarande och förvaltning av spin sonder ex vivo vs. invivo. För att utföra EPR mätningar på lungvävnad, vi först används flash frysta lungvävnad från kontroll eller skadade möss. Figur 5A visar den totala CM. -signalen i supernatanten av en liten bit av lungvävnad inkuberas vid 37 ° C med CMH i PBS - och Bleo-behandlade möss, respektive. På grund av heterogenitet i lungskada efter Bleo behandling rekommenderas att skära bitar från olika regioner av lungan och genomsnittlig flera mätningar för att ge ett mer representativt värde. Alternativt kan en homogenisera hela lungan och använda ett prov av denna Homogenatet. Data samlas in på 77 K med PTFE slangar och finger dewar. Figur 5B visar representativa spektra av nitroxide (.CM) signaler från PBS - och Bleo-behandlade möss, respektive.
En begränsning att behandla lunga vävnad ex vivo är att det inte är möjligt att på ett tillförlitligt sätt skilja extracellulära från intracellulära superoxid på grund av bearbetning av vävnad som stör cellernas membran. Om denna information är viktig för den experimentella frågan, kan det åtgärdas med hjälp av in-vivo CPH instillation metoden beskrivs nedan. Fryst vävnad kan inte användas för att utvärdera mitokondriella superoxid; för denna mätning, men anpassas protokollet för att använda mito-TEMPO-H i vävnad eller nymalen isolerade mitokondrier.
Som en andra metod för EPR mätningar i lungvävnad, var färsk vävnad homogeniserad i sackaros buffert. Lungan Homogenatet var inkuberas med CMH sond i KHB buffert som innehåller DTPA. EPR mätningar genomfördes på RT. figur 6A visar ökningen av CM. med Bleo. Vi presenterade en ytterligare tester med olika hämmare som kan användas för att bestämma de arter som bidrar till CM. signalen. För att belysa ursprunget till CM. signal genereras från lungvävnad, förbehandlade vi den lung-homogenates med flera asätare och enzym-hämmare. Lung homogenates inkuberades med CMH i frånvaron eller närvaron av SOD, deferoxamin (DFO) och diphenyliodonium klorid (DIP) att redovisa (respektive) bidragen från superoxid, järn eller superoxid genereras från flavin-innehållande enzymer (figur 6B). Detta tillvägagångssätt kan anpassas att bedöma de särskilda radikala arter som genereras i ett system eller belysa andra enzymatisk källors bidrag (t.ex., NOX, eNOS eller xantin oxidas).
Möss injicerades med CPH spin sonder (20 mg/kg) via retroorbital rutten för att utföra EPR mätningar i vivo. Det är okänt huruvida CMH kan administreras säkert till djur, medan CPH sonden har rapporterats vara giftfri; således valt vi CPH för de in-vivo -experiment. Lungvävnad var skördade och blixt fryst i flytande kväve 1 h efter cirkulation av CPH sonder. Möss kan behandlas samtidigt med specifika antioxidanter att skilja arterna som är ansvarig för signalen. Figur 7A visar högre CP. signal i Bleo-behandlade möss jämfört med kontroll möss. Representativa spektra av lungvävnad från kontroll- och Bleo-behandlade möss visas i figur 7B. En blandad EPR spektra av CP. och askorbinsyra radikal observerades. De värden som redovisas i figur 7A är koncentrationerna av CP. komponenter. Data samlades in på RT använder cellen vävnad.
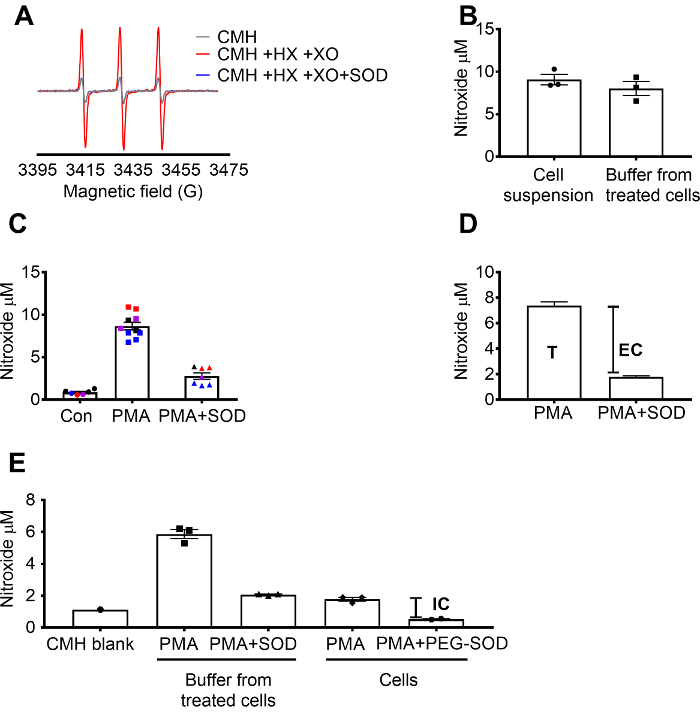
Figur 1: Påvisande av superoxid i olika cell fack. (A) EPR spectra genereras av 0.25 mM CMH i 0,5 mM hypoxantin/xantin oxidas (8 mU/mL) med och utan SOD (30 U/mL). (B) RAW 264,7 celler (1 x 106 celler per brunn) stimuleras med 10 µM PMA i närvaro av CMH för 50 min vid 37 ° C och nitroxide koncentration (µM) upptäcks i cellsuspension (celler + buffert) och buffert som samlats in från behandlade cellerna. (C) RAW 264.7 celler stimuleras med PMA vs. fordonskontroll (Con). En uppsättning celler var förbehandlats för 10 min med 30 U/mL cell-impermeable SOD (PMA + SOD). Varje färg representerar data från olika experimentella dagar och varje punkt representerar celler individ väl. Nitroxide signalen i en tidsmatchade Tom med CMH i KHB var subtraheras från varje signal att erhålla slutvärdena. (D) beräkning av total- och extracellulära superoxid i PMA stimulerade celler; T = total superoxid, EG = extracellulära superoxid (SOD inhibitable signal). (E) för att utvärdera den intracellulära superoxid signalen (IC), jämfördes signalen i bufferten efter PMA + SOD PMA-behandlade celler efter avlägsnande av buffert. För att bekräfta, var brunnar förbehandlats med 60 U/mL cell-permeable PEG-SOD för 1,5 timme att bestämma den intracellulära SOD inhibitable. Den tidsmatchade CMH tomrummet visas, och data som speglar absolut nitroxide signal. Data uttryckt som medelvärde ± SEM. vänligen klicka här för att visa en större version av denna siffra.

Figur 2: Påvisande av mitokondriell superoxid i RAW celler stimuleras med antimycin A. (A) representativa spektra av mitokondrie-specifika EPR spin sond, 0,25 mM mito-TEMPO-H i RAW 264,7 celler utan (Con) eller med 25 µM antimycin A (AA) för 50 min vid 37 ° C. (B) CM. koncentration (µM) i celler behandlas med AA jämfört med kontrollgruppen. Nitroxide signal i en tidsmatchade mito-TEMPO-H Tom var subtraheras från totala signal att erhålla slutvärdena. Data uttryckt som medelvärde ± SEM. vänligen klicka här för att visa en större version av denna siffra.

Figur 3: Påvisande av superoxid i RAW 264,7 celler på 77K. (A) RAW 264.7 celler stimuleras med 10 µM PMA och EPR spin sond, CMH 0,25 mM (50 min vid 37 ° C) med (svart) eller utan (röd) förbehandling med 30 U/mL SOD. 100 µL av supernatanten lastades i en 1-tum i längd bit PTFE slangar, då blixt fryst i flytande kväve. Proppar avlägsnades och frysta PTFE slangar placerades i fingret dewar för datainsamling på 77 K. (B) en foto av PTFE slangar och proppar. Klicka här för att se en större version av denna siffra.

Figur 4: EPR mätningar i blod och BALF från kontroll och bleomycin-behandlade möss. Möss behandlades med en engångsdos av intratrakeal bleomycin (IT Bleo) (100 µL 1 U/ml) eller PBS fordon. På 7 dagar, var möss bedövas och avlivas. Blodet var insamlade via höger kammare punktering i en spruta belagd med 1000 USP/mL heparin som innehåller 100 µM DTPA. Bronkoalveolär lavage vätska (BALF) samlades in av lavaging lungorna med 1 mL 100 µM DTPA i PBS. Blod och BALF inkuberades för 10 eller 50 min, respektive, med 0,2 mM CMH vid 37 ° C. 150 µL blod eller BALF lästes i PTFE slangar flash frysta i flytande kväve och EPR uppgifter insamlade på 77 K med ett finger dewar. Data visar nitroxide koncentrationer i blod (A) och (B) BALF från PBS - och Bleo-behandlade möss (n = 4-6). Data uttryckta menar ± SEM. (C) Representative spektra av nitroxide i blod från PBS - och Bleo-behandlade möss. Klicka här för att se en större version av denna siffra.

Figur 5: EPR mätningar i flash frysta lungvävnad. Möss behandlades med en engångsdos av intratrakeal bleomycin (IT bleo) (100 µL 1 U/ml) eller PBS fordon. På 7 dagar, var lungorna spolas med kallt PBS ta bort blod och blixt fryst i flytande kväve. 5-15 mg flash-fryst lungvävnad var inkuberas med 0,2 mM CMH i KHB innehållande 100 µM i 200 µL av totalvolymen för 1 h vid 37° C. supernatanten samlades in och placeras i PTFE slangar och kör på 77 K i fingret dewar. (A) Nitroxide koncentration (µM av nitroxide normaliserade 1 mg vävnad). Data representerar i genomsnitt 2-3 mätningar för varje lunga. Data uttryckt som menar ± SEM. B representativa spektra av nitroxide i lungvävnad från PBS - och Bleo-behandlade möss. Klicka här för att se en större version av denna siffra.

Figur 6: EPR mätningar i lungvävnaden som bevarats i sackaros buffert. Möss behandlades med en engångsdos av intratrakeal bleomycin (100 µL 1 U/ml). 7 dagar efter behandling, lungorna var spolas med kallt PBS ta bort blod och frisk lungvävnad var homogeniserad i Tris-EDTA buffert som innehåller 0,25 mM sackaros i förhållandet 1:6 lung vikt/buffer volym (mg/µL). 50 µL av lung Homogenatet var teststamman med KHB med eller utan de följande hämmare under 20 minuter vid 37 ° C: SOD (100 U/mL), deferoxamin (DFO; 800 µM) och diphenyliodonium klorid (dopp; 100 μM) följt av inkubation med 0,2 mM CMH i KHB innehållande 100 µM DTPA under 20 minuter vid 37 ° C. Data erhölls på RT använder EPR kapillärrör. (A) Nitroxide koncentration i lungorna från PBS - och Bleo-behandlade möss. (B) Nitroxide koncentration i Bleo lungor i frånvaron eller närvaron av hämmare (n = 3). Data uttryckt som medelvärde ± SEM. vänligen klicka här för att visa en större version av denna siffra.

Figur 7: EPR mätningar i lungvävnad från möss som injicerats med CPH spin sond. 100 µL av CPH var administrerad via retroorbital injektion för en slutlig koncentration på 20 mg av CPH per kg kroppsvikt. Efter 1 h av cirkulation, möss var euthanized, lungorna var spolas med 10 mL kall PBS via höger kammare och lungvävnad var flash frysta. 20-30 mg i lungvävnad placerades i vävnad cell och EPR mätningar utförs på RT. (A) Data uttryckt som snurrar / mg. b representativa spektra av nitroxide signal i PBS och Bleo lungvävnad (* anger överlappningen med askorbinsyra radikal). Data uttryckt som medelvärde ± SEM. vänligen klicka här för att visa en större version av denna siffra.
| Hämmare | Arter |
| Superoxiddismutas (SOD) | Extracellulära superoxid |
| Superoxid dismutase – polyetylenglykol (PEG-SOD) | Intracellulära superoxid |
| Katalas | Väteperoxid baserade radikaler |
| Urat | Peroxynitrate |
| Etanol och DMSO | Hydroxyl radikala |
| Metall kelater | Metalljoner (järn och koppar) |
Tabell 1. Gemensamma hämmare används för att skilja arter ansvarar för spin sonden oxidation.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Bedömningen av produktionen av fria radikaler i biologiska inställningar är viktigt i förståelse redox reglerade signalering vid hälsa och sjukdom, men åtgärden av dessa arter är mycket utmanande på grund av den korta halveringstiden av fria radikaler arter och tekniska begränsningar med vanliga metoder. EPR är ett värdefullt och kraftfullt verktyg i redox biologi, eftersom det är den enda entydig metoden för att upptäcka fria radikaler. I det här projektet visar vi praktiska EPR metoder för att utforma experiment och förbereda prover att upptäcka ROS med spin sonder i olika cellulära fack in vitro- och annan vävnad fack invivo. Vi ger också praktiska metoder för att hantera biologiska prover och lagra prover för att förbättra effektiviteten.
Spin sonder reagera effektivt med ROS och producera en stabil nitroxide radikala som kan upptäckas med EPR. Flera derivat av spin sonden (cyklisk hydroxylamin) har syntetiserats med olika genomsläpplighet egenskaper, vilket gör dem lämpliga för påvisande av fri radikal produktion i olika cellulära fack10. Detta protokoll används den cell-permeable spin sonden, CMH; den ogenomträngliga spin sond 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium klorid HCl (CAT1H) kan dock användas för att upptäcka extracellulära superoxid. Liknar vår tidigare studie i mänsklig lymphoblast cell linjer18, vi har kunnat validera användning av genomsläpplig CMH spin sonden med ogenomtränglig SOD och cell genomsläpplig PEG-SOD i RAW264.7 celler (en mus lung makrofag cell fodrar) stimuleras med PMA till skilja mellan extracellulära och intracellulära superoxid.
Vi också validerade den snabba Jämviktstiden av CMH mellan intra - och extra - celler fack och vi fann också att superoxid signalen i cellerna sjunker avsevärt efter tvätta cellerna en gång med KHB (inga data anges). Vi bekräftade nyttan av den mitokondriella specifika spin sonden mito-TEMPO-H i RAW 264,7 celler att mäta den ökade mitokondriell superoxid genereras vid stimulering med mitokondriell elektrontransport kedja hämmare antimycin A. Det specifika bidraget av mitokondriell superoxid produktion till mito-TEMPO-H har visats tidigare och kan verifieras i experiment med isolerade färska mitokondrier eller system med mitokondriellt superoxiddismutas MnSOD (SOD2) överuttryck10.
Bedömningen av ROS produktion i vivo är särskilt utmanande, men förmågan att upptäcka produktion av specifika ROS ger viktig information när förhör oxidativ stress eller redox roll regleras signalering i biologiska inställningar. Lämplig hantering av vävnad när du använder spin sonder och EPR är väsentligt att skapa reproducerbar och meningsfulla resultat. Användning av spin sonder med vävnad kommer inte sannolikt åtgärd superoxid radikaler närvarande vid tidpunkten för vävnad skörd på grund av en kort halveringstid, men istället den upptäcker superoxid produceras av enzymer såsom NAPDH oxidas, uncoupled endothelial kväveoxid syntas , eller xantin oxidas när lungvävnad eller homogenates inkuberas med spin sonden vid 37 ° C. Användning av fryst vävnad kommer inte att innehålla superoxid genereras av mitokondrierna, eftersom frysning skador mitokondriell elektrontransport kedja verksamhet. För att testa mitokondriell superoxid, behöver utredare isolera färska mitokondrier eller användning mitokondriell särskilda sonder i vivo eller i frisk vävnad.
Flera olika protokoll att bevara vävnad har publicerats i litteratur14,15. Vi jämförde tre publicerade metoder för EPR mätningar i lungvävnad: 1) flash frysa vävnad i flytande kväve, 2) homogenisering vävnad i sackaros buffert och 3) att behandla möss i vivo med en snurrande probe 1 timme före vävnad skörd. Vi jämförde kontroll möss till möss med svår lunginflammation och oxidativ stress induceras av bleomycin att testa varje metodens förmåga att Visa konsekventa skillnader i nitroxide signaler i skadade lungor. Alla tre metoderna visade en liknande relativ ökning i nitroxide signal i lungorna av bleomycin-behandlade möss. Användning av blixt fryst vävnad skulle sannolikt vara den enklaste metoden att samla vävnad för de flesta laboratorier, förneka behovet av att bearbeta vävnaden i sackaros bufferten vid tidpunkten för skörd. Injektion av CPH fånga fria radikaler i vivo är kraftfull, men för att bekräfta de specifika arterna, detta kräver en behandlingsgrupp inklusive lämpliga antioxidant.
En utmaning att använda spin sonder är att oxidation av spin sonder för att nitroxide genererar en liknande tre-line EPR spectrum oavsett arterna som är ansvarig för oxidation; Således, det skiljer inte mellan olika ROS arter. Det har också rapporterats att det finns potentiella reaktioner av hydroxylamin sonder med fotosyntetiska elektrontransport kedja och cytokrom c oxidas19,20. Dessa observationer bör övervägas vid tolkning av resultaten. Fotosyntetiska systemet är inte närvarande i detta protokoll, och införlivandet av DTPA med bufferten hämmar risken för nedsmutsning av gratis järnklorid och röd joner10 . Vi visat hur man använder en serie specifika enzymer eller kelatorer i lungvävnaden för att upprätta särskilda ROS bidrag eller enzymhämmare att fastställa källan till ROS. Detta tillvägagångssätt har använts tidigare med EPR för att bestämma ROS bidrag på grund av uncoupled eNOS13,15. Vi tillhandahåller en lista över vanliga hämmare används för att skilja arterna ansvarar för spin sonden oxidation (tabell 1).
Vi visade också vikten av att optimera inkubationstiden för varje experimentella villkor. När jämföra spin sonder snurra fällor, generera spin fällor unika spectra beroende på den reaktant som möjliggör specificitet av fria radikaler art. dock de också uppvisar långsam kinetik för superoxid snurra svällning och är benägna att biologisk nedbrytning. Behandling av lungvävnaden med den EPR sond ex vivo begränsas också av en oförmåga att på ett adekvat sätt skilja extracellulära från intracellulära superoxid på grund av störningar i cellernas membran under bearbetningen av vävnad (frysning eller homogenisering). Användning av den injicerade spin sonden i vivo tillsammans med SOD eller cell-permeable PEG-SOD kan lösa detta problem.
Ett mål var att upprätta ett protokoll för att effektivt samla in prover och lagra dem vid-80 ° C före EPR mätningar. Därför har vi utvecklat en praktisk metod för att använda PTFE slangar för att hålla proverna. Denna slang placeras direkt i fingret dewar för EPR analys på 77 K utan att behöva rengöra dewar mellan prover. Detta är ett alternativ till den nyligen publicerade metod som innebär frysning av prov i 1 mL sprutor. Mätningarna i frysta prover lagras i PTFE slangar kan upprepas över flera dagar att demonstrera stabilitet av signalen. Detta tillvägagångssätt möjliggör dosering EPR mätningarna och underlättar överföring av proverna mellan laboratorier så en remote EPR-anläggning kan köra prover.
Dessa protokoll ger sammantaget ett enkelt tillvägagångssätt för att förbereda celler och vävnader för EPR mätningar i biologiska system. Protokollen kan anpassas till andra modeller som är associerad med oxidativ stress och med användning av andra spin sonder. Timing och koncentration av spin sonden kommer att behöva justeras för varje experimentella villkor. EPR förmåga att fastställa förekomst och produktion av fria radikaler arter otvetydigt ger stringens till experimentella metoder inom redox biologi.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har något att avslöja.
Acknowledgments
Detta arbete stöds av University of Colorado skola av medicin rektorns strategiska forskningsinfrastruktur award, R01 HL086680-09 och 1R35HL139726-01, till E.N.G. och UCD CFReT fellowship award (han). Författarna tackar Dr. Sandra Eaton och Dr Gareth Eaton (University of Denver), Dr Gerald Rosen och Dr. Joseph P. Kao (University of Maryland), och Dr Sujatha Venkataraman (University of Colorado Denver) för bra diskussioner och Joanne Maltzahn, Ashley Trumpie och Ivy McDermott (University of Colorado Denver) för teknisk support.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



