Summary
Elektron paramagnetic rezonans (EPR) spektroskopisi serbest radikallerin ölçmek için kesin bir yöntemdir. Farklı hücresel kompartmanlarda serbest radikallerin algılanması için seçici spin sonda kullanımı sağlar. Biz tedavi, depolama ve örnekleri EPR ölçümler için aktarma kolaylaştırmak biyolojik örnekler toplamak için pratik ve verimli bir yöntem mevcut.
Abstract
Reaktif oksijen türleri (ROS) farklı cep ve doku bölmeleri içinde doğru ve belirli algılama redoks düzenlenir sinyal biyolojik ayarlarında çalışması esastır. Elektron paramagnetic rezonans sprektroskopisidir (EPR) serbest radikallerin belirsizliğe yer bırakmadan değerlendirmek için yalnızca doğrudan yöntemidir. Onun avantajı yüksek özgüllük ile belirli türlerin fizyolojik düzeyleri algılar, ama özel teknolojisi, dikkatli numune hazırlama ve uygun denetimleri doğru verilerin yorumlanması sağlamak için gerektirir. Çevrimsel hydroxylamine spin probları seçerek süperoksit veya EPR spektroskopisi tarafından sayısal bir nitroxide sinyal oluşturmak için diğer radikalleri ile tepki. Hücre geçirgen spin probları ve spin probları hızla mitokondri içinde birikir için tasarlanmış farklı hücresel kompartmanlarda süperoksit konsantrasyon belirlenmesi için izin verir.
Kültürlü hücreleri, hücre geçirgen 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) ile birlikte ve hücre geçirimsiz süperoksit dismutaz (SOD) Önarıtma olmadan kullanımı veya hücre geçirgen PEG-SOD kullanımı, sağlar ekstrasellüler sitozolik süperoksit üzerinden farklılaşma. Mitokondriyal 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethyl-piperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido] piperidinium ve (mito-TEMPO-H) için ölçüm sağlar Mitokondrial ROS (ağırlıklı olarak süperoksit).
Spin sonda ve EPR spektroskopisi vivo içinde modelleri için de uygulayabilirsiniz. Süperoksit ekstraselüler sıvı kan ve alveoler sıvı gibi yanı sıra doku akciğer dokusu gibi algılanabilir. Birkaç yöntem işlemek ve doku EPR ölçümler için depolamak ve intravenöz 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine (CPH) spin sonda içinde vivoteslim için sunulmaktadır. Ölçümler-ebilmek var olmak kılınmak oda sıcaklığında iken, vitro ve in vivo modellerden alınan örnekleri de-80 ° C'de saklanabilir ve 77 K. EPR tarafından analiz Örnekleri özel boru istikrarlı-80 ° C'de depolanan ve bir pratik, verimli, etkinleştirmek için 77 K ve depolama ve aktarma örnekleri kolaylaştırır tekrarlanabilir yöntemini çalıştırın.
Introduction
Oksidatif stres ve reaktif oksijen türlerine tüm organ sistemleri arasında çeşitli hastalıkları çalışma için önemli olmakla birlikte, reaktif oksijen türleri (ROS) tespiti kısa yarılanma ömrü ve yüksek reaktivite nedeniyle zordur. Serbest radikallerin algılamak için en belirgin yöntemi bir elektron paramagnetic rezonans (EPR) tekniğidir. Spin probları daha yaygın olarak kullanılan floresan problar üstünlükleri vardır. Floresan problar nispeten ucuz ve kullanımı kolay ve hızlı, hassas ROS tespiti sağlamak olsa da, onlar manipülasyonun sinyalleri, ROS konsantrasyonları ve özgüllük1 Genel eksikliği hesaplamak için bir yetersizlik nedeniyle ciddi sınırlamalar var mı .
Biyolojik araştırmalar EPR kullanımını kolaylaştırmak için çeşitli biyolojik ilgili serbest radikal türlerin yanı sıra pO2, pH ve redoks ölçebilirsiniz probları sentezlenmiş spin çeşitli devletler2,3, 4,5,6,7. Spin tuzakları da kısa ömürlü radikaller yakalamak için geliştirilmiştir ve form uzun yaşam adducts, hangi EPR8tarafından algılama kolaylaştırır. Her iki sınıfları (spin probları ve spin tuzakları) avantajları ve sınırlamalar vardır. Bir sık kullanılan spin probları sınıfıdır EPR-sessiz ve kararlı bir nitroxide oluşturmak için kısa ömürlü radikaller ile tepki çevrimsel hydroxylamines. Çevrimsel hydroxylamines süperoksit ile 100 kez spin tuzakları, olanaklı kılmak onları hücresel antioksidanlar ile rekabet edebilmek daha hızlı tepki ancak özgüllüğü eksikliği ve uygun denetimleri ve radikal türler veya kaynak tanımlamak için inhibitörleri kullanılmasını sağlayın nitroxide sinyal için sorumludur. Spin sergi özgüllük yakalar süre ile farklı spektral süperoksit bindirme spin için radikal biyolojik yatkındır için desen kapana kısılmış türler üzerinde bağlı olarak, onlar yavaş kinetik var ve adducts. Uygulamalar için spin bindirme Biyomedikal araştırma9,10,11,12,13' te iyi belgelenmiş oldu.
Bu projenin amacı ve deneyler tasarlamaya yönelik pratik EPR yöntemleri göstermektedir için spin kullanarak süperoksit algılamak için örnek hazırlanması farklı hücresel kompartmanlarda içinde vitro ve farklı doku bölmeleri içinde vivoprobları. Birkaç el yazmaları protokolleri analiz fare modelleri için hedef farklı hücresel kompartmanlarda vitro ve işlem doku hücre geçirgen, hücre geçirimsiz ve mitokondrial hedeflenen spin probları kullanarak bu gol ile ilgili yayınlanan 14 , 15. biz kurmak bu beden edebiyat doğru emin olmak için farklı hücresel kompartmanlarda vitro içinde bir 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine (CMH) spin sonda kullanarak süperoksit ölçmek için bir yaklaşım doğrulayarak ölçümler, sonuçları çarpık olası teknik sorunları vurgulayarak. Ayrıca kan, bronchoalveolar lavaj sıvı ve akciğer doku CMH spin sonda kullanarak EPR ölçümleri gerçekleştirmek için yöntemleri sağlar. Bu çalışmalar doku işlemek gibi başka bir spin robot, CPH, doku hasat önce fareler içine enjekte etmek için bir yöntem sunmak için farklı yöntemler karşılaştırın. Son olarak, politetrafloroetilin (PTFE) boru muhafazası ve transferi önce 77 K. ölçülerde EPR örnekleri için izin vermek için örnekleri depolamak için pratik bir yöntem geliştirmek
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tüm hayvan çalışmaları University of Colorado Denver kurumsal hayvan bakım ve kullanım Komitesi tarafından kabul edildi.
1. hazırlanması reaktifler
-
Diethylenetriaminepentaacetic asit (DTPA) hisse senedi (150 mM)
- DTPA 2.95 g ekleyin (393.35 g/mol) 10 mL deiyonize su için.
- DTPA çözülmeye, 1 M NaOH dropwise ekleyin ve 7.0 bir pH getirmek.
- 50 mL su için 150 mM son DTPA konsantrasyon ile ses getirmek ve 4 ° C'de depolayın
-
Fosfat tampon serum (PBS) (50 mM, pH 7,4)
- 5 M sodyum klorür (NaCl) (58.44 g/mol; 29.22 g/100 mL) hazırlayın.
- Potasyum fosfat dibasic HK2PO4 (174.18 g/mol; 17.42 g/100 mL) 1 M hazırlamak
- Potasyum fosfat Yem mono KH2PO4 (136.1 g/mol; 13.61 g/100 mL) 1 M hazırlamak. 5 M NaCl 3 mL 1 M potasyum fosfat dibasic 4.24 mL ve 0,760 mL 1 M potasyum fosfat Yem mono karıştırın. PH kontrol edin.
- 100 mL deiyonize su ile ses getirmek.
- Kısa süreli (gün) (RT) Oda sıcaklığında ve uzun vadeli (hafta) depolama için 4 ° C'de depolayın.
-
100 µM DTPA içeren Krebs-Henseleit arabellek (KHB)
- 50 mL konik santrifüj tüpü 150 mM DTPA hisse senedi çözüm 33,3 µL ekleyin.
- Krebs-Henseleit arabellek (KHB) 50 mL birimle getirmek.
- Her gün taze DTPA önbellekle hazırlamak ve RT. tutmak
-
Sükroz içeren Tris-EDTA arabellek
- 0, 5 M Tris hisse senedi hazırlamak: 15.14 g 150 ml deiyonize su (121.14 g/mol) Tris tabanının geçiyoruz. HCl kullanarak, pH 7.8 için ayarlamak ve 250 mL nihai bir birime getir.
- 21.4 g sükroz dağıtılması (342.29 g/mol; son konsantrasyonu = 0,25 mM) 150 mL deiyonize su içinde.
- Tris stokunun 5 mL sukroz için 10 mM son Tris konsantrasyonu elde etmek için ekleyin.
- 0.5 mL 0.5 M EDTA stokunun Tris-sükroz için 1 mM son konsantrasyonu elde etmek için ekleyin.
- PH kontrol edin ve 7.4 için ayarlayın.
- 250 mL deiyonize su ile son hacmi getirmek ve 4 ° C'de depolayın
-
Sığır eritrosit Cu/Zn süperoksit dismutaz (SOD) hisse senedi (30.000 U/mL)
- PBS (yaklaşık 5.7 mg, etkinlik SOD çok bağlı olarak) 1 mL 30.000 SOD U sulandırmak.
- Aliquot karıştırın ve kısa süreli (6-12 ay)-20 ° C'de ve uzun süreli depolama için-80 ° C'de depolayın.
-
SOD çalışma çözüm (1000 U/mL)
- 30.000 U/mL SOD stokunun 30 µL aliquot steril PBS bir 870 µL aktarın.
- Çözüm buz üzerinde tutmak ve taze kullanabilirsiniz.
-
Phorbol 12-myristate 13-asetat (PMA) hisse senedi (5 mM)
- PMA 1 mg dağıtılması (616.83 g/mol) 325 µL DMSO içinde (son konsantrasyonu 5 mM =).
- Aliquot 5 mM PMA çözüm ve -20 ° C'de saklayın
-
PMA çalışma çözüm (125 µM)
- 5 mM PMA stokunun 10 µL aliquot steril PBS 390 µL sulandırmak.
- Çözüm buz üzerinde tutmak ve taze kullanabilirsiniz.
- PMA için araç kontrol için DMSO 10 µL PBS 390 µL içinde kullanın.
-
Diphenyliodonium klorür (DIP) (2.5 mM)
- 3.2 mg dağıtılması (316.57 g/mol) 4 mL 2.5 mM hisse senedi almak için daldırma.
- Çözüm hazırlamak ve taze kullanabilirsiniz.
-
Deferoxamine mesylate tuz (DFO) (20 mM)
- DFO 4.5 mg dağıtılması (656.79 g / mol) 20 mM hisse senedi almak için 340 µL içinde.
- Çözüm hazırlamak ve taze kullanabilirsiniz.
-
Antimycin A (AA) hisse senedi (5 mM) hazırlanması
- Aa 5.4 mg dağıtılması (532 g/mol) 2 ml etanol (son konsantrasyonu 5 mM =).
- Aliquot cam şişeleri ve mağaza-20 ° C'de stokta
-
Spin probları hazırlanması
- Çözünmüş oksijen bellekten kaldırmak için 50 mM fosfat tampon içeren 100 µM DTPA 30 dk için azot ile kabarcık.
- -20 ° C dondurucudan spin sonda kaldırmak ve RT (10-15 dk) gelmek kapsayıcı sağlar.
- 1-hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine· 2.4 mg tartmak HCl (CMH) (237.8 g/mol)
- 10 mM son bir konsantrasyon için deoxygenated fosfat tampon 1 mL içine CMH geçiyoruz.
- 1-hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine,1-hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium ve (mito-TEMPO-H) (529.1 g/mol) 5 mg tartın.
- Mito-TEMPO-H 9,5 mM son bir konsantrasyon için deoxygenated fosfat tampon 1 mL içine geçiyoruz.
- 1-hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine· 4.9 mg tartmak HCl (CPH) (223.7 g/mol).
- CPH için 22 mM son bir konsantrasyon deoxygenated fosfat tampon 1 mL içine geçiyoruz.
- Aliquot ve mağaza-80 ° c (donma-çözülme tavsiye edilmez).
2. süperoksit içinde vitro tespiti
-
Toplam, hücre ve hücre içi süperoksit RT, ham 264.7 PMA uyarılmış hücrelerdeki tespiti
- Aşağıdaki uygun aseptik teknik, ham 264.7 hücreleri çözülme ve onları DMEM medya ile %10 FBS (düşük endotoksin ücretsiz) ve % 1'antimycotic / ampisilin CO2 kuluçka 37 ° C'de takıma geçiş.
- 1 x 106 tohum ham 264.7 hücreler hücreleri/6-şey kalıplara tedavi öncesinde bir gün iyi.
- Yavaşça medyayı çıkarın ve 1 mL KHB arabelleği bir kez hücrelerle yıkayın.
- Her şey için 100 µM DTPA içeren KHB ekleyin ve aşağıdaki ile 500 µL toplam hacmi içinde tedavi:
- SOD ile ön işleme wells eklemek için 15 µL/iyi SOD çalışma çözüm (1000 U/mL; SOD son konsantrasyonu 30 U/mL =) ve 10 min için önce ek 37 ° C'de CMH ve PMA kuluçkaya.
- 12.5 µL/iyi 10 mM CMH stokunun ekleyin (son konsantrasyonu = 0,25 mM).
- 40 µL/iyi 125 µM PMA çalışma çözüm ekleyin (son konsantrasyonu 10 µM =) ya da 40 µL araç (DMSO hisse senedi 10 µL PBS 390 µL içinde).
- CO2 kuluçka 37 ° C'de 50 dk için kuluçkaya.
- Tabakları da kuluçka kaldır ve hemen buza koyun.
- Arabellek ayrı, 1,5 mL tüpler etiketli, her kuyuya toplamak. Buzda tut.
- Taze KHB arabelleği 100 µM DTPA içeren 100 µL eklemek, yavaşça hücreleri scrape ve yukarı ve aşağı birkaç kez pipetting tarafından resuspend. Hücre resuspension boyunca buzda tut.
- Yük örnek adım 2.1.10 ve 2.1.11 (50 µL) her kılcal tüpler içinde toplanır. Her iki ucu mühür ve EPR çalıştırın.
Not: Her zaman bir tüp test veya arabellek soruşturma de olmayan (hücreler) içeren (aynı konsantrasyonu = 0,25 mM), sonda yoğunluğunu arka plan olduğundan sıcaklık - bir denetim olarak (aynı kuluçka zaman ve sıcaklık) hücreler olarak aynı koşullarda tedavi ve saat-bağımlı. - EPR satın alma parametrelerini ayarlamak için aşağıdaki: Mikrodalga frekansı 9.65 GHz; = Orta sahaya 3432 G; = Modülasyon genlik = 2.0 G; Süpürme genişliği = 80 G; Mikrodalga güç 19,9 = mW; Toplam Tarama sayısı = 10; süpürme zaman 12.11 = s; ve zaman sabit 20.48 ms =.
-
HAM 264.7 hücrelerde mitokondrial süperoksit tespiti
- 2.1.1 ve 2.1.2 tohum ham 264.7 hücrelere bir gün önce deneme adımları.
- Medyayı çıkarın ve 1 mL KHB arabelleği bir kez hücrelerle yıkayın.
- Her şey için 100 µM DTPA içeren KHB 200 µL ekleyin.
- 5.3 µL/iyi 9,5 mM mito-TEMPO-H stokunun ekleyin (son konsantrasyonu = 0,25 mM)
- 10 dakika dik, kuluçkaya
- 1 µL/iyi antimycin A (AA), 5 mM etanol hisse senedi çözümde eklemek (son toplama 25 µM =).
- CO2 kuluçka 37 ° C'de 50 dk için kuluçkaya.
- Tabakları da kuluçka kaldır ve hemen buza koyun.
- Yavaşça hücreleri scrape ve yukarı ve aşağı pipetting tarafından resuspend. Buz üstünde tutun.
- Örnek bir kılcal tüp yükleyin. Her iki ucu kapatın.
- EPR ayarı için önceki bölüme bakın.
-
Süperoksit 77 k ham 264.7 hücrelerdeki tespiti
- Adım 1.1.10 önceden hazırlanmış PTFE 1-2 inç içinde uzunluk (3/16" x 1/8" kimliği OD) boru'de toplanan arabelleği yerleştirin. Böylece bunu kolaylıkla eklenen ve parmak kaldırıldı PTFE boru düz olduğundan emin olun dewar. Kauçuk tıpa PTFE boru bir ucunu kapatın, arabellek veya hücre süspansiyon (100-150 µL) PTFE boru içine pipette ve ikinci bir tıpa ile tüp mühür kullanmak.
- Flaş donma örnek sıvı azot. Örnek bir etiketli dondurma tüp-80 ° C'de depolama için transfer veya hemen çalıştırın.
- Parmak doldurmak dewar sıvı azot ve INSERT parmak örnek içeren PTFE boru ile dewar. Emin olun örnek rezonatör etkin uzayda merkezli ve 77 K. EPR çalıştırın
Not: Azot Gaz akışı, spektrometre için başlatma 15-30 dk önce ölçümleri ve su yoğunlaşma rezonatör içinde önlemek için ölçümleri boyunca bu akışı devam. - Set EPR edinme parametreler şu şekilde: Mikrodalga frekansı 9.65 GHz; = Orta sahaya 3438 G; = Modülasyon genlik = 4.0 G; Süpürme genişliği = 150 G; Mikrodalga güç 0.316 = mW; Toplam Tarama sayısı = 10; süpürme saat = 60 s; ve zaman sabit 1.28 ms =.
3. EPR ölçümlerde sıvıları
-
Tam kan
- Fareler (8-12 hafta yaşlı) PBS veya PBS yukarıda açıklanan16,17olarak yalnız çözünmüş boğaza bleomycin (Bleo; 1 U/mL, 100 µL) tek bir doz ile tedavi.
- Fareler inhale isoflurane (1.5-%4) ardından kan kaybı ve servikal çıkığı yönetmek olarak ötenazi. Kan yoluyla sağ ventrikül içine 100 µM DTPA ve 1,5 mL tüp transferi içeren heparin (1000 USP/mL) ile kaplı bir şırınga Aspire edin.
- Bir ayrı 1,5 mL tüp 100 µM DTPA içeren PBS 15 µL ekleyin ve CMH (10 mM) 3 µL kan 150 µL toplam hacmi ve 0.2 mM son CMH konsantrasyon için 132 µL için.
- Kan bir su banyosu içinde 37 ° C'de 10 dakika için kuluçkaya.
- Borular su banyosundan kaldırın.
- Bir aliquot kan kılcal tüp içinde yükleyerek alıp EPR RT aşağıdaki EPR edinme parametrelerle: Mikrodalga frekansı 9.65 GHz; = Orta sahaya 3432 G; = Modülasyon genlik = 1.0 G; Süpürme genişliği = 80 G; Mikrodalga güç 19,9 = mW; Toplam Tarama sayısı = 3; süpürme zaman 12.11 = s; ve zaman sabit için 77 K. EPR edinme parametreleri ölçülerde aşağıdaki örnekleri olmak flash başlığı altında açıklandığı adım 2.3 olarak donmuş 20.48 Bayan alternatif olarak, =: Mikrodalga frekansı 9.65 GHz; = Orta sahaya 3438 G; = Modülasyon genlik = 4.0 G; Süpürme genişliği = 150 G; Mikrodalga güç 0.316 = mW; Toplam Tarama sayısı = 2; süpürme saat = 60 s; ve zaman sabit 1.28 ms =.
-
Bronchoalveolar lavaj sıvısı (BALF)
- Ötenazi sonra (bkz. Adım 3.1.2), yavaş yavaş instilling ve 1 mL 100 µM DTPA borusunda yerleştirilen bir kanül üç kez bir şırınga ile içinde içeren PBS çekilmesi tarafından BALF toplamak.
- Bir 1,5 mL tüp BALF 200 µL 4 µL 0.2 mM son bir konsantrasyon elde etmek için CMH (10 mM) ile tedavi.
- BALF su banyosu içinde 37 ° C'de 50 dk için kuluçkaya.
- Borular su banyosu dışarı almak ve buza koyun.
- Yük BALF bir kılcal tüp ve RT, çalışma EPR aynı EPR ayarları ile kullanılan gibi adım 1.1.13 veya flaş dondurma sıvı azot 2.3 adımda anlatıldığı gibi.
-
Kan ve BALF EPR ölçümlerde 77 k
- Kan toplamak için yukarıdaki protokolü takip (3.1.1 adımlar. 3.1.4 için) ve BALF (adım 3.2.1 3.2.4).
- Tedavi kan veya BALF PTFE (1-2 inç) boru içinde yer 150 µL. Kauçuk tıpa örnek ve tüp mühürlemek için başka bir tıpa eklemeden önce PTFE boru bir ucunu kapatmak için kullanın.
- Flaş donma örnek sıvı azot.
- Ayrıntılar için bölümüne 2.3 EPR dewar 77 K. Çalıştır dondurulmuş CMH, kan örnekleri ile bir haftada tedavi parmak kullanarak PTFE boru içinde donmuş numuneler üzerinde çalışıyor bakın.
4. EPR ölçümleri akciğer dokusu üzerinde
-
Donmuş akciğer doku flash
- 3.2.1. adımda BALF toplama sonra göğüs açılır ve akciğerler 10 mL ile soğuk PBS üzerinden kan kaldırmak için sağ ventrikül temizlendi. Flaş donma sıvı azot akciğer dokusunda. Donmuş akciğer doku-80 ° C'de EPR ölçümleri için 6 ay kullanım kadar depolanabilir.
- Akciğer dokusu Kuru buz üzerinde cımbız ile stabilize ve birden çok küçük parçalar (5-15 mg) tek-kenar bıçak kullanarak akciğer dokusunun kesin.
- Doku tartmak bir 1,5 mL Tüp, tüp ölçek üzerinde yer ve ölçeğin, Dara sonra doku parçaları ekleyin ve ağırlığı kaydetmek.
- 1.5 mL tüp dokusunda için 200 µL toplam hacmi elde etmek için DTPA ve 4 µL CMH (0.2 mM) içeren KHB 196 µL ekleyin.
- Bir su banyosu içinde 37 ° C'de 1 h için kuluçkaya.
- Aşağı bir microcentrifuge 3,884 x g de (birkaç saniye) spin.
- Buza koyun ve süpernatant ile 150 µL PTFE boru içine pipet ve 77 K ölçülerini 2.3 bölümünde açıklandığı gibi dondurma.
Not: Bu yöntem için yaralanma heterojen dikkate alınması gerekiyor. Son derece heterojen bir yaralanma, verilen bu bleomycin kaynaklı akciğer yaralanma için her fareden farklı yerlerinden akciğer birkaç doku parçaları kesmek için önerilir. Alternatif olarak, doku daha büyük bir parça KHB arabelleği 100 µM DTPA 1:6 kilo hacim oranı (mg/µL), aşağıda açıklandığı gibi içeren homojen.
-
Sükroz arabellekte korunmuş taze akciğer dokusu
- Adım 3.1.2 yapılır gibi kan kaldırmak için soğuk PBS ile lavaged akciğer Temizleme.
- Dounce doku değirmeni bir cam veya PTFE havaneli ile kullanarak 1:6 akciğer/arabellek (mg/µL) oranı ile 0.25 M Sükroz içeren Tris-EDTA arabellek taze akciğer dokusunda lunaparkçı.
- Akciğer homogenate 50 µL 100 µM DTPA içeren KHB 450 µL için ekleyin.
- Bir 1,5 mL tüp içinde (bir toplam hacmi 100 µL), 98 µL KHB akciğer homogenate için 10 mM stokunun CMH-0.2 mM son bir konsantrasyon elde etmek için 2 µL ekleyin.
- 20 dk 37 ° C'de bir su banyosu için kuluçkaya.
- Örnekleri buza koyun ve kapiller tüpünde yükleyin. EPR RT (2.1.13 adımda kullanılan ayarları) çalıştırın.
- Belirli tür ve farklı inhibitörleri kullanarak kaynakları katkısını sınamak için akciğer homogenate inhibitörü KHB ile 98 µL son hacmi elde etmek için ayarlama, +/-88 µL önceden tedavi. Bu deneyde, SOD 10 µL inhibitörleri dahil (100 U/mL), Deferoksamin 4 µL (DFO; son konsantrasyonu = 800 µM), veya diphenyliodonium klorür 4 µL (DIP; son toplama 100 µM =). Bir su banyosu içinde 37 ° C'de 20 dk için kuluçkaya.
- CMH 2 µL ekleyin ve yukarıda açıklandığı gibi EPR ölçümleri tarafından takip 37 ° C'de başka bir 20 dk için kuluçkaya. Bir kerelik eşleşen boş örnek CMH sükroz arabellek içeren KHB ile içerir. Alternatif olarak, gelecekte ölçümler için-80 ° C'de kalan akciğer homogenates (adım 3.1.2) aliquots saklayın.
Not: Toplam hacim gerektiği şekilde ölçeklenebilir.
-
Akciğer doku spin probları vivo içinde (RT doku hücre kullanarak) adlı enjekte fareler üzerinde EPR ölçümler
- CPH hisse senedi çözüm CPH 4.9 mg 50 mM filtre uygulanmış ve deoxygenated fosfat tampon 1 ml çözülerek hazırlayın.
- Fareler inhale isoflurane (% 1.5-4) ile 20-30 saniye boyunca yanıt vermiyor kadar çimdik tırnağa anestezi. Fare ile retroorbital yol CPH spin inceleyebilirsek 25 g fare vücut ağırlığı için 100 µL ile enjekte (son dozu 20 mg/kg =) ve sonda 1 h. için hemen retroorbital enjeksiyon sonra dolaşımda, % 0.5 proparacaine HCl bir damla göz çevresi için preve eklemek izin NT göz ağrısı ve kuruluk. Fareler için 1 h izlemek ve doku hasat için devam edin.
- Akciğer dokusu yukarıda açıklandığı gibi hasat ve flaş dondurma akciğerler.
- 20-30 mg donmuş doku kuru buza kesti ve tam ağırlık kaydedin.
- Doku temizlik bezleri herhangi bir yüzey su emme ile yavaşça silin.
- Doku (suç ortağı doku örnekleri EPR ölçülerini sağlar) doku hücre penceresi içinde yerleştirin ve EPR toplam spin belirlemek için çalıştırın. Verileri doku mg başına toplam spin olarak ifade edilebilir.
5. veri analizi
- Tezgah üstü EMXnano EPR Spektrometre Xenon yazılım verilen SpinFit modülü kullanılarak EPR spectra simülasyonu. SpinCount modülü tarafından nitroxide konsantrasyonu belirlemek. Alternatif olarak, istikrarlı bir nitroxide 4-hidroksi-TEMPO veya TEMPOL gibi bir kalibrasyon eğrisi yapılabilir ve konsantrasyonu örnek ve standart ile sinyal yoğunluğu karşılaştırarak elde edilebilir.
- 77 K toplanan veriler için çift entegrasyon tarafından SpinCount ardından kullanın.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
CMH süperoksit algılama doğrulanmış X kullanarak / XO süperoksit üreten katalaz (Şekil 1A) etkisi varken nitroxide (CM.) sinyal SOD tarafından inhibe tam olarak göstermek için sistem. Toplam, hücre dışı süperoksit, hücre geçirgen CMH spin sonda SOD Önarıtma +/-ile sonra çiğ 264.7 hücreleri kuluçka hücreleri tarafından değerlendirilmiştir. Nitroxide konsantrasyonu hücre süspansiyon ve iki örnek türü değerleri benzer geçirgen doğa ve spin inceleyebilirsek (Şekil 1B) hızlı denge nedeniyle gösterdi arabellek ölçüldü. Nitroxide radikal sinyal kontrol hücrelere kıyasla PMA ile ham 264.7 hücrelerde uyarılmış arttı. Bu sinyal önemli ölçüde hücre geçirimsiz SOD (Şekil 1 c) ön işleme hücrelerdeki zayıflatılmış. Her rengin farklı günlerde belirli günlerde toplanan verilerin tutarlılığını ve tekrarlanabilirlik sonuçları zamana gösteren test wells temsil eder. Hücre dışı süperoksit konsantrasyonu SOD ile gelen sinyal PMA sonra SOD (T) yokluğunda ön işleme PMA hücrelere sinyal çıkararak tespit edilmiştir. Kalan sinyal hücre içi süperoksit (Şekil 1 c) neden olduğu bildirildi. Şekil 1 d toplam ve ekstraselüler süperoksit hesaplanması göstermektedir. (E) hücre içi sinyal PMA tedavi hücrelerde medya ve PEG-SOD etkisi sinyal tarafından çıkarıldıktan sonra doğrulandı. (C), aksine bu grafikte CMH boş ölçümleri düşülen değil ve ham veriler gösterilir.
HAM 264.7 hücrelerde mitokondrial süperoksit EPR spin sonda mito-TEMPO-mitochondia içinde biriken H, kullanarak tespit edildi. (A) temsilcisi EPR spectra temel mito-TEMPO-H sinyal arabellek, artan mito-TEMPO-H sinyal kontrol hücreleri (Con) içinde ve hücrelerde mitokondrial inhibitörü Antimycin A (AA) ile uyarılan daha gelişmiş sinyal için. Sinyal artışı önemli ölçüde zayıflatılmış ölçümleri mito-TEMPO-H10ile o SOD2 overexpression gösterilen bizim önceki çalışmada mitokondrial süperoksit için neden olduğu bildirildi. Şekil 2B, mitokondriyal nitroxide konsantrasyon zaman eşlemeli hücre ölçümleri arabelleğinden mito-TEMPO-H sinyalin çıkararak tespit edilmiştir. HAM 264.7 hücrelerdeki düşük sıcaklıklarda stimülasyon ile PMA sonra SOD de elde edilen CM. sinyal. (Şekil 3A) CM. sinyal SOD, oda sıcaklığında veri (Şekil 1) ile tutarlı huzurunda zayıflatılmış. Şekil 3B için hücreleri ve in vivo örnekleri 77 k veri toplamak için kullanılan stoper ile PTFE boru fotoğrafı gösterir. Süperoksit üretimi ve CMH spin sonda kullanarak BALF kanıyla tespit edildi. Kan veya BALF örnekleri PBS ve Bleo tedavi fareler toplanmıştır ve hemen CMH ile inkübe. Örnekleri PTFE boru ve dondurulmuş flaş transfer edildi ve EPR veri 77 K. denizden çıkarıldı Nitroxide (CM.) konsantrasyonu 10 dk (Şekil 4A) 37 derece CMH (0.2 mM) ile inkübe kan birikmiş. Nitroxide (CM.) konsantrasyon BALF üzerinden 50 dk (Şekil 4B) inkübe. BALF denemede kullanılan ya da Nitroxide konsantrasyon kan hacmindeki birikmiş konsantrasyonu (cm.) gösterir.
Üç yöntem doku koruma bazı yayımlanmış teknikler değerlendirmek için test edilmiş ve ex vivo vsspin İdaresi sondalar. içinde vivo. EPR ölçümleri akciğer dokusu üzerinde gerçekleştirmek için biz ilk flash donmuş akciğer doku denetiminden kullanılan ya da fareler yaralandı. Şekil 5A toplam CM. sinyal 37 ° C'de CMH ile PBS ve Bleo tedavi edilen farelerde sırasıyla inkübe akciğer doku küçük bir parçası süpernatant gösterir. Bleo tedavi sonrası akciğer yaralanması heterojen nedeniyle bu akciğer farklı bölgelerden parçalar kesip daha temsili bir değer sağlamak için çeşitli ölçümler ortalama önerilir. Alternatif olarak, bir bütün akciğer homojenize ve bu homogenate bir örneğini kullanın. 77 K PTFE boru kullanarak toplanan veri ve dewar parmak. Şekil 5B nitroxide (CM.) sinyallerin temsilcisi spectra sırasıyla PBS ve Bleo tedavi fareler gösterir.
Akciğer doku ex vivo tedavi için bir güvenilir bir şekilde hücre içi süperoksit hücre zarı bozan doku işlenmesi nedeniyle ekstrasellüler ayırt etmek mümkün değildir kısıtlamadır. Bu bilgi için deneysel soru önemli ise, aşağıda açıklanan vivo içinde CPH korumak yöntemini kullanarak ele alınabilir. Donmuş doku mitokondrial süperoksit değerlendirmek için kullanılamaz; Yine de, bu ölçüm için protokol mito-TEMPO-H doku veya taze izole mitokondri içinde kullanmak için adapte edilebilir.
Akciğer dokusunda EPR ölçümler için ikinci bir yöntem taze doku sükroz arabellekte homojenize. Akciğer homogenate DTPA içeren KHB arabellekte CMH sonda ile inkübe. EPR ölçümleri taşınan out RT. Şekil 6A , CM. artış gösterir Bleo ile. Biz bir ek sınama CM. katkıda tür belirlemek için kullanılan farklı inhibitörleri kullanarak sundu sinyal. Akciğer dokusundan üretilen CM. sinyal kökeni aydınlatmak için biz birkaç leş yiyiciler ve enzim inhibitörleri ile akciğer homogenates pretreated. Akciğer homogenates CMH ile olmaması veya SOD, deferoxamine (DFO) ve diphenyliodonium klorür (DIP (sırasıyla) süperoksit, demir veya oluşturulan süperoksit katkıları için hesap) varlığı üzerinden flavin içeren inkübe enzimler (Şekil 6B). Bu yaklaşım bir sistemde oluşturulan belirli radikal türler değerlendirmek veya enzimatik diğer kaynaklardan katkısını aydınlatmak için adapte edilebilir (Örn., NOX, eNOS veya ksantin oksidaz).
Fareler EPR ölçüleri içinde vivogerçekleştirmek için retroorbital yol CPH spin problar (20 mg/kg) yolu ile ile enjekte edildi. CPH sonda toksik olmayan olmak rapor ederken olup CMH güvenli bir şekilde hayvanlar için yönetilebilir bilinmiyor; Böylece, CPH in vivo deneyler için seçili. Akciğer dokusu hasat ve flash sıvı nitrojen 1 h CPH probları dolaşım sonra donmuş. Fareler aynı anda sinyal için sorumlu tür ayırt etmek için belirli antioksidanlar ile tedavi edilebilir. Şekil 7A daha yüksek CP. gösterir farelerde Bleo tedavi kontrol fareler için karşılaştırıldığında sinyal. Kontrol ve Bleo tedavi edilen farelerde akciğer dokusunun temsilcisi spectra Şekil 7Biçinde gösterilir. CP. , karışık bir EPR spectra ve askorbik asit radikal gözlendi. Şekil 7A içinde bildirilen değerlerin CP. konsantrasyonları vardır bileşenleri. Veri RT doku hücre kullanarak toplanmıştır.
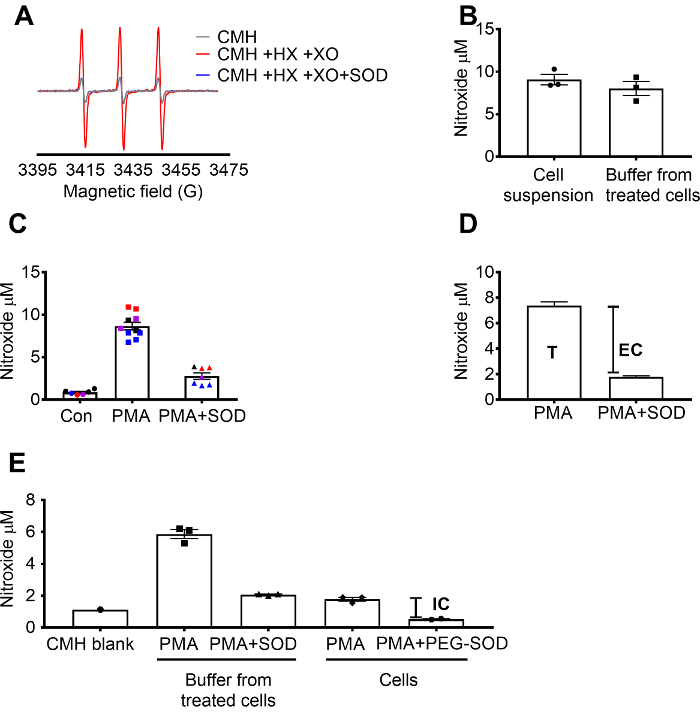
Şekil 1: farklı hücre bölmeleri süperoksit tespiti. (A) EPR spectra 0,25 mM CMH 0,5 mM hypoxanthine/ksantin oksidaz (8 mU/mL) ve SOD olmadan tarafından oluşturulan (30 U/mL). (B) RAW 264.7 hücreleri (1 x 106 hücreler/de) ile 10 µM PMA CMH huzurunda 50 dk 37 ° C ve nitroxide konsantrasyonu (µM), hücre süspansiyon (hücre + arabellek) tespit ve tedavi hücreleri toplanan arabellek için teşvik. (C) RAW 264.7 hücreleri PMA vsile teşvik. Araç kontrol (Con). Bir hücre kümesi ön işleme ile 30 U/mL hücre geçirimsiz SOD (PMA + SOD) 10 dk için. Her renk veri farklı deneysel gün ve bireysel hücrelerin her noktası iyi temsil eder. Zaman eşlemeli boş nitroxide sinyal KHB CMH ile son değerleri elde etmek için her sinyal düşülen. (D) PMA toplam ve ekstraselüler süperoksit hesaplanması hücreleri teşvik; T toplam süperoksit, EC = hücre dışı süperoksit (SOD inhibitable sinyal) =. (E) hücre içi süperoksit sinyal (IC) değerlendirmek için PMA + SOD sonra tampon sinyal arabellek kaldırıldıktan sonra PMA tedavi hücrelere karşılaştırıldı. Onaylamak için kuyu 60 U/mL hücre geçirgen PEG-hücre içi SOD inhibitable belirlemek için çim ile 1,5 saat için ön işleme. Zaman eşlemeli CMH boş gösterilir ve mutlak nitroxide sinyal verileri yansıtacak. İfade ortalama ± SEM veri Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2: antimycin A. ile uyarılan ham hücrelerdeki mitokondrial süperoksit tespiti (A) mitokondrial özgü EPR spin temsilcisi spectra sonda, 0,25 mM mito-TEMPO-H (Con) olmadan ham 264.7 hücrelerdeki veya 37 ° C'de 50 dk 25 µM antimycin A (AA) ile (B) CM. konsantrasyonu (µM) hücrelerdeki denetimine göre AA ile tedavi. Nitroxide sinyal zaman eşlemeli mito-TEMPO-H boş son değerleri elde etmek için toplam sinyalini düşülen. İfade ortalama ± SEM veri Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3: ham 264.7 süperoksit tespiti hücreleri 77 K. (A) ham 264.7 hücreleri ile 10 µM PMA ve EPR spin sonda, CMH 0,25 mM (50 dak. 37 ° C'de) (siyah) ile uyarılan veya ile 30 U/mL SOD (kırmızı) Önarıtma olmadan. 100 µL süpernatant, 1-inç içinde uzunluk parça PTFE boru, daha sonra sıvı azot içinde dondurulmuş flaş yüklendi. Stoper çıkarıldı ve donmuş PTFE boru parmak yerleştirildi dewar PTFE boru ve stoper 77 K. (B) A fotoğraf veri toplama. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4: kan ve BALF EPR ölçümlerde kontrol ve fareler bleomycin tedavi. Fareler tek doz boğaza bleomycin (BT Bleo) ile tedavi (1 U/mL, 100 µL) ya da PBS araç. 7 gün fare anestezi ve ötenazi. Toplanan yolu ile sağ ventrikül delik içine 1000 ile kaplı bir şırınga kandı USP/mL heparin 100 µM DTPA içeren. Bronchoalveolar lavaj sıvısı (BALF) lavaj tarafından toplanan 1 mL 100 µM DTPA PBS ile akciğerler. Kan ve BALF 10-50 dk için sırasıyla, 0.2 mm CMH 37 ° C'de inkübe 150 µL kan veya BALF sıvı azot ve EPR veri 77 K bir parmak kullanarak toplanan dondurulmuş PTFE boru Flash yüklü olduğunu dewar. (A) ve (B) BALF kanıyla verileri göstermek nitroxide konsantrasyonları PBS ve Bleo tedavi fareler (n = 4-6). ± SEM (C) temsilcisi spectra nitroxide fareler PBS ve Bleo tedavi kan içinde yani ifade veri. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 5: flash donmuş akciğer doku ölçümlerde EPR. Fareler tek doz boğaza bleomycin (BT bleo) ile tedavi (1 U/mL, 100 µL) ya da PBS araç. 7 gün, akciğerlere kan ve sıvı azot içinde donmuş flash kaldırmak için soğuk PBS ile sarf. 5-15 mg flaş donmuş akciğer dokusunun 0.2 mM 200 µL 37 ° C. süpernatant ve PTFE boru yerleştirilmiş toplanan 1 h için toplam hacminin 100 µM içeren KHB CMH ile inkübe ve parmağında 77 K çalıştırın dewar. (A) Nitroxide konsantrasyonu (nitroxide doku 1 mg için normalleştirilmiş µM). Verileri her akciğer için 2-3 ölçüm ortalamasını temsil eder. Veri olarak ifade ± nitroxide PBS ve Bleo tedavi fareler gelen akciğer dokusunda SEM (B) temsilcisi spectra demek. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 6: akciğer doku sükroz arabellekte korunmuş ölçümlerde EPR. Fareler boğaza bleomycin (1 U/mL, 100 µL) tek bir doz ile tedavi edildi. 7 gün tedavi sonrası, akciğerlere kan kaldırmak için soğuk PBS ile sarf ve taze akciğer doku 1:6 akciğer ağırlık/tamponu birim (mg/µL) oranında 0,25 mM Sükroz içeren Tris-EDTA arabellekte homojenize. Akciğer homogenate 50 µL preincubated KHB ile veya olmadan 37 20 dk için aşağıdaki inhibitörleri ° C: SOD (100 U/mL), kuluçka 0.2 mM 100 µM DTPA içeren KHB CMH ile tarafından takip deferoxamine (DFO; 800 µM) ve diphenyliodonium klorür (DIP; 100 mikron) 37 ° C'de için 20 dk Veri RT EPR kılcal tüpler kullanarak elde edildi. (A) PBS ve Bleo tedavi fareler akciğerlerden konsantrasyon Nitroxide. (B) Nitroxide konsantrasyon olmaması veya inhibitörleri varlığı Bleo akciğerlerde (n = 3). İfade ortalama ± SEM veri Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 7: CPH spin sonda ile enjekte fareler akciğer dokusundan ölçümlerde EPR. CPH 100 µL yönetilen yolu ile retroorbital enjeksiyon için 20 mg son bir konsantrasyon CPH kg vücut ağırlığı başına yapıldı. 1 h dolaşım sonra fareler ötenazi, akciğerler 10 mL ile soğuk PBS üzerinden sağ ventrikül sarf ve akciğer doku dondurulmuş flash yapıldı. 20-30 mg akciğer doku doku hücresine yerleştirildi ve EPR ölçümleri spin ifade edilen (A) veri RT gerçekleştirilen / mg. (B) temsilcisi spectra nitroxide, sinyal PBS ve Bleo akciğer dokusu (* askorbik asit radikal ile örtüşme gösterir). İfade ortalama ± SEM veri Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| İnhibitörleri | Türler |
| Süperoksit dismutaz (SOD) | Hücre dışı süperoksit |
| Süperoksit dismutaz-Polietilen glikol (PEG-SOD) | Hücre içi süperoksit |
| Katalaz | Hidrojen peroksit radikalleri dayalı |
| Ürat | Peroxynitrate |
| Etanol ve DMSO | Radikal hidroksil |
| Metal şelatörlerin | Metal iyonları (demir ve bakır) |
Tablo 1. Tür spin sonda oksidasyon için sorumlu ayırt etmek için kullanılan ortak inhibitörleri.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Düzenlenmiş anlayış redoks sağlık ve hastalık sinyal biyolojik ayarları üretimde serbest radikal değerlendirilmesi önemlidir ama bu tür son derece serbest radikal türlerin kısa yarılanma nedeniyle zorlu ve teknik ölçüsüdür Genel olarak kullanılan sınırlamalarla. EPR redoks biyoloji, değerli ve güçlü bir araç olduğu serbest radikallerin algılamak için sadece belirli bir yöntemdir. Bu projede, biz tasarlama deneyler ve spin kullanarak ROS probları farklı hücresel kompartmanlarda vitro ve farklı doku bölmeleri algılamak için örnek hazırlanması için pratik EPR yöntemleri göstermek içinde vivo. Ayrıca biyolojik örnekler üstesinden ve verimliliği artırmak için örnekleri depolamak için pratik yöntemler sağlar.
Spin sonda ROS ile verimli bir şekilde tepki ve EPR ile tespit edilebilir bir istikrarlı nitroxide radikal üretmek. Spin sonda (siklik hydroxylamine) çeşitli türevleri onları serbest radikal üretim farklı hücresel kompartmanlarda10algılamak için uygun hale farklı geçirgenlik özelliklere sahip sentez. Bu iletişim kuralı hücre geçirgen spin sonda, CMH kullanılan; Yine de, geçirimsiz spin sonda 1-hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium klorür HCl (CAT1H) hücre dışı süperoksit algılamak için kullanılabilir. İnsan lymphoblast hücre hatları18' de önceki bizim eğitim için benzer, Biz geçirgen CMH spin sonda ile geçirimsiz SOD kullanımını doğrulamak ve geçirgen PEG-SOD RAW264.7 hücrelerinde (bir fare akciğer makrofaj hücre satır) teşvik için PMA ile hücre başardık hücre dışı ve hücre içi süperoksit arasında ayırt etmek.
Biz de CMH hızlı denge içi ve ekstra cellular bölmeleri arasında doğrulanır ve süperoksit sinyal önemli ölçüde sonra sadece bir kez hücrelerle KHB (veri gösterilmez) yıkama damla hücreleri de bulduk. Biz yardımcı programı mitokondrial belirli spin sonda mito-TEMPO-h ham 264.7 hücrelerde mitokondrial elektron taşıma zinciri inhibitörü antimycin A. ile stimülasyon üzerine oluşturulan artan mitokondrial süperoksit ölçmek için doğruladı Mito-TEMPO-h mitokondrial süperoksit üretiminin belirli katkı daha önce gösterdi ve deneylerde izole taze mitokondri veya sistemleri mitokondrial süperoksit dismutaz MnSOD (SOD2) ile kullanarak onaylanabildiğini overexpression10.
ROS üretim vivo içinde değerlendirilmesi, özellikle zorlu ama oksidatif stres veya redoks rolü sorguya biyolojik sinyal düzenlenir önemli bilgileri belirli ROS üretimini algılama yeteneğini sağlar Ayarlar. Uygun işleme spin kullanırken doku probları ve EPR tekrarlanabilir ve anlamlı sonuçlar üretmek için esastır. Spin probları ile doku kullanımı büyük olasılıkla ölçü süperoksit radikalleri doku nedeniyle kısa yarılanma hasat zamanında mevcut, ancak bunun yerine NAPDH oksidaz, edilişi endotelyal nitrik oksit sentaz gibi enzimler tarafından üretilen süperoksit algılar won't , ya da ne zaman akciğer doku veya homogenates ile spin sonda 37 ° C'de inkübe ksantin oksidaz Donmuş doku kullanımı mitokondri tarafından oluşturulan dondurucu hasar mitokondrial elektron taşıma zinciri aktivite beri süperoksit içermez. Mitokondrial süperoksit, müfettişler ayrı tut moduyla yeni mitokondri veya kullanım mitokondrial belirli probları vivo içinde veya taze doku yeterlidir;
Doku korumak için birkaç farklı protokolleri edebiyat14,15' te yayınlanmıştır. Biz akciğer dokusunda EPR ölçümler için yayımlanmış üç yöntem göre: 1) flaş doku sıvı azot içinde dondurma, 2) sükroz arabellek dokusunda homojenizasyon ve 3) fareler vivo içinde bir spin ile tedavi sonda doku hasat önce 1 saat. Biz kontrol fareler farelere şiddetli akciğer iltihabı ve oksidatif stres yaralı akciğerlerde tutarlı nitroxide sinyalleri farklılıkları göstermek için her yöntemin olanağı sınamak için bleomycin tarafından indüklenen ile karşılaştırıldığında. Üçünü nitroxide sinyal bleomycin tedavi farelerin akciğerlerde benzer bir göreceli artış gösterdi. Flash donmuş doku kullanımı büyük olasılıkla doku doku sükroz arabellekte hasat anda işleme gerek inkâr çoğu labs için toplamak için en kolay yaklaşım olurdu. CPH serbest radikallerin vivo içinde yakalamak için enjeksiyon güçlüdür ama belirli türler doğrulamak için bu uygun antioksidan de dahil olmak üzere bir tedavi grubunda gerektirir.
Spin probları kullanmanın bir spin probları nitroxide için oksidasyon oksidasyon için sorumlu türü ne olursa olsun benzer bir üç satırlık EPR spektrum oluşturur mücadeledir; Böylece, farklı ROS türler arasında ayrım yapmaz. Ayrıca, bu fotosentetik elektron taşıma zinciri ve sitokrom c oksidaz19,20hydroxylamine sondalar olası tepkileri vardır bildirilmiştir. Bu gözlem sonuçlarını yorumlarken düşünülmelidir. Bu iletişim kuralı, fotosentetik sistemi mevcut değil ve DTPA eklenmesi arabellek ile ücretsiz ferrik ve bileşiklerinin iyonları10 potansiyel kirlilik engeller. Biz bir dizi belirli enzimler veya şelatörlerin akciğer dokusunda belirli ROS katkısını veya enzim inhibitörleri ROS kaynağını belirlemek için kurmak için nasıl kullanılacağı gösterilmiştir. Bu yaklaşım daha önce EPR ile ROS katkı nedeniyle edilişi eNOS13,15belirlemek için kullanılmıştır. Biz ortak inhibitörleri tür spin sonda oksidasyon (Tablo 1) sorumlu ayırt etmek için kullanılan bir listesini sağlar.
Biz de kuluçka zaman deneysel her koşul için en iyi duruma getirme önemini gösterdi. Ne zaman tuzakları dönmeye spin karşılaştırma probları, serbest radikal türler özgüllük için izin veren reaksiyona bağlı olarak benzersiz spectra spin tuzak üreten; Ancak, onlar da süperoksit spin için bindirme yavaş kinetik sergi ve biyolojik için daha yatkındır. Tedavi ile EPR sonda ex vivo akciğer dokusunun da yeterli hücre dışı doku işleme sırasında hücre zarı bozulma nedeniyle hücre içi süperoksit dan ayırmak için bir yetersizlik ile sınırlıdır (donma veya Homojenizasyon). SOD veya hücre geçirgen PEG-çimen ile birlikte enjekte spin sonda vivo içinde kullanımı bu sorunu ele alabilir.
Verimli bir şekilde örnekler toplamak ve bunları EPR ölçümleri önce-80 ° C'de depolamak için bir protokol kurmak bir gol oldu. Bu nedenle PTFE boru örnekleri tutmak için kullanmak için pratik bir yöntem geliştirdik. Bu boru doğrudan parmak yerleştirilir dewar 77 k EPR analiz örnekleri arasında dewar temizlemek için gerek kalmadan. Bu örnekleri 1 mL şırınga dondurulması içeren kısa bir süre önce yöntemi için bir alternatiftir. Donmuş numuneler PTFE boru içinde depolanan ölçümlerde sinyal kararlılığını göstermek için birkaç gün içinde tekrar edilebilir. Bu yaklaşım EPR ölçümleri istifleme için izin verir ve örnekleri uzak bir EPR tesis örnekleri çalıştırmak böylece laboratuvarlar arasında aktarma kolaylaştırır.
Genel olarak, bu protokoller hücre ve dokuların EPR ölçülerini biyolojik sistemlerde hazırlanması için basit bir yaklaşım sağlar. İletişim kuralları ile oksidatif stres ve diğer spin sonda kullanımı ile ilgili diğer modelleri için adapte edilebilir. Zamanlama ve spin sonda konsantrasyon deneysel her koşul için ayarlanması gerekir. EPR varlığı ve üretim serbest radikal türlerin belirsizliğe yer bırakmadan belirlemek yeteneği rigor redoks biyoloji alanında deneysel yaklaşımlara sağlar.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarlar ifşa gerek yok.
Acknowledgments
Bu eser tıp Dekan'ın Stratejik Araştırma altyapı Ödülü, R01 HL086680-09 ve 1R35HL139726-01, E.N.G. ve UCD CFReT Dostluk Ödülü (o) Colorado Üniversitesi Okulu tarafından desteklenmiştir. Dr Sandra Eaton ve Dr. Gareth Eaton (Denver Üniversitesi), Dr. Gerald Rosen ve Dr. Joseph P. Kao (İstanbul Üniversitesi) ve Dr Sujatha Venkataraman (Colorado Üniversitesi, Denver) için yararlı tartışmalar ve Joanne Maltzahn, Ashley yazarlar teşekkür Trumpie ve teknik destek için Ivy McDermott (Colorado Üniversitesi, Denver).
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | LifeTech | 10566-016 | cell culture media |
| Diethylenetriaminepentaacetic acid (DTPA) | Sigma Aldrich | D6518-5G | |
| sodium chloride (NaCl) | Fisher Scientific | BP358-212 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate dibasic (HK2PO4 ) | Fisher Scientific | BP363-500 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| potassium phosphate monobasic (KH2PO4 ) | Sigma Aldrich | P-5379 | used to prepare 50 mM phosphate saline buffer according to Sigma aldrish |
| Krebs-Henseleit buffer (KHB) | (Alfa Aesar, Hill) | J67820 | |
| Bovine erythrocyte superoxide dismutase (SOD) | Sigma Aldrich | S7571-30KU | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich | P1585-1MG | Dissolve in DMSO |
| Antimycin A (AA) | Sigma Aldrich | A8674-25MG | Dissolve in Ethanol and store in glass vials(MW used is the averaged molecular weights for four lots) |
| 1-Hydroxy-3-methoxycarbonyl-2,2,5,5-tetramethylpyrrolidine . HCl (CMH) | Enzo Life Sciences | ALX-430-117-M050 | |
| 1-Hydroxy-3-carboxy-2,2,5,5-tetramethylpyrrolidine . HCl (CPH) | Enzo Life Sciences | ALX-430-078-M250 | |
| 1-Hydroxy-4-[2-triphenylphosphonio)-acetamido]-2,2,6,6-tetramethylpiperidine, 1-Hydroxy-2,2,6,6-tetramethyl-4-[2-(triphenylphosphonio)acetamido]piperidinium dichloride ( mito-TEMPO-H) | Enzo Life Sciences | ALX-430-171-M005 | |
| 1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl-trimethylammonium chloride . HCl (CAT1H) | Enzo Life Sciences | ALX-430-131-M250 | |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | |
| Diphenyliodonium chloride | Sigma Aldrich | 43088 | |
| Deferoxamin mesylate salt | Sigma Aldrich | D9533-1G | |
| Critoseal | Leica | 39215003 | |
| BRAND disposable BLAUBRAND micropipettes, intraMark | Sigma Aldrich | 708733 | Capillaries |
| PTFE FRACTIONAL FLUOROPOLYMER TUBING 3/16” OD x 1/8” ID |
NORELL | 1598774A | Teflon tubing |
| SILICONE RUBBER STOPPERS FOR NMR SAMPLE TUBES FOR THIN WALL TUBES HAVING AN OD OF 4mm-5mm (3.2mm TO 4.2mm ID) TS-4-5-SR | NORELL | 94987 | |
| EMXnano Bench-Top EPR spectrometer | Bruker BioSpin GmbH | E7004002 | |
| EMX NANO TISSUE CELL | Bruker BioSpin GmbH | E7004542 |
References
- Kalyanaraman, B., et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations. Free Radical Biology and Medicine. 52 (1), 1-6 (2012).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magnetic Resonance in Medicine. 67 (6), 1827-1836 (2012).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magnetic Resonance in Chemistry. 53 (4), 280-284 (2015).
- Elajaili, H., et al. Imaging disulfide dinitroxides at 250 MHz to monitor thiol redox status. Journal of Magnetic Resonance. 260, 77-82 (2015).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic-Resonance. Proceedings of the National Academy of Sciences of the United States of America. 91 (26), 13047-13051 (1994).
- Epel, B., et al. Imaging thiol redox status in murine tumors in vivo with rapid-scan electron paramagnetic resonanc. Journal of Magnetic Resonance. 276, 31-36 (2017).
- Legenzov, E. A., Sims, S. J., Dirda, N. D. A., Rosen, G. M., Kao, J. P. Y. Disulfide-Linked Dinitroxides for Monitoring Cellular Thiol Redox Status through Electron Paramagnetic Resonance Spectroscopy. Biochemistry. 54 (47), 6973-6982 (2015).
- Abbas, K., et al. Medium-throughput ESR detection of superoxide production in undetached adherent cells using cyclic nitrone spin traps. Free Radical Research. 49 (9), 1122-1128 (2015).
- Dikalov, S. I., et al. Distinct roles of Nox1 and Nox4 in basal and angiotensin II-stimulated superoxide and hydrogen peroxide production. Free Radical Biology and Medicine. 45 (9), 1340-1351 (2008).
- Dikalov, S. I., Kirilyuk, I. A., Voinov, M., Grigor'ev, I. A. EPR detection of cellular and mitochondrial superoxide using cyclic hydroxylamines. Free Radical Research. 45 (4), 417-430 (2011).
- Dikalova, A. E., et al. Therapeutic Targeting of Mitochondrial Superoxide in Hypertension. Circulation Research. 107 (1), 106-116 (2010).
- Dikalov, S. I., Polienko, Y. F., Kirilyuk, I. Electron Paramagnetic Resonance Measurements of Reactive Oxygen Species by Cyclic Hydroxylamine Spin Probes. Antioxidants & Redox Signaling. , (2017).
- Sharma, S., et al. L-Carnitine preserves endothelial function in a lamb model of increased pulmonary blood flow. Pediatric Research. 74 (1), 39-47 (2013).
- Berg, K., Ericsson, M., Lindgren, M., Gustafsson, H. A High Precision Method for Quantitative Measurements of Reactive Oxygen Species in Frozen Biopsies. PloS One. 9 (3), (2014).
- Kozlov, A. V., et al. EPR analysis reveals three tissues responding to endotoxin by increased formation of reactive oxygen and nitrogen species. Free Radical Biology and Medicine. 34 (12), 1555-1562 (2003).
- Van Rheen, Z., et al. Lung Extracellular Superoxide Dismutase Overexpression Lessens Bleomycin-Induced Pulmonary Hypertension and Vascular Remodeling. American Journal of Respiratory Cell and Molecular Biology. 44 (4), 500-508 (2011).
- Mouradian, G. C., et al. Superoxide Dismutase 3 R213G Single-Nucleotide Polymorphism Blocks Murine Bleomycin-Induced Fibrosis and Promotes Resolution of Inflammation. American Journal of Respiratory Cell and Molecular Biology. 56 (3), 362-371 (2017).
- Dikalov, S. I., Li, W., Mehranpour, P., Wang, S. S., Zafari, A. M. Production of extracellular superoxide by human lymphoblast cell lines: comparison of electron spin resonance techniques and cytochrome C reduction assay. Biochem Pharmacol. 73 (7), 972-980 (2007).
- Kozuleva, M., et al. Quantification of superoxide radical production in thylakoid membrane using cyclic hydroxylamines. Free Radical Biology and Medicine. 89, 1014-1023 (2015).
- Chen, K., Swartz, H. M. Oxidation of Hydroxylamines to Nitroxide Spin Labels in Living Cells. Biochimica Et Biophysica Acta. 970 (3), 270-277 (1988).



