Summary
本研究介绍了一种利用激光散斑对比成像技术测量人体口腔黏膜微循环的方法。临床上介绍了前庭成形术联合异源性胶原蛋白移植后创面愈合的监测。
Abstract
激光散斑对比成像 (lsci) 是测量大面积浅表血液灌注的一种新方法。由于它是非侵入性的, 避免了与测量区域的直接接触, 因此适合监测人类患者伤口愈合过程中的血液流动变化。前庭成形术是对口腔前庭的牙周手术, 目的是恢复前庭深度, 同时扩大角化牙龈。在这种特殊的临床病例中, 在第一上上前磨牙上增加了分裂厚度皮瓣, 并将异原胶原蛋白基质适应了由此产生的受体床。采用 lsci 对移植物及周围黏膜的再血管和新生血管进行了一年的监测。提出了一种正确调整口腔黏膜微循环测量的方案, 突出了困难和可能的故障。
临床案例研究表明, 按照适当的协议, lsci 是一种合适和可靠的方法, 用于跟踪人口腔黏膜愈合伤口的微循环, 并提供了有关移植整合的有用信息。
Introduction
在临床情况下监测人类牙龈微循环的长期变化是口腔和牙周手术的热门话题。然而, 可靠的灌注评估可能是困难的。只有少数方法不能侵入性地测量人类黏膜血液循环的变化。其中两个采用了激光束1,2,3,4, 但方式不同。激光多普勒流量测量 (ldf) 利用激光束5,6 中的多普勒频移, 而激光散斑对比成像 (lsci) 方法则依靠背散射激光的散斑模式来测量红血速度单元格7。
ldf 仅在单点测量, 传感器位置的可重复标准化是一项理想而又困难的任务。另一个问题是 ldf 的探头直径较小 (1 毫米2)。手术前在预定的时间点测量过于具体, 可能对术后循环变化视而不见, 而水肿、组织切除、组织运动或植入移植导致受影响患者术后几何形状发生重大变化软组织。ldf 的测量距离小于1毫米, 禁止在组织体积变化的情况下使用带有预定孔的牙夹板。lsci 不需要任何特殊的本地化工具, 可以测量几个厘米2的区域。因此, 伤口愈合可以在整个手术部位进行。此外, lsci 还可以在彩色编码的图像中以一秒的速度显示血液灌注, 分辨率高达20μm。
本文介绍的 lsci 器件主要用于动物研究应用, 需要在小测量区域实现高分辨率。然而, 由于人口腔黏膜的结构和组织学因区域 (附着牙龈、边缘牙龈、前庭黏膜) 而异质性 8.因此, 与通常用于人体测试的正常分辨率 lsci 相比, 高分辨率 lsci 具有很大的优势。
lsci 仪器采用了一种隐形激光 (波长 785 nm)。光束被分流以照亮测量区域, 形成散斑图案。ccd 摄像机对照明区域中的散斑图案进行成像。该系统中使用的 ccd 摄像机的有 1386 x 1034 像素的有源成像区域, 其分辨率在20–60μm/pms 之间, 具体取决于测量区域的大小和软件的设置 (低、中、高)。如果图像大小减小, 它可以以每秒16帧的速度拍摄图像, 甚至可以拍摄高达每秒100帧的图像。血液灌注是由内置软件计算的。它分析散斑图案的变化, 并量化对比度。生成的通量经过彩色编码, 可生成灌注图像。根据我们之前的结果, lsci 评估牙龈的血液灌注具有良好的重复性和重现性9。这意味着, 它是一个可靠的工具, 监测口腔黏膜微循环的变化, 不仅在短期实验中, 而且在长期研究, 以跟踪疾病进展或伤口愈合10。
本文通过临床病例报告, 证明 lsci 的高空间分辨率使其能够揭示异源性胶原蛋白移植的新生血管模式。此外, 该案例表明, lsci 由于其可靠性高, 可以敏感地检测到个体的变化。这一点很重要, 因为在牙周手术的临床试验中, 由于局部解剖的显著变化和不同的系统背景, 很难规范手术干预。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
所报告的方法被用于一项临床试验, 该试验得到了健康登记和培训中心匈牙利委员会的道德批准 (批准号: 034c/2013)。
1. lsci 设置
- 打开计算机和任何外围设备。
- 打开要与后面板上的开关一起使用的 lsci 仪器。
- 让仪器预热至少5分钟。当后面板上的两个 led 都停止闪烁时, 仪器就可以进行测量了。
- 通过双击桌面上的软件图标或通过 "开始" 菜单启动软件。
- 等待, 直到后面板上的黄色和绿色 led 停止闪烁, 这表明激光是温暖的, 初始化已完成。
注意: 启动系统时, 偶尔会提示您执行系统的验证过程。
2. 系统验证
- 使用提供的校准框。从校准盒中取下盖子并摇一摇, 以避免胶体悬浮液中的沉淀。
- 将盖子关闭 30秒, 以避免气泡。
- 将盖子放回校准盒上。
- 点击"高级"验证码验证仪器。
- 选择常规验证下一个, 下一个
- 将头部旋转90°, 使用集成的磁铁拧紧校准盒, 然后单击 "下一步"。
- 在文本框中输入室温, 选择°c, 然后单击 "开始"。
- 向导在完成验证过程时等待。
- 成功的验证过程后, 单击"完成"关闭向导。
3. 参与者准备
- 确保在温控室 (26°c) 进行测量。
- 将患者放在牙科椅上的舒适仰角位置, 并将真空枕头放在头下 (图 1)。
- 在进行任何测量之前, 让患者保持15分钟不受干扰。
4. 微循环图像测量
- 在 "工具"菜单中, 选择并单击 "项目编辑器"。将打开一个新窗口, 在其中可以保存常用的设置。
- 在 "项目" 框中, 单击 "新建" 以创建新项目。输入 "vestibulum", 然后单击 "确定"。
- 在 "网站" 框中, 单击 "新建" 以创建新网站。输入 "牙 14", 然后单击 "确定"。
- 在"牙齿 14" 面板的内容下, 添加 "10 厘米" 作为工作距离所需的距离, 并在测量框中输入3厘米的宽度和2厘米的高度。
- 将点密度分辨率设置为正常, 将帧速率设置为16像图, 然后从 "持续时间" 下拉菜单中选择"时间", 将录制持续时间设置为0:30。
- 选择 "没有平均的记录", 并将彩色照片捕获率设置为秒。
- 然后单击 "应用" 和 "确定" 以保存项目参数。
- 在 "文件"菜单中, 选择并单击 "新建录制"。将打开一个新的图像窗口, 并显示 "设置" 面板。
- 在"录制设置"下, 为项目选择 "vestibulum", 为4.9 选择 "齿 14"。网站。
- 打开"主题" 下拉菜单, 单击 "选择主题" 对话框中的 "新建", 然后输入 "患者" 的名称。
- 单击 "确定", 然后在 " rec 名称"字段中输入录制的名称: 例如, 第1天 (操作后经过的天数) 和 "操作员" 字段中的操作员名称。
- 在开始微循环图像测量之前, 测量患者的血压和脉搏。
- 从真空枕头中疏散空气, 将患者的头部固定在适合被调查区域的位置。
- 让病人张开嘴。
- 用两个牙科镜轻轻收回嘴唇 (图 1)。
- 调整仪器的头部平行于牙龈的测量区域。内置可见 (650 nm) 指示器激光器便于成像仪相对于患者口腔的定位。
- 通过移动仪器相对于组织, 将工作距离调整到10厘米。该距离由 lsci 设备连续测量, 并由软件显示为图像设置下的工作距离测量值。
- 指示主体在测量期间保持静止。
- 点击"录制" 按钮开始录制。图像窗口的颜色现在更改为红色, 表示录制正在进行中。"设置" 面板将替换为 "录制" 面板。录制在30秒后自动停止。录制完成后, 图像窗口的颜色将更改为蓝色, "录制" 面板将替换为 "审阅" 面板。
- 取下牙镜, 让病人闭上嘴吞咽。
- 按下 "恢复录制" 按钮, 切换回实时图像。
- 重复从4.14 到4.14 的步骤两次。
- 关闭该文件。数据将自动保存。
- lsci 测量后测量血压和脉搏。
5. 离线分析
- 使用内置软件分析 lsci 图像。转到 "图像" 或 "拆分" 视图 (图 2)。
- 定义感兴趣的区域 (roi)。注意: roi 内像素的灌注值是平均值, 并定义为 roi 的血流值, 用称为激光散斑灌注单元 (lspu) 的任意值表示。
- 在右侧的 roi 工具选项板中选择所需的 roi 形状。
- 在 roi 工具选项板中选择 "应用"选项, 该选项将 roi 操作应用于录制的所有图像。
- 通过单击并按住强度图像中的鼠标按钮, 将 roi 拖动到所需的大小, 并释放鼠标按钮 (单击并双击自由格式的 roi) 来绘制 roi。根据需要调整 roi 的位置、调整大小或旋转投资回报率。
- 重复5.3 中的步骤。到5.5 倍的数量的 roi (图 3)。
- 定义感兴趣的时间段 (toi)。这样就可以在一定的时间内平均在 roi 中灌注 (图 2)。
- 转到 "图形" 或 "拆分" 视图。选择 "添加 toi 工具" 按钮。
- 单击并按住您希望 toi 开始的位置的图形, 并将光标拖动到所需的结束位置。然后松开鼠标按钮。
- 从平均值表中导出数据以进行进一步处理。
- 通过用于统计分析的合适软件构建血液流动曲线。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
前庭成形术是对口腔前庭的牙周手术, 旨在增加前庭深度, 角化牙龈区和软组织厚度, 以增强美观和功能。顶部重新定位的分裂厚度皮瓣结合胶原蛋白基质是一个常用的前庭成形术。异源性胶原蛋白基质是一种可行的替代自体牙龈移植, 增加角化牙龈11,12,13的量;然而, 没有关于移植物血运重建的方向及其如何影响周围组织微循环的数据。了解这些机制可以促进牙周手术中正确的皮瓣和切口设计。
一名17岁男性患者, 在上颌骨第一前磨牙角化牙龈宽度不足, 采用前庭成形术, 使用顶部重新定位的分裂厚度皮瓣结合胶原蛋白基质进行治疗。lsci 的口腔内照片 (由相机拍摄) 和血液流动 (bf) 测量是在前庭成形术 (基线) 之前以及术后1、2、3、4、5、7、9、11、14、21、27天以及2、3、4、5、6和12个月。每次测量前后都对血压和脉搏进行评估。
在离线分析中, 在增强性黏膜区域确定了多个 roi;有的在移植区, 有的在周围的粘膜, 定义为 "" 区。如图 3所示, 根据与植入移植中心的距离, 将 "peri" 和移植区域进一步分割成区域, 在图片中标记为 f 区。在嫁接区的 "peri" 区域和 c、d 和 e 区定义了 a 区和 b 区。这些区域中的每一个都在移植的所有四个侧面 (下部、远端、顶端和冠状) 分别划定。每一次30秒的拍摄都被确定为 toi (图 2)。每个 roi 和 toi 的数据都导出到电子表格程序中。血液流动曲线是用一个合适的软件来构建的, 用于统计分析。
在为期一年的实验中, 无论是在每次血流测量之前还是之后, 平均动脉压力 (map) 都没有明显变化。图 4显示了我们研究的代表日的彩色照片、强度图像和操作牙龈的灌注图像。术后第一个星期完全闭合, 移植区有一层厚厚的纤维蛋白, 周围牙龈可见轻度红斑和水肿。血液灌注图像显示手术区缺血, "围生" 区充血。从第14天开始, 移植区域出现临床红斑, 同时在血液灌注图像上观察到严重充血。到移植后的第三个月, 伤口愈合, 牙龈灌注接近术前循环水平。
图 5显示了模糊的强度图像和整个图像的灌注图。图上的突然峰值表示患者的运动。在确保患者处于舒适的位置后, 立即重复测量。图 6显示了接枝内不同区域和 "peri" 区域中 bf 的变化。在所有曲线中, 都很常见, 从第四个月开始, 血液流动直到调查结束才进一步改变。这一时期的平均血流可用作新组织的静息血流值, 时间点之间的随机变化使我们能够使用线性混合模型分别计算每个 roi 的基于时间的方差分量。然后可以计算出最小的可检测差异, 以确定愈合期间 (第四个月之前) 时间点之间的实际变化 (有95% 的置信度), 以确定充血和缺血阶段。在移植物中的所有 roi 中, 曲线的基本特征相似, 从缺血阶段开始, 然后是充血期。然而, 这两个阶段的长度不同 (表 1)。缺血时间最长 (7-9天) 在中部和所有冠状区域, 后期充血从第11天和第27天开始。在移植物的其他区域, 缺血仅持续 4-7天, 在第7天至第21天之间开始的充血较早。
接枝两侧带的高炉曲线具有独特的特征 (图 6)。在顶端一侧, 这四个区域都有类似的血液流动曲线。在冠状侧, 与内侧和远端外区的灌注时间晚于内区。在两侧, bf 首先在 c 区增加, 然后在 d 区增加, 然后在 e 区增加, 最后在中心区增加 f 区。在周围粘膜区 (a 区和 b 区) 没有观察到明显的缺血。相反, 在不同的侧面观察到不同规模和程度的充血。
当 bf 值与 bf 曲线的整体特征不一致时, 有两个时间点。第9天, 大多数区域突然下降, 主要是顶端和远端的 "" 区。不能肯定地说这是一个测量误差, 因为没有对上一天和第二天进行测量。然而, 根据测量报告中的说明, 操作人员在太大压力下收回了口腔褶皱, 导致 bf 下降。考虑到主要是远端和顶端两侧的循环可能会因为拉脸颊而受到影响, 这一点是有道理的。在第182天 (6个月后), 由于测量时间间隔较长, 患者忘记在测量前遵守商定的限制。彩色照片 (图 6) 上边缘牙龈的出血表明在测量前刷牙严重。在此期间, 患者也接受了正畸治疗, 他使用了上颌间弹性。这两个因素都可以大大增加bf 1 4、1 5,因此在更仔细控制的情况下, 以后会重复测量。

图 1: 手术区域血液流动测量的实验 lsci 设置和患者准备.嘴唇被牙镜收回。请点击这里查看此图的较大版本.
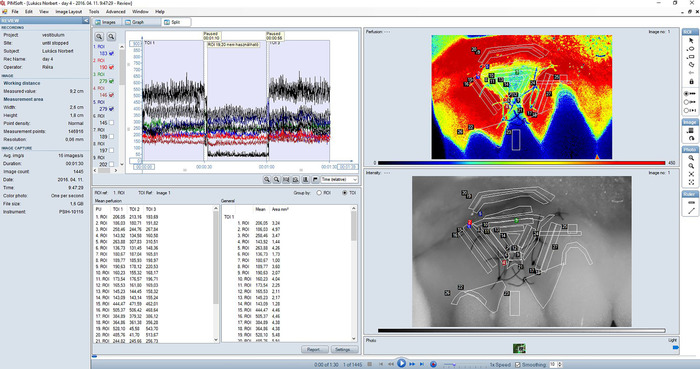
图 2: 处理区域牙龈血流的典型记录的拆分视图 (图像视图和图形视图的组合).灌注图像 (右上角的子视图) 是牙龈中血液灌注的颜色编码表示。高灌注区域显示为红色, 而低灌注区域为蓝色。灌注图像的颜色范围为 0-450 lspu;平滑设置为10。强度图像 (右下角视图) 是由总背散射激光创建的。它与灌注图像完全吻合, 有助于对灌注图像的定位和细节的识别。感兴趣的区域 (roi) 总是在强度图像中定义。该图 (左上角面板) 显示了记录中每个 roi 的实时血液灌注跟踪。左侧的复选框可用于选择要显示的跟踪。图上显示了三个连续的测量值。每一次 3 0 枪都被确定为 toi。显示每个 roi 和 toi 中的平均值值表也显示在拆分视图中 (左下角面板) 中。请点击这里查看此图的较大版本.

图 3: 在强度图像中被检查的牙龈区域内定义的感兴趣的区域 (roi).区域 a 和 b 在 "peri" 区域, 而区域 c、d 和 e 在接枝中, 距离移植物中心的距离在减小, 标记为 f 区 a 位于嘴唇的前庭表面。请点击这里查看此图的较大版本.

图 4: 代表性照片 (上线)、lsci 强度图像 (中线) 和运行牙龈的 lsci 灌注图像 (下线).图像表现为术后1、4、7、14、21、27和98天的术前状态和灌注, 以及伤口愈合和灌注。请点击这里查看此图的较大版本.
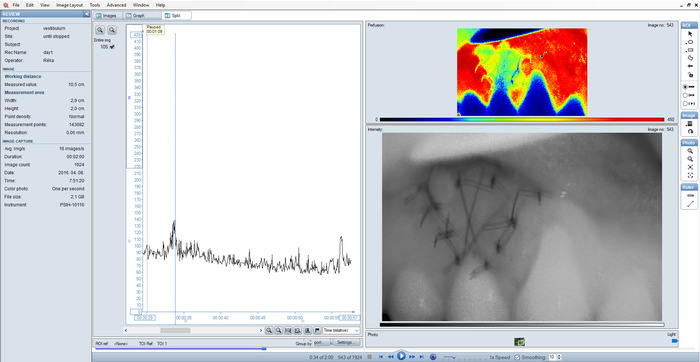
图 5: 次优记录的拆分视图.由于设置不正确, 图形上的强度模糊的图像和外围峰值。请点击这里查看此图的较大版本.

图 6: bf 在接枝的冠状 (a)、间 (b)、远端 (c) 和顶端 (d) 侧随着时间的推移而绘制的散点图.在所有图中都描绘了嫁接 (f 区) 的中心部分, 作为更多外部区域的参考。请点击这里查看此图的较大版本.
| 一边 | 区 | 缺血结束 | 开始充血 | 充血结束 |
| 冠 状 | C | 9 | 27 | 27 |
| 冠 状 | D | 9 | 21 | 27 |
| 冠 状 | e | 7。 | 11 | 98 |
| 中央 | F | 9 | 11 | 98 |
| 内侧 | C | 5 | 21 | 27 |
| 内侧 | D | 5 | 11 | 61 |
| 内侧 | e | 7。 | 11 | 61 |
| 远端 | C | 5 | 11 | 27 |
| 远端 | D | 4个 | 7。 | 98 |
| 远端 | e | 4个 | 11 | 98 |
| 顶端 | C | 4个 | 11 | 27 |
| 顶端 | D | 5 | 11 | 61 |
| 顶端 | e | 5 | 11 | 61 |
表 1: 移植物各区缺血和充血期的时间框架, 天数
Subscription Required. Please recommend JoVE to your librarian.
Discussion
本研究的目的是介绍一种监测人类牙龈移植物新生血管的新技术。根据我们之前的结果, lsci 评估牙龈的血液灌注具有良好的重复性和重现性9, 当严格执行计划的协议的每一步作为一个关键的要求。lsci 被认为是一种半定量技术, 需要定期校准, 以确保准确性和稳定性。在验证过程中, 必须尽可能准确地测量室温, 因为验证算法使用此值来计算灌注。
lsci 方法对工作距离设置和运动伪影也高度敏感。在这项研究中, 工作距离固定在 1 0 厘米。测量面积为2.7 厘米 x 2 厘米, 对应于大约三颗牙齿宽的牙龈区域。有效帧率为16图像和 0.06 s 图像, 因为动脉脉冲诱导牙龈微循环的脉动变化 9, 这必须从记录中平均出来。快速成像也降低了运动文物的风险。但是, 在设置不正确或患者移动不正确的情况下, 应停止录制并在最佳条件下重复。
两个操作人员参加了每一次测量: 一个人调整了 lsci 头部, 控制了电脑, 另一个人收回了病人的嘴唇。在这项研究中, 每节进行三次重复测量, 每次测量30秒。由于由于嘴唇和脸颊不可避免地缩回, 干扰牙龈微循环, 测量总是会对软组织产生某种刺激, 因此会发生随机误差的增加。但是, 可以通过重复整个测量过程 (即重新打开口腔、再次收回软组织、重新设置相机位置和重新选择软件9中的 roi) 来最大限度地减少这种白天的变化.
牙龈微循环表现出较高的区域变异8。因此, 像 lsci 这样测量大范围内血液流动的方法比 ldf 等单点测量技术有很大的优势。在这项研究中, 测量区域涵盖了整个手术领域。在我们的研究中, 宽测量面积使我们能够比较受伤区域内各区域的再或新生血管。与 ldf 相反, 在 lsci 方法的情况下, 探头是由手术前制造的支架固定的, 因此没有必要事先定义要检查的区域。因为在个性化医学中监测伤口愈合的主要目的是识别伤口或皮瓣周围任何地方的意外模式。此外, 术后组织几何形状的变化和软硬组织增强引起的水肿将使手术后预制支架无用。为了帮助进行视觉评估, 在录制过程中打开了平滑, 平滑值设置为10。这意味着灌注平均超过10张图像, 以使灌注图像更平滑, 并降低背景噪声。但是, 平滑只是一种视觉效果, 不会影响实际记录的灌注值。
牙龈血流量也有较高的时间变化。这可能与日常生活中伴随而来的许多生理因素有关, 如牙龈炎症16、17、18、生理节律19、血压20、温度 16,21、机械压力8、22、23、24、刷牙14、17、25或正畸力 15.因此, 这些因素的标准化和稳定是成功的后续措施所必需的。
早期用于研究移植血管的方法具有很强的侵入性, 这意味着在愈合过程中对测量时间点的主要限制, 特别是在人类研究26,27, 28, 29、30、31、32。它们在定量衡量区域差异方面也有局限性。我们以前的研究9,10已经证明了 lsci 在临床试验中的高可靠性, 并被发现是有用的, 以确定一个人的软组织愈合后, 牙齿拔牙的时间, 以优化植入物放置33。在本研究中, 异源性胶原蛋白移植所覆盖的伤口区域表现出良好的新生血管, 如术后第11天移植物内所有区域均达到最大血流水平。然而, 可以推测, 胶原蛋白移植脱落或吸收在第11天, 我们实际上测量了接收床的血运重建。除了非侵入性特性外, lsci 的另一个特殊特性是能够在单个级别的整合过程中表征移植物不同区域的再灌注曲线。移植物新生血管的向心特征与以往的组织学观察30相似.这表明, 移植物血运重建不仅发生在骨膜血管丛, 也发生在伤口边缘。
实验表明, 如果严格遵循每一步, 可以清楚地跟踪嫁接的血运重建。然而, 在第182天, 不符合要求的病人准备和指导导致 bf 大幅增加。
lsci 被广泛用于血管结构和其他组织中相关血液流动的全领域成像, 如视网膜34、35、皮肤7、36和大脑37,38.lsci 最有前途的临床应用是烧伤创面评估39,40, 片状41 评估和术中脑血流监测42。显然, lsci 对人体广泛的牙龈测量存在严重限制。这个工具非常坚固和沉重。主要的困难出现在与文档相机, 具有低分辨率, 位于离测量相机几厘米远。这些功能使得直接在彩色照片上识别感兴趣的区域变得困难。lsci 机头的大小可防止在口腔内拍摄。因此, 不能直接显示的区域无法测量。我们已经证明了, 使用间接方法与摄影镜可以作为一种替代方法9。然而, 使用镜像涉及更多的运动伪影, lsci 是敏感的, 使其更难捕捉垂直图像, 并降低焦距。当无法垂直捕获测量区域时, 血流值可能是正确的 9,39, 但由于三维扭转, 图像上的区域识别仍然很复杂。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可透露的。
Acknowledgments
这项工作的部分工作是匈牙利科学研究基金在 grant编号 k12364 下提供的支助, 由匈牙利人的能力部、semmelweis 大学高等教育卓越方案、治疗研究单元和国家研究、发展和创新办公室 KFI_16-1-2017-0409。
Materials
| Name | Company | Catalog Number | Comments |
| PeriCam PSI-HR | Perimed AB, Stockholm, Sweden | The PeriCam PSI System is an imaging system based on LASCA technology (LAser Speckle Contrast Analysis). The system measures superficial blood perfusion over large areas at fast capture rates. This makes it ideal for investigations of both the spatial and temporal dynamics of microcirculation in almost any tissue. | |
| PIMSoft | Perimed AB, Stockholm, Sweden | PIMSoft is a data acquisition and analysis software, intended for use together with the PeriCam PSI System and the PeriScan PIM 3 System, for measurement and imaging of superficial blood perfusion. | |
| Geistlich Mucograft | Geistlich, Switzerland | It's a unique 3D collagne matrix designed specifically for soft tissue regeneration. It's indicated for the gain of keratinized tissue and recession coverage. | |
| Omron M4 | Omron Healthcare Inc., Kyoto, Japan | Blood pressure monitor, which gives accurate readings. | |
| Nikon D5200 | Nikon Corportation, Tokyo, Japan | Taking intra oral photos | |
| MS Excel | Microsoft Corporation, Redmond, Washington, USA | The software used for data management | |
| IBM SPSS Statistics 25 | IBM Corp., Armonk, NY, USA | The software used for statistical analysis |
References
- Nakamoto, T., et al. Two-Dimensional Real-Time Blood Flow and Temperature of Soft Tissue Around Maxillary Anterior Implants. Implant Dentistry. 21 (6), 522-527 (2012).
- Kajiwara, N., et al. Soft tissue biological response to zirconia and metal implant abutments compared with natural tooth: microcirculation monitoring as a novel bioindicator. Implant Dentistry. 24 (1), 37-41 (2015).
- Kemppainen, P., Forster, C., Handwerker, H. O. The importance of stimulus site and intensity in differences of pain-induced vascular reflexes in human orofacial regions. Pain. 91 (3), 331-338 (2001).
- Kemppainen, P., Avellan, N. L., Handwerker, H. O., Forster, C. Differences between tooth stimulation and capsaicin-induced neurogenic vasodilatation in human gingiva. Journal of Dental Research. 82 (4), 303-307 (2003).
- Riva, C., Ross, B., Benedek, G. B. Laser Doppler measurements of blood flow in capillary tubes and retinal arteries. Investigative ophthalmology. 11 (11), 936-944 (1972).
- Humeau, A., Steenbergen, W., Nilsson, H., Stromberg, T. Laser Doppler perfusion monitoring and imaging: novel approaches. Medical & Biological Engineering & Computing. 45 (5), 421-435 (2007).
- Briers, J. D., Webster, S. Laser speckle contrast analysis (LASCA): a nonscanning, full-field technique for monitoring capillary blood flow. Journal of Biomedical Optics. 1 (2), 174-179 (1996).
- Fazekas, R., et al. Functional characterization of collaterals in the human gingiva by laser speckle contrast imaging. Microcirculation. 25 (3), 12446 (2018).
- Molnar, E., Fazekas, R., Lohinai, Z., Toth, Z., Vag, J. Assessment of the test-retest reliability of human gingival blood flow measurements by Laser Speckle Contrast Imaging in a healthy cohort. Microcirculation. 25 (2), (2018).
- Molnar, E., et al. Evaluation of Laser Speckle Contrast Imaging for the Assessment of Oral Mucosal Blood Flow following Periodontal Plastic Surgery: An Exploratory Study. BioMed Research International. 2017, 4042902 (2017).
- Sanz, M., Lorenzo, R., Aranda, J. J., Martin, C., Orsini, M. Clinical evaluation of a new collagen matrix (Mucograft prototype) to enhance the width of keratinized tissue in patients with fixed prosthetic restorations: a randomized prospective clinical trial. Journal of Clinical Periodontology. 36 (10), 868-876 (2009).
- Nevins, M., Nevins, M. L., Kim, S. W., Schupbach, P., Kim, D. M. The use of mucograft collagen matrix to augment the zone of keratinized tissue around teeth: a pilot study. The International Journal of Periodontics and Restorative Dentistry. 31 (4), 367-373 (2011).
- Lorenzo, R., Garcia, V., Orsini, M., Martin, C., Sanz, M. Clinical efficacy of a xenogeneic collagen matrix in augmenting keratinized mucosa around implants: a randomized controlled prospective clinical trial. Clinical Oral Implants Research. 23 (3), 316-324 (2012).
- Perry, D. A., McDowell, J., Goodis, H. E. Gingival microcirculation response to tooth brushing measured by laser Doppler flowmetry. Journal of Periodontology. 68 (10), 990-995 (1997).
- Yamaguchi, K., Nanda, R. S., Kawata, T. Effect of orthodontic forces on blood flow in human gingiva. Angle Orthodontist. 61 (3), 193-203 (1991).
- Molnár, E., et al. Assessment of heat provocation tests on the human gingiva: the effect of periodontal disease and smoking. Acta Physiologica Hungarica. 102 (2), 176-188 (2015).
- Gleissner, C., Kempski, O., Peylo, S., Glatzel, J. H., Willershausen, B. Local gingival blood flow at healthy and inflamed sites measured by laser Doppler flowmetry. Journal of Periodontology. 77 (10), 1762-1771 (2006).
- Hinrichs, J. E., Jarzembinski, C., Hardie, N., Aeppli, D. Intrasulcular laser Doppler readings before and after root planing. Journal of Clinical Periodontology. 22 (11), 817-823 (1995).
- Svalestad, J., Hellem, S., Vaagbo, G., Irgens, A., Thorsen, E. Reproducibility of transcutaneous oximetry and laser Doppler flowmetry in facial skin and gingival tissue. Microvascular Research. 79 (1), 29-33 (2010).
- Sasano, T., Kuriwada, S., Sanjo, D. Arterial blood pressure regulation of pulpal blood flow as determined by laser Doppler. Journal of Dental Research. 68 (5), 791-795 (1989).
- Ikawa, M., Ikawa, K., Horiuchi, H. The effects of thermal and mechanical stimulation on blood flow in healthy and inflamed gingiva in man. Archives of Oral Biology. 43 (2), 127-132 (1998).
- Baab, D. A., Oberg, P. A., Holloway, G. A. Gingival blood flow measured with a laser Doppler flowmeter. Journal of Periodontal Research. 21 (1), 73-85 (1986).
- Fazekas, A., Csempesz, F., Csabai, Z., Vág, J. Effects of pre-soaked retraction cords on the microcirculation of the human gingival margin. Operative Dentistry. 27 (4), 343-348 (2002).
- Csillag, M., Nyiri, G., Vag, J., Fazekas, A. Dose-related effects of epinephrine on human gingival blood flow and crevicular fluid production used as a soaking solution for chemo-mechanical tissue retraction. Journal of Prosthetic Dentistry. 97 (1), 6-11 (2007).
- Tanaka, M., Hanioka, T., Kishimoto, M., Shizukuishi, S. Effect of mechanical toothbrush stimulation on gingival microcirculatory functions in inflamed gingiva of dogs. Journal of Clinical Periodontology. 25 (7), 561-565 (1998).
- Rothamel, D., et al. Biodegradation pattern and tissue integration of native and cross-linked porcine collagen soft tissue augmentation matrices - an experimental study in the rat. Head & Face Medicine. 10, 10 (2014).
- Schwarz, F., Rothamel, D., Herten, M., Sager, M., Becker, J. Angiogenesis pattern of native and cross-linked collagen membranes: an immunohistochemical study in the rat. Clinical Oral Implants Research. 17 (4), 403-409 (2006).
- Vergara, J. A., Quinones, C. R., Nasjleti, C. E., Caffesse, R. G. Vascular response to guided tissue regeneration procedures using nonresorbable and bioabsorbable membranes in dogs. Journal of Periodontology. 68 (3), 217-224 (1997).
- Oliver, R. C., Loe, H., Karring, T. Microscopic evaluation of the healing and revascularization of free gingival grafts. Journal of Periodontal Research. 3 (2), 84-95 (1968).
- Janson, W. A., Ruben, M. P., Kramer, G. M., Bloom, A. A., Turner, H. Development of the blood supply to split-thickness free ginival autografts. Journal of Periodontology. 40 (12), 707-716 (1969).
- Mormann, W., Bernimoulin, J. P., Schmid, M. O. Fluorescein angiography of free gingival autografts. Journal of Clinical Periodontology. 2 (4), 177-189 (1975).
- Busschop, J., de Boever, J., Schautteet, H. Revascularization of gingival autografts placed on different receptor beds. A fluoroangiographic study. Journal of Clinical Periodontology. 10 (3), 327-332 (1983).
- Fazekas, R., et al. A proposed method for assessing the appropriate timing of early implant placements: a case report. Journal of Oral Implantology. , (2018).
- Briers, J. D., Fercher, A. F. Retinal blood-flow visualization by means of laser speckle photography. Investigative Ophthalmology & Visual Science. 22 (2), 255-259 (1982).
- Srienc, A. I., Kurth-Nelson, Z. L., Newman, E. A. Imaging retinal blood flow with laser speckle flowmetry. Front Neuroenergetics. 2, (2010).
- Choi, B., Kang, N. M., Nelson, J. S. Laser speckle imaging for monitoring blood flow dynamics in the in vivo rodent dorsal skin fold model. Microvascular Research. 68 (2), 143-146 (2004).
- Ayata, C., et al. Laser speckle flowmetry for the study of cerebrovascular physiology in normal and ischemic mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 24 (7), 744-755 (2004).
- Armitage, G. A., Todd, K. G., Shuaib, A., Winship, I. R. Laser speckle contrast imaging of collateral blood flow during acute ischemic stroke. Journal of Cerebral Blood Flow & Metabolism. 30 (8), 1432-1436 (2010).
- Lindahl, F., Tesselaar, E., Sjoberg, F. Assessing paediatric scald injuries using Laser Speckle Contrast Imaging. Burns. 39 (4), 662-666 (2013).
- Mirdell, R., Iredahl, F., Sjoberg, F., Farnebo, S., Tesselaar, E. Microvascular blood flow in scalds in children and its relation to duration of wound healing: A study using laser speckle contrast imaging. Burns. , (2016).
- Zotterman, J., Bergkvist, M., Iredahl, F., Tesselaar, E., Farnebo, S. Monitoring of partial and full venous outflow obstruction in a porcine flap model using laser speckle contrast imaging. Journal of Plastic, Reconstructive & Aesthetic Surgery. 69 (7), 936-943 (2016).
- Hecht, N., Woitzik, J., Dreier, J. P., Vajkoczy, P. Intraoperative monitoring of cerebral blood flow by laser speckle contrast analysis. Neurosurgical Focus. 27 (4), E11 (2009).



