Summary
Este estudo apresenta um protocolo para medição da microcirculação em mucosa oral humana por imagens de contraste de salpico do laser. O acompanhamento da cicatrização após vestibuloplasty combinado com um enxerto de colágeno xenogénica é apresentado um caso clínico.
Abstract
Laser do salpico contraste de imagem (LSCI) é um método novo para medir perfusão sanguínea superficial em grandes áreas. Desde que é não-invasivo e evita o contato direto com a área de medição, é apropriado para monitorar as mudanças do fluxo de sangue durante a cicatrização de feridas em pacientes humanos. Vestibuloplasty é a cirurgia periodontal para o vestíbulo oral, com o objetivo de restaurar a profundidade vestibular com alargamento simultâneo da gengiva queratinizada. Neste caso clínico especial, um retalho de espessura dividida foi elevado no primeiro pré-molar superior e uma matriz de colagénio xenogénica foi adaptado ao leito receptor resultante. LSCI foi usado para monitorar a re - e neovascularização da prótese e a mucosa circundante durante um ano. Um protocolo é introduzido para o ajuste correto da medição da microcirculação na mucosa oral, destacando as dificuldades e possíveis falhas.
O estudo de caso clínico apresentado demonstrou que — seguindo o protocolo apropriado — LSCI é um método adequado e confiável para acompanhar a microcirculação em uma cura ferida na mucosa bucal humana e dá informações úteis sobre a integração do enxerto.
Introduction
Monitoramento de mudanças de longo prazo da microcirculação gengival humana em uma situação clínica é um tema quente em cirurgia oral e periodontal. No entanto, a avaliação confiável de perfusão pode ser difícil. Existem apenas alguns métodos que não invasiva medir as mudanças na circulação de sangue da mucosa humana. Dois destes empregam um feixe do laser1,2,3,4, mas de uma maneira diferente. Laser doppler flowmetry (LDF) faz uso do Doppler shift em um laser de feixe5,6, enquanto o contraste de speckle laser imagem método (LSCI) se baseia no padrão do salpico o retroespalhados de luz de laser para medir a velocidade do sangue vermelho células7.
LDF mede apenas em um único ponto, e reprodutível padronização da posição dos sensores é uma tarefa difícil mas desejável. Outro problema é que a sonda do LDF é pequena em diâmetro (1 mm2). Medição em pontos predeterminados antes da cirurgia é muito específico e pode ser cego para alterações circulatórias no pós-operatório, enquanto o edema, a remoção de tecido, movimento de tecido ou a prótese implantada causar alterações significativas na geometria de pós-operatório dos afetados tecidos moles. A distância de medição da LDF é menos de 1 mm, que proíbe o uso de uma tala dental com um buraco predeterminado para a sonda em caso de alteração volumétrica do tecido. LSCI não requer ferramentas especiais para localização e pode medir em áreas de vários cm2. Como resultado, a cicatrização pode ser seguido em todo o sítio cirúrgico. Além disso, LSCI pode exibir perfusão sanguínea em imagens codificadas por cores em uma fração de segundo, com uma resolução de até 20 μm.
O dispositivo LSCI apresentado neste artigo é usado principalmente para aplicações de pesquisa animal onde alta resolução em áreas pequenas de medição é desejada. No entanto, uma vez que a estrutura e histologia da mucosa oral humana são diferentes de área para área (anexado a gengiva, gengiva marginal, mucosa vestibular), circulação sanguínea também é heterogêneo8. Portanto, de alta resolução LSCI tem uma vantagem grande sobre LSCI resolução normal, que geralmente é usado em testes em humanos.
O instrumento LSCI emprega um laser invisível (comprimento de onda de 785 nm). O feixe é divergiu para iluminar a área de medição, criando um padrão de salpico. O padrão do salpico na área iluminada de imagens de uma câmera CCD. A câmera CCD usada neste sistema tem uma área de imagem ativa de 1386 x 1034 pixels e sua resolução é entre 20 a 60 µm/pixel, dependendo do tamanho da área de medição e na configuração do software (baixa, média, alta). Pode levar imagens a uma velocidade de 16 quadros por segundo, ou até mais, até 100 quadros por segundo, se o tamanho da imagem é reduzido. Perfusão sanguínea é calculado pelo software interno. Análise de variações no padrão do salpico e quantifica o contraste. O fluxo resultante é cor codificada para produzir uma imagem de perfusão. De acordo com nossos resultados anteriores, LSCI avalia a perfusão de sangue da gengiva com boa repetibilidade e reprodutibilidade9. Isto implica que é uma ferramenta confiável para monitorar alterações na microcirculação da mucosa oral, não só em experiências de curto prazo, mas também durante estudos de longo prazo para controlar a progressão da doença ou ferimento cura10.
Neste trabalho, apresentamos um relato de caso clínico para demonstrar que a alta resolução espacial de LSCI torna possível revelar o padrão de neovascularização de um enxerto de colágeno xenogénica. Além disso, neste caso indica que LSCI, devido à sua alta confiabilidade, poderia com sensibilidade detectar variação individual. Isto é importante como significativa variação anatômica local e um fundo diferente sistêmico entre os casos torna difícil padronizar a intervenção cirúrgica em ensaios clínicos de cirurgia periodontal.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
O método relatado foi empregado em um ensaio clínico, que foi concedido a aprovação ética do Comitê húngara do registo de saúde e centro de treinamento (número de aprovação: OTIG/034310/2014).
1. LSCI Setup
- Ligue o computador e periféricos.
- Liga o aparelho LSCI para ser usado com o interruptor no painel traseiro.
- Permitir que o instrumento aquecer durante pelo menos 5 min. O instrumento está pronto para medição, quando ambos os LEDs no painel traseiro pararam de piscar.
- Inicie o software clicando duas vezes no ícone do software na área de trabalho ou através do menu iniciar.
- Espere até que ambos o amarelo e os verdes LEDs no painel traseiro pararam de piscar, que indica que o laser é quente e inicialização for concluída.
Nota: Ao iniciar o sistema, um ocasionalmente precisará executar o procedimento de verificação para o sistema.
2. o sistema verificação
- Use a caixa de calibração fornecida. Remover a tampa da caixa de calibração e agitá-lo para evitar a sedimentação em suspensão coloidal.
- Deixe a tampa aberta por 30 s para evitar bolhas.
- Voltar a pôr a tampa da caixa de calibração.
- Clique avançada | Verificação | Verifique se o instrumento.
- Selecione a rotina de verificação | Próximo.
- Gire a cabeça 90°, fixar a caixa de calibração usando os ímãs integrados e clique em seguinte.
- Digite a temperatura na caixa de texto, selecione o ° C e clique em Iniciar.
- Aguarde enquanto o assistente é concluído o procedimento de verificação.
- Após um procedimento de verificação bem-sucedida feche o assistente clicando em terminar.
3. participante preparação
- Certifique-se de que a medida é realizada em uma sala com temperatura controlada (26 ° C).
- Colocar o paciente em posição supina confortável em uma cadeira de dentista e coloque um travesseiro vácuo debaixo da cabeça (Figura 1).
- Deixe o paciente sem ser perturbado por 15 min antes de quaisquer medições.
4. a microcirculação imagem de medição
- No menu ferramentas , selecione e clique em Editor do projeto. Uma nova janela abre na qual as configurações usadas podem ser salvos.
- Na caixa de projectos, clique em novo para criar um novo projeto. Digite o "Vestibulum" e clique em Okey.
- Na caixa de Sites, clique em novo para criar um novo site. Digite "Dente 14" e clique em Okey.
- Sob o painel de conteúdo do dente 14 adicionar "10cm" como a distância necessária para a Distância e insira uma largura de 3 cm e uma altura de 2 cm nas caixas de medição.
- Definir a resolução de densidade do ponto ao normal e a taxa de quadros para imagens/s 16 e selecione o menu drop-down de duração para definir a duração da gravação para 0 tempo : 30.
- Selecione "Record com nenhuma média" e definir a taxa de captura de foto de cor de 1/segundo.
- Clique em "Aplicar" e "Okey" para salvar os parâmetros de projeto.
- No menu arquivo , selecione e clique em nova gravação. Abrirá uma nova janela de imagem e o painel de configuração será exibido.
- Em Configuração de gravação, selecione "Vestibulum" para o projeto e "dente de 14" para a 4.9. Site.
- Abrir o menu drop-down de objecto , clique em novo na caixa de diálogo Selecione o assunto e digite o nome do paciente.
- Clique Okey e digite um nome para a gravação no campo Nome de Rec : por exemplo, dia 1 (dias decorridos após a operação) e o nome do operador no campo operador .
- Antes de iniciar a medição de imagem de microcirculação, pressão arterial e pulso do paciente de medida.
- Evacue o ar do vácuo travesseiro para fixar a cabeça do paciente em posição adequada à área sob investigação.
- Peça o paciente abrir a boca.
- Retrai os lábios suavemente por dois espelhos dentais (Figura 1).
- Ajuste a cabeça do instrumento paralela à área medida da gengiva. Um built-in visível (650 nm) laser indicador facilita o posicionamento da câmera em relação à boca do paciente.
- Ajuste a distância de trabalho de 10 cm, movendo o instrumento em relação ao tecido. A distância é medida continuamente pelo dispositivo LSCI e é exibido pelo software como trabalho distância/medida valor sob a Configuração de imagem.
- Instrua o sujeito a ficar ainda durante a duração da medição.
- Clique no botão gravar para iniciar a gravação. A cor da janela de imagem agora muda para vermelho, indicando que a gravação está em andamento. O painel de configuração é substituído pelo painel de gravação. Gravação para automaticamente depois de 30 s. Quando a gravação estiver concluída, a cor das alterações janela de imagem para azul e o painel de gravação é substituída pelo painel de revisão.
- Remova os espelhos dentais e permitir que o paciente feche a boca e engolir.
- Opção voltar para a imagem ao vivo, pressionando o botão retomar a gravação .
- Repita as etapas de 4.14 para 4.21 duas vezes.
- Feche o arquivo. Os dados são salvos automaticamente.
- Medir a tensão arterial e pulso após as medições LSCI.
5. off-line análise
- Analise as imagens LSCI usando o built-in software. Vá para exibição de imagem ou Split (Figura 2).
- Defina as regiões de interesse (ROI). Nota: os valores de perfusão de pixels dentro de um ROI são em média e definidos como o valor do fluxo de sangue do ROI, expressado em um valor arbitrário, chamado unidade de perfusão de Speckle Laser (LSPU).
- Selecione a forma ROI desejada dentro da paleta de ferramentas ROI à direita.
- Selecione a opção de aplicar na paleta de ferramentas ROI, que se aplica a operações de ROI para todas as imagens da gravação.
- Desenhar o ROI, clicando e segurando o botão do mouse na imagem de intensidade, arrastando o ROI para fora para o tamanho desejado e soltar o mouse botão (clique e clique duas vezes para ROIs de forma livre). Ajuste a posição do ROI, redimensionar ou girá-lo, se necessário.
- Repita as etapas de 5.3. a 5.5 tantas vezes quanto o número desejado de ROIs (Figura 3).
- Defina períodos de tempo de interesse (TOI). Isto permite uma média de perfusão em um ROI durante um período definido de tempo (Figura 2).
- Ir para o modo gráfico ou Split. Selecione o botão de ferramenta Adicionar TOI.
- Clique e segure o gráfico na posição onde você deseja que o TOI para iniciar e arraste o cursor para a posição final desejada. Em seguida, solte o botão do mouse.
- Exporte dados da tabela de valor médio para processamento adicional.
- Construa curvas de fluxo de sangue por um software apropriado, usado para a análise estatística.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vestibuloplasty é a cirurgia periodontal para o vestíbulo oral, com o objetivo de aumentar a profundidade do vestibular, a zona da gengiva queratinizada e espessura de tecidos moles para o aprimoramento estético e função. O retalho de espessura dividida reposicionado apicalmente combinado com uma matriz de colágeno é um procedimento de vestibuloplasty usados com frequência. Matriz de colagénio xenogénica é uma alternativa viável para enxerto gengival autógeno para aumentar a quantidade de gengiva queratinizado11,12,13; no entanto, não existem dados sobre a direção da revascularização do enxerto e como isso afeta a microcirculação dos tecidos circundantes. Compreender esses mecanismos pode facilitar a aba apropriada e design de incisão em cirurgia periodontal.
Um paciente do sexo masculino 17 anos de idade com uma largura inadequada da gengiva queratinizada no primeiro pré-molar na maxila foi tratada por vestibuloplasty, utilizando um retalho de espessura dividida reposicionado apicalmente combinado com uma matriz de colágeno. Intraorais fotografias (tiradas por uma câmera de foto) e medições de fluxo (BF) sangue por LSCI foram tiradas antes da vestibuloplasty (linha de base) assim como 1, 2, 3, 4, 5, 7, 9, 11, 14, 21, 27 dias e 2, 3, 4, 5, 6 e 12 meses no pós-operatório. Pressão arterial e pulso foram avaliadas antes e após cada medição.
Durante a análise off-line, determinaram-se múltiplos ROIs na área da mucosa aumentada; alguns da região do enxerto e outros na mucosa circundante, definida como 'peri' regiões. Como mostrado na Figura 3, 'peri' e enxerto regiões ainda eram divididas em zonas, dependendo da distância do centro da prótese implantada, marcado como zona F na foto. Zonas A e B foram definidas na região de 'peri' e zonas C, D e E da região do enxerto. Cada uma destas zonas foi delimitados separadamente em todos os quatro lados do enxerto (mesial, distal, apical e coronário). Cada tiro de 30 segundos foi identificado como um TOI (Figura 2). Dados em cada ROI e TOI foram exportados para um programa de planilha. Curvas de fluxo de sangue foram construídas por um software apropriado, usado para a análise estatística.
Não houve alteração significativa na pressão arterial média (mapa) durante a experiência de um ano, ou no mapa antes ou após as medições de fluxo de sangue por sessão. A Figura 4 mostra uma foto colorida, uma imagem de intensidade e uma perfusão da gengiva operada nos dias representativos do nosso estudo. Durante o primeiro fechamento de flap completa semana pós-operatória, uma espessa camada de fibrina na área enxertada e leve eritema e edema na gengiva circundante eram visíveis. Imagens de perfusão de sangue mostrou isquemia na região operada e hiperemia nas regiões 'peri'. De dia 14, a área enxertada foi clinicamente eritematosa, em paralelo com hiperemia severa observado nas imagens de perfusão de sangue. Pelo terceiro mês após a incorporação do enxerto, a ferida sarou, e perfusão gengival estava perto de níveis pré-operatórios de circulação.
A Figura 5 mostra uma imagem borrada de intensidade e o gráfico de perfusão de toda a imagem. O pico repentino no gráfico indica o movimento pelo paciente. A medição foi repetida imediatamente, após certificar-se de que o paciente está em uma posição confortável. Alterações em BF nas diferentes zonas dentro do enxerto e nas regiões 'peri' são mostradas na Figura 6. É comum em todas as curvas que a partir do quarto mês, o fluxo sanguíneo não alterou mais longe, até ao final do inquérito. O fluxo de sangue média para este período pode ser usado como um descanso valor de fluxo de sangue para o tecido novo e a variação aleatória entre os pontos de tempo nos permitiu calcular a componente de variância baseados em tempo para cada ROI respectivamente, usando um modelo linear misto. A diferença mínima detectável poderia ser calculada então para identificar mudança real (com 95% de confiança) entre os pontos de tempo durante o período de cicatrização (antes do quarto mês), a fim de determinar a hiperemia e a fase isquêmica. As características básicas das curvas foram semelhantes em todos os ROIs dentro do enxerto, começando com uma fase isquêmica, seguida por uma fase hiperemiada. No entanto, o comprimento destas duas fases foi diferente (tabela 1). Isquemia foi mais longos (7-9 dias) na região central e em todas as zonas coronais, com hiperemia tarde começando entre dia 11 e 27. Em outras zonas do enxerto, isquemia durou apenas 4 – 7 dias e hiperemia começou mais cedo, entre 7 e 21 dias.
As curvas BF das zonas dos lados diferentes do enxerto tinham características únicas (Figura 6). Na parte apical, todas as quatro zonas tinham semelhante curvas de fluxo de sangue. No lado coronal, perfusão foi retomada na zona exterior mais tarde do que nas zonas de interior, ao contrário do lado mesial e distal. Em ambos os lados laterais, BF aumentou primeiro na zona C, zona D, seguido por BF aumentar na zona E e finalmente, na região central, zona F. Nas zonas da mucosa circundante (zona A e B) sem isquemia significativa foi observada. Em vez disso, observou-se hiperemia de uma magnitude diferente e a medida dos lados diferentes.
Havia dois pontos de tempo quando o valor BF não se coaduna com as características globais da curva de BF. No dia 9, houve uma queda brusca na maioria das zonas e principalmente nas zonas 'peri' do lado apical e distal. Não posso afirmar com certeza que se tratava de um erro de medição, como não há medições foram tomadas na anterior e no dia seguinte. No entanto, de acordo com uma nota do relatório de medição, a dobra bucal foi recolhida com muita pressão pelo operador, resultando em uma queda no BF. Isto faz sentido considerar que principalmente a circulação dos lados distais e apicais ter sido afetada, puxando a bochecha. No dia 182 (6 meses depois), devido a maiores intervalos entre tempos de medição, esqueceu-se do paciente manter as restrições acordadas antes da medição. O sangramento da gengiva marginal na fotografia colorida (Figura 6) indica o dente dura escovar antes da medição. Entretanto, o paciente foi submetido a tratamento ortodôntico, também, e ele usou elásticos intermaxilares. Ambos os fatores podem aumentar significativamente o BF14,15, então a medição repetiu-se em um momento posterior sob condições cuidadosamente controladas.

Figura 1: preparação de paciente e instalação Experimental LSCI para medição do fluxo de sangue na região operada. Os lábios estão retraídos por espelhos odontológicos. Clique aqui para ver uma versão maior desta figura.
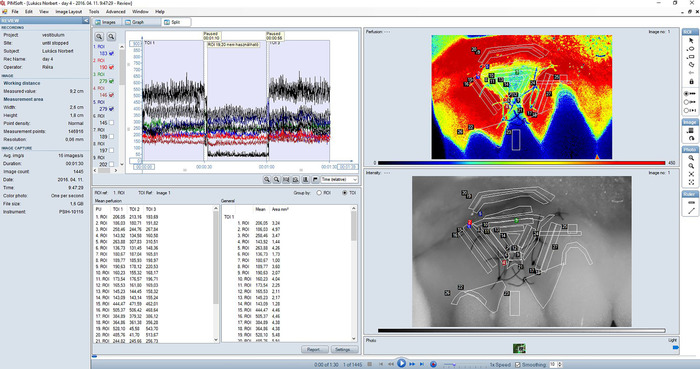
Figura 2: vista (combinação de gráfico e à visualização de imagens) de uma gravação típica gengival do fluxo de sangue na área tratada dividida. Imagem de perfusão (vista sub direita superior) é uma representação Color-coded da perfusão de sangue na gengiva. Áreas de alta perfusão são mostradas em vermelho, enquanto as áreas de baixa perfusão são azuis. A gama de cores de imagens de perfusão corresponde a 0-450 LSPU; suavização foi definida como 10. Uma imagem de intensidade (vista sub direita inferior) é criada pela luz do laser retroespalhados total. Isso corresponde exatamente com a imagem de perfusão e é útil para orientação e para a identificação de detalhes na imagem da perfusão. Regiões de interesse (ROI) são sempre definidas na imagem de intensidade. O gráfico (painel esquerdo superior) mostra vestígios de perfusão de sangue em tempo real para cada ROI na gravação. As caixas de seleção à esquerda pode ser usadas para selecionar quais traços para mostrar. Três medições consecutivas são mostradas no gráfico. Cada 30 s tiro foi identificado como um TOI. Uma tabela de valor médio, apresentando valores de má perfusão em cada ROI e TOI também é exibida na vista dividida (painel inferior esquerdo). Clique aqui para ver uma versão maior desta figura.

Figura 3: regiões de interesse (ROI) definido na área gengival examinada na imagem intensidade. Zona A e B estão na região 'peri', enquanto a zona C, D e E são o enxerto no diminuindo distâncias do centro do enxerto, marcado como zona zona F. A situa-se na superfície vestibular dos lábios. Clique aqui para ver uma versão maior desta figura.

Figura 4: fotografias representativas (linha superior), a imagem de intensidade LSCI (linha média) e a imagem de perfusão LSCI (linha inferior) da gengiva operada. As imagens representam o estado pré-operatório e perfusão e ferida cura e perfusão 1, 4, 7, 14, 21, 27 e 98 dias no pós-operatório. Clique aqui para ver uma versão maior desta figura.
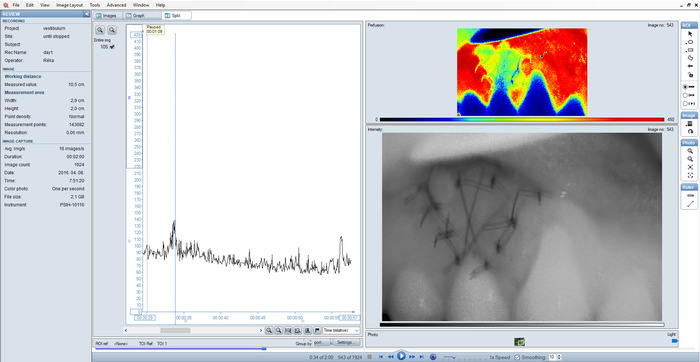
Figura 5: vista de uma gravação sub-ótimo dividida. Imagem desfocada intensidade e distantes picos no gráfico devido a configuração incorreta. Clique aqui para ver uma versão maior desta figura.

Figura 6: gráfico de dispersão de BF ao longo do tempo no coronal (a), b mesial, distal (c) e apical (d) lado do enxerto. A parte central do enxerto (zona F) foi descrita em todos os gráficos para servir como uma referência para as zonas mais externas. Clique aqui para ver uma versão maior desta figura.
| Lado | Zona | Final de isquemia | Início de hiperemia | Fim de hiperemia |
| coronal | c | 9 | 27 | 27 |
| coronal | d | 9 | 21 | 27 |
| coronal | e | 7 | 11 | 98 |
| Central | f | 9 | 11 | 98 |
| mesial | c | 5 | 21 | 27 |
| mesial | d | 5 | 11 | 61 |
| mesial | e | 7 | 11 | 61 |
| distal | c | 5 | 11 | 27 |
| distal | d | 4 | 7 | 98 |
| distal | e | 4 | 11 | 98 |
| apical | c | 4 | 11 | 27 |
| apical | d | 5 | 11 | 61 |
| apical | e | 5 | 11 | 61 |
Tabela 1: período de tempo da fase isquêmica e hiperemiada em várias zonas no enxerto, em dias
Subscription Required. Please recommend JoVE to your librarian.
Discussion
O objetivo deste estudo foi apresentar uma nova técnica para monitorar a neovascularização de um enxerto na gengiva humana. De acordo com nossos resultados anteriores, LSCI avalia a perfusão de sangue da gengiva com boa repetibilidade e reprodutibilidade9, quando implementação rigorosa de cada etapa do protocolo planejada como uma exigência fundamental é atendida. LSCI é considerado como uma técnica semi-quantitativa que requer calibração periodicamente para assegurar a exatidão e a estabilidade. Durante a verificação, a temperatura deve ser medida com a maior precisão possível, porque esse valor é usado pelo algoritmo de verificação para calcular a perfusão.
O método LSCI é altamente sensível para o ajuste de distância de trabalho e artefatos de movimento também. Neste estudo, a distância de trabalho foi fixada em 10 cm. A área de medição foi 2,7 cm x 2 cm, que corresponde a uma área de aproximadamente três dentes largura gengival. A taxa de quadros eficaz foi 16 imagens/s e 0.06 s/imagem, como o pulso arterial induz mudanças pulsátil na microcirculação gengival9, que tem que ser em média da gravação. Imagem rápida reduziu o risco de artefatos de movimento, também. No entanto, no caso de configurações incorretas ou movimentos do paciente, a gravação deve ser parada e repetida, em condições óptimas.
Dois operadores participaram em cada medição: uma ajustada na cabeça LSCI e controlado o computador enquanto o outro retraído dos lábios do paciente. Neste estudo, três repetidas medições foram realizadas em cada sessão, cada um tendo 30 s. Desde que as medições envolvem sempre algum tipo de irritação do tecido mole, devido a inevitável retração dos lábios e bochechas, que perturba a microcirculação da gengiva, ocorre um aumento no erro aleatório. Tal variação inter dia, no entanto, pode ser minimizada, repetindo o processo de medição inteira, ou seja,, , re-abrindo a boca, retrai o tecido mole de novo, re-definindo a posição da câmera e re-selecionando ROIs do software9.
Microcirculação gengival mostrou alta variação regional8. Portanto, um método, como LSCI que mede o fluxo de sangue em uma vasta área tem uma grande vantagem sobre as técnicas de medição de ponto único como LDF. Neste estudo, a área de medição coberto o campo todo cirúrgico. A área de medição ampla nos permitiu comparar re - ou neovascularização em várias regiões dentro da área de feridos em nosso estudo. Ao contrário do LDF, onde a sonda é fixada por stents fabricados antes da cirurgia, no caso do método LSCI, não há nenhuma necessidade para definir a região a ser examinado com antecedência. Para o principal objectivo da monitorização a cicatrização de feridas em medicina personalizada é reconhecer padrões inesperados em qualquer lugar ao redor da ferida ou o retalho. Além disso, alterações no pós-operatório em tecido geometria e edema causado pelo aumento do tecido macio ou duro faria os stents pré-fabricados inútil após a cirurgia. Para ajudar a avaliação visual, suavização foi ligada durante a gravação e o alisamento valor foi definido como 10. Isto significa que a perfusão foi em média dez imagens para uma aparência mais suave da imagem a perfusão e a fim de diminuir o ruído de fundo. No entanto, suavização é apenas um efeito visual e não influencia os valores reais de perfusão gravado.
Fluxo sanguíneo gengival tem uma alta Variação temporal também. Isto pode estar relacionado a vários fatores fisiológicos que acompanham a vida cotidiana, tais como inflamação gengival16,17,18, ritmo circadiano19, pressão arterial20temperatura16 , do dente 21, pressão mecânica8,22,23,24, escovagem14,17,25 ou força ortodôntica15 . Portanto, a padronização e a estabilização destes factores é obrigatória para as medidas de acompanhamento bem sucedidas.
Os métodos utilizados anteriormente para investigar a vascularização do enxerto são altamente invasivos, o que significava uma restrição maior na medição de pontos de tempo durante a cicatrização, especialmente em estudos humanos26,,27,28, 29,30,31,32. Eles também têm limitações em termos de diferenças regionais de medição quantitativa. Nosso anterior de9,de estudos10 já provaram a alta confiabilidade de LSCI em ensaios clínicos e foi encontrado para ser útil para determinar o tempo de tecidos moles cura de um indivíduo após a extração do dente, a fim de otimizar implante de colocação33. Neste estudo, a ferida coberta por um enxerto colágeno xenogénica mostrou excelente neovascularização, como no dia de pós-operatório 11th todas as zonas dentro do enxerto alcançado o nível de fluxo de sangue máxima. No entanto, pode presumir-se que o enxerto colágeno descartadas ou foi reabsorvido pelo dia 11 e na verdade medimos a revascularização do leito receptor. Além de sua característica não-invasiva, outro atributo especial de LSCI é um recurso para caracterizar as curvas de reperfusão em várias regiões de um enxerto durante a incorporação, a nível individual. As características centrípetas do enxerto neovascularização são semelhantes às anteriores observações de histologia30. Isto sugere que a revascularização do enxerto ocorre não somente do plexo vascular do periósteo, mas também da margem da ferida.
O experimento apresentado mostra que a revascularização do enxerto pode ser claramente seguido se cada passo é seguido rigorosamente. No entanto, no dia 182, instrução e preparação do paciente não conformes resultaram em um aumento significativo no BF.
LSCI é usado extensivamente para campo-total de imagens da estrutura vascular e associada a fluxo de sangue em outros tecidos, como a retina34,35, a pele7,36 e o cérebro37,38 . As aplicações clínicas mais promissoras de LSCI são queimar ferida avaliação39,40, avaliação de retalhos41 e recuperação intra-operatória de sangue cerebral fluxo monitoramento42. Aparentemente, existem sérias limitações para medições gengivais generalizadas por LSCI em cobaias humanas. Esta ferramenta é muito robusto e pesado. As principais dificuldades surgem em conexão com a câmera de documentação, que tem baixa resolução e está localizado a poucos centímetros de distância da câmera de medição. Estas características tornam difícil identificar regiões de interesse diretamente sobre fotos coloridas. O tamanho da cabeça da máquina LSCI impede que o tiroteio no interior da cavidade oral. Portanto, áreas que não são visíveis diretamente não podem ser medidas. Temos demonstrado anteriormente que usar uma abordagem indireta com um espelho fotográfico pode servir como um método alternativo de9. No entanto, usando um espelho envolve mais artefatos de movimento que LSCI é sensível, torna mais difícil de capturar uma imagem perpendicular e diminui a distância focal. Quando a área medida não pode ser capturada perpendicularmente, o valor do fluxo de sangue pode ser correta9,39, mas identificação de região na imagem continua a ser complicada por causa da torção 3D.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Este trabalho foi realizado em parte do apoio pelo fundo de pesquisa científica húngara, sob K112364 de número de Grant, pelo Ministério das capacidades humanas, programa de excelência de ensino superior para Universidade Semmelweis, módulo de pesquisa de terapia e pelo húngaro a Nacionais de investigação, desenvolvimento e inovação Office KFI_16-1-2017-0409.
Materials
| Name | Company | Catalog Number | Comments |
| PeriCam PSI-HR | Perimed AB, Stockholm, Sweden | The PeriCam PSI System is an imaging system based on LASCA technology (LAser Speckle Contrast Analysis). The system measures superficial blood perfusion over large areas at fast capture rates. This makes it ideal for investigations of both the spatial and temporal dynamics of microcirculation in almost any tissue. | |
| PIMSoft | Perimed AB, Stockholm, Sweden | PIMSoft is a data acquisition and analysis software, intended for use together with the PeriCam PSI System and the PeriScan PIM 3 System, for measurement and imaging of superficial blood perfusion. | |
| Geistlich Mucograft | Geistlich, Switzerland | It's a unique 3D collagne matrix designed specifically for soft tissue regeneration. It's indicated for the gain of keratinized tissue and recession coverage. | |
| Omron M4 | Omron Healthcare Inc., Kyoto, Japan | Blood pressure monitor, which gives accurate readings. | |
| Nikon D5200 | Nikon Corportation, Tokyo, Japan | Taking intra oral photos | |
| MS Excel | Microsoft Corporation, Redmond, Washington, USA | The software used for data management | |
| IBM SPSS Statistics 25 | IBM Corp., Armonk, NY, USA | The software used for statistical analysis |
References
- Nakamoto, T., et al. Two-Dimensional Real-Time Blood Flow and Temperature of Soft Tissue Around Maxillary Anterior Implants. Implant Dentistry. 21 (6), 522-527 (2012).
- Kajiwara, N., et al. Soft tissue biological response to zirconia and metal implant abutments compared with natural tooth: microcirculation monitoring as a novel bioindicator. Implant Dentistry. 24 (1), 37-41 (2015).
- Kemppainen, P., Forster, C., Handwerker, H. O. The importance of stimulus site and intensity in differences of pain-induced vascular reflexes in human orofacial regions. Pain. 91 (3), 331-338 (2001).
- Kemppainen, P., Avellan, N. L., Handwerker, H. O., Forster, C. Differences between tooth stimulation and capsaicin-induced neurogenic vasodilatation in human gingiva. Journal of Dental Research. 82 (4), 303-307 (2003).
- Riva, C., Ross, B., Benedek, G. B. Laser Doppler measurements of blood flow in capillary tubes and retinal arteries. Investigative ophthalmology. 11 (11), 936-944 (1972).
- Humeau, A., Steenbergen, W., Nilsson, H., Stromberg, T. Laser Doppler perfusion monitoring and imaging: novel approaches. Medical & Biological Engineering & Computing. 45 (5), 421-435 (2007).
- Briers, J. D., Webster, S. Laser speckle contrast analysis (LASCA): a nonscanning, full-field technique for monitoring capillary blood flow. Journal of Biomedical Optics. 1 (2), 174-179 (1996).
- Fazekas, R., et al. Functional characterization of collaterals in the human gingiva by laser speckle contrast imaging. Microcirculation. 25 (3), 12446 (2018).
- Molnar, E., Fazekas, R., Lohinai, Z., Toth, Z., Vag, J. Assessment of the test-retest reliability of human gingival blood flow measurements by Laser Speckle Contrast Imaging in a healthy cohort. Microcirculation. 25 (2), (2018).
- Molnar, E., et al. Evaluation of Laser Speckle Contrast Imaging for the Assessment of Oral Mucosal Blood Flow following Periodontal Plastic Surgery: An Exploratory Study. BioMed Research International. 2017, 4042902 (2017).
- Sanz, M., Lorenzo, R., Aranda, J. J., Martin, C., Orsini, M. Clinical evaluation of a new collagen matrix (Mucograft prototype) to enhance the width of keratinized tissue in patients with fixed prosthetic restorations: a randomized prospective clinical trial. Journal of Clinical Periodontology. 36 (10), 868-876 (2009).
- Nevins, M., Nevins, M. L., Kim, S. W., Schupbach, P., Kim, D. M. The use of mucograft collagen matrix to augment the zone of keratinized tissue around teeth: a pilot study. The International Journal of Periodontics and Restorative Dentistry. 31 (4), 367-373 (2011).
- Lorenzo, R., Garcia, V., Orsini, M., Martin, C., Sanz, M. Clinical efficacy of a xenogeneic collagen matrix in augmenting keratinized mucosa around implants: a randomized controlled prospective clinical trial. Clinical Oral Implants Research. 23 (3), 316-324 (2012).
- Perry, D. A., McDowell, J., Goodis, H. E. Gingival microcirculation response to tooth brushing measured by laser Doppler flowmetry. Journal of Periodontology. 68 (10), 990-995 (1997).
- Yamaguchi, K., Nanda, R. S., Kawata, T. Effect of orthodontic forces on blood flow in human gingiva. Angle Orthodontist. 61 (3), 193-203 (1991).
- Molnár, E., et al. Assessment of heat provocation tests on the human gingiva: the effect of periodontal disease and smoking. Acta Physiologica Hungarica. 102 (2), 176-188 (2015).
- Gleissner, C., Kempski, O., Peylo, S., Glatzel, J. H., Willershausen, B. Local gingival blood flow at healthy and inflamed sites measured by laser Doppler flowmetry. Journal of Periodontology. 77 (10), 1762-1771 (2006).
- Hinrichs, J. E., Jarzembinski, C., Hardie, N., Aeppli, D. Intrasulcular laser Doppler readings before and after root planing. Journal of Clinical Periodontology. 22 (11), 817-823 (1995).
- Svalestad, J., Hellem, S., Vaagbo, G., Irgens, A., Thorsen, E. Reproducibility of transcutaneous oximetry and laser Doppler flowmetry in facial skin and gingival tissue. Microvascular Research. 79 (1), 29-33 (2010).
- Sasano, T., Kuriwada, S., Sanjo, D. Arterial blood pressure regulation of pulpal blood flow as determined by laser Doppler. Journal of Dental Research. 68 (5), 791-795 (1989).
- Ikawa, M., Ikawa, K., Horiuchi, H. The effects of thermal and mechanical stimulation on blood flow in healthy and inflamed gingiva in man. Archives of Oral Biology. 43 (2), 127-132 (1998).
- Baab, D. A., Oberg, P. A., Holloway, G. A. Gingival blood flow measured with a laser Doppler flowmeter. Journal of Periodontal Research. 21 (1), 73-85 (1986).
- Fazekas, A., Csempesz, F., Csabai, Z., Vág, J. Effects of pre-soaked retraction cords on the microcirculation of the human gingival margin. Operative Dentistry. 27 (4), 343-348 (2002).
- Csillag, M., Nyiri, G., Vag, J., Fazekas, A. Dose-related effects of epinephrine on human gingival blood flow and crevicular fluid production used as a soaking solution for chemo-mechanical tissue retraction. Journal of Prosthetic Dentistry. 97 (1), 6-11 (2007).
- Tanaka, M., Hanioka, T., Kishimoto, M., Shizukuishi, S. Effect of mechanical toothbrush stimulation on gingival microcirculatory functions in inflamed gingiva of dogs. Journal of Clinical Periodontology. 25 (7), 561-565 (1998).
- Rothamel, D., et al. Biodegradation pattern and tissue integration of native and cross-linked porcine collagen soft tissue augmentation matrices - an experimental study in the rat. Head & Face Medicine. 10, 10 (2014).
- Schwarz, F., Rothamel, D., Herten, M., Sager, M., Becker, J. Angiogenesis pattern of native and cross-linked collagen membranes: an immunohistochemical study in the rat. Clinical Oral Implants Research. 17 (4), 403-409 (2006).
- Vergara, J. A., Quinones, C. R., Nasjleti, C. E., Caffesse, R. G. Vascular response to guided tissue regeneration procedures using nonresorbable and bioabsorbable membranes in dogs. Journal of Periodontology. 68 (3), 217-224 (1997).
- Oliver, R. C., Loe, H., Karring, T. Microscopic evaluation of the healing and revascularization of free gingival grafts. Journal of Periodontal Research. 3 (2), 84-95 (1968).
- Janson, W. A., Ruben, M. P., Kramer, G. M., Bloom, A. A., Turner, H. Development of the blood supply to split-thickness free ginival autografts. Journal of Periodontology. 40 (12), 707-716 (1969).
- Mormann, W., Bernimoulin, J. P., Schmid, M. O. Fluorescein angiography of free gingival autografts. Journal of Clinical Periodontology. 2 (4), 177-189 (1975).
- Busschop, J., de Boever, J., Schautteet, H. Revascularization of gingival autografts placed on different receptor beds. A fluoroangiographic study. Journal of Clinical Periodontology. 10 (3), 327-332 (1983).
- Fazekas, R., et al. A proposed method for assessing the appropriate timing of early implant placements: a case report. Journal of Oral Implantology. , (2018).
- Briers, J. D., Fercher, A. F. Retinal blood-flow visualization by means of laser speckle photography. Investigative Ophthalmology & Visual Science. 22 (2), 255-259 (1982).
- Srienc, A. I., Kurth-Nelson, Z. L., Newman, E. A. Imaging retinal blood flow with laser speckle flowmetry. Front Neuroenergetics. 2, (2010).
- Choi, B., Kang, N. M., Nelson, J. S. Laser speckle imaging for monitoring blood flow dynamics in the in vivo rodent dorsal skin fold model. Microvascular Research. 68 (2), 143-146 (2004).
- Ayata, C., et al. Laser speckle flowmetry for the study of cerebrovascular physiology in normal and ischemic mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 24 (7), 744-755 (2004).
- Armitage, G. A., Todd, K. G., Shuaib, A., Winship, I. R. Laser speckle contrast imaging of collateral blood flow during acute ischemic stroke. Journal of Cerebral Blood Flow & Metabolism. 30 (8), 1432-1436 (2010).
- Lindahl, F., Tesselaar, E., Sjoberg, F. Assessing paediatric scald injuries using Laser Speckle Contrast Imaging. Burns. 39 (4), 662-666 (2013).
- Mirdell, R., Iredahl, F., Sjoberg, F., Farnebo, S., Tesselaar, E. Microvascular blood flow in scalds in children and its relation to duration of wound healing: A study using laser speckle contrast imaging. Burns. , (2016).
- Zotterman, J., Bergkvist, M., Iredahl, F., Tesselaar, E., Farnebo, S. Monitoring of partial and full venous outflow obstruction in a porcine flap model using laser speckle contrast imaging. Journal of Plastic, Reconstructive & Aesthetic Surgery. 69 (7), 936-943 (2016).
- Hecht, N., Woitzik, J., Dreier, J. P., Vajkoczy, P. Intraoperative monitoring of cerebral blood flow by laser speckle contrast analysis. Neurosurgical Focus. 27 (4), E11 (2009).



