Summary
本文为构建具有良好干细胞性质的多层干细胞片提供了一种高效可行的方法。
Abstract
干细胞治疗在再生损伤器官和组织中具有广阔的发展前景, 细胞表技术的发展, 提高了靶区内细胞的低滞留率和存活率。然而, 在体外构建过程中, 迫切需要一种维持干细胞生物活性和增加细胞表中细胞数量的解决方案。本协议提出了一种具有良好的干细胞生物活性和最佳可操作性的多层细胞表的构建方法。脱细胞猪心包 (DPP) 由磷脂酶 A2 (PLA2) 去细胞法制备, 作为细胞表支架, 大鼠骨髓间充质干细胞 (骨髓基质细胞) 被孤立并扩展为种子细胞。采用 RAD16-I 肽水凝胶构建了临时多层细胞表结构。最后, 用动态灌注系统培养细胞表以稳定三维 (3D) 结构, 并在体外48 小时培养后获得细胞表。该方案为多层干细胞的构建提供了一种有效可行的方法, 今后可作为一种有利的干细胞治疗产品开发出细胞表。
Introduction
干细胞治疗已被报道为许多疾病的有效治疗;然而, 在传统的干细胞注射之后, 低细胞保留率和目标区内存活的不良仍然是关键问题。为了解决这个问题, 组织工程科学家开发了细胞表技术。采用温度-反应培养皿1制备了 monolayered 细胞表, 并对其后续研究报告了在梗死中干细胞保留和存活的显著改善。面积2,3。在这些方法中, 建立多层细胞表是提高细胞存活和细胞表治疗效果3、4的有效策略。从那时起, 科学家们一直在开发不同的细胞表结构方法, 以增加细胞数量, 干细胞属性和细胞表的力学性能。目前, 在心肌梗死5、软骨损伤6、皮肤创面7的治疗中, 已经建立和研究了某些类型的细胞表。
干细胞在移植前的生物活性表现出对损伤组织再生的影响, 不同的细胞表构建策略对干细胞有不同的影响。一方面, 汇合细胞表仅由高密度干细胞组成, 而天然细胞外基质可通过堆叠 monolayered 细胞表8或使用磁性组织工程技术9获得。另一方面, 研究人员开发了不同的支架, 以提供足够的机械强度和支持细胞生长10,11,12, 使低干细胞播种密度, 以确保营养供应。然而, 尽管有这些方法, 多层细胞板结构中的低效营养供应仍然是体外构建过程中的一个重要问题。因此, 迫切需要一种高效、可行的电池板施工系统。
本协议描述了准备 multilayeredmesenchymal 干细胞 (MSC) 细胞表的步骤。在这个施工系统中, 单元板的机械强度由 DPP 提供。基于该脚手架, 可利用 RAD16-I 肽水凝胶快速构建3D 细胞结构, 并采用动态灌注系统培养多层细胞表, 以稳定3D 细胞表结构, 提供足够的营养电池的供应。采用该系统, 成功制备了多层 BMSC 片, 对大鼠心肌梗死模型13进行了最佳的治疗效果。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
所有干细胞和动物实验程序均按照《国家实验室动物护理指南》的道德准则进行, 并经济南大学动物护理与使用委员会 (中国广州) 批准。
1. 用 PLA2去细胞方法制备民进党脚手架14
注: 有关 PLA2去细胞方法的示意图, 请参见图 1A 。
- 准备100毫升 200 U/毫升 PLA2溶液。在198毫升碳酸盐缓冲液中加入0.5 克脱氧胆酸钠和2毫升 PLA2 。此解决方案应在24小时内使用它的准备工作。
- 从屠宰场获得新鲜的猪心包 (FPP), 并在1小时内返回实验室。
注意: 在运输过程中, FPP 应存储在4摄氏度。步骤 1.2-1.10 应在恒温器控制的水浴中进行连续震动。 - 彻底洗涤 FPP 与200毫升磷酸盐缓冲液 (PBS) 含有1% 青霉素链霉素在500毫升烧杯10°Cfor 10 分钟. 重复此步骤2x。
- 将 FPP 分成两层, 用镊子和剪刀去除脂肪组织。
注意: 在去除脂肪组织的过程中, 每20分钟添加50毫升 PBS, 保持 FPP 湿润。 - 用剪刀把 FPP 的形状变成 10 x 10 厘米2块。用200毫升碳酸盐缓冲液 (CBS) 洗涤 FPP, 其中含有1% 青霉素链霉素, 500 毫升烧杯10摄氏度, 10 分钟. 重复此步骤2x。
- 将 FPP 转移到纯净水中, 在10°c 浸泡12小时。
- 将 10 x 10 cm2样品浸泡在50毫升的 CBS 中, 其中包含 200 U/毫升 PLA2和 0.5% (脱氧胆酸) 钠溶液, 37 摄氏度为 6 h。
- 用 CBS 1% 青霉素-链霉素 (10 摄氏度) 清洗样品10分钟. 重复此步骤2x。
- 将每个样品浸泡在50毫升的 CBS 中, 其中包含 200 U/毫升 PLA2和 0.5% (脱氧胆酸) 钠溶液, 37 摄氏度为 2 h。
- 用 CBS 1% 青霉素-链霉素 (10 摄氏度) 清洗样品2小时. 至少重复此步骤10x。将样品放在平板上, 在55摄氏度的恒温烘箱中晾干以保持恒定的重量。
注: 样品需要完全干燥。每10分钟称量 DPP 样品一次, 重复3x 或直到重量不再变化。 - 将每个 DPP 样本的形状环钻为直径为10.5 毫米的圆。将每个 DPP 装在无菌密封袋中。
- 通过伽玛辐照消毒 DPP 样品 (25 kGy)。使用前将 DPP 样本存储在4摄氏度。
注: 所有样品在4摄氏度下最多可储存六月。
2. 细胞表结构的准备工作
- 热压罐所有仪器和组织载体组件在121摄氏度30分钟, 包括1.5 毫升离心管, 镊子, 齿钳, 剪刀, 黑碱 (组织载体组件), 和白色张力环 (组织载体组件)。
- 准备20毫升无菌10% 蔗糖溶液。重量2克蔗糖和溶解蔗糖在18毫升的超纯水。热压罐10% 蔗糖溶液在121摄氏度30分钟或过滤溶液与0.22 µm 过滤器。
- 在121摄氏度的动态灌流系统设备上热压30分钟, 包括气体交换设备、500毫升玻璃瓶、灌注培养容器和结缔组织。
- 准备蒸压仪器和组织载体组件。将组织载体的黑底部分放入培养皿中。
- 拿起一个干的民进党脚手架, 把它放在黑基地的中心。在民进党脚手架上放置一个白色张力环, 并将其固定在组织载体中。
注意: 确保支架完全固定在组织载体中, 黑色底座与白色张力环之间没有空隙。如果没有, 分离组织载体和修复脚手架再次。 - 在民进党脚手架上添加100µL 培养基, 用于补液。
注意: 如果支架在组织载体中没有固定好, 培养基将渗入培养皿中。 - 将脚手架放入37摄氏度培养箱中, 使其浸泡15分钟。
3. 细胞表结构的制备
注意: 此协议用于细胞培养使用100毫米的盘子。有关多层单元结构的构造示意图, 请参见图 1B 。
- 隔离骨髓基质细胞13。
注意: 此方法是为构建多层 MSC 单元格表而设计的。本协议使用大鼠骨髓基质细胞。采用全骨髓贴壁法分离骨髓基质细胞,体外扩增骨髓基质, 获得足够的胞量。- 将仪器在121摄氏度热压30分钟, 包括镊子、齿钳和剪刀。准备2毫升注射注射器和 BMSC 培养基 (杜尔贝科的改良老鹰培养基 [DMEM]、10% 胎牛血清、1% 谷氨酰胺和1% 青霉素-链霉素)。
- 安乐死三周龄雄性杜勒 (SD) 大鼠颈椎脱位。浸泡在100毫升75% 酒精溶液中的动物在烧杯5分钟。
- 将动物从烧杯中取出, 并将其放置在操作台上。用剪刀和镊子切割动物背部的皮肤。隔离皮肤和肌肉组织, 露出大腿股骨。
- 隔离大腿股骨, 并把它在30毫升 PBS 在一个50毫升离心管。将两个大腿股骨成一根管子。涡旋离心管, 彻底清洗组织。重复此步骤2x。
- 用剪刀切开股骨的两端, 露出骨髓腔。
- 用注射注射器吸2毫升 BMSC 培养基。将针头插入骨髓腔内, 用培养基冲洗骨髓。将每两个大腿股骨冲洗出100毫米的培养皿。
- 每种100毫米培养皿, 在培养皿中加入2毫升培养基。将培养皿放入37摄氏度孵化器和静态培养72小时。
- 从孵化器中取出培养皿。用6毫升新鲜培养基取代上清液。
- 在显微镜下观察原发性骨髓基质细胞。随后, 每隔 5-7 d 通过骨髓基质细胞。
- 把细胞从孵化器中取出。观察显微镜下的细胞, 选择合适的细胞进行细胞表的构建。当骨髓基质干细胞达到 80%-90% 汇合时, 细胞可以选择为种子细胞。
- 从培养皿中去除培养基。用2毫升温热 PBS 轻轻冲洗细胞。从培养皿中取出所有 PBS, 确保没有液体残留。添加2毫升0.25% 胰蛋白酶 (或其他游离溶液) 到菜和孵育在37摄氏度3分钟。
- 通过添加2毫升培养基来停止胰蛋白酶效应, 轻轻地从盘子中洗涤细胞。将细胞悬浮液转移到新的15毫升离心管中。Centrifugate 细胞在 225 x g 5 分钟。
- 移除上清液。用3毫升 10% (w/v) 蔗糖溶液重悬细胞。
注: 10% (w/v) 蔗糖溶液用于洗涤细胞, 以便在以下步骤中获得统一的细胞-水凝胶混合物。 - 吸出细胞悬浮液的10µL, 用血细胞计数器计数细胞数。计算下一步骤所需的卷。对于一个细胞表, 使用300万骨髓基质。
- 提取300万个细胞并将其转移到一个新的15毫升离心管中。离心细胞在 225 x g 5 分钟。
- 移除上清液。用1毫升 10% (w/v) 蔗糖溶液重悬细胞。将细胞悬浮液转移到1.5 毫升离心管中。
注: 使用1.5 毫升离心管有利于制备细胞-水凝胶混合物。 - 离心细胞在 260 xg 5 分钟. 完全去除上清液, 获得细胞沉积物。
4. 骨髓基质细胞和 RAD16-I 肽水凝胶混合物的制备
注: 有关多层单元结构构造示意图, 请参见图 1B 。
- 将20µL 10% (w/v) 蔗糖溶液添加到1.5 毫升离心管中。轻轻地重悬骨髓基质, 获得均匀的悬浮液。
注意: 请勿在再悬浮期间生成任何气泡。 - 在悬浮液顶部添加20µL RAD16-I 肽水凝胶。用移液头轻轻搅拌 RAD16-I 肽和细胞悬浮液。当细胞悬浮液和水凝胶混合在一起时, 轻轻地移出混合物几次。
- 从组织载体中取出 DPP 脚手架, 用移液头轻轻吸出培养基。
注: 在添加细胞水凝胶混合物之前, 确保 DPP 脚手架完全水化。 - 吸匀混合物并均匀地将其添加到 DPP 脚手架。
注: 混合物的总容积约为 40-50 µL。建议从中心到脚手架外添加10µL 的混合物。 - 将1毫升培养基添加到组织载体的底部。将电池片放在37摄氏度孵化器中5分钟。
- 从孵化器中取出细胞表。在培养皿中轻轻添加4毫升培养基, 浸入细胞片中。将电池片放在37摄氏度培养箱中, 2 小时的静态培养。
5. 使用动态培养系统的3D 多层细胞片体外培养
注: 有关3D 动态系统的示意图, 请参见图 1C 。
- 准备动态灌注系统, 包括蠕动泵、气体交换设备、500毫升玻璃瓶、灌注培养容器和结缔组织。组装动态灌注系统, 如图 2所示。
- 将200毫升培养基添加到无菌玻璃瓶中。将单元格表插入到区域性容器的腔室中。
注意: 注意细胞表上表面的方向。 - 在组织容器中添加3毫升培养基并关闭容器。将动态灌注系统放入孵化器, 启动泵。将蠕动泵的流速设置为8毫升/分钟. 培养 48 h 动态灌注系统中的细胞表。
6. 获得多层 MSC 电池片
- 将仪器和组织载体组件在121摄氏度热压30分钟, 包括1.5 毫升离心管、镊子和齿钳。
- 从玻璃瓶中拉出输入管道, 停止向容器供应培养基。
注: 当区域性容器为空时, 停止蠕动泵。 - 从培养容器中取出细胞表, 放入培养皿中。
- 使用一个镊子固定的组织载体和使用另一个齿钳分开白色张力环与黑色底座。最后, 获得多层骨髓基质细胞表。
- 对于短保存, 每个电池片可以转移到1.5 毫升离心管与镊子。应将民进党脚手架附着在离心管的内壁上, 在离心管中应尽可能多地扩散细胞片。
- 在离心管中轻轻添加1毫升培养基, 浸泡细胞表。关闭离心管的盖子, 将电池片储存在4摄氏度。
注: 应尽早移植或分析细胞表。建议在 4 h 内使用电池片。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
多层干细胞片结构示意图如图 1所示。采用 PLA2去细胞法制备细胞表支架是第一步。以脚手架为基础, 通过将干细胞与 RAD16-1 肽水凝胶混合, 构建一个临时的3D 细胞结构。为了获得具有良好的干细胞生物活性和最佳机械强度的多层细胞表, 在动态灌注系统中培养细胞表。在动态营养供应的条件下, 干细胞可以在多层细胞片中增殖和建立细胞接触, 最终稳定的多层细胞片产品可在24到72小时的种植后获得。
在这种情况下, 由 PLA2去细胞方法制备的细胞表支架 DPP。干民进党的外观平坦、光滑、半透明 (图 3A)。由于 PLA2的特定裂解作用, 可以完全去除异质细胞, 而民进党脚手架内天然胶原的超微结构保存完好 (图 3B), 这对于维持脚手架的机械强度和生物相容性。此外, 支架可以被修改为生长因子控制释放系统, 以支持干细胞生长和改善体内再生13。
当干细胞达到约 80%-90% 汇合时, 细胞与培养皿分离, 用10% 蔗糖溶液洗涤。离心后, 细胞与 RAD16-I 肽水凝胶混合, 并添加到水化民进党脚手架。一个临时的多层结构是在两小时的静态文化之后形成的。最后, 在动态灌注系统中, 在48小时的培养下获得多层 BMSC 板产品 (图 4)。在民进党脚手架的支持下, 细胞表可以很容易地用镊子操作, 并且可以在1.5 毫升试管中的培养基中暂时保存4摄氏度, 在检查或移植前4小时 (图 4)。免疫荧光染色结果表明, 骨髓基质细胞对干细胞标记物 CD90 和 CD29 具有高度阳性的作用。在细胞表结构后, 多层细胞表内的骨髓干细胞显示高水平的 CD29 和 CD90 (图 5)。

图 1: 构建多层干细胞表的流程图.(A) 使用 PLA2脱细胞方法, FPP 内的异质细胞被破坏, 而在民进党脚手架中, 天然细胞外基质保存完好。(B) 根据民进党脚手架, 通过混合干细胞和自组装肽水凝胶, 构建临时多层细胞结构。(C) 随后, 细胞表在3D 动态系统中培养, 干细胞有望在动态营养供应下增殖并建立细胞接触。请点击这里查看这个数字的更大版本.

图 2: 组织载体和动态灌注系统.(A) 此面板显示13毫米直径的组织载体。(B) 该面板显示了动态灌注系统的装配。请点击这里查看这个数字的更大版本.
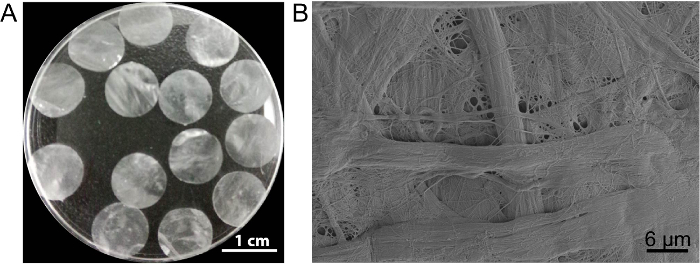
图 3: 民进党的外观和超微结构.(A) 该面板显示了10.5 毫米口径的民进党脚手架的外观。(B) 该面板显示了民进党脚手架扫描电子显微镜 (SEM) 结果的代表性图像。请点击这里查看这个数字的更大版本.
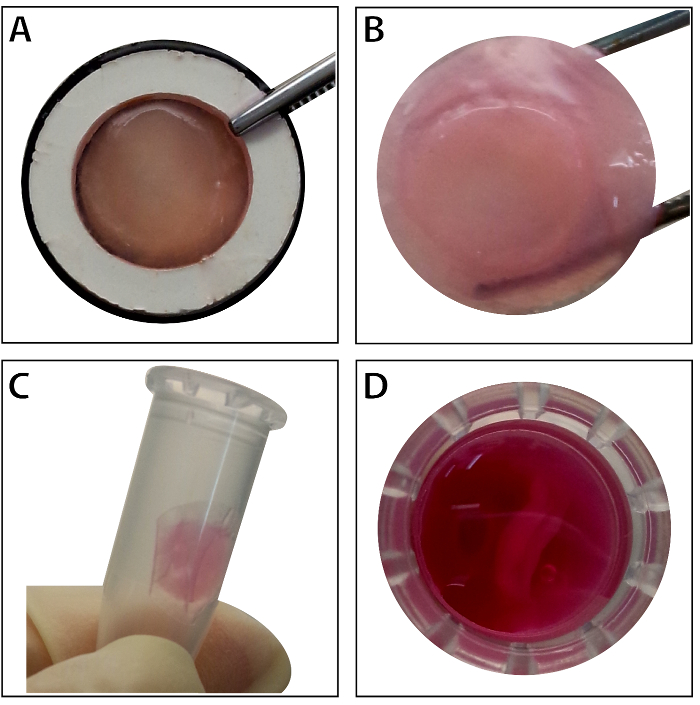
图 4: 多层 BMSC 板的外观.(A) 此面板显示了组织载体内多层 BMSC 片的外观。(B) 完整的多层 BMSC 板由镊子持有。(C - D)在使用前, 可在1.5 毫升管中暂时保留多层细胞表。请点击这里查看这个数字的更大版本.
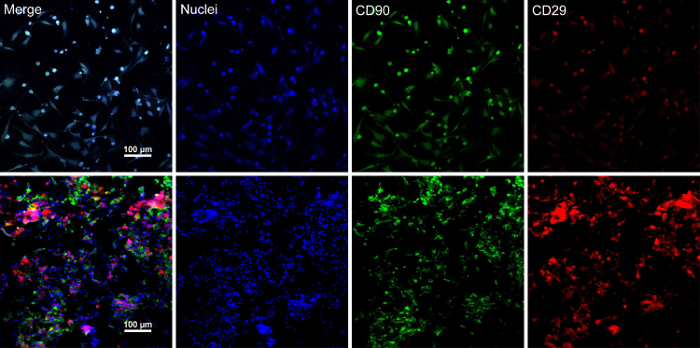
图 5: BMSC 标记表达的免疫荧光染色结果.(A) 本小组在细胞表构造前显示骨髓基质干细胞的免疫荧光染色结果。(B) 此面板显示多层 BMSC 片节的免疫荧光染色结果。CD90 (绿色) 和 CD29 (红色) 在骨髓基质干细胞和细胞表中呈阳性表达。请点击这里查看这个数字的更大版本.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
本议定书报告了构建多层 MSC 表的有效方法。该细胞表具有最佳的机械强度、高细胞播种密度和良好的干细胞生物活性。以骨髓基质细胞为例, 用 RAD16-I 多肽水凝胶快速构建3D 单元结构。在动态灌注系统中培养后, 成功地获得了多层 BMSC 片, 骨髓基质细胞保持了干细胞标记的高表达。
构建临时多层单元结构是协议的关键步骤。RAD16-I 是一种商业水凝胶肽, 由1% 氨基酸和99% 水组成。一些研究报告说, 这种肽水凝胶可以模拟自然的 ECM 环境, 有利于干细胞的增殖和存活15,16,17。在本议定书中, 300万 MSC 悬浮液 (20 µL 10% 蔗糖溶液) 与20µL 的 RAD16-I 肽水凝胶混合。细胞悬浮液和多肽水凝胶的体积比为1:1。此肽水凝胶对环境 ph 值敏感, 当 pH 值从酸性变为中性时, 肽分子会自动形成3D 网络。由于细胞表面含有带电粒子, 细胞混合物在短时间内从液体转变为水凝胶, 影响细胞均匀混合。一个有利的细胞水凝胶应该是细胞悬浮液和多肽水凝胶的均匀混合物, 使细胞混合物均匀地添加到脚手架上。研究人员可以根据实际需要, 通过改变种子细胞数、蔗糖溶液体积和肽水凝胶量来优化混合条件。值得注意的是, 用10% 蔗糖溶液洗涤细胞和均匀地混合细胞-水凝胶是该协议的关键步骤, 不均匀的混合物可能导致大细胞丢失和不稳定的临时多层结构。
将细胞-水凝胶混合物添加到民进党脚手架上后, 由于多肽水凝胶网络不够强, 无法维持长期的多层细胞结构, 多层细胞板结构的机械强度较弱, 细胞需要连接和 ECM 分泌物来增强细胞表的稳定性。此外, 培养基的动态浸润可促进干细胞在多层细胞结构内增殖和建立细胞接触, 而营养供应不足将导致细胞凋亡, 降低细胞密度。细胞表13。因此, 动态灌注系统对稳定多层板结构具有重要意义。此外, 应根据特定的干细胞类型和细胞播种密度调整培养基的适当流速。同时, 民进党脚手架与多层细胞结构之间的弱机械连接仍然是目前施工方法的局限性, 可能导致多层细胞层和脚手架的分裂。因此, 需要进一步研究, 以提高3D 水凝胶脚手架和民进党脚手架的机械生物相容性。
到目前为止, 组织工程科学家一直致力于建立高效的体外营养供应系统, 如 coculturing 内皮细胞18和使用多孔支架19。然而, 在传统的静态3D 培养体系中, 3D 结构内的营养渗透率较低, 其干细胞活力将受到很大影响。在这种情况下, 使用动态灌注系统可以提供足够的营养供应, 以维持干细胞的生存能力。采用该协议, 多层 BMSC 片改善了大鼠心肌梗死模型13的心功能和血管生成。构建具有高细胞负荷和良好干细胞性质的干细胞片状产物对组织再生具有重要意义。采用这种高效的构造方法, 可以通过改变种子干细胞类型, 如上皮干细胞片、神经干细胞片或心梗细胞表来构造不同种类的多层干细胞片。进一步探索和替代的多层干细胞表有望扩大应用, 更多的组织再生。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有什么可透露的。
Acknowledgments
这项工作得到了中国国家自然科学基金 (31771064 号赠款) 的支持;广东省科技规划项目 (赠款编号2013B010404030、2014A010105029、2016A020214012);广州市科技规划项目 (授权号 201607010063);本科创新与创业培训项目 (授权编号 201610559028);中国青年科学家国家科学基金会 (赠款号 31800819)。
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



