Summary
Cet article fournit une méthode efficace et réalisable pour la construction de plusieurs couches de cellules souches feuilles dont la propriété des cellules souches favorables.
Abstract
Thérapie de cellules souches montre un prometteur future dans la régénération de blessés organes et tissus, et la technique de feuille de cellule a été développée pour améliorer la rétention cellulaire faible et faible taux de survie dans la zone cible. Cependant, au cours du processus de construction in vitro , une solution pour le maintien des cellules souches bioactivité et augmentant la quantité de cellules dans la feuille de la cellule est absolument nécessaire. Ici, ce protocole présente une méthode pour construire une feuille de plusieurs couches de cellules avec des cellules souches favorables bioactivité et opérabilité optimale. DECELLULARISE péricarde porcin (DPP) est préparée par la phospholipase une méthode de DÉCELLULARISATION2 (PLA2) comme l’échafaud de feuille de cellule, et rat cellules souches mésenchymateuses de moelle osseuse (BMSC) sont isolées et élargis comme les cellules ensemencées. La structure en tôle cellulaire multicouche temporaire est construite à l’aide de RAD16-j’ai peptide hydrogel. Enfin, la feuille de la cellule est cultivée avec un système de perfusion dynamique pour stabiliser la structure de tridimensionnelle (3D) et la plaque de cellules pourrait être obtenue après une culture de 48 heures en vitro. Ce protocole fournit une méthode efficace et réalisable pour la construction d’une feuille de plusieurs couches de cellules souches, et la plaque de cellules pourrait être développée comme un produit de thérapie des cellules souches favorables à l’avenir.
Introduction
Thérapie de cellules souches a été signalée comme un traitement efficace pour de nombreuses maladies ; Cependant, rétention cellulaire faible et faible taux de survie dans la zone cible restent des problèmes critiques après l’injection des cellules souches traditionnelles. Pour résoudre ce problème, les scientifiques ingénierie tissulaire a développé la technique de feuille de cellule. Une feuille d’examen cellule avec la matrice extracellulaire intacte a été tout d’abord préparée à l’aide de la réponse de la température de culture plat1, et ses études de suivi a signalé les améliorations significatives de la conservation de cellules souches et la survie au sein de la strangulation zone2,3. Parmi les méthodes, la construction de la plaque de plusieurs couches de cellules a signalé comme une stratégie efficace pour améliorer la survie de la cellule et la cellule feuille effet thérapeutique3,4. Depuis lors, les scientifiques ont travaillé sur l’élaboration de méthodes de construction différentes cellules feuille afin d’augmenter la quantité de cellules, propriété des cellules souches et des propriétés mécaniques des feuilles cellule. Jusqu'à présent, certains types de plaque de cellules ont été construites et étudiés dans le traitement de l’infarctus du myocarde5, blessures des cartilages6, et peau plaie7.
La bioactivité des cellules souches avant la transplantation a montré une influence émergente sur la régénération des tissus lésés, et les stratégies de construction différentes cellules feuille ont des effets différents sur les cellules souches. D’une part, feuilles de cellules confluentes consistaient seulement à haute densité de cellules souches, et matrices extracellulaires naturelles pourraient être acquis par empilement de feuilles cellule examen8 ou à l’aide de tissus magnétique d’ingénierie techniques9. En revanche, les chercheurs ont développé différents échafaudages pour offrir une résistance mécanique suffisante et un soutien cellule croissance10,11,12, qui a permis une cellule souche basse densité pour assurer la nutrition de l’ensemencement approvisionnement. Cependant, malgré ces approches, l’alimentation faible nutrition efficace au sein de la structure en tôle multicouches cellule reste une préoccupation majeure lors de la construction en vitro . Par conséquent, il est urgent d’un système de construction efficace et réalisable cellule feuille.
Ce protocole décrit les étapes pour préparer une feuille de cellules multilayeredmesenchymal stem cell (MSC). Dans ce système de construction, la résistance mécanique de feuille de cellule est assurée par un DPP. Se fondant sur cet échafaudage, la structure cellulaire 3D peut être construite rapidement avec RAD16-j’ai hydrogel de peptide et un système de perfusion dynamique est utilisée pour la culture de la feuille de plusieurs couches de cellules, afin de stabiliser la structure de feuille 3D cell et de fournir une alimentation suffisante alimentation pour les cellules. Grâce à ce système, une feuille BMSC multicouche a été préparée avec succès et montre un effet thérapeutique optimal sur le rat infarctus du modèle13.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Toutes les procédures de l’expérimentation animale et de cellules souches ont été réalisées selon les directives éthiques du Guide National pour le soin et l’utilisation des animaux de laboratoire et approuvés par le Comité de l’urbanisme (Guangzhou, Chine) et de Jinan University animalier.
1. préparation de l’échafaudage DPP avec la PLA2 DÉCELLULARISATION méthode14
Remarque : Voir la Figure 1 a pour une représentation schématique de la méthode de DÉCELLULARISATION2 PLA.
- Préparer 100 mL de solution de2 200 U/mL PLA. Ajouter 0,5 g de désoxycholate de sodium et 2 mL de PLA2 dans 198 mL de solution tampon de carbonate. Cette solution devrait être utilisée dans les 24h après sa préparation.
- Obtenir le péricarde porcin fraîche (FPP) de l’abattoir et retourner au laboratoire de moins de 1 h.
Remarque : Le FPP doit être conservé à 4 ° C durant le transport. 1.2-1.10 des mesures devraient être menées sous agitation continue dans un bain d’eau contrôlé par thermostat. - Lavez soigneusement le FPP avec 200 mL de tampon phosphate (PBS) contenant 1 % de pénicilline-streptomycine dans un bécher de 500 mL à 10 ° Cpendant 10 min. Répétez cette étape 2 x.
- Le FPP scindée en deux couches et retirer le tissu adipeux avec pinces et ciseaux.
Remarque : Conservez le FPP humide en ajoutant 50 mL de PBS toutes les 20 min lors du retrait du tissu adipeux. - Façonner le FPP en morceaux de2 de 10 x 10 cm avec des ciseaux. Laver le FPP avec 200 mL de solution tampon de carbonate (CBS) contenant 1 % de pénicilline-streptomycine dans un bécher de 500 mL à 10 ° C pendant 10 min. Répétez cette étape 2 x.
- Transférer le FPP pure de l’eau et faire tremper à 10° C pendant 12 h.
- Faire tremper les2 échantillons de 10 x 10 cm dans 50 mL de CBS contenant 200 U/mL PLA2 et solution de désoxycholate de sodium 0,5 % (p/v) à 37 ° C pendant 6 h.
- Laver les échantillons avec CBS contenant 1 % de pénicilline-streptomycine à 10 ° C pendant 10 min. répéter cette étape 2 x.
- Tremper chaque échantillon dans 50 mL de CBS contenant 200 U/mL PLA2 et solution de désoxycholate de sodium 0,5 % (p/v) à 37 ° C pendant 2 h.
- Laver les échantillons avec CBS contenant 1 % de pénicilline-streptomycine à 10 ° C pendant 2 h. répéter cette étape pour x 10 au moins. Placer les échantillons dans des assiettes plates et les faire sécher à poids constant dans un four à température constante à 55 ° C.
NOTE : L’échantillon doit être complètement sec. Peser l’échantillon DPP toutes les 10 min et le répéter 3 x ou jusqu'à ce que le poids n’est plus de changements. - Façonner chaque échantillon DPP dans un cercle de 10,5 mm de diamètre avec un trépan. Emballez chaque DPP dans un sac scellé stérile.
- Stériliser les échantillons DPP par irradiation gamma (25 kGy). Stockés les échantillons DPP à 4 ° C avant utilisation.
Remarque : Tous les échantillons peuvent être conservés pendant six mois à 4 ° C.
2. les préparations pour la cellule de feuille de Construction
- Stériliser tous les instruments et composants de support tissulaires à 121 ° C pour les dents de 30 min, y compris les tubes centrifuges de 1,5 mL, pinces, pinces, ciseaux, noir bases (composant de porteuse de tissu) et les bagues de tension blanc (composant de porteuse de tissu).
- Préparer 20 mL de solution de saccharose de 10 % sans germes. Poids 2 g de saccharose et dissoudre le saccharose dans 18 mL d’eau ultrapure. Autoclave la solution 10 % de sucrose à 121 ° C pendant 30 min ou filtrer la solution avec un filtre de 0,22 µm.
- Stériliser les dispositifs de perfusion dynamique à 121 ° C pendant 30 min, y compris un gaz échangent des équipements, une bouteille de verre de 500 mL, un conteneur de culture de perfusion et les tubes conjonctives.
- Préparer les instruments stérilisés à l’autoclave et les tissus composants du transporteur. Mettre la pièce de base noire du transporteur le tissu dans une boîte de Petri.
- Ramasser un échafaudage DPP séché et mettez-le dans le centre de la base noire. Mettre une bague de serrage blanc sur l’échafaud DPP et fixez-le dans le support de tissu.
Remarque : S’assurer que l’échafaudage est totalement fixe dans le support de tissu et il n’y a pas d’espace entre la base noire et la bague de serrage blanc. Si ce n’est pas le cas, séparer le transporteur de tissu et fixez l’échafaud encore. - Ajouter 100 µL de milieu de culture sur l’échafaud DPP pour la réhydratation.
Remarque : Si l’échafaudage n’est pas fixe dans le transporteur de tissu, le milieu de culture sera d’infiltrer la boîte de Petri. - Mettez l’échafaud dans un incubateur à 37 ° C et laisser tremper pendant 15 min.
3. préparation des cellules pour cellule feuille Construction
Remarque : Ce protocole est pour la culture cellulaire à l’aide d’un plat de 100 mm. Voir Figure 1 b pour une représentation schématique de la construction de la structure plusieurs couches cellulaires.
- Isoler BMSC13.
Remarque : Cette méthode est conçue pour la construction d’une feuille de cellules CSM multicouche. Rat BMSC est utilisés dans le présent protocole. Le BMSC est isolées en utilisant la méthode adhérentes de toute la moelle osseuse et le BMSC est élargis in vitro d’obtenir assez montant de cellule.- Stériliser les instruments à 121 ° C pendant 30 min, y compris les pinces, pinces crantées et ciseaux. Préparer une seringue d’injection de 2 mL et le milieu de culture BMSC (Dulbecco modifié moyen [DMEM] de l’aigle, 10 % sérum de veau fœtal, glutamine 1 % et 1 % la pénicilline-streptomycine).
- Euthanasier les rats Sprague-Dawley (SD) mâles de trois semaines par luxation de vertèbre cervicale. Faire tremper l’animal dans 100 mL de solution d’alcool 75 % dans un bécher pendant 5 min.
- Sortir l’animal le bécher et placez-le sujets sur la table d’opération. Inciser la peau sur le dos de l’animal avec des ciseaux et pinces. Isoler les tissus de la peau et des muscles afin d’exposer les fémurs de la cuisse.
- Isoler les fémurs de la cuisse et le mettre dans 30 mL de PBS dans un tube à centrifuger 50 mL. Placez deux fémurs de cuisse dans un tube. Vortex le tube à centrifuger de se laver le tissu de fond. Répétez cette étape 2 x.
- Couper les deux extrémités du fémur avec des ciseaux et exposer la cavité de moelle osseuse.
- Aspirer 2 mL de milieu de culture BMSC avec une seringue à injection. Introduire l’aiguille dans la cavité de moelle et débusquer la moelle osseuse avec milieu de culture. Rincer chaque fémur deux cuisse dans une boîte de Petri de 100 mm.
- Pour chaque boîte de Petri de 100 mm, ajouter 2 mL de milieu de culture dans la boîte de Pétri. Mettre la boîte de Pétri dans l’incubateur de 37 ° C et de la culture statique pendant 72 h.
- Sortez de la boîte de Pétri de l’incubateur. Remplacer le liquide surnageant avec 6 mL de milieu de culture frais.
- Observer BMSC primaire sous un microscope. Suite à cela, le passage du BMSC tous les 5 à 7 jours.
- Prendre les cellules hors de l’incubateur. Observer des cellules au microscope et choisir les cellules appropriés pour la construction de cellule feuille. Quand le BMSC atteindre 80 % - 90 % confluence, les cellules peuvent être choisis comme les cellules ensemencées.
- Enlever le milieu de culture de la boîte de Pétri. Laver délicatement les cellules avec 2 mL de PBS chaud. Retirez tous les PBS de la boîte de Petri et faire reste bien sûr aucun liquide. Ajouter 2 mL de 0,25 % de trypsine (ou une autre solution de dissociation) au plat et incuber à 37 ° C pendant 3 min.
- Arrêtez l’effet de la trypsine en ajoutant 2 mL de milieu de culture et laver délicatement les cellules du plat. Transférer la suspension cellulaire dans un nouveau tube à centrifuger 15 mL. Centrifuger les cellules à 225 x g pendant 5 min.
- Retirez le surnageant. Remettre en suspension les cellules avec 3 mL de solution sucrée 10 % (p/v).
NOTE : solution de sucrose à 10 % (p/v) est utilisée pour laver les cellules afin d’obtenir un mélange uniforme de cellule-hydrogel dans les étapes suivantes. - Aspirer 10 µL de la suspension cellulaire et compter le nombre de cellule avec un hémocytomètre. Calculer le volume nécessaire pour la prochaine étape. Pour les tôles d’une seule cellule, BMSC 3 millions est utilisés.
- Extrait de 3 millions de cellules et de les transférer dans un nouveau tube à centrifuger 15 mL. Centrifuger les cellules à 225 x g pendant 5 min.
- Retirez le surnageant. Remettre en suspension les cellules avec 1 mL de solution sucrée 10 % (p/v). Transférer la suspension de cellules dans un tube à centrifuger 1,5 mL.
NOTE : À l’aide d’un tube centrifuge de 1,5 mL est bénéfique pour la préparation du mélange de cellule-hydrogel. - Centrifuger les cellules à 260 xg pour 5 min. complètement éliminer le surnageant et obtenir le sédiment de la cellule.
4. préparation de la BMSC et le RAD16-je mélange Hydrogel Peptide
Remarque : Voir la Figure 1 b pour une représentation schématique de la construction de la structure plusieurs couches cellulaires.
- Ajouter 20 µL de solution de saccharose de 10 % (p/v) dans le tube centrifuge de 1,5 mL. Resuspendre le BMSC doucement et obtenir une suspension homogène.
Remarque : Ne génèrent pas de bulles lors de la remise en suspension. - Ajouter 20 µL de RAD16-j’ai peptide hydrogel en haut de la suspension. Remuer doucement le RAD16-j’ai suspension peptide et cellulaire avec l’embout de la pipette. Lorsque la suspension cellulaire et hydrogel sont mélangés ensemble, Pipetez doucement le mélange une couple de fois.
- Sortez de l’échafaud DPP par le transporteur de tissu et aspirer doucement le milieu de culture avec un embout de la pipette.
Remarque : Assurez-vous que l’échafaud DPP est complètement réhydraté avant d’ajouter le mélange de la cellule-hydrogel. - Aspirer le mélange et ajouter uniformément à l’échafaud DPP.
Remarque : Le volume total du mélange serait d’environ 40-50 µL. Il est recommandé d’ajouter le mélange 10 µL à la fois du centre vers l’extérieur de l’échafaudage. - Ajouter 1 mL de milieu de culture vers le bas de la porteuse de tissu. Mettre la plaque de cellules dans un incubateur à 37 ° C pendant 5 min.
- Retirez la plaque de cellules de l’incubateur. Doucement, ajouter 4 mL de milieu de culture dans la boîte de Petri et plonger la feuille de la cellule. Mettre la plaque de cellules dans un incubateur à 37 ° C pendant 2 h de culture statique.
5. la Culture in Vitro d’une feuille de cellules multicouches 3D à l’aide d’un système dynamique de la Culture
Remarque : Voir la Figure 1 pour une représentation schématique du système dynamique 3D.
- Préparation du système de perfusion dynamique, y compris une pompe péristaltique, équipement de commutation de gaz, une bouteille de verre de 500 mL, un conteneur de culture de perfusion et les tubes conjonctives. Assemblage du système de perfusion dynamique tel qu’illustré à la Figure 2.
- Ajouter 200 mL de milieu de culture à la bouteille en verre stérile. Insérer la plaque de cellules dans la chambre du conteneur de culture.
Remarque : Faites attention à la direction de la surface supérieure de la feuille de la cellule. - Ajouter 3 mL de milieu de culture dans le conteneur de tissu et fermer le récipient. Mettre le système de perfusion dynamique dans l’incubateur et démarrer la pompe. Régler le débit de la pompe péristaltique à 8 mL/min. Culture la plaque de cellules dans le système de perfusion dynamique pendant 48 h.
6. l’obtention de la plaque de cellules multicouches MSC
- Stériliser les instruments et les composants de support tissulaires à 121 ° C pendant 30 min, y compris les tubes centrifuges de 1,5 mL, pinces et pinces crantées.
- Retirez le conduit d’entrée de la bouteille en verre pour arrêter la fourniture de milieu de culture pour le conteneur.
Remarque : Arrêter la pompe péristaltique lorsque le récipient de culture est vide. - Sortez la plaque du récipient de culture de cellules et le mettre dans une boîte de Petri.
- Utilisez une pince pour immobiliser le transporteur de tissus et d’utiliser une autre pince crantée pour détacher la bague de serrage blanc du fond noir. Enfin, obtenir la plaque de cellules BMSC multicouche.
- Pour la conservation courte, chaque feuille de la cellule peut être transférée dans un tube centrifuge de 1,5 mL avec la pince. L’échafaudage DPP doit être fixé à la paroi interne du tube centrifuge, et la feuille de la cellule doit se propager autant que possible dans le tube à centrifuger.
- Doucement, ajouter 1 mL de milieu de culture dans le tube centrifuge de plonger la feuille de la cellule. Fermer le bouchon du tube centrifuge et stocker la plaque de cellules à 4 ° C.
Remarque : La feuille de la cellule doit être transplantée ou analysée dès que possible. Il est recommandé d’utiliser la plaque de cellules moins de 4 h.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Le schéma de la construction de feuille de plusieurs couches de cellules souches est illustré à la Figure 1. Préparer l’échafaud de feuille cellulaire par la méthode de DÉCELLULARISATION PLA2 est la première étape. Basé sur l’échafaud, une structure de cellule 3D temporaire est construite en mélangeant les cellules souches à l’hydrogel de peptide RAD16-1. Afin d’obtenir une feuille de plusieurs couches de cellules avec des cellules souches favorables bioactivité et une résistance mécanique optimale, la feuille de la cellule est cultivée dans un système de perfusion dynamique. Au titre de la fourniture de la dynamique de la nutrition, les cellules souches sont autorisés à proliférer et à établir des contacts de cellule dans la feuille de plusieurs couches de cellules, et le produit final stable cellulaire multicouche peut être obtenu après un ~ 24-72-culture de l’heure.
Dans ce cas, l’échafaud de feuille de cellule DPP est préparé par la méthode de DÉCELLULARISATION2 PLA. L’apparition de DPP séchée est plat, lisse et translucide (Figure 3 a). En raison des conséquences spécifiques de lyse PLA2, les cellules hétérogènes peuvent être complètement enlevés alors que l’ultrastructure du collagène naturel au sein de l’échafaud DPP est bien conservé (Figure 3 b), et c’est important pour le maintien de la résistance mécanique et la biocompatibilité de l’échafaudage. En outre, les échafaudages peuvent être modifiées dans un système de sortie de contrôle de facteur de croissance pour soutenir la croissance de cellules souches et améliorer la de régénération en vivo 13.
Quand les cellules souches atteignent environ 80 % - 90 % confluence, les cellules sont isolées de la boîte de Petri et lavés avec une solution de saccharose de 10 %. Après centrifugation, les cellules sont mélangés avec le RAD16-j’ai peptide hydrogel et ajouté à l’échafaud DPP réhydraté. Une structure multicouche temporaire est formée suite à une culture statique de deux heures. Enfin, le produit de feuille BMSC multicouche (Figure 4) est acquis après une culture de 48 heures dans le système de perfusion dynamique. Avec le soutien de l’échafaudage de la DPP, la plaque de cellules peut être manipulée facilement avec une pince, et il peut être temporairement conservée en milieu de culture dans le tube de 1,5 mL à 4 ° C pendant 4 heures avant l’examen ou de la transplantation (Figure 4). L’immunofluorescence souillant résultat montre, le BMSC est très positifs pour les marqueurs de cellules souches CD90 et CD29. Après la construction de cellule feuille, le BMSC dans les niveaux élevés de CD29 et CD90 de le Voir la plusieurs couches de cellules de la feuille (Figure 5).

Figure 1 : L’organigramme de la construction de la feuille de plusieurs couches de cellules souches. (A) en utilisant la méthode de2 DECELLULARISE PLA, les cellules hétérogènes au sein de la FPP sont détruites alors que les matrices extracellulaires naturelles sont bien conservés dans l’échafaudage DPP. (B) basé sur l’échafaud de la DPP, la structure cellulaire multicouche temporaire est construite en mélangeant les cellules souches et auto-assemblage peptide hydrogel. (C) à suivre, la feuille de la cellule est cultivée dans un système dynamique 3D, et les cellules souches sont censés se multiplient et établir des contacts cellulaires sous l’alimentation nutrition dynamique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Le transporteur de tissu et le système de perfusion dynamique. Transporteur de tissu (A), ce panneau montre les 13 mm de diamètre. (B), ce panneau décrit l’assemblage du système dynamique de perfusion. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
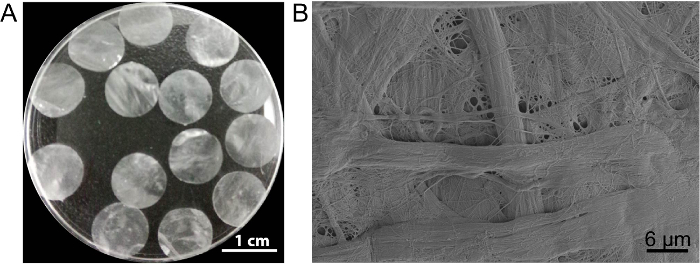
Figure 3 : L’apparence et l’ultrastructure de DPP. (A), ce panneau affiche l’apparence de l’échafaudage DPP 10,5 mm de diamètre. (B), ce panneau affiche une image représentative du microscope électronique à balayage (SEM) résultat de l’échafaudage DPP. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
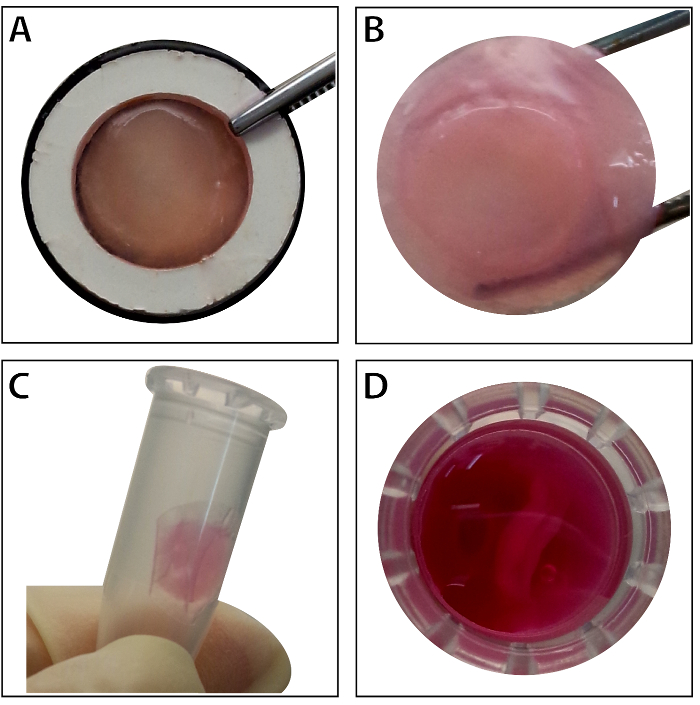
Figure 4 : L’apparence de la feuille BMSC multicouche. (A), ce panneau montre l’apparence de la BMSC multicouche feuille dans le support de tissu. (B) la feuille BMSC multicouche intacte est détenue par forceps. (C - D) La plaque de plusieurs couches de cellules peut être conservée temporairement dans le tube de 1,5 mL avant utilisation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
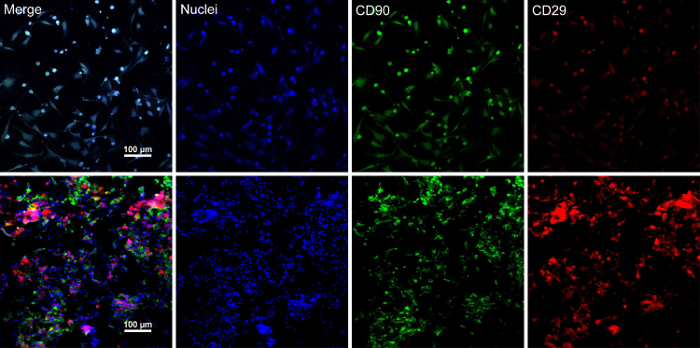
Figure 5 : Immunofluorescence souillant des résultats d’expression de marqueurs BMSC. (A), ce panneau montre immunofluorescence souillant résultats de BMSC avant la construction de cellule feuille. (B), ce panneau affiche immunofluorescence souillant les résultats de la section de feuille BMSC multicouche. CD90 (vert) et CD29 (rouge) ont été exprimés positivement dans le BMSC et la plaque de cellules. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Le présent protocole rapporte une méthode efficace pour la construction d’une feuille MSC multicouche. Cette feuille de cellules présente une résistance mécanique optimale, la densité de semis cellulaire élevée et bioactivité favorable des cellules souches. En utilisant BMSC à titre d’exemple, la structure cellulaire 3D est rapidement construite avec RAD16-j’ai peptide hydrogel. Après cultivée dans le système de perfusion dynamique, la feuille BMSC multicouche est obtenue avec succès et le BMSC maintenir une forte expression des marqueurs de cellules souches.
Construction de la structure cellulaire multicouche temporaire est l’étape critique du protocole. Le RAD16-I est un peptide hydrogel commerciale, et il se compose de 1 % des acides aminés et 99 % d’eau. Plusieurs études ont rapporté que ce peptide hydrogel peut imiter l’environnement ECM et est bénéfique pour les cellules souches la prolifération et la survie15,16,17. Dans le présent protocole, une suspension MSC 3 millions (dans 20 µL de solution de sucrose à 10 %) a été mélangé avec 20 µL de RAD16-j’ai peptide hydrogel. Le rapport de volume de la suspension cellulaire et l’hydrogel de peptide était de 1:1. Ce peptide hydrogel est sensible à l’environnement de pH, et les molécules peptidiques formerait automatiquement le réseau 3D lorsque la valeur de pH acide à neutre. Parce que la surface de la cellule contient des particules chargées, le mélange de la cellule passe de liquide à hydrogel en peu de temps, qui a des influences du même mélange des cellules. Un cellule-hydrogel favorable devrait être un même mélange de la suspension cellulaire et l’hydrogel de peptide et permet le mélange de cellules à ajouter uniformément sur l’échafaud. Les chercheurs peuvent optimiser la condition de mélange en modifiant le nombre de cellules ensemencées, volume de solution de saccharose et le volume d’hydrogel de peptide selon leurs besoins réels. Il est intéressant de remarquer que laver les cellules avec une solution de saccharose de 10 % et mélanger uniformément le mélange de la cellule-hydrogel sont les étapes critiques du protocole, et un mélange inégal pourrait provoquer la perte de grandes cellules et une instabilité de la structure multicouche temporaire.
Après avoir ajouté le mélange de cellule-hydrogel sur l’échafaud de la DPP, la résistance mécanique de la structure de feuille de plusieurs couches de cellules est faible parce que le réseau d’hydrogel de peptide n’est pas assez fort pour maintenir la structure de plusieurs couches de cellules à long terme et de cellules les connexions et les sécrétions de l’ECM sont nécessaires pour améliorer la stabilité de la plaque de cellules. Par ailleurs, l’infiltration dynamique du milieu de culture peut faciliter les cellules souches pour proliférer et établir des contacts cellulaires au sein de la structure de plusieurs couches cellulaires, alors qu’un apport nutritionnel insuffisant va provoquer l’apoptose des cellules et réduire la densité des cellules de la cellule de la feuille13. Par conséquent, le système de perfusion dynamique est important pour stabiliser la structure de feuille de plusieurs couches de cellules. En outre, le débit approprié du milieu de culture doit être ajusté selon le type spécifique de cellules souches et de la cellule, densité de semis. Aussi, la faible connexion mécanique entre l’échafaudage DPP et la structure cellulaire multicouche reste la limitation de la méthode actuelle de la construction, qui peut-être provoquer la division des couches cellulaires multicouches et l’échafaudage. Donc, plus amples études sont nécessaires afin d’améliorer la biocompatibilité des mécanique de l’hydrogel 3D échafaud et l’échafaud DPP.
Jusqu'à présent, scientifiques de génie tissulaire ont mis l’accent sur l’établissement nutrition efficace d’alimentation des systèmes in vitro, tels que coculturing endothelial cells18 et à l’aide d’un échafaudage poreux19. Cependant, la perméabilité de la nutrition au sein de la structure 3D est faible dans le système de culture traditionnelle de 3D statique, et la viabilité de cellules souches sera grandement affectée. Dans ce cas, en utilisant le système de perfusion dynamique peut fournir assez d’alimentation de nutrition pour maintenir la viabilité de cellules souches. Utilisant ce protocole, une feuille BMSC multicouche amélioré la fonction cardiaque et l’angiogenèse dans un rat infarctus du modèle13. Construction d’un produit de feuille de cellules souches avec une charge cellulaire élevée et la propriété des cellules souches favorable est importante pour la régénération des tissus. En utilisant cette méthode efficace construite, différentes sortes de feuilles de plusieurs couches de cellules souches pourraient être construits en altérant les types des cellules souches ensemencées, telles que les cellules souches épithéliales feuille, feuille de cellules souches neurales ou feuille de cellules souches cardiaques. Autres explorations des et des solutions de rechange à la feuille de plusieurs couches de cellules souches sont censées développer les applications pour la régénération des tissus plus.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (numéro de licence 31771064) ; la Science et la technologie de planification projet la Province du Guangdong (subvention numéros 2013B010404030, 2014A010105029 et 2016A020214012) ; la Science et la technologie de planification projet de Guangzhou (numéro de licence 201607010063) ; et l’Innovation de premier cycle et le programme de formation de l’esprit d’entreprise (numéro de licence 201610559028) ; la National Science Foundation des jeunes scientifiques de la Chine (nombre 31800819 de subventions).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



