Summary
Este artigo fornece um método eficiente e viável para a construção de várias camadas de células estaminais folhas com propriedade de célula-tronco favorável.
Abstract
Terapia de células-tronco mostra um promissor futuro em regenerar órgãos feridos e tecidos, e a técnica de folha célula foi desenvolvida para melhorar a retenção de cela baixa e pobre sobrevivência dentro da zona alvo. No entanto, durante o processo construção in vitro , uma solução para a manutenção de células-tronco Bioatividade e aumentando a quantidade de células dentro da camada de células é urgentemente necessária. Aqui, este protocolo apresenta um método para a construção de uma folha de várias camadas de células com bioatividade de células-tronco favorável e operabilidade ideal. Decellularized Pericárdio Porcino (DPP) é preparado pela fosfolipase um método de decellularization2 (PLA2) como o andaime de folha de célula, e rato medula células-tronco mesenquimais (BMSCs) são isoladas e expandiu-se como as células semeadas. O organelo várias camadas folha temporária é construído usando RAD16-eu hidrogel de peptídeo. Finalmente, a camada de células é cultivada com um sistema dinâmico de perfusão para estabilizar a estrutura tridimensional (3D), e a camada de células poderia ser obtida após uma cultura de 48 horas em vitro. Este protocolo fornece um método eficiente e viável para a construção de uma folha de células-tronco em várias camadas, e a camada de células poderia ser desenvolvida como um produto de terapia de células-tronco favorável no futuro.
Introduction
Terapia de células-tronco tem sido relatada como um tratamento eficaz para muitas doenças; no entanto, a célula baixa retenção e sobrevivência pobre dentro da zona alvo permanecem questões críticas depois da injeção de células-tronco tradicional. Para resolver esse problema, cientistas engenharia de tecido desenvolveram a técnica de folha de célula. Uma folha de monolayered células com matriz extracelular intacta em primeiro lugar foi preparada usando o prato de cultura de temperatura-resposta1, e seus estudos de seguimento relataram as melhorias significativas da retenção de células-tronco e sobrevivência dentro o enfartado área2,3. Entre os métodos, a construção de camada de células em várias camadas tem sido relatado como uma estratégia eficaz para melhorar a sobrevivência da célula e a célula folha efeito terapêutico3,4. Desde então, cientistas têm trabalhado no desenvolvimento de métodos de construção de folha de célula diferente a fim de aumentar a quantidade de células, células-tronco Propriedade e propriedade mecânica das folhas de célula. Até agora, foram construídos e estudados no tratamento de infarto do miocárdio5, lesão de cartilagem6, certos tipos de folha de célula e pele ferida7.
A bioatividade de células-tronco antes do transplante mostrou uma influência emergente na regeneração do tecido lesado, e estratégias de construção de folha de célula diferentes têm efeitos diferentes sobre as células-tronco. Por um lado, folhas de célula confluente consistiam apenas de células-tronco de alta densidade, e matrizes extracelulares naturais poderiam ser adquiridas por empilhamento de folhas de célula monolayered8 ou por meio de técnicas engenharia de tecido magnético9. Por outro lado, os pesquisadores desenvolveram diferentes andaimes para fornecer resistência mecânica adequada e apoio celular crescimento10,11,12, que permitiu uma célula-tronco baixa densidade para garantir a nutrição de semeadura abastecimento. No entanto, apesar dessas abordagens, o fornecimento de baixa nutrição eficiente dentro da estrutura da folha em várias camadas de células continua a ser uma grande preocupação durante a construção em vitro . Portanto, um sistema de construção de folha célula eficiente e viável é urgentemente necessário.
Este protocolo descreve as etapas para preparar uma camada de células multilayeredmesenchymal células-tronco (MSC). Neste sistema de construção, a resistência mecânica de folha de célula é fornecida por um DPP. Baseia este andaime, a estrutura celular 3D pode ser rapidamente construída com RAD16-eu hidrogel peptídeo e um sistema dinâmico de perfusão é usado para cultura folha de várias camadas de células, a fim de estabilizar a estrutura da folha célula 3D e fornecer nutrição suficiente fornecimento para as células. Usando este sistema, uma folha BMSC várias camada com êxito foi preparada e exibiu um efeito terapêutico ideal no rato do miocárdio modelo13.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Todas as células-tronco e experimento animal procedimentos foram conduzidos de acordo com as diretrizes éticas do guia nacional para o cuidado e o uso de animais de laboratório e aprovados pelo Comitê de uso (Guangzhou, China) e cuidado de Animal de Universidade de Jinan.
1. preparação do cadafalso DPP com o PLA2 Decellularization método14
Nota: Ver figura 1A para um esquema do método PLA2 decellularization.
- Prepare 100 mL de solução de2 200 U/mL PLA. Adicione 0,5 g de Deoxycholate do sódio e 2 mL de PLA2 em 198 mL de solução tampão de carbonato. Esta solução deve ser usada dentro de 24 h após sua preparação.
- Obter o pericárdio porcino fresco (FPP) do matadouro e retornar ao laboratório dentro de 1 h.
Nota: O FPP deve ser armazenado a 4 ° C, durante o transporte. Etapas 1.2-1.10 devem ser conduzidas com agitação contínua em um banho de água controlado por termostato. - Lave cuidadosamente o FPP com 200 mL de tampão fosfato (PBS) contendo 1% penicilina-estreptomicina em um copo de 500 mL em 10 min. ° Cfor 10 Repita este passo 2x.
- Dividir o FPP em duas camadas e remover o tecido adiposo com pinças e tesouras.
Nota: Mantenha o FPP molhado, adicionando 50 mL de PBS cada 20min durante a remoção do tecido adiposo. - Moldar o FPP em pedaços de2 10 x 10 cm com uma tesoura. Lave o FPP com 200 mL de solução tampão de carbonato (CBS), que contém 1% penicilina-estreptomicina em um copo de 500 mL a 10 ° C por 10 min. Repita este passo 2x.
- Transferir o FPP para água pura e mergulhe-a 10° C, durante 12 h.
- Mergulhe as amostras de2 10 x 10 cm em 50 mL de CBS contendo 200 U/mL PLA2 e solução de 0,5% (p/v) de sódio deoxycholate a 37 ° C, durante 6 h.
- Lave as amostras com CBS contendo 1% penicilina-estreptomicina a 10 ° C durante 10 min. Repita este passo 2x.
- Mergulhe cada amostra em 50 mL de CBS contendo 200 U/mL PLA2 e solução de 0,5% (p/v) de sódio deoxycholate a 37 ° C por 2 h.
- Lave as amostras com CBS contendo 1% penicilina-estreptomicina a 10 ° C, durante 2 h. Repita esta etapa para x 10 pelo menos. Colocar as amostras em placas planas e secá-las até peso constante em um forno de temperatura constante, a 55 ° C.
Nota: A amostra precisa estar completamente seca. Pesar a amostra DPP cada 10min e repetir isso 3 x ou até o peso já não muda. - Forma cada amostra DPP em um círculo de 10,5 mm de diâmetro com uma trefina. Embale cada DPP em um saco lacrado estéril.
- Esterilize as amostras DPP por irradiação gama (25 kGy). Armazenadas as amostras DPP a 4 ° C antes do uso.
Nota: Todas as amostras podem ser armazenadas por até seis meses a 4 ° C.
2. os preparativos para a célula da folha construção
- Autoclave todos os instrumentos e componentes de tecido portador a 121 ° C por 30 min, incluindo tubos de centrífuga de 1,5 mL, fórceps, com dentes pinça, tesoura, preto bases (componente do portador de tecido) e anéis de tensão branco (componente do portador de tecido).
- Prepare-se 20 mL da solução de sacarose 10% livre de germes. Peso 2 g de sacarose e dissolver a sacarose em 18 mL de água ultrapura. Autoclave a 121 ° C por 30 min ou filtrar a solução com um filtro de 0,22 µm a solução de 10% de sacarose.
- Autoclave os dispositivos de sistema dinâmico de perfusão a 121 ° C por 30 min, incluindo um gás trocam de equipamento, uma garrafa de vidro de 500 mL, um recipiente de cultura de perfusão e os tubos de conjuntivo.
- Prepare os instrumentos esterilizados e tecidos componentes do portador. Coloque a parte preta de base da transportadora tecido em um prato de cultura.
- Pegar um andaime DPP secado e colocá-lo no centro da base preta. Colocar um anel branco tensão no cadafalso DPP e fixá-lo à transportadora de tecido.
Nota: Certifique-se o andaime é totalmente fixo no portador de tecido e não há nenhuma diferença entre a base preta e o anel de tensão branco. Se não, separar o portador de tecido e corrigi o andaime novamente. - Adicione 100 µ l de meio de cultura no cadafalso DPP para reidratação.
Nota: Se o andaime não é fixa bem no portador de tecido, meio de cultura vai se infiltrar o prato de cultura. - Colocar o andaime em uma incubadora de 37 ° C e deixe de molho por 15 min.
3. preparação das células para a construção de folha de célula
Nota: Este protocolo é para cultura de células, usando um prato de 100 mm. Ver figura 1B para um esquema de construção da estrutura de várias camadas de células.
- Isole o BMSCs13.
Nota: Este método destina-se para a construção de uma camada de células MSC em várias camadas. BMSCs rato são utilizados no presente protocolo. Os BMSCs são isolados usando o método aderente toda medula óssea, e os BMSCs são expandidos em vitro para obter suficiente quantidade de célula.- Autoclave os instrumentos a 121 ° C por 30 min, incluindo fórceps fórceps dentado e tesoura. Prepare uma seringa de injeção de 2 mL e meio de cultura BMSC (Dulbecco modificado da águia médio [DMEM], 10% de soro fetal bovino, glutamina 1% e 1% penicilina-estreptomicina).
- Eutanásia em ratos Sprague-Dawley (SD) do macho três semanas pela luxação de vértebra cervical. Mergulhe o animal em 100 mL de solução de álcool 75% num copo por 5 min.
- Tire o copo do animal e colocá-lo inclinado sobre a mesa de operação. Faça uma incisão na pele na parte de trás do animal com tesoura e pinça. Isole os tecidos da pele e músculo para expor os fêmures de coxa.
- Isolar os fêmures de coxa e colocá-lo em 30 mL de PBS em um tubo de centrífuga de 50 mL. Coloque dois fêmures de coxa em um tubo. Tubo de centrífuga para lave o tecido de vórtice. Repita este passo 2x.
- Corte as duas extremidades dos fêmures com uma tesoura e expor a cavidade da medula.
- Aspire 2 mL do meio de cultura BMSC com uma seringa de injeção. Introduza a agulha na cavidade da medula e expulsar da medula óssea com meio de cultura. Expulsar todos os fêmures duas coxas em um prato de cultura de 100 mm.
- Para cada prato de cultura de 100mm, adicione 2 mL de meio de cultura a placa de cultura. Colocar o prato de cultura a incubadora 37 ° C e a cultura estática para 72 h.
- Retire o prato de cultura da incubadora. Substitua o sobrenadante com 6 mL de meio de cultura fresco.
- Observe a BMSCs primárias sob um microscópio. Em seguida, passagem as BMSCs d cada 5-7.
- Leve as células fora da incubadora. Observar as células sob um microscópio e escolha células adequadas para construção de folha de célula. Quando os BMSCs chegarem a confluência de 80-90%, as células podem ser escolhidas como as células semeadas.
- Retire o prato de cultura, o meio de cultura. Lave delicadamente as células com 2 mL de PBS quente. Remova todos os PBS o prato de cultura e fazer restos de certeza não líquidos. Adicionar 2 mL de tripsina 0,25% (ou outra solução dissociating) ao prato e incubar a 37 ° C por 3 min.
- Parar o efeito de tripsina, adicionando 2 mL de meio de cultura e lave delicadamente as células do prato. Transferi a suspensão de células para um novo tubo de centrífuga de 15 mL. Centrifugate as células a 225 x g por 5 min.
- Remova o sobrenadante. Ressuspender as células com 3 mL de solução de sacarose 10% (p/v).
Nota: a solução de sacarose 10% (p/v) é usada para lavar as células a fim de obter uma mistura uniforme de célula-hidrogel nas etapas a seguir. - Aspirar 10 µ l da suspensão celular e contar o número de células com um hemocytometer. Calcule o volume necessário para o próximo passo. Para a folha de uma célula, são utilizados 3 milhões BMSCs.
- Extrato de 3 milhões de células e transferi-los para um novo tubo de centrífuga de 15 mL. Centrifugar as células a 225 x g por 5 min.
- Remova o sobrenadante. Ressuspender as células com 1 mL de solução de sacarose 10% (p/v). Transferi a suspensão de células para um tubo de centrifugação de 1,5 mL.
Nota: Usar um tubo de centrífuga de 1,5 mL é benéfico para preparar a mistura de célula-hidrogel. - Centrifugar as células a 260 xg por 5 min. completamente remover o sobrenadante e obter o sedimento da célula.
4. preparação dos BMSCs e o RAD16-eu peptídeo Hydrogel mistura
Nota: Ver figura 1B para um esquema de construção da estrutura de várias camadas de células.
- Adicione 20 µ l de solução de sacarose 10% (p/v) no tubo de centrífuga de 1,5 mL. Delicadamente Resuspenda os BMSCs e obter uma suspensão uniforme.
Nota: Não geram quaisquer bolhas durante a ressuspensão. - Adicionar 20 µ l de RAD16-eu peptídeo hidrogel na parte superior da suspensão. Misture delicadamente o RAD16-eu suspensão do peptide e celular com a ponta da pipeta. A suspensão de células e hidrogel são misturados, delicadamente Pipete a mistura algumas vezes.
- Pegue o andaime DPP do compartimento de tecido e aspire suavemente o meio de cultura com uma ponta da pipeta.
Nota: Certifique-se que o cadafalso DPP é totalmente reidratado antes de adicionar a mistura de célula-hidrogel. - Aspirar a mistura e adicioná-lo uniformemente para o cadafalso DPP.
Nota: O volume total da mistura seria sobre 40-50 µ l. Recomenda-se adicionar a mistura 10 µ l de cada vez do centro para o exterior do cadafalso. - Adicione 1 mL de meio de cultura para o fundo da transportadora tecido. Colocar a folha de célula na incubadora 37 ° C por 5 min.
- Retire a camada de células da incubadora. Delicadamente, adicione 4 mL de meio de cultura a placa de cultura e mergulhe a camada de células. Colocar a folha de célula na incubadora 37 ° C por 2 h de cultura estática.
5. cultura in Vitro de uma folha de célula de várias camadas 3D usando um sistema dinâmico de cultura
Nota: Consulte a Figura 1 para um diagrama esquemático do sistema dinâmico 3D.
- Prepare o sistema de perfusão dinâmico, incluindo uma bomba peristáltica, equipamento de troca de gás, uma garrafa de vidro de 500 mL, um recipiente de cultura de perfusão e os tubos de conjuntivo. Monte o sistema de perfusão dinâmico, como mostrado na Figura 2.
- Adicione 200 mL de meio de cultura para o frasco de vidro estéril. Inserir a folha de célula dentro da câmara do contêiner de cultura.
Nota: Preste atenção à direção da superfície superior da camada de células. - Adicionar 3 mL de meio de cultura no recipiente de tecido e fechar o recipiente. Colocar o sistema de perfusão dinâmico na incubadora e ligue a bomba. Defina a taxa de fluxo da bomba peristáltica no 8 mL/min. cultura camada de células no sistema dinâmico de perfusão por 48 h.
6. obtenção de camada de células de várias camadas de MSC
- Autoclave a instrumentos e componentes de tecido portador a 121 ° C por 30 min, incluindo tubos de centrífuga de 1,5 mL, pinças e pinças dentadas.
- Retire o duto de entrada da garrafa de vidro para parar o fornecimento do meio de cultura para o recipiente.
Nota: Pare a bomba peristáltica quando o recipiente de cultura está vazio. - Retire a folha de célula do contêiner de cultura e colocá-lo em um prato de cultura.
- Use uma pinça para imobilizar o portador de tecido e outra pinça dentada para separar o anel branco tensão da base preta. Finalmente, obter a camada de células BMSCs em várias camadas.
- Para preservação curta, cada folha de célula pode ser transferida para um tubo de centrífuga de 1,5 mL com a pinça. O andaime do DPP deve ser anexado à parede interna do tubo de centrífuga, e camada de células deve se espalhar para fora tanto quanto possível no tubo de centrífuga.
- Delicadamente, adicione 1 mL do meio de cultura no tubo de centrífuga de imergir a camada de células. Feche a tampa do tubo de centrífuga e armazenar a camada de células, a 4 ° C.
Nota: A camada de células deve ser transplantada ou analisada logo que possível. É recomendável usar a camada de células dentro de 4 h.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
O esquema da construção folha várias camadas de células estaminais é mostrado na Figura 1. Preparar o andaime de folha célula pelo método de decellularization PLA2 é o primeiro passo. Com base no cadafalso, uma estrutura temporária celular 3D é construída misturando as células-tronco com o hidrogel de peptídeo RAD16-1. A fim de obter uma folha de várias camadas de células com bioatividade de células-tronco favorável e ótima resistência mecânica, a camada de células é cultivada em um sistema dinâmico de perfusão. Sob o fornecimento de nutrição dinâmica, as células-tronco são permitidas para proliferar e estabelecer contatos de célula dentro da folha de várias camadas de células, e produto final estável várias camadas celulares folha pode ser obtido após um ~ 24-a 72-cultivo de hora.
Neste caso, o andaime de folha célula DPP é preparado pelo método de decellularization PLA2 . O aparecimento de seca DPP é plana, Lisa e semitransparente (Figura 3A). Devido ao efeito de lyse específico do PLA2, as células heterogêneas podem ser completamente removidas enquanto a ultraestrutura do colágeno natural dentro do andaime DPP está bem preservado (Figura 3B), e isto é importante para manter a resistência mecânica e biocompatibilidade do cadafalso. Além disso, os andaimes podem ser modificados como um sistema de liberação de controle de fator de crescimento para apoiar o crescimento de células-tronco e melhorar na vivo regeneração13.
Quando as células-tronco alcança a confluência de ~ 80% - 90%, as células são isoladas do prato cultura e lavagem com uma solução de sacarose 10%. Após a centrifugação, as células são misturadas com o RAD16-eu peptídeo hidrogel e adicionado para o cadafalso DPP re-hidratado. Uma estrutura temporária de várias camada é formada após uma cultura de estática de duas horas. Finalmente, o produto de folha BMSC várias camado (Figura 4) é adquirido após uma cultura de 48 horas no sistema dinâmico de perfusão. Com o apoio do andaime DPP, camada de células pode ser facilmente manipulada, com fórceps, e que pode ser temporariamente preservado em meio de cultura no tubo de 1,5 mL a 4 ° C por 4 horas antes do exame ou transplante (Figura 4). Como a imunofluorescência mostra resultado de coloração, os BMSCs são altamente positivas para os marcadores de células-tronco CD90 e CD29. Após a construção de folha de célula, os BMSCs dentro de várias camadas de células folha mostrar altos níveis de CD29 e CD90 (Figura 5).

Figura 1 : O fluxograma de construção folha de várias camadas de células tronco. (A) usando o método de2 decellularized PLA, as células heterogêneas dentro o FPP são destruídas, enquanto as matrizes extracelulares naturais são bem preservadas no cadafalso DPP. (B) com base no cadafalso DPP, a estrutura de pilha multicamada temporária é construída misturando as células-tronco e auto montagem hidrogel de peptídeo. (C) a seguir, a camada de células é cultivada em um sistema dinâmico 3D, e as células-tronco são esperadas para proliferar e estabelecer contatos de célula sob o fornecimento de nutrição dinâmica. Clique aqui para ver uma versão maior desta figura.

Figura 2 : O portador de tecido e o sistema dinâmico de perfusão. Portador de tecido (A), este painel mostra a 13 mm de diâmetro. (B), este painel mostra a montagem do sistema dinâmico de perfusão. Clique aqui para ver uma versão maior desta figura.
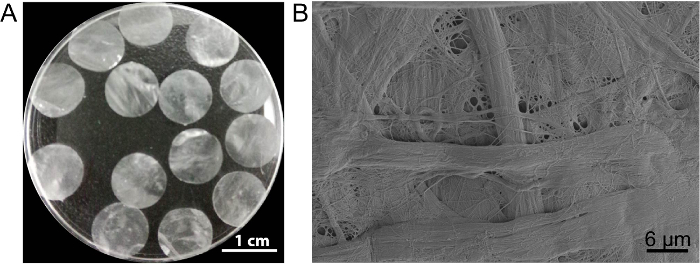
Figura 3 : A aparência e a ultraestrutura do DPP. (A), este painel mostra a aparência dos andaimes DPP 10,5 mm de diâmetro. (B), este painel mostra uma imagem representativa do microscópio eletrônico de varredura (MEV) resultado de andaime do DPP. Clique aqui para ver uma versão maior desta figura.
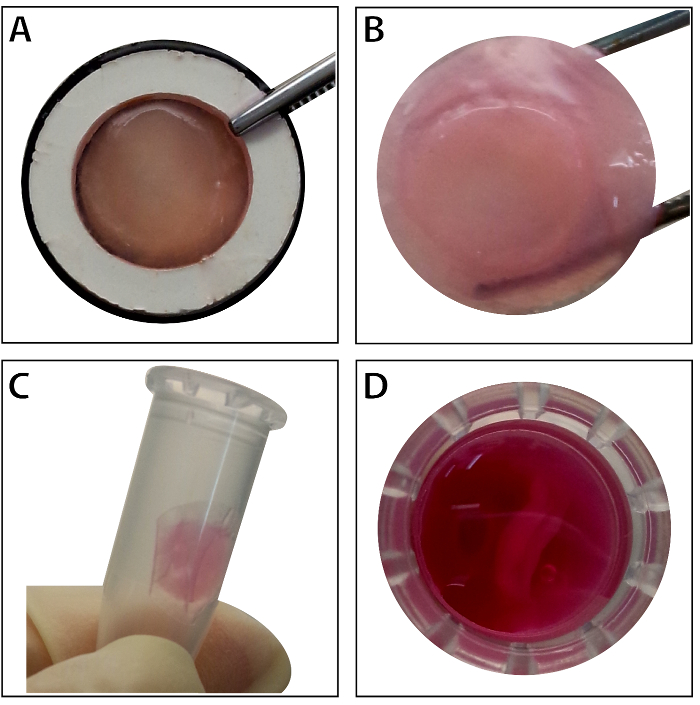
Figura 4 : A aparência da folha de várias camada BMSC. (A), este painel mostra a aparência da BMSC várias camada de folha dentro da transportadora de tecido. (B) a folha BMSC várias camada intacta é realizada pelo fórceps. (C - D) Folha de várias camadas de células pode ser preservada temporariamente no tubo de 1,5 mL antes do uso. Clique aqui para ver uma versão maior desta figura.
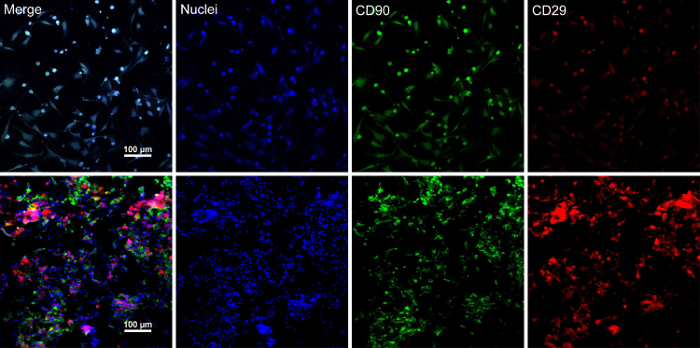
Figura 5 : Mancha resultados da expressão de marcadores BMSC. (A), este painel mostra imunofluorescência coloração resultados de BMSCs antes da construção de folha de célula. (B), este painel mostra mancha resultados da seção de folha BMSC várias camada. CD90 (verde) e CD29 (vermelho) manifestaram-se positivamente nas BMSCs e a camada de células. Clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
O presente protocolo relata um método eficiente para a construção de uma folha MSC em várias camadas. Esta folha de célula apresenta ótima resistência mecânica e densidade de semeadura de pilha alta Bioatividade favorável células-tronco. Usando BMSCs como exemplo, a estrutura celular 3D rapidamente é construída com RAD16-eu hidrogel de peptídeo. Depois a ser cultivada no sistema de perfusão dinâmico, folha de várias camada BMSC é obtida com êxito e os BMSCs mantêm uma alta expressão de marcadores de células estaminais.
Construir a estrutura de pilha multicamada temporária é a etapa crítica do protocolo. O RAD16-I é um peptídeo de hidrogel comercial, e consiste de 1% de ácido aminado e 99% de água. Vários estudos relataram que este peptídeo hidrogel pode imitar o ambiente natural do ECM e é benéfico para a célula-tronco proliferação e sobrevivência15,16,17. No presente protocolo, uma suspensão MSC 3 milhões (em 20 µ l de solução de sacarose 10%) foi misturado com 20 µ l de RAD16-eu hidrogel de peptídeo. A relação do volume da suspensão celular e o peptídeo hidrogel foi de 1:1. Este peptídeo hidrogel é sensível ao valor de pH ambiental, e as moléculas do peptide automaticamente formaria a rede 3D quando o valor do pH de ácido para neutro. Porque a superfície da célula contém partículas carregadas, a mistura de célula alterada de líquido para hidrogel em um curto período de tempo, que tem influências a mistura até mesmo das células. Um célula-hidrogel favorável deve ser uma mistura até mesmo da suspensão celular e o peptídeo hidrogel e permite a mistura de célula a ser adicionado uniformemente sobre o andaime. Os pesquisadores podem otimizar a condição de mistura, alterando o número de células semeado, volume de solução de sacarose e o volume de hidrogel de peptídeo de acordo com sua necessidade real. Vale a pena notar que a lavagem das células com solução de sacarose 10% e mistura uniformemente a mistura de célula-hidrogel são os passos críticos do protocolo, e uma mistura irregular pode causar perda de célula grande e uma instável estrutura temporária de várias camada.
Depois de adicionar a mistura de célula-hidrogel sobre o andaime DPP, a resistência mecânica da estrutura celular várias camadas de folha é fraca porque a rede de hidrogel de peptídeo não é forte o suficiente para manter a estrutura de várias camadas de células a longo prazo e celular conexões e ECM secreções são necessárias para melhorar a estabilidade da camada de células. Além disso, a infiltração dinâmica do meio de cultura pode facilitar as células-tronco para proliferar e estabelecer contatos de célula dentro da estrutura de várias camadas de células, enquanto uma fonte de nutrição insuficiente irá causar apoptose celular e reduzir a densidade celular da célula folha13. Portanto, o sistema dinâmico de perfusão é importante para estabilizar a estrutura da folha em várias camadas de células. Além disso, a taxa de fluxo apropriado do meio de cultura deve ser ajustada de acordo com o tipo específico de células estaminais e densidade de semeadura de célula. Além disso, o fraco conexão mecânica entre o andaime DPP e a estrutura de várias camadas de células permanece a limitação do método de construção de presente, que pode causar a divisão das camadas de várias camadas de células e o andaime. Portanto, mais estudos são necessários para melhorar a mecânica biocompatibilidade de hidrogel 3D andaime e o andaime DPP.
Até agora, os cientistas engenharia de tecido tem focalizado no estabelecimento de nutrição eficiente fornecimento sistemas em vitro, tais como coculturing endoteliais células18 e usando um andaime porosa19. No entanto, a permeabilidade de nutrição dentro da estrutura 3D é baixa no sistema tradicional cultura 3D estática, e a viabilidade de células-tronco será grandemente afetada. Neste caso, usar o sistema de perfusão dinâmico pode fornecer suficiente fonte de nutrição para manter a viabilidade de células-tronco. Usando este protocolo, uma folha BMSC várias camada melhorou a função cardíaca e angiogênese em um rato do miocárdio modelo13. Construção de um produto de folha de células-tronco com uma célula de alta carga e propriedade de célula-tronco favorável é significativo para a regeneração de tecidos. Usando este método eficiente construído, diferentes tipos de folhas de várias camadas de células estaminais poderiam ser construídos, alterando os tipos de células-tronco semeado, como folha de células-tronco epiteliais, células-tronco neurais folha ou folha de células-tronco cardíacas. Outras explorações de e alternativas para a folha de várias camadas de células estaminais são esperadas para expandir as aplicações para regeneração de tecido mais.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Este trabalho foi apoiado pela Fundação Nacional de ciências naturais da China (número de concessão 31771064); a ciência e a tecnologia planejamento projeto da província de Guangdong (concessão números 2013B010404030, 2014A010105029 e 2016A020214012); a ciência e a tecnologia planejamento projeto de Guangzhou (número de concessão 201607010063); e a inovação de graduação e programa de formação de empreendedorismo (número de concessão 201610559028); a National Science Foundation para jovens cientistas da China (conceder número 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



