Summary
Эта статья предоставляет метод эффективно и целесообразно для построения листы многослойного стволовых клеток с свойства благоприятные стволовых клеток.
Abstract
Терапия стволовой клетки показывает многообещающее будущее в регенерации потерпевшего органов и тканей и клеток листа техника была разработана для улучшения удержания низкой клеток и бедными выживания в целевой зоне. Однако во время процесса строительства в vitro срочно необходима решение для сохранения стволовых клеток биологическую и увеличивая объем ячейки в ячейку листа. Здесь этот протокол представляет метод для построения клеток многослойного листа с благоприятным стволовых клеток биологическую и оптимальной работоспособности. Decellularized свинину перикарда (DPP) подготовлен фосфолипазы decellularization метод2 (2пла) как на эшафот ячейки листа, и изолированы и расширена в сеяный клетки костного мозга крысы мезенхимальных стволовых клеток (BMSCs). Временные многослойных клеточной структуры листа строится с помощью RAD16-я пептид гидрогеля. Наконец лист клетки культивировали с системой динамического перфузии стабилизировать структуру трехмерного (3D), и ячейку листа могут быть получены после 48-часовой культуры в пробирке. Этот протокол предоставляет метод эффективно и целесообразно для создания многослойных стволовых клеток лист и ячейку листа могут быть разработаны как продукт терапии благоприятные стволовых клеток в будущем.
Introduction
Терапия стволовой клетки было сообщено как эффективным средством лечения многих заболеваний; Однако низкий ячейки хранения и бедными выживания в целевой зоне остаются критические вопросы, после инъекции традиционные стволовых клеток. Для решения этой проблемы, ткани инженерных ученые разработали технику ячейки листа. Однослойное ячейки листа с нетронутыми внеклеточная матрица сначала был подготовлен с помощью температуры ответ культуры блюдо1, и его последующие исследования сообщили значительные улучшения сохранения стволовых клеток и выживания в infarcted Площадь2,3. Среди методов создания многослойных ячейки листа было сообщено как эффективную стратегию для улучшения выживание клетки и клетки листа терапевтический эффект3,4. С тех пор ученые работали на разработке методов строительства различных клеток листа для того, чтобы увеличить количество клеток, свойства стволовых клеток и механические свойства ячеек листов. До настоящего времени определенные типы клеток листа были построены и учился в лечении инфаркта миокарда5, хряща травмы6, и кожи раны7.
Биологическую стволовых клеток до пересадки показал возникающих влияние на регенерацию тканей потерпевшего, и стратегии строительства различных клеток листа имеют различные эффекты на стволовые клетки. С одной стороны вырожденная ячеек листов только состояла из высокой плотности стволовых клеток, и естественных внеклеточной матрицы могут быть приобретены укладки листов однослойное клетки8 или с помощью магнитных ткани, инженерной техники9. С другой стороны исследователи разработали различные леса для обеспечения адекватного механическую прочность и поддержки клеток роста10,11,12, что позволило низкий стволовых клеток, заполнение плотности для обеспечения питания питания. Однако несмотря на эти подходы, поставки низкой эффективности питания в структуре многослойных ячейки листа остается серьезной проблемой во время строительства в пробирке . Таким образом эффективно и целесообразно ячейки листа строительство системы срочно требуется.
Этот протокол описывает шаги по подготовке multilayeredmesenchymal стволовых клеток (МСК) ячейку листа. В этой конструкции системы клетки листа механическую прочность обеспечивается DPP. Основываясь на этом леску, 3D клеточной структуры может быть быстро построен с RAD16-я пептид гидрогеля и динамический перфузия системы используется для культуры многослойных ячейки листа, чтобы стабилизировать 3D клеточную структуру листа и обеспечить достаточное питание поставка для клеток. С помощью этой системы, многослойных BMSC лист был успешно подготовлен и выставлены оптимального терапевтического эффекта на инфаркт миокарда крыс модель13.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Все стволовых клеток и животных эксперимент процедуры были проведены согласно этические принципы национального руководства для ухода и использования лабораторных животных и одобрен Цзинань университета животное уход и использование Комитетом (Гуанчжоу, Китай).
1. Подготовка DPP леску с PLA2 Decellularization метод14
Примечание: Смотрите Рисунок 1A схема метода decellularization2 PLA.
- Подготовка 100 мл раствора2 200 ед/мл PLA. Добавьте 0,5 g Дезоксихолат натрия и 2 мл2 пла в 198 мл буферного раствора карбоната. Это решение следует использовать в течение 24 часов после его подготовки.
- Получить свежие свиные перикарда (FPP) от бойни и вернуться в лабораторию в течение 1 ч.
Примечание: FPP должны храниться при температуре 4 ° C во время транспортировки. 1.2-1.10 шаги должны проводиться с непрерывной тряски в контролируемой термостат водяной бане. - Тщательно промойте FPP с 200 мл фосфатного буферного раствора (PBS) содержащие пенициллин стрептомицина 1% в 500 мл стакан на 10 ° КСОР 10 мин повторить этот шаг 2 x.
- Разделите FPP на два слоя и удаление жировой ткани с щипцами и ножницы.
Примечание: Держите мокрый, добавляя 50 мл PBS FPP каждые 20 минут во время удаления жировой ткани. - Форма FPP в 10 x 10 см2 шт с ножницами. Вымойте FPP с 200 мл буферного раствора карбоната (CBS), содержащие пенициллин стрептомицина 1% в 500 мл стакан на 10 ° C, за 10 мин повторить этот шаг 2 x.
- Передача FPP к чистой воде и замочить на 10° C в течение 12 ч.
- Замочите 10 x 10 см2 образцы в 50 мл CBS, содержащие 200 ед/мл PLA2 и раствор Дезоксихолат натрия 0,5% (w/v) при 37 ° C в течение 6 ч.
- Стирать образцы с CBS, содержащих пенициллин стрептомицина 1% при 10 ° C на 10 мин повторить этот шаг 2 x.
- Замочите каждого образца в 50 мл CBS, содержащие 200 ед/мл PLA2 и раствор Дезоксихолат натрия 0,5% (w/v) при 37 ° C на 2 ч.
- Стирать образцы с CBS, содержащих пенициллин стрептомицина 1% при 10 ° C на 2 ч. Повторите этот шаг для 10 x по крайней мере. Поместите образцы на плоских пластин и высушите их до постоянной массы в постоянной температуры печи при температуре 55 ° C.
Примечание: Образец должен быть полностью высох. Взвесить образец DPP каждые 10 минут и повторить 3 x или до веса больше не изменяется. - Форма каждого образца DPP в круг 10,5 мм в диаметре с трепанации. Пакет каждого DPP в стерильных запечатанный пакет.
- Стерилизация DPP образцы гамма облучение (25 КГР). Хранятся пробы DPP на 4 ° C перед использованием.
Примечание: Все образцы могут быть сохранены на срок до шести месяцев при 4 ° C.
2. Подготовка к ячейке листа строительство
- Автоклав все инструменты и компоненты тканей перевозчиком при температуре 121 ° C за 30 мин, в том числе 1,5 мл трубки и центробежных, щипцы, зубчатый щипцы, ножницы, черный баз (тканей перевозчиком компонент) и белый натяжение кольца (тканей перевозчиком компонент).
- Подготовка 20 мл раствора стерильных 10% сахарозы. Вес 2 г сахарозы и распустить сахарозы в 18 мл ультрачистая вода. 10%-ая сахароза раствор при температуре 121 ° C за 30 мин или фильтр решение с 0,22 мкм фильтром автоклав.
- Автоклав динамический перфузия системные устройства при температуре 121 ° C за 30 минут, включая газовый обмен оборудования, стеклянная бутылка 500 мл, контейнер культуры перфузии и соединительной трубки.
- Подготовьте газобетона инструментов и тканей перевозчиком компоненты. Положите черный базовой частью ткани перевозчика в культуры блюдо.
- Возьмите сушеные DPP леску и положил его в центре черный базы. Положить белый зажимное кольцо на эшафот DPP и исправить ее в держатель ткани.
Примечание: Обеспечить эшафот полностью исправлена в ткани перевозчика и существует разрыв между базе черный и белый зажимное кольцо. Если нет, отдельные ткани перевозчика и исправить эшафот снова. - Добавьте 100 мкл питательной среды на эшафот DPP для регидратации.
Примечание: Если леска не зафиксировано также в ткани перевозчика, питательной среды проникновения культуры блюдо. - Положите леску в инкубатор 37 ° C и позволить ему впитаться в течение 15 мин.
3. Подготовка клетки клетки листа строительства
Примечание: Этот протокол предназначен для культуры клеток с помощью блюдо 100 мм. Смотрите Рисунок 1B схема строительства многослойных клеточной структуры.
- Изолируйте BMSCs13.
Примечание: Этот метод предназначен для создания многослойных MSC ячейки листа. Крыса BMSCs используются в настоящем Протоколе. BMSCs изолированы с помощью метода сторонником всего костного мозга, и BMSCs расширенной в vitro получить достаточное количество клеток.- Автоклав для документов при температуре 121 ° C 30 мин, в том числе щипцы, зубчатый щипцы, ножницы и. Подготовьте шприц 2 мл инъекций и BMSC культуры среднего (Дульбекко изменение средних [DMEM] орла, плода бычьим сывороточным 10%, 1% глютамина и 1% пенициллин стрептомицином).
- Усыпить три недельных самцов крыс Sprague-Dawley (SD), вывих шейного позвонка. Замочите животного в 100 мл 75% спиртового раствора в стакан за 5 мин.
- Принять животное из стакан и поместите его подверженных на операционном столе. Надрезать кожу на спине животного с ножницами и пинцет. Изолируйте кожи и мышечной тканях подвергать бедра бедра.
- Изолировать бедра бедра и положил его в 30 мл в пластиковых пробирок 50 мл ФСБ. Место два бедра бедра в одну трубу. Вихрь пластиковых пробирок тщательно мыть ткани. Повторите этот шаг 2 x.
- Вырезать обоих концах бедра с ножницами и разоблачить полости костного мозга.
- Аспирационная 2 мл BMSC питательной среды инъекции шприцом. Вставить иглу в полости костного мозга и промыть костного мозга с питательной среды. Промойте каждые два бедра бедра в одной культуры блюдо 100 мм.
- Для каждого 100 мм культуры блюдо добавьте 2 мл питательной среды в культуре блюдо. Положите культуры блюдо в инкубатора 37 ° C и статические культуры за 72 ч.
- Примите вне культуры блюдо из инкубатора. Замените супернатант 6 мл свежей питательной среды.
- Наблюдать за первичной BMSCs под микроскопом. После этого проход BMSCs каждые 5-7 d.
- Возьмите клетки из инкубатора. Соблюдать клетки под микроскопом и выбрать подходящие клетки для строительства ячейки листа. Когда BMSCs достигают 80% - 90% слияния, клетки могут быть выбраны в сеяный клетки.
- Удалите средство культуры из культуры блюдо. Осторожно промойте клетки с 2 мл теплой PBS. Удалите все PBS из культуры блюдо и сделать конечно не жидкие остатки. Добавить 2 мл 0,25% трипсина (или другой разъединять раствора) в блюдо и инкубировать при 37 ° C на 3 мин.
- Остановить действие трипсина, добавив 2 мл питательной среды и осторожно промыть клетки от блюдо. Перенесите суспензию клеток в новых пластиковых пробирок 15мл. Центрифугировать клетки на 225 x g за 5 мин.
- Удалите супернатант. Ресуспензируйте клетки с 3 мл раствора сахарозы 10% (w/v).
Примечание: 10% (w/v) раствор сахарозы используется для стирки клетки для получения единой клетки гидрогеля смесь в следующих шагах. - Аспирационная 10 мкл суспензии клеток и подсчитать ячейки с Горяева. Вычислите объем, необходимые для следующего шага. Для одной ячейки листа используются три миллиона BMSCs.
- Извлеките три миллиона клеток и перенести их в новых пластиковых пробирок 15мл. Центрифуга клетки на 225 x g за 5 мин.
- Удалите супернатант. Ресуспензируйте клетки с 1 мл раствора сахарозы 10% (w/v). Передача в пластиковых пробирок 1.5 мл суспензии клеток.
Примечание: С помощью центробежных трубки 1,5 мл выгодно для приготовления смеси клетки гидрогеля. - Центрифуга клетки на 260 xg 5 мин полностью удалить супернатант и получить клетки отложений.
4. Подготовка BMSCs и RAD16-я пептид гидрогеля смесь
Примечание: Смотрите Рисунок 1B схема строительства многослойных клеточной структуры.
- Добавьте 20 мкл раствора сахарозы 10% (w/v) центробежные 1,5 мл. Нежно ресуспензируйте BMSCs и получить равномерное подвеска.
Примечание: Не создавать любое пузырей во время ресуспендирования. - 20 мкл RAD16-я пептид Гидрогель в верхней части подвески. Аккуратно перемешать RAD16-я пептида и клеток подвеска с кончиком пипетки. Когда смешиваются суспензию клеток и гидрогелевые, нежно Пипетка смесь пару раз.
- Взять DPP леску от перевозчика ткани и мягко аспирационная питательной среды с кончиком пипетки.
Примечание: Убедитесь, что DPP эшафот полностью Регидратированные перед добавлением смесь клеток гидрогеля. - Аспирационная смеси и равномерно добавить его в DPP эшафот.
Примечание: Общий объем смеси будет около 40-50 мкл. Рекомендуется добавить смесь 10 мкл в то время из центра за пределами леса. - Добавьте 1 мл питательной среды в нижней части ткани перевозчика. Положите лист ячеек в инкубаторе 37 ° C за 5 мин.
- Примите вне ячейки листа из инкубатора. Аккуратно добавить 4 мл питательной среды в культуре блюдо и погружать ячейки листа. Положите лист ячеек в инкубаторе 37 ° C на 2 ч статической культуры.
5. в Vitro культуры 3D многослойных ячейки листа с помощью системы динамичной культуры
Примечание: Смотрите Рисунок 1 c схема 3D динамической системы.
- Подготовка динамического перфузии системы, включая Перистальтический насос, газовое оборудование обмена, стеклянная бутылка 500 мл, контейнер культуры перфузии и соединительной трубки. Соберите систему динамический перфузия, как показано на рисунке 2.
- Добавьте 200 мл питательной среды в стерильной стеклянной бутылке. Вставьте ячейки листа в зале культуры контейнера.
Примечание: Обратите внимание на направлении верхней поверхности ячейки листа. - Добавить 3 мл питательной среды в контейнере ткани и закрыть контейнер. Системы динамического перфузии в инкубаторе и запуска насоса. Задайте скорость потока перистальтического насоса на 8 мл/мин культуры клеток листа в системе динамический перфузия за 48 ч.
6. получение многослойных MSC ячейки листа
- Автоклав инструменты и компоненты тканей перевозчика при 121 ° C за 30 минут, включая центробежные 1.5 мл пробирок, щипцы и зубчатый щипцами.
- Вытащите входной канал от стеклянной бутылки прекратить поставки питательной среды для контейнера.
Примечание: Остановка Перистальтический насос, когда культура контейнер пуст. - Взять из ячейки листа из контейнера культуры и положил его в культуры блюдо.
- Используйте один щипцы для иммобилизации перевозчик ткани и использовать другой зубчатый щипцы для разделения белый зажимное кольцо из черного базы. Наконец получения многослойных BMSCs ячейку листа.
- Для коротких сохранения каждая ячейка листа могут быть переданы 1,5 мл центробежные с щипцами. DPP эшафот должен прилагаться к внутренней стенке центробежные трубки, и ячейку листа должны распространяться как можно в пластиковых пробирок.
- Аккуратно добавьте 1 мл питательной среды в центробежных трубки погрузиться ячейки листа. Закройте крышку центробежные трубки и хранить клетки листа при 4 ° C.
Примечание: Ячейки листа следует пересадить или проанализированы как можно скорее. Рекомендуется использовать ячейки листа в течение 4 ч.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Схема строительства лист многослойных стволовых клеток показана на рисунке 1. Первым шагом является подготовка на эшафот ячейки листа методом decellularization2 пла. Основываясь на эшафот, временного 3D клеточной структуры строится путем смешивания стволовых клеток с RAD16-1 пептида гидрогеля. С целью получения многослойных ячейки листа с благоприятным стволовых клеток биологическую и оптимальная механическая прочность, ячейку листа культивировали в систему динамической перфузии. При динамических питания поставок, стволовые клетки разрешены размножаться и установить контакты клеток в многослойных ячейки листа, и заключительный стабильный многослойных ячейки листа продукта могут быть получены после ~ 24-72-стойка культивирования.
В этом случае ячейки листа эшафот DPP готовится методом decellularization2 PLA. Появление сушеные DPP является плоской, гладкая и полупрозрачные (рис. 3A). Благодаря эффекту конкретных lyse PLA2, гетерогенных клетки могут быть полностью удалены в то время как Ультраструктура природного коллагена в DPP эшафот сохранившаяся (рис. 3B), и это важное значение для поддержания Механическая прочность и биосовместимость эшафот. Кроме того леса могут быть изменены как фактор роста выпуска система управления для поддержки роста стволовых клеток и улучшения в vivo регенерации13.
Когда стволовых клеток достигают слияния ~ 80% - 90%, клетки изолированы от культуры блюдо и промывают раствором сахарозы 10%. После центрифугирования, клетки смешивают с RAD16-я пептид гидрогеля и добавляется Регидратированные DPP эшафот. Временная многослойная структура формируется после двухчасовой статической культуры. Наконец многослойный продукт BMSC листа (рис. 4) приобретается после 48-часовой культуры в системе динамический перфузия. При поддержке DPP эшафот ячейку листа можно легко манипулировать с щипцами, и она может быть временно сохранена в среде культуры в 1,5 мл на 4 ° C за 4 часа до обследования или трансплантации (рис. 4). Как иммунофлюоресценции, окрашивание результат показывает BMSCs являются весьма позитивными для маркеры стволовых клеток CD90 и CD29. После строительства ячейки листа, BMSCs в многослойных ячейки листа показать высокий уровень CD29 и CD90 (рис. 5).

Рисунок 1 : Блок-схема построения многослойных стволовых клеток листа. (A) с помощью метода2 decellularized PLA, гетерогенных клетки в ГЛС разрушаются в то время как естественный внеклеточной матрицы сохранившаяся в DPP эшафот. (B), основанный на эшафот DPP, временные многослойных клеточной структуры построен путем смешивания стволовые клетки и самостоятельной сборке пептид гидрогеля. (C), чтобы следовать, лист клетки культивировали в 3D динамической системы, и ожидается, что стволовые клетки размножаются и установить контакты клеток под поставку динамических питания. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Ткани перевозчика и системе динамический перфузия. (A) Эта группа показывает 13 мм диаметр ткани перевозчика. (B) Эта группа показывает Ассамблея динамический перфузия системы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
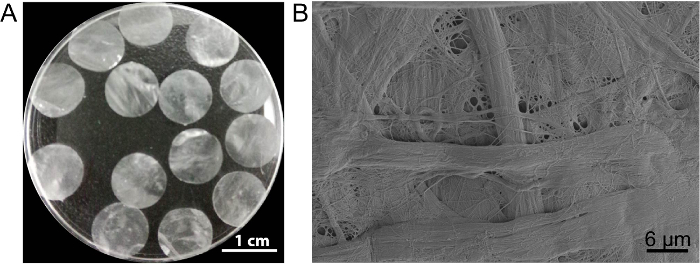
Рисунок 3 : Внешний вид и ультраструктура DPP. (A) Эта группа показывает внешний вид 10,5 мм диаметр DPP подмостей. (B) Эта группа показывает образ представителя сканирующего электронного микроскопа (SEM) результат DPP эшафот. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
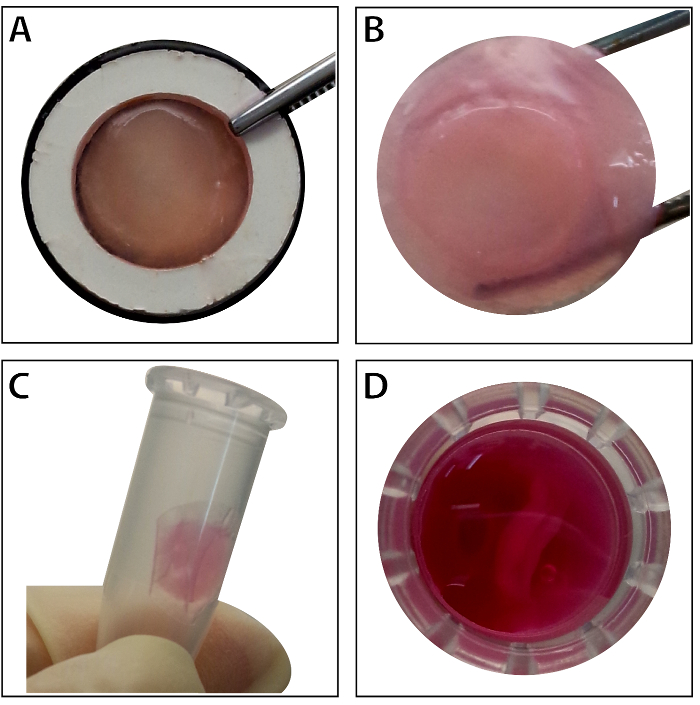
Рисунок 4 : Появление многослойных листов BMSC. (A) Эта группа показывает внешний вид многослойного BMSC листа в пределах перевозчику Салфетницы. (B) нетронутыми многослойных BMSC лист проводится щипцами. (C - D) Многослойный ячейки листа могут быть временно сохранены в 1,5 мл перед использованием. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
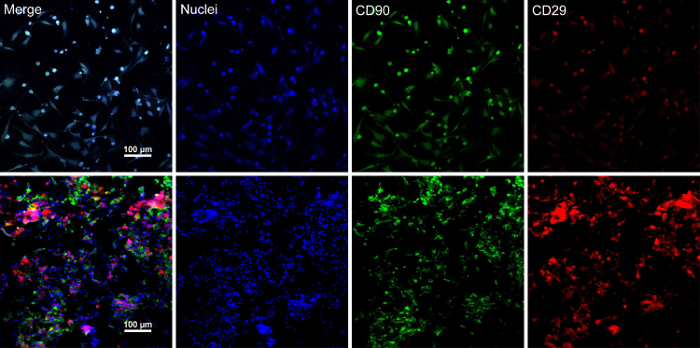
Рисунок 5 : Иммунофлюоресценции, пятнать результаты выражения маркеров BMSC. (A) Эта группа показывает иммунофлюоресценции пятнать результаты BMSCs до строительства ячейки листа. (B) Эта группа показывает иммунофлюоресценции, пятнать результаты многослойных BMSC лист секции. В BMSCs и ячейки листа позитивно высказывались CD90 (зеленый) и CD29 (красный). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Настоящий Протокол сообщает эффективный метод для построения многослойных листов MSC. Эта ячейка листа экспонатов оптимальная механическая прочность, плотность посева высокой клеток и отпорности благоприятные стволовых клеток. Использование BMSCs в качестве примера, 3D клеточной структуры быстро построен с RAD16-я пептид гидрогеля. После быть культивировали в системе динамический перфузия, многослойных BMSC листа успешно получены и BMSCs поддерживать высокое выражение маркеры стволовых клеток.
Строительство временного многослойных клеточной структуры является важным шагом протокола. RAD16-я коммерческих гидрогеля пептид, и он состоит из 1% аминокислот и 99% воды. Несколько исследований сообщили, что этот пептид гидрогеля могут имитировать природной среды ECM и выгодно для стволовых клеток распространения и выживания15,16,17. В настоящем Протоколе, три миллиона КБМ подвеска (в 20 мкл раствора 10% сахарозы) была смешана с 20 мкл RAD16-я пептид гидрогеля. Соотношение объема суспензию клеток и пептид гидрогеля был 1:1. Этот пептид гидрогеля чувствителен к окружающей среды рН, и пептидных молекул будет автоматически формировать 3D сети при изменении значения рН от кислоты в нейтральное положение. Потому что поверхности клеток содержит заряженные частицы, смесь ячейки изменено с жидкость Гидрогель в короткое время, которое влияет даже смешивание клеток. Выгодные клетки гидрогеля должно быть даже смесь суспензии клеток и пептида гидрогеля и позволяет ячейки смесь равномерно добавляться на эшафот. Исследователи могут оптимизировать состояние смеси, изменяя число клеток в сеяный, сахароза решение тома и тома гидрогеля пептид согласно их фактической потребности. Стоит заметить, что мытье клетки с 10% раствором сахарозы и равномерно перемешивания смесь клеток гидрогеля критические шаги протокола, и неравномерным смесь может привести к большой ячейка потерь и нестабильной временные многослойной структуры.
После добавления смесь клеток гидрогеля на эшафот DPP, механической прочности многослойных клеточной структуры листа слаб, потому что сеть пептид гидрогеля не достаточно сильны, чтобы поддерживать долгосрочный многослойных клеточной структуры и клетки соединения и ECM выделениями необходимы для повышения стабильности ячейки листа. Кроме того динамические проникновение питательной среды может облегчить стволовые клетки размножаются и установить контакты клеток в многослойных клеточной структуры, в то время как поставки недостаточного питания будет вызывать апоптоз клеток и уменьшить плотность клеток ячейка листа13. Таким образом динамический перфузия система имеет важное значение для стабилизации многослойных клеточной структуры листа. Кроме того соответствующие расхода питательной среды должны корректироваться согласно типа конкретных стволовых клеток и клеток, плотность посева. Кроме того слабый механического соединения между DPP леску и многослойных клеточной структуры остается ограничение нынешнего метода строительства, который может привести к Отделу слои многослойных клеток и леска. Таким образом необходимы дальнейшие исследования для повышения механической биосовместимость эшафот 3D гидрогеля и DPP эшафот.
До настоящего времени ткани инженерных ученые сосредоточили на установление эффективного питания поставки систем в пробирке, такие, как coculturing эндотелиальных клеток18 и с помощью пористых эшафот19. Однако проницаемость питания в пределах структуры 3D низка в системе традиционные статические 3D культуры, и жизнеспособность стволовых клеток будет значительно пострадавших. В этом случае используя динамический перфузия системы может обеспечить достаточно поставки питания для поддержания жизнеспособности стволовых клеток. Используя этот протокол, многослойных листов BMSC улучшены функции сердца и ангиогенеза в инфаркт миокарда крыс модель13. Построение продукта лист стволовых клеток с высоким ячейки нагрузки и благоприятные стволовых клеток свойство имеет важное значение для регенерации тканей. Используя этот эффективный сконструированный метод, различные виды листы многослойного стволовых клеток может быть построена путем изменения в сеяный стволовых клеток типы, такие как эпителиального стволовых клеток листа, нервных стволовых клеток лист или лист сердца стволовой клетки. Ожидается, что дальнейшие исследования и альтернативы для многослойных стволовых клеток листа расширить применение для более регенерации тканей.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не имеют ничего сообщать.
Acknowledgments
Эта работа была поддержана Фонд национального естественных наук Китая (Грант номер 31771064); Наука и технологии планирования проекта провинции Гуандун (Грант номера 2013B010404030, 2014A010105029 и 2016A020214012); Наука и технологии планирования проекта Гуанчжоу (Грант номер 201607010063); и студентов инноваций и предпринимательства программа обучения (Грант номер 201610559028); Национальный научный фонд для молодых ученых Китая (предоставить номер 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



