Summary
Denna artikel ger en effektiv och genomförbar metod för att konstruera multilayered stamceller ark med gynnsamma stamceller boende.
Abstract
Stamcellsterapi visar en lovande framtid i regenererande skadade organ och vävnader, och cellen ark tekniken har utvecklats för att förbättra lågt retention och dålig överlevnad inom träningszonen. Dock under in vitro- byggprocessen behövs en lösning för att upprätthålla stamceller bioaktivitet och ökar cell inom cellagret snarast. Här, presenterar detta protokoll en metod för att konstruera ett multilayered cellagret med gynnsamma stamceller bioaktivitet och optimal funktion. Cell-lösa svin hjärtsäck (DPP) är utarbetad av fosfolipas en2 (PLA2) decellularization metod som cellen ark schavotten, och råtta benmärgen mesenkymala stamceller (BMSCs) är isolerade och expanderade som seedade cellerna. Tillfälliga multilayered ark cellstrukturen konstrueras genom att använda RAD16-jag peptid hydrogel. Slutligen, cellagret är odlade med en dynamisk perfusion-system för att stabilisera den tredimensionella (3D) strukturen och cellagret kunde erhållas efter en 48-timmars kultur i vitro. Detta protokoll ger en effektiv och genomförbar metod för att konstruera ett multilayered stamceller blad och cellagret skulle kunna utvecklas som en gynnsam stamceller behandling produkt i framtiden.
Introduction
Stamcellsterapi har rapporterats som en effektiv behandling för många sjukdomar. dock fortfarande låg cell lagring och dålig överlevnad inom träningszonen kritiska problem efter traditionella stamceller injektion. För att lösa problemet, utvecklat tissue engineering forskare cell ark tekniken. En monolayered cellagret med intakt extracellulärmatrix förbereddes för det första genom att använda temperatur-svar kultur maträtt1, och dess uppföljande studier rapporterade betydande förbättringar av stamceller retention och överlevnad inom den infarcted område2,3. Bland metoderna, har konstruera multilayered cellagret rapporterats som en effektiv strategi för att förbättra cellöverlevnad och den cell blad terapeutiska effekt3,4. Sedan dess har forskare arbetat på utveckla annan cell ark byggmetoder för att öka den cell belopp, stamceller egendom och mekaniska egenskaper av cell täcker. Hittills har vissa typer av cellagret har konstruerats och studerade vid behandling av hjärtinfarkt5, brosk skada6, och hud sår7.
Bioaktiviteten av stamceller före transplantation visade en framväxande påverkan på skadade vävnadsregenerering och annan cell blad konstruktion strategier har olika effekter på stamcellerna. Å ena sidan, konfluenta cell ark endast bestod av högdensitets stamceller och naturliga extracellulära matriser kan förvärvas genom att stapla monolayered cell ark8 eller med hjälp av magnetiska tissue engineering tekniker9. Å andra utvecklat forskare olika ställningar för att ge tillräcklig mekanisk styrka och stöd cell tillväxt10,11,12, som får en låg stamcell sådd densitet för att säkerställa näringen leverans. Trots dessa synsätt dock låg effektiv näring leverans inom multilayered ark cellstrukturen en stor oro under in vitro- byggandet. En effektiv och genomförbar cell ark byggsystem är därför angeläget.
Det här protokollet beskriver stegen för att förbereda en multilayeredmesenchymal stamceller (MSC) cellagret. I detta byggsystem tillhandahålls cell ark mekaniska styrka av en DPP. Baserat på denna byggnadsställning, 3D cellens struktur kan snabbt byggas med RAD16-jag peptid hydrogel och en dynamisk perfusion systemet används till kultur multilayered cellagret, för att stabilisera 3D ark cellstruktur och ge tillräcklig näring utbudet för cellerna. Med detta system, ett multilayered BMSC ark var förberetts och ställde ut en optimal terapeutisk effekt på råtta hjärtinfarkt modell13.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alla stamceller och djurförsök förfaranden utfördes enligt de etiska riktlinjerna av den nationella Guide för skötsel och användning av laboratoriedjur och godkänts av Jinan University djur vård och användning kommittén (Guangzhou, Kina).
1. beredning av DPP ställningen med de PLA2 Decellularization metod14
Obs: Se figur 1A för en schematisk av metoden PLA2 decellularization.
- Förbereda 100 mL 200 U/mL PLA2 lösning. Tillsätt 0,5 g natriumdeoxikolat och 2 mL av PLA2 i 198 mL buffertlösning med karbonat. Denna lösning bör användas inom 24 timmar efter beredningen.
- Få färsk svin hjärtsäck (FPP) från slakteriet och återgå till laboratoriet inom 1 h.
Obs: FPP ska förvaras vid 4 ° C under transport. Steg 1.2-1.10 bör utföras under ständig skakning i en termostatstyrd vattenbad. - Tvätta noggrant FPP med 200 mL fosfatbuffertlösning (PBS) som innehåller 1% penicillin-streptomycin i en 500 mL-glasbägare på 10 ° för 10 min. Upprepa detta 2 x.
- Dela FPP i två lager och ta bort fettvävnaden med pincett och sax.
Obs: Håll den FPP våt genom att lägga till 50 mL PBS varje 20 min under borttagning av fettvävnad. - Forma FPP i 10 x 10 cm2 bitar med en sax. Tvätta FPP med 200 mL buffertlösning med karbonat (CBS) som innehåller 1% penicillin-streptomycin i en 500 mL-glasbägare på 10 ° C för 10 min. Upprepa detta 2 x.
- Överföra FPP till rent vatten och blöta det vid 10° C i 12 h.
- Blötlägg de 10 x 10 cm2 proverna i 50 mL av CBS som innehåller 200 U/mL PLA2 och lösning 0,5% (w/v) natrium deoxicholat vid 37 ° C i 6 h.
- Tvätta proverna med CBS som innehåller 1% penicillin-streptomycin vid 10 ° C i 10 min. Upprepa detta steg 2 x.
- Blötlägg varje prov i 50 mL av CBS som innehåller 200 U/mL PLA2 och lösning 0,5% (w/v) natrium deoxicholat vid 37 ° C i 2 h.
- Tvätta proverna med CBS som innehåller 1% penicillin-streptomycin vid 10 ° C under 2 h. Upprepa detta steg för 10 x åtminstone. Placera proverna på flata tallrikar och torka dem till konstant vikt i en konstant temperatur ugn vid 55 ° C.
Obs: Urvalet måste torkas helt. Väga DPP provet var 10 minut och upprepa att 3 x eller tills vikten inte längre ändras. - Forma varje DPP prov till en 10,5 mm diameter cirkel med en trephine. Packa varje DPP i en steril försluten påse.
- Sterilisera DPP proverna av gammastrålning (25 kGy). Lagras de DPP proverna vid 4 ° C före användning.
Obs: Alla prover kan lagras i upp till sex månader vid 4 ° C.
2. preparat för cellen blad konstruktion
- Autoklav alla instrument och vävnad carrier komponenter vid 121 ° C för 30 min, inklusive 1,5 mL centrifugal rör, pincett, tandad peang, sax, svart baser (vävnad carrier komponent) och ringer vit spänning (vävnad carrier komponent).
- Förbereda 20 mL bakteriefria 10% sackaroslösning. Vikt 2 g sackaros och upplösa sackaros i 18 mL ultrarent vatten. Autoklav 10% sackaros lösningen vid 121 ° C i 30 min eller filtrera lösningen med 0,22 µm filter.
- Autoklav de dynamiska perfusion systemenheterna vid 121 ° C i 30 min, inklusive en gas utbyte av utrustning, en 500 mL glasflaska, en perfusion kultur behållare och sammanbindande rören.
- Förbereda Ånghärdad instrument och vävnad carrier komponenter. Sätta den svarta basera delen av vävnad bäraren i en kultur maträtt.
- Plocka upp en torkade DPP byggnadsställning och lägga den i mitten av den svart bas. Sätta en vit spänning ring på DPP schavotten och fixa det i vävnad transportören.
Observera: Kontrollera ställningen är helt fast i den vävnad hållaren och det finns ingen lucka mellan svart bas och vit spänning ringen. Om inte, separata vävnad transportören och fixa ställningen igen. - Tillsätt 100 µL av odlingsmedium på DPP schavotten för rehydrering.
Obs: Om ställningen inte är fast bra i vävnad transportören, odlingssubstratet kommer att infiltrera kultur skålen. - Sätta ställningen i en inkubator i 37 ° C och låt det dra i 15 min.
3. beredning av cellerna för Cell blad konstruktion
Obs: Detta protokoll är för cellodling med hjälp av en 100 mm maträtt. Se figur 1B för en schematisk av byggandet av multilayered cellens struktur.
- Isolera BMSCs13.
Obs: Denna metod är konstruerad för att konstruera ett multilayered MSC cell blad. Rat BMSCs används i detta protokoll. BMSCs är isolerade med metoden hela benmärgen vidhäftande, och BMSCs är expanderade in vitro- att få tillräckligt cell belopp.- Autoklavera instrumenten vid 121 ° C i 30 min, inklusive tång, tandad tång och sax. Förbereda en 2 mL injektionsspruta och BMSC odlingsmedium (Dulbeccos modifierad örnens medium [DMEM], 10% fetalt bovint serum, 1% glutamin och 1% penicillin-streptomycin).
- Avliva tre veckor gamla hanråttor Sprague-Dawley (SD) av halskotan dislokation. Blötlägg djuret i 100 mL 75% alkohollösning i en bägare under 5 minuter.
- Ta ut djuret ur bägaren och placera den benägna på tabellen drift. Incisionsfilm huden på baksidan av djuret med sax och pincett. Isolera hud och muskel vävnader för att exponera de lår lårbenet.
- Isolera de lår lårbenet och lägga den i 30 mL PBS i ett 50 mL centrifugrör. Placera två lår lårbenet i en tub. Vortex centrifugröret att tvätta vävnaden. Upprepa detta steg 2 x.
- Skär båda ändarna av lårbenet med sax och exponera märg hålrummet.
- Aspirera 2 mL BMSC odlingsmedium med en injektionsspruta. Stick in nålen i benmärg kaviteten och spola ut benmärgen med odlingsmedium. Spola ut varje två lår lårbenet till en 100 mm kultur maträtt.
- För varje 100 mm kultur skålen, tillsätt 2 mL odlingsmedium i kultur skålen. Sätt skålen kultur i 37 ° C inkubator och statisk kultur för 72 h.
- Ta ut kultur skålen från inkubatorn. Ersätta supernatanten med 6 mL färsk odlingsmedium.
- Iaktta primära BMSCs under ett mikroskop. Efter detta passage i BMSCs varje 5-7 d.
- Tar cellerna ur inkubatorn. Observera cellerna i Mikroskop och välja lämplig celler för cell blad konstruktion. När BMSCs når 80% - 90% sammanflödet, kan cellerna väljas som seedade cellerna.
- Ta bort odlingssubstratet från kultur skålen. Försiktigt tvätta cellerna med 2 mL varm PBS. Ta bort alla PBS från kultur skålen och göra säker ingen vätska återstår. Tillsätt 2 mL av 0,25% trypsin (eller en annan separera lösning) i skålen och inkubera vid 37 ° C i 3 min.
- Stoppa trypsin effekten genom att lägga till 2 mL odlingssubstrat och försiktigt tvätta cellerna från skålen. Överföra cellsuspensionen i en ny 15 mL centrifugrör. Centrifugate cellerna vid 225 x g i 5 min.
- Ta bort supernatanten. Att resuspendera cellerna med 3 mL 10% (w/v) sackaroslösning.
Obs: 10% (w/v) sackaroslösning används för att tvätta cellerna för att få en enhetlig cell-hydrogel blandning i följande steg. - Aspirera 10 µL cellsuspension och räkna antalet cell med en hemocytometer. Beräkna volymen som behövs för nästa steg. För en cell ark används tre miljoner BMSCs.
- Extrahera tre miljoner celler och överföra dem i en ny 15 mL centrifugrör. Centrifugera cellerna vid 225 x g i 5 min.
- Ta bort supernatanten. Att resuspendera cellerna med 1 mL 10% (w/v) sackaroslösning. Överföra cellsuspensionen i ett 1,5 mL centrifugrör.
Obs: Använda en centrifugal 1,5 mL-röret är fördelaktigt för att förbereda blandningen cell-hydrogel. - Centrifugera cellerna på 260 xg för 5 min. helt avlägsna supernatanten och få cell sediment.
4. beredning av BMSCs och RAD16-jag peptid Hydrogel blandning
Obs: Se figur 1B för en schematisk av byggandet av multilayered cellens struktur.
- Tillsätt 20 µL av 10% (w/v) sackaroslösning i 1,5 mL centrifugal röret. Försiktigt Omsuspendera BMSCs och få en homogen suspension.
Obs: Inte generera några bubblor under resuspension. - Tillsätt 20 µL av RAD16-jag peptid hydrogel överst i suspensionen. Rör försiktigt om RAD16-jag peptid och cell fjädringen med pipettspetsen. När den cellsuspension och hydrogel blandas, Pipettera försiktigt blandningen ett par gånger.
- Ta ut DPP ställningen från vävnad transportören och sug försiktigt ut odlingssubstratet med en pipettspetsen.
Observera: Kontrollera DPP ställningen är fullt rehydrerad innan du lägger till cell-hydrogel blandningen. - Aspirera blandningen och Lägg jämnt till DPP schavotten.
Obs: Den totala volymen av blandningen skulle vara ungefär 40-50 µL. Det rekommenderas att lägga till den blandningen 10 µL samtidigt från mitten på utsidan av ställningen. - Tillsätt 1 mL odlingsmedium till botten av vävnad transportören. Sätta cellagret i 37 ° C inkubator för 5 min.
- Ta ut cellagret från inkubatorn. Försiktigt lägga till 4 mL odlingsmedium i kultur skålen och fördjupa cellagret. Sätta cellagret i 37 ° C inkubator för 2 h av statisk kultur.
5. in Vitro kultur av en 3D Multilayered cellagret som använder en dynamisk kultur System
Obs: Se figur 1 c för en schematisk av 3D dynamiska systemet.
- Förbered den dynamiska perfusion system, inklusive en Peristaltisk pump, gas exchange utrustning, en 500 mL glasflaska, en behållare med perfusion i kultur och de sammanbindande rören. Montera dynamiska perfusion systemet som visas i figur 2.
- Tillsätt 200 mL odlingsmedium till steril glasflaska. Infoga cellagret i kammaren av behållaren kultur.
Obs: Var uppmärksam på riktningen av den övre ytan av cellagret. - Tillsätt 3 mL odlingsmedium i behållaren vävnad och Stäng behållaren. Sätta systemet dynamiska perfusion i inkubatorn och starta pumpen. Ställa in flödet klassar av den peristaltiska pumpen på 8 mL/min. kultur cellagret i dynamiska perfusion systemet för 48 h.
6. att erhålla Multilayered MSC cellagret
- Autoklav instrument och vävnad carrier komponenter vid 121 ° C i 30 min, inklusive 1,5 mL centrifugal rör, pincett och tandad tång.
- Dra ut ingående kanalen från glasflaska att stoppa tillhandahållandet av odlingsmedium till behållaren.
Obs: Stoppa den peristaltiska pumpen när kultur behållaren är tom. - Ta ut cellagret från behållaren kultur och lägga den i en kultur maträtt.
- Använd en pincett för att immobilisera vävnad transportören och använda en annan tandad tång för att separera vit spänning ringen från svart bas. Slutligen få multilayered BMSCs cellagret.
- För kort konservering, kan varje cell ark överföras till ett 1,5 mL centrifugal rör med tången. DPP ställningen bör knytas till den inre väggen av centrifugal röret och cellagret bör spridas så mycket som möjligt i centrifugröret.
- Varsamt tillsätt 1 mL odlingsmedium i centrifugal röret att fördjupa cellagret. Stäng locket på centrifugal röret och lagra cellagret vid 4 ° C.
Obs: Cellagret ska transplanteras eller analyseras så snart som möjligt. Det rekommenderas att använda cellagret inom 4 h.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Schematiskt av multilayered stamceller ark konstruktionen visas i figur 1. Förbereda cell ark ställningen av metoden PLA2 decellularization är det första steget. Baserat på schavotten, är en tillfällig 3D cellstruktur konstruerad genom att blanda stamcellerna med den RAD16-1 peptid hydrogel. För att erhålla ett multilayered cellagret med gynnsamma stamceller bioaktivitet och optimal mekanisk styrka, är cellagret odlade i en dynamisk perfusion system. Under dynamisk näring leverans, stamceller tillåts föröka sig och upprätta Cellkontakter inom multilayered cellagret och produktens slutliga stabil multilayered cell ark kan erhållas efter en ~ 24-72-timmars odling.
I det här fallet cell ark schavotten DPP bereds genom metoden PLA2 decellularization. Utseendet på torkade DPP är platt, smidig och halvtransparent (figur 3A). På grund av specifika lyse effekten av PLA2, heterogena celler kan tas bort helt medan ultrastruktur av naturliga kollagen inom DPP ställningen är välbevarad (figur 3B), och detta är viktigt för att bibehålla den mekanisk hållfasthet och biokompatibilitet av ställningen. Dessutom kan ställningar ändras som en tillväxtfaktor kontroll release system för att stödja stamcellstillväxt och förbättra den-13 i vivo regenerering.
När stamcellerna når ~ 80% - 90% sammanflödet, cellerna är isolerade från kultur skålen och tvättas med en 10% sackaroslösning. Efter centrifugering, cellerna blandas med RAD16-jag peptid hydrogel och lagt till återfuktad DPP schavotten. En tillfällig mångbottnat struktur bildas efter en två timmars statisk kultur. Slutligen förvärvas multilayered BMSC ark produkten (figur 4) efter en 48-timmars kultur i systemets dynamiska perfusion. Med stöd av DPP schavotten, cellagret kan lätt manipuleras med pincett, och det kan tillfälligt bevaras i odlingsmedium i 1,5 mL röret vid 4 ° C i 4 timmar före undersökning eller transplantation (figur 4). Som den immunofluorescens färgning resultat visar, är BMSCs mycket positiva för stamceller markörerna CD90 och CD29. Efter cell ark byggandet, BMSCs inom de multilayered cell ark Visa hög CD29 och CD90 (figur 5).

Figur 1 : Flödesschemat för att bygga bladet multilayered stamceller. (A) genom att använda metoden PLA2 cell-lösa, de heterogena cellerna inom FPP förstörs medan de naturliga extracellulära matriserna är väl bevarade i DPP schavotten. (B) baserat på DPP schavotten, tillfälliga multilayered cellens struktur är uppbyggd genom att blanda stamcellerna och självmonterande peptid hydrogel. (C) att följa, cellagret är odlade i en 3D dynamiska system och stamcellerna förväntas att föröka sig och upprätta Cellkontakter under dynamisk näring leverans. Klicka här för att se en större version av denna siffra.

Figur 2 : Vävnad transportören och systemets dynamiska perfusion. (A) denna panel visar 13 mm diameter vävnad bärare. (B) denna panel visar montering av systemets dynamiska perfusion. Klicka här för att se en större version av denna siffra.
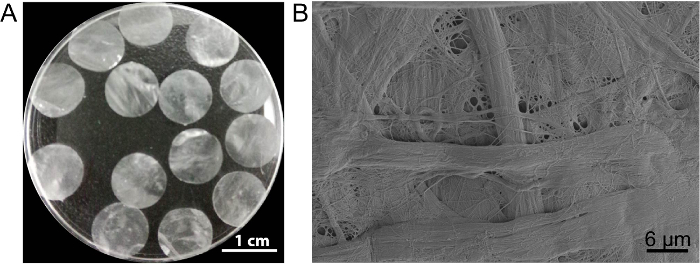
Figur 3 : Utseende och ultrastruktur av DPP. (A) denna panel visar utseendet på de 10,5 mm diameter DPP ställningar. (B) denna panel visar en representativ bild av svepelektronmikroskop (SEM) resultatet av DPP schavotten. Klicka här för att se en större version av denna siffra.
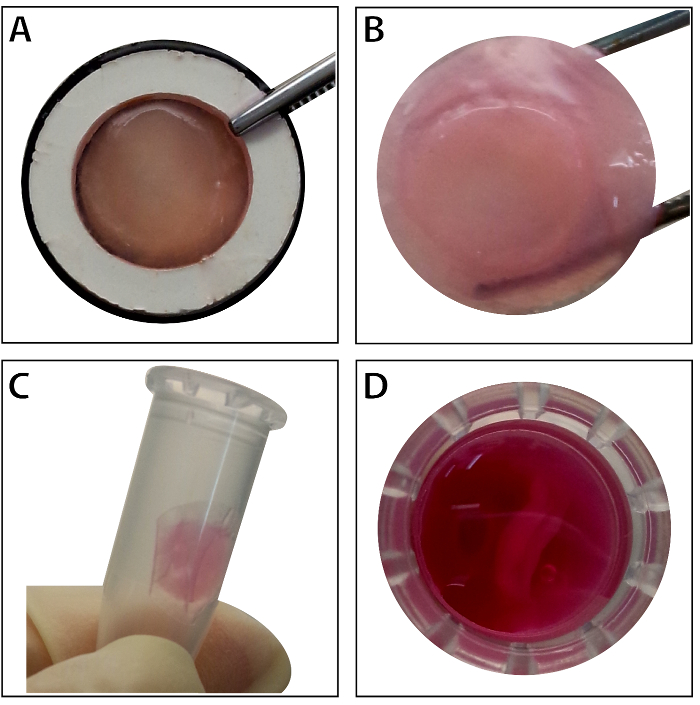
Figur 4 : Utseendet på bladet multilayered BMSC. (A) denna panel visar utseendet på det multilayered BMSC plåt inom vävnad transportören. (B) hålls intakt multilayered BMSC arket av tången. (C - D) Multilayered cellagret kan bevaras tillfälligt i 1,5 mL röret före användning. Klicka här för att se en större version av denna siffra.
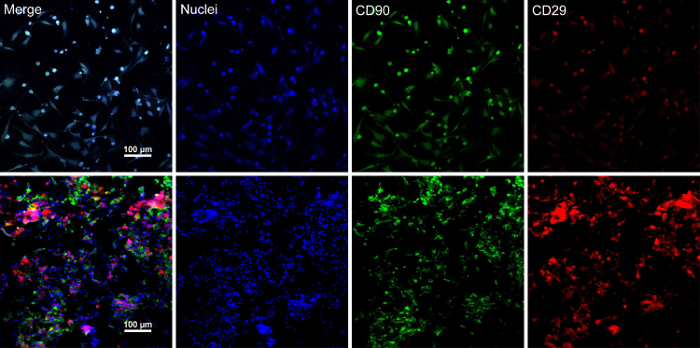
Figur 5 : Immunofluorescens färgning resultatet av BMSC markörer uttryck. (A) denna panel visar immunofluorescens färgning resultaten av BMSCs före cellen blad konstruktion. (B) denna panel visar immunofluorescens färgning resultat i avsnittet multilayered BMSC blad. CD90 (grön) och CD29 (röd) var positivt uttryckt i BMSCs och cellagret. Klicka här för att se en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Protokolls rapporterar en effektiv metod för att konstruera ett multilayered MSC-blad. Detta cellagret uppvisar optimal mekanisk hållfasthet, hög celldensitet sådd och gynnsamma stamceller bioaktivitet. Använda BMSCs som ett exempel, 3D cellens struktur byggs snabbt med RAD16-jag peptid hydrogel. Efter att vara odlade i systemets dynamiska perfusion, bladet multilayered BMSC erhålls framgångsrikt och BMSCs upprätthålla ett högt uttryck av stamceller markörer.
Att bygga tillfälliga multilayered cellens struktur är den kritiska steget i protokollet. RAD16-jag är en kommersiell hydrogel-peptid, och består av 1% aminosyra och 99% vatten. Flera studier rapporteras att denna peptid hydrogel kan efterlikna den naturliga ECM-miljön och är fördelaktigt för stem cell spridning och överlevnad15,16,17. I detta protokoll, en tre miljoner MSC suspension (i 20 µL av 10% sackaroslösning) blandades med 20 µL av RAD16-jag peptid hydrogel. Volymförhållandet av cellsuspensionen och den peptid hydrogel var 1:1. Denna peptid hydrogel är känslig för miljön pH värdet och peptid molekylerna skulle automatiskt bilda 3D nätverket när pH-värdet ändras från syra till neutral. Eftersom cellytan innehåller laddade partiklar, ändras cell blandningen från flytande till hydrogel på kort tid, som har influenser även blandning av cellerna. En gynnsam cell-hydrogel bör en jämn blandning av cellsuspensionen och den peptid hydrogel och gör att cellen blandningen läggas jämnt på schavotten. Forskarna kan optimera villkoret blandningen genom att ändra antalet seedade cell, sackaros lösningsvolym och peptid hydrogel volymen beroende på deras faktiska behov. Det är värt att lägga märke till att tvätta cellerna med 10% sackaroslösning och jämnt blandning cell-hydrogel blandningen är de kritiska steg i protokollet, och en ojämn blandning kan orsaka stora cellförlust och en instabil tillfällig mångbottnat struktur.
Efter tillägger cell-hydrogel blandningen på DPP ställningen, är den mekaniska styrkan hos multilayered ark cellstruktur svagt eftersom peptid hydrogel nätverket inte är tillräckligt starka för att upprätthålla långsiktiga multilayered cellstrukturen, och cell anslutningar och ECM sekret behövs för att öka stabiliteten i cellagret. Dessutom kan dynamiska infiltrationen av odlingssubstratet underlätta stamcellerna för att föröka sig och upprätta Cellkontakter inom multilayered cellstrukturen, medan en otillräcklig näring leverans kommer att orsaka cell apoptos och minska cell densiteten cellens blad13. Därför är systemets dynamiska perfusion viktigt för att stabilisera multilayered ark cellstruktur. Dessutom bör lämpliga flödet klassar av odlingssubstratet anpassas efter specifika stamceller typ och cell sådd densitet. Svag mekaniska sambandet mellan DPP schavotten och mångbottnad cellens struktur förblir också, begränsning av nuvarande byggnadssätt, vilket kan orsaka uppdelningen av de multilayered cell-lagrarna och ställningen. Därför ytterligare krävs studier för att förbättra den mekaniska biokompatibiliteten 3D hydrogel schavotten och DPP schavotten.
Tissue engineering forskare har hittills fokuserat på upprättar effektiv näring leverans system i vitro, såsom coculturing endothelial celler18 och använder en porös byggnadsställning19. Dock näring permeabilitet inom 3D-strukturen är låg i traditionella statiska 3D kultur systemet och stamceller livskraft påverkas kraftigt. I det här fallet kan använder dynamisk perfusion systemet förse tillräckligt näring för att behålla stamceller livskraft. Ett multilayered BMSC blad använder detta protokoll, och förbättrat hjärtfunktion och angiogenes i en råtta hjärtinfarkt modell13. Att konstruera en stamcell ark produkt med en hög cell belastning och gynnsamma stamceller boende är viktigt för vävnadsregeneration. Med den här effektiva Byggyta metoden, kan olika sorters multilayered stamceller ark konstrueras genom att ändra de seedade stamceller typerna, såsom epitelial stamceller, neurala stamceller blad, eller hjärt stamceller ark. Ytterligare utforskning av och alternativ till bladet multilayered stamceller förväntas expandera ansökningar om mer vävnadsregeneration.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har något att avslöja.
Acknowledgments
Detta arbete stöds av den nationella naturvetenskap Foundation i Kina (licensnummer 31771064); Vetenskap och teknik planering projekt i provinsen Guangdong (grant nummer 2013B010404030, 2014A010105029 och 2016A020214012); Vetenskap och teknik planering projekt i Guangzhou (licensnummer 201607010063); och grundutbildning Innovation och entreprenörskap träningsprogram (licensnummer 201610559028); National Science Foundation för unga forskare i Kina (bevilja nummer 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



