Summary
כאן אנו מציגים פרוטוקול להצפנה אינדוקציה של שמאל cryoinjury חדרית ואחריו ההשתלה של תיקון שריר הלב, נגזר iPS-התא האנושי cardiomyocytes במודל של שפן.
Abstract
בשל יכולת התחדשות מוגבלת של הלב ביונקים למבוגרים, אוטם שריר הלב גורמת לאובדן בלתי הפיך cardiomyocytes. אובדן זה של כמויות רלוונטיים של שריר הלב מסה יכול להוביל לאי-ספיקה. מלבד השתלת לב, אין אפשרות טיפול מרפא עבור לאי-ספיקה סופנית. בתקופות של מחסור תורם איברים, איבר עצמאי לטיפול לאופנים נחוצים. שמאל-חדרית לסייע התקנים הם אפשרות טיפול מבטיח, אולם, במיוחד כמו טיפול היעד, מוגבל על ידי שלה תופעות הלוואי כמו שבץ, זיהומים, לפרקים. בשנים האחרונות נחקרו מספר אסטרטגיות תיקון הלב כולל הזרקת תאי גזע, לב אבות או הנדסת רקמות שריר הלב. השיפורים האחרונים ב ביולוגיה של התא מאפשרים הבידול של כמויות גדולות של cardiomyocytes שמקורם בתאי גזע pluripotent המושרה אנושי (iPSC). אחת האסטרטגיות תיקון הלב כעת תחת הערכה היא להשתיל רקמה לב מלאכותי. רקמת הלב מהונדסים (בובה) היא רשת תלת מימדי cardiomyocyte שנוצר במבחנה, עם מאפיינים פונקציונליים של רקמת הלב מקורית. יצרנו בובה-תיקוני מ cardiomyocytes hiPSC נגזר. כאן אנו מציגים פרוטוקול עבור אינדוקציה של שמאל cryoinjury חדרית שריר הלב בשפן, ואחריו השרשת hiPSC נגזר בובה על הקיר השמאלי חדרית.
Introduction
מספר החולים עם אי ספיקת לב הולכת וגוברת שלנו הזדקנות האוכלוסייה. לאי ספיקת לב בשלב הסופי, השתלת לב orthotopic היא האפשרות הטיפול המרפא בלבד. עם זאת, במיוחד במדינות אירופה, יש מחסור התורם הגוברת איברים. לכן, אפשרויות טיפול אלטרנטיבי נחוצים. ההישגים האחרונים בתמיכה הדם מכני מבטיחים, אבל במיוחד לטווח הארוך לרוץ, מוגבל על ידי שלה תופעות לוואי כמו דימום, משאבת פקקת, סיבוכים זיהומיות1.
יכולת התחדשות אנדוגני של הלב האנושי למבוגרים מוגבלת מאד. לכן, טיפולים התחדשות לב עלול להפוך אפשרות טיפול אלטרנטיבי עבור2,חולי אי ספיקת לב בשלב הסופי3. טכניקות שונות כולל הזרקת מבוססי תאי גזע תאים או רקמות גישות הנדסה כבר תיאר3,4,5.
תאי גזע pluripotent המושרה אנושי (hiPSC), כמו גם תאי גזע עובריים (hESC) ניתן ביעילות להבחין להכות ספונטני cardiomyocytes האנושי6, אשר כבר הישג גדול בשטח של הלב רגנרטיבית טיפולים.
כדי להחליף את שריר הלב לאחר אוטם שריר הלב וכדי לשפר את התפקוד של הלב כושל, הישרדות של מספר מתאים של cardiomyocytes ו שלהם מכניים וחשמליים צימוד עם הלב המקורי הוא חיוני. כדי לחקור את הפוטנציאל של הלב משובי טיפולים עם cardiomyocytes תא נגזר iPS אנושי, דרושה מודל מחקר מתאימים. המודל האידיאלי צריך להיות חסכונית ויש להם פיזיולוגיה אנושית אלקטרופיזיולוגיה. מודלים גדולים בעלי חיים כמו חזירים יהיה אידיאלי מנקודת המבט הזו, אולם, הניסויים האלה יקרים מאוד ולא כמויות גדולות של cardiomyocytes יהיה צורך להחליף מספר cardiomyocytes הרלוונטיים על מנת לראות תופעות מצד שמאל חדרית פונקציית במודל אוטם חזיר.
לענות על שאלות ביולוגיות יסודי לקראת התחדשות לב מבוססת תא אנושי, למשל, הישרדות cell, vascularization וצימוד חשמלי, מודלים בעלי חיים קטנים מתאימים יותר. מן הדגמים בעלי חיים קטנים זמינים, שפן הוא המין השימושי ביותר, בהשוואה לעכברים, אלקטרופיזיולוגיה שלהם דומה יותר מקרוב המצב בני7. במודל זה שפן, אנחנו המושרה על cryoinjury transmural של החדר השמאלי. שבוע לאחר הגיוס של אוטם שריר הלב השרשה של תלת ממדי, להכות ספונטני הירכיים-תא נגזר cardiomyocyte תיקון בוצעה. הישרדות cell Cardiomyocyte הוערך 28 ימים לאחר ההשתלה בבדיקה היסטולוגית.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
בעלי חיים קיבל טיפול אנושי בדרישות המדריך העקרונות של חיות מעבדה, שהוכנו על ידי המכון של מעבדה חיה המשאבים, שפורסם על ידי מכוני הבריאות הלאומיים. כל הפרוטוקולים בעלי חיים אושרו על-ידי הרשות המקומית אחראית (' Amt לדנציג Gesundheit und Verbraucherschutz, המבורג Hansestadt"/ בעל חיים פרוטוקול # 109/16).
1. לקבל חיות
- מסחרית להשיג נקבה שרקנים במשקל של 500-600 גרם.
- בית אותם בתנאים רגילים בעלי חיים בכלובים. להאכיל עכבר סטנדרטי האוכל ואת המים בלוק לספירה libidum.
2. אקו אקו
- למקם את שפן תא אינדוקציה, עזים ומתנגד החיה עם איזופלוריין (2-3%). בדוק את עומק ההרדמה על ידי חוסר התגובה הבוהן-בלחץ.
- הצב שפן anesthetized על פלטפורמה התחממות כדור הארץ (40-42 ° C) במצב פרקדן. המשך הרדמה באמצעות קונוס האף (איזופלוריין-1.5-2%)
- לגלח, depilate בית החזה pig´s גינאה באמצעות של גילוח שיער בעלי חיים חשמלי.
- החל ג'ל מתמר אולטרסאונד prewarmed (~ 25 ° C). השתמש מערכת אקוקרדיוגרפיה הינו מצויד עם ממירי תדר גבוה יותר מאשר 15 מגה-הרץ.
- רוכשים מימדי מתחת ציר זמן תצוגות על-ידי הצבת המתמר על בית החזה חזיר guinea´s מול מהצוואר ימינה לכיוון רגלו השמאלית ואת ציר זמן שיא B-מצב תמונות במישור שסתום אבי העורקים עם ויזואליזציה בו-זמניות של LV השיא. חיקרו בפונקציה שמאל-חדרית שטרם-נותחו.
- הפעל המתמר ב- 90° מעלות כדי לקבל מבט קצר ציר B-מצב רמת אמצע-papillary.
הערה: החיה ואז מועבר מיד או הטבלה. החיה הוא מורדם ברציפות עם 3% איזופלוריין. אטרופין 0.05 מ"ג/ק"ג (i.m.) מוזרק כדי למנוע הפרשת מוגברת במהלך אוורור מכני.
3. ניתוח
-
אינדוקציה של אוטם שריר הלב
- להזריק carprofen 4-5 מ"ג/ק"ג ו- 0.05 מ"ג/ק"ג. הבופרנורפין על שיכוך כאבים subcutaneously עם מחט 21 G ומזרק 10 מ"ל. 0.5 מ ג/ק ג אטרופין מוזרק subcutaneously עם מחט 21 G ומזרק 10 מ"ל.
- במקום שפן על גבו ולשמור הרדמה עם facemask כיסוי הפה והאף. בדוק את עומק הרדמה על ידי צובט את הרגליים האחוריות (חוסר רפלקס פדלים).
- ופשקו את הרגליים של חזירים גינאה ולתקן את המיקום באמצעות הקלטת.
- מגלח את החזה, אזור הנשימה של החיה anesthetized עם מכונת גילוח חשמלית. לחטא את האזור נרחב באמצעות פילינג המבוסס על יוד, ואחריו 80% אתנול. חזור על שלבים חיטוי פעמיים.
- לבצע חתך אנכי של 1.5 ס מ באזור והכו אותי ומנתחים שמותחת את השרירים מכסה קנה הנשימה עד שתראו. את קנה הנשימה. ניקוב קנה הנשימה עם 18 גרם הזרקה והכנס את חלק גמיש הצינורית כמו צינור הנשימה.
- לחבר את הצינור בקנה הנשימה בעלי חיים מסכת סינון אוויר לנשום באופן רציף שפן במהלך ההליך.
הערה: עכשיו ההרדמה נשמר עם איזופלוריין % 3 דרך הצינור בקנה הנשימה (השראה בסיוע אוורור עם השראה המרבי לחץ, קצב הנשימה: 100-120/דקה, שיא הלחץ השראה: 18-22 ס מ כספית באמצעות ציוץ-איוורור כאשר החזה פתוח ). - לזהות לחלל הבין-צלעיth 5 על ידי ספירת החללים צלעות מתחיל ברווח הבין-צלעי הראשון. לבצע חתך אופקי של 2 ס מ על המרחב הבין-צלעי החמישי בצד שמאל של שפן באמצעות פינצטה ומספריים. הכנס מפסק בעלי חיים קטנים. לנתח את שרירי עם electrocautery עד השרירים הבין-צלעי נגישים, אשר ניתן לראות לאחר הסרת הרקמה התת עורית, נגישים.
- לנתח בעדינות את השרירים הבין-צלעי עם פינצטה, עד השטח pleural נגיש, אפשר לראות את הריאה השמאלית מקדימה. הוסף את המדחק בין הצלעות ופתח אותו בזהירות עד תצפית טובה על הלב, מתקבל.
- פתח את קרום הלב כ 1 ס"מ באזור של הקיר חדרית השמאלי הקדמי עם מספריים. הניחו קומפרסים על הריאה השמאלית כדי להגן עליו מפני נזק בעת גרימת את cryoinjury של החדר השמאלי.
- המקום הקצה בחותמת מתכת השחוקים (אלומיניום) בקוטר חתך הרוחב של 0.5 ס מ לתוך חנקן נוזלי למשך 3 דקות.
- הקש החנקן מקורר רגש על גבי הקיר הקדמי השמאלי של הלב 30 s. ואז להפריד את זה מכל הלב באמצעות של חשמלי מלחם (250 מעלות צלזיוס) אשר ממוקם בתוך הבול כדי לחמם את זה. חזור על הליך זה 3 פעמים כדי להשיג פגיעה שריר הלב transmural. להתבונן על בישול לבן של שריר הלב.
- מנפח הריאות עם מרב הלחץ (על-ידי מחבר חובק למעקה הצינור יצוא של ההנשמה 2 s), כדי למנוע תמט הריאות של הריאה. הסר את המדחק מן המרחב הבין-צלעי.
- סגור את הצלעות עם שני תפרים 3-0. סגור השרירים מעל הצלעות עם 4-0 פועל תפר. לשימוש הסגר של העור 5-0 בתפר אחד התפרים.
- להפחית את איזופלוריין ל- 1%. כאשר החיה נושם באופן ספונטני, להסיר את הצינור בקנה הנשימה, ולהמשיך הרדמה עם facemask (איזופלוריין 2-3%).
- מבטיח העדר רפלקסים מאת צובט את האיבר הינד לעקוב אחר עומק מספיק של הרדמה. לאחר מכן השתמש יחיד 8-0 תפרים כדי לסגור את האתר ניקוב על קנה הנשימה. לסגור את הפצע עם שלושה תפרים stich יחידה 4-0.
- השתמש הבופרנורפין (0.05 מ"ג/ק"ג לכל 12 שעות) carprofen (5 מ"ג/ק"ג לכל 24 שעות ביממה) לתרופות כאב עבור 5 הימים הבאים.
-
השרשה של בובה (7 ימים לאחר cryoinjury)
- למקם את שפן תא אינדוקציה, עזים ומתנגד החיה עם איזופלוריין הסימון העומק של הרדמה לתחושה של חוסר תגובה הבוהן-בלחץ.
- להזריק carprofen 4-5 מ"ג/ק"ג ו- 0.05 מ"ג/ק"ג. הבופרנורפין subcutaneously עם מחט 21 G ומזרק 10 מ"ל לאחר אינדוקציה של הרדמה. במקום שפן על גבו ולשמור הרדמה עם facemask כיסוי הפה והאף.
הערה: תנאי הכרחי של הרדמה צריך להיבדק על ידי צובט הרגליים האחוריות. - ופשקו את הרגליים של שפן ולתקן את המיקום באמצעות הקלטת.
- לבצע את ההכנות טרום הניתוח כפי שמתואר בשלב 3.1.4–3.1.6. לבצע חתך אופקי העור 2 ס מ באזור הצלקת של הצד הלטראלי השמאלי באמצעות פינצטה ומספריים.
- בעדינות לנתח את ההדבקויות extrapleural שימוש electrocautery. בזהירות לפתוח את השטח pleural עם מספריים. הכנס מפסק צלעות לחשוף את הלב.
- זיהוי חזותי של האזור של שריר הלב על-ידי צבעה חיוור בהשוואה לשריר שמסביב בריא. הצב את תיקון רקמת הלב מהונדסים מעל האזור אוטם.
- לאבטח אותו עם שני 8-0 התפרים על שני הצדדים. הקפד לאבטח את התיקון באזור הלא-infarcted של הלב (איור 1). מנפח הריאות עם לחץ, כדי למנוע תמט הריאות של הריאה. הסר את המדחק מן המרחב הבין-צלעי.
- סגור את הצלעות עם שני תפרים 3-0. סגור השרירים מעל הצלעות עם 4-0 פועל תפר. לשימוש הסגר של העור 5-0 בתפר אחד התפרים.
- להפחית את איזופלוריין ל- 1%. כאשר החיה נושם באופן ספונטני, להסיר את הצינור בקנה הנשימה, ולהמשיך הרדמה עם facemask (איזופלוריין 2-3%).
- מבטיח העדר רפלקסים מאת צובט את האיבר הינד לעקוב אחר עומק מספיק של הרדמה. לאחר מכן השתמש יחיד 8-0 תפרים כדי לסגור את האתר ניקוב על קנה הנשימה. סגור הפצע עם שלושה יחיד, תפר התפרים 4-0
- השתמש הבופרנורפין (0.05 מ"ג/ק"ג לכל 12 שעות) carprofen (5 מ"ג/ק"ג לכל 24 שעות ביממה) לתרופות כאב עבור 5 הימים הבאים.
- ארבעה שבועות לאחר ההשתלה בובה לבצע אקו אקו (כפי שמתואר בשלב 2) כדי לעקוב אחר תפקוד LV לאורך זמן.
הערה: הפונקציה LV מנוטר לפני ההשתלה בובה ו- 4 שבועות לאחר ההשתלה כדי לפקח על שיפור בתפקוד הלב על ידי בובה השרשה - להרדימו הפרוטוקול IACUC אושרה, בניתוח explant הלב לצורך ניתוח נוסף.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
מודל זה שפן הוא מודל מתאים לחקור התחדשות לב לאחר ההשתלה של hiPSC נגזר בובה-תיקונים. זה מוביל reproducibly פציעות שריר הלב transmural גדולים. גודל הצלקת מוערך על-ידי היסטולוגיה ארבעה שבועות לאחר cryoinjury. צביעת trichrome מייסון מגלה צלקות גדולות transmural (איור 2). גודל הצלקת היה דומה על פני מספר רב של בעלי חיים פצועים משקף רמה גבוהה של הפארמצבטית8. בממוצע 25% של שריר הלב הימני חדרית הוחלף על ידי רקמת צלקת. הדיסטרופין הכתמה הפגינו שתלים שריר הלב גדול חלקית remuscularized את הצלקת (איור 3 א). צביעת עבור האדם Ku80 הוכיח את מקור אנושי זה שריר הלב שהוקם (איור 3b). הגדלה גבוהה יותר חשף כי אלה שתלי כללה נייטרלים בצפיפות. תפקוד השמאלי היה פיקוח באמצעות אקו אקו. בובה שכל מאופיין על ידי שיפור LVEF אזור השבר קיצור, ירידה בקוטר דיאסטולי חדרית השמאלי (איור 4).
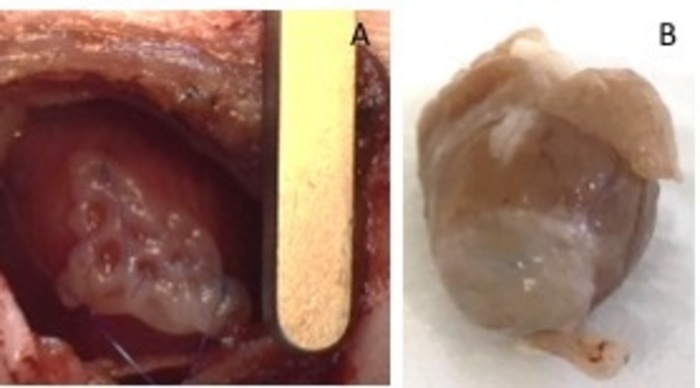
איור 1: hEHT-תיקונים לאחר ההשתלה. (א) תיקון מיד לאחר ההשתלה. תיקון (B) ארבעה שבועות לאחר ההשתלה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
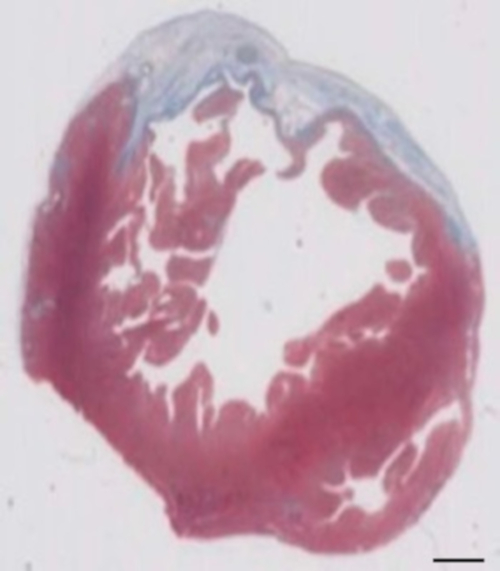
איור 2: קביעת אוטם על מאסון של trichrome צבעונית פרפין סעיף 28 ימים לאחר cryoinjury. אוטם נקבע לפי הצבע הכחול של מאסון trichrome מכתים, המייצג שהותירה רקמות. סרגל קנה מידה = 2 מ מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
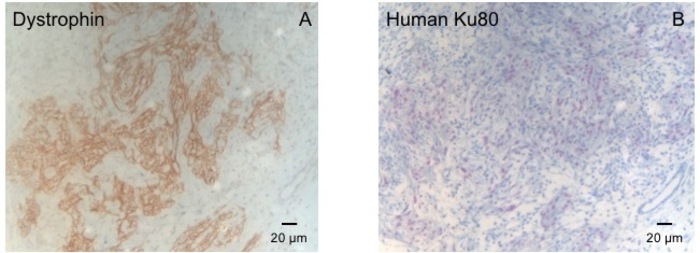
איור 3: צביעת הדיסטרופין ועם Ku80 אנושי. () הדיסטרופין מכתים מראה שרירים גדולות איי (חום) באזור הצלקת (B) מכתים Ku פרפין למחלקה הלב. Ku-80 היא נוגדנים ספציפיים האדם. לכן, התאים מוכתם באופן חיובי (צבע חום) הן ממקור אנושי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
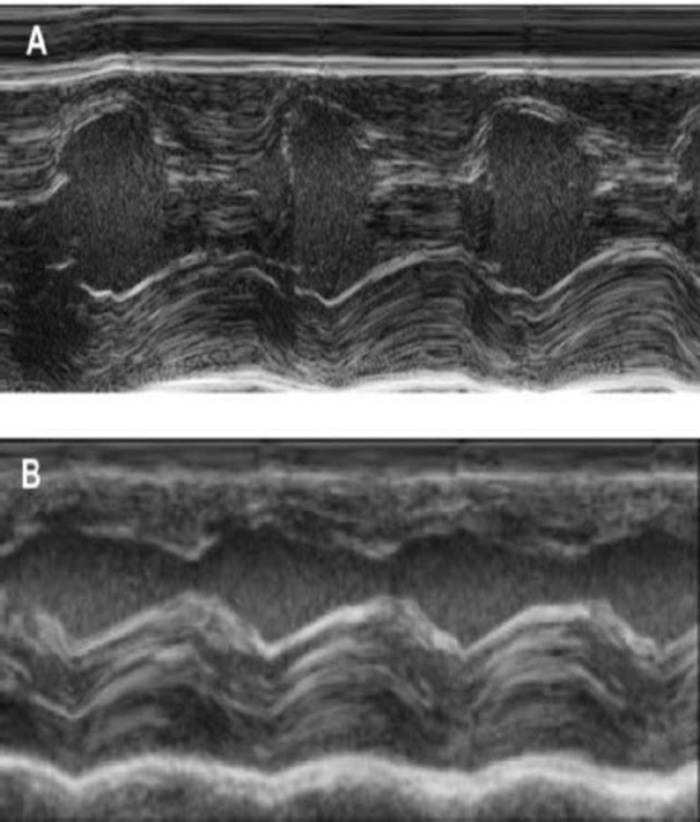
איור 4: M-Mode מדידה של החדר השמאלי באמצעות אקו אקו- (א)-בסיסית ו- (B) שבוע לאחר cryoinjury. (עירויים: מחצה ע, LV: החדר השמאלי, PW: הקיר האחורי). המדידות מבוצעות 3 פעמים. בנקודת ההתחלה, שבוע לאחר cryoinfarction, 4 שבועות לאחר ההשתלה בובה אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
מגוון דגמים בעלי חיים קטנים זמינים לחקור את ההשפעה השתלת תא מפעילה לבבות הפצועים9,10,11. בחרנו מודל שפן בגלל חיים קטן כל הדגמים שלה (האלקטרו) פיזיולוגיה דומה ביותר לזו של בני אדם. היתרונות של מודלים בעלי חיים קטנים הם דיור פשוטה לניהול עלויות, כמה workforces. בהשוואה עכברים וחולדות, גינאה pigs´ הלב (אלקטרו) פיזיולוגיה דומה יותר לבני אדם. בפרט הלב תדירות היא נמוכה יותר (~250/min), הופעות פוטנציאלי פעולה חדרית שלב הרמה של אשלגן הנוכחי אניkr חשוב עבור רה-פולריזציה7. יתר על כן, במידה הגדולה מבין השתיים של בעלי החיים מקלה על ניתוחים, אשר חשוב במיוחד כמו ניקור re הוא נדרש שבוע אחרי אינדוקציה של פציעה. עם זאת, שרקנים רגישים לחומר הרדמה הדורשים ניסיון.
שיבא. et al., תיאר את השימוש 50 מ"ג/ק"ג קטמין ו- 2 מ"ג/ק"ג חריגות השירותים הווטרינריים (i.p.) כדי עזים ומתנגד שרקנים הלב cryoinjury4. אנחנו גם העריכו הגדוד הזה הרדמה. אחד החסרונות הוא העובדה שזה בלתי אפשרי להשעות את השפעה נרקוטית של חריגות השירותים הווטרינריים, קטמין עקב חסר נוגדנים חזק. בהתחשב בכך כי שרקנים הם בסיכון גבוה של היפוגליקמיה במהלך ניתוחים, החלטנו להשתמש גז נרקוטיים אשר אפקט קל לבצע בקרה, המוביל לכן שלב ההתאוששות הרדמה קצר מאוד. בחיתוך הקנה משמש כדי להבטיח אוורור בטוח לאורך כל ההליך. אורו-צנרור קנה הוא מבחינה טכנית מאוד תובעניים שרקנים, כמו הפריט החזותי של הפתח של קנה הנשימה הוא לעתים קרובות קשה ולא ניתן להבטיחן של צנרור בטוח.
למרות הקפאה-פגיעה המניע לחבלה חמורה שריר הלב זה לא בדיוק במראה של מחלת עורקים כללית / אוטם שריר הלב אצל בני אדם. במובן זה, מצדו של הנער או אפילו מודל פציעה איסכמיה-פגיעה reperfusion יותר מקרוב recapitulates פתופיזיולוגיה אנושי. עם זאת, האנטומיה עורקים שרקנים-מאופיין של collateralization מקיף. לכן, מצדו של השמאלי הקדמי היורד העורק הראשי לא reproducibly לגרום לפציעות שריר הלב גדול שרקנים12,13. בחור-מצדו של עכברים וחולדות מוביל, שיפוץ מקיף ו בסופו של דבר דליל של הקיר הקדמי, תכונה לא ראיתי בני אדם לדרגה זו. המודל הקפאה-פגיעה שפן מעוררת תהליכי שיפוץ, דילול של הקיר חדרית, אבל במידה מסוימת, זה הדוק יותר דומה של שריר הלב פגיעה אצל בני אדם. לכן, מודל cryoinjury וכתוצאה מכך פגיעה שריר הלב אמין יותר נבחר13. Periprocedural התמותה היא בעיה רצינית עם מודל זה. בתחילה, כ- 30% מבעלי החיים מת במהלך הפעולה הראשונה, או תוך 7 ימים לאחר פציעה הלב. עוד 30% מתו במהלך ההשתלה בובה לדעה התמותה הכללית של 60%. מספר שינויים להוביל ירידה משמעותית בתמותה. איזופלוריין גורם שיעולים כבדים, הפרשת. אטרופין מפחית את הפרשת והיה גורם מרכזי להפחתת התמותה. הגורם השני זה בכבדות ירדה התמותה הוא בשימוש במלחם לשחרר את החותמת מתכת קר מכל הלב. מים חמים שימש בתחילה כדי לנתק את החותמת של שריר הלב. עם זאת, זה היה קשה להסיר את המים בחלל בית-החזה. נותרו מים השפיעו לרעה על הנשימה ולהוביל להתפתחות של אדהזיה זה החמיר את האבחנה animal´s. עוד שינוי חיובי והשפיע על ההליך היה ההגנה של הריאה השמאלית של החותמת מתכת קר עם קומפרסים. לאחר לבצע שינויים אלה היו מיושמים התמותה ירד ל ~ 20% עבור פעולת הלב פציעה (כולל השבוע לאחר הניתוח הראשון), עוד 25% עבור השתלת בובה. אינדוקציה של פגיעה הקפאה מייצג את הפעולה יותר מבחינה טכנית, ניתן להשיג תוצאות עקביות לאחר 5-10 חיות יש כבר פעלו תחת פיקוח. בובה-השתלת היא תובענית יותר, ניתוחים כ-20 תחת פיקוח מומלצים עד ניתן להשיג תוצאות לשחזור.
בהתחלה השתמשנו מלוחים חמים לשטוף את הלב ולנתק, לכן, החללית קפואים מן הקיר השמאלי חדרית. ההליך זה הרבה יותר קל לטפל, אך כמה מיליליטר של תמיסת מלח נשארים בבית החזה מעלה את הסיכון של כשל נשימתי.
לסיכום, המודל מתוארים שפן לשחזור, זול ומוביל אל תוצאות עקביות. אקו אקו מציע כלי ריאלי, לא פולשנית כדי להעריך את הנוכחות של פציעה הלב לפני הניתוח מחדש, שתל-ההשרשה מבוצעת.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
אף אחד מחברי יש מתחרות אינטרסים כלכליים או אחרים ניגודי עניינים להכריז.
Acknowledgments
אין מימון התקבלה במחקר זה
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



