Summary
Aquí presentamos un protocolo para la inducción de la criocauterización ventricular izquierdo seguido de la implantación de un parche de músculo cardiaco, derivado de los cardiomiocitos células iPS humanas en un modelo del conejillo de Indias.
Abstract
Debido a la capacidad limitada de regeneración del corazón en mamíferos adultos, infarto de miocardio resulta en una pérdida irreversible de cardiomiocitos. Esta pérdida de cantidades importantes de músculo cardíaco masa puede llevar a la insuficiencia cardíaca. Además de trasplante de corazón, no hay ninguna opción de tratamiento curativo para la insuficiencia de la fase final. En tiempos de escasez de donantes de órganos, modalidades de tratamiento independiente del órgano son necesarios. Dispositivos de asistencia ventricular izquierda son una opción promisoria de tratamiento, sin embargo, especialmente como terapia de destino, limitada por sus efectos secundarios, como accidentes cerebrovasculares, infecciones y bleedings. En los últimos años se han investigado varias estrategias de reparación cardíaca, incluyendo la inyección de células madre, progenitoras cardiacas o ingeniería tisular del miocardio. Las mejoras recientes en biología celular permiten la diferenciación de grandes cantidades de cardiomiocitos derivados de las células madre humanas pluripotentes inducidas (iPSC). Una de las estrategias de reparación cardíaca actualmente bajo evaluación es trasplantar tejido cardíaco artificial. Tejido del corazón Ingeniería (EHT) es una red tridimensional cardiomiocitos creado in vitro, con propiedades funcionales de los tejidos del corazón nativo. Hemos creado EHT-parches de cardiomiocitos hiPSC derivado. Aquí presentamos un protocolo para la inducción de la criocauterización miocardio ventricular izquierdo en un conejillo de Indias, seguida por la implantación de hiPSC derivados EHT en la pared ventricular izquierda.
Introduction
El número de pacientes con insuficiencia cardíaca está aumentando en nuestra población que envejece. Final-insuficiencia cardíaca, trasplante cardíaco ortotópico es la opción de tratamiento curativo sólo. Sin embargo, especialmente en países europeos, existe una creciente escasez de donantes de órganos. Por lo tanto, son necesarios tratamientos alternativos. Los logros recientes en soporte circulatorio mecánico son prometedores, pero sobre todo a largo plazo funcionan, limitado por sus efectos secundarios como sangrado, trombosis de la bomba y las complicaciones infecciosas1.
La capacidad de regeneración endógena del corazón humano adulto es extremadamente limitada. Por lo tanto, terapias de regeneración cardiaca podrían convertirse en una opción alternativa del tratamiento para la fase final insuficiencia cardíaca los pacientes2,3. Diferentes técnicas incluyendo inyección celular basada en células o tejidos enfoques de ingeniería han sido describen3,4,5.
Las células madre humanas pluripotentes inducidas (hiPSC), así como células de vástago embrionarias humanas (hESCs) se pueden distinguir eficazmente a espontáneamente superando a cardiomiocitos humanos6, que ha sido un logro importante en el campo de regeneración cardiaca terapias.
Para reemplazar el miocardio después de un infarto de miocardio y mejorar la función del corazón falla, la supervivencia de un número adecuado de cardiomiocitos y sus mecánicos y eléctricos de acoplamiento con el corazón nativo es esencial. Para investigar el potencial de las terapias regenerativas cardiacas con cardiomiocitos de celular basada en células iPS humanas, se necesita un modelo de investigación adecuado. El modelo ideal debe ser rentable y tiene una apariencia humana fisiología y electrofisiología. Modelos animales grandes como cerdos sería lo ideales desde este punto de vista, sin embargo, estos experimentos son muy costosos y grandes cantidades de cardiomiocitos sería necesarios reemplazar un relevante número de cardiomiocitos para ver efectos en el ventrículo izquierdo función en un modelo de infarto de cerdo.
Para responder a preguntas biológicas elementales hacia la regeneración cardiaca basadas en células humana, por ejemplo, supervivencia celular, vascularización y acoplamientos eléctricos, modelos animales pequeños son más convenientes. De los modelos disponibles de animales pequeños, el conejillo de Indias es la especie más útil, en comparación con las ratas y ratones, como su electrofisiología asemeja más de cerca la situación en los seres humanos7. En este modelo de conejillo de Indias, indujo una criocauterización transmural del ventrículo izquierdo. Una semana después de la inducción de infarto de miocardio la implantación de un tridimensional, espontáneamente a cardiomiocitos derivados de células caderas parche fue realizado. Supervivencia celular de cardiomiocitos se evaluó 28 días después de la implantación por la examinación histológica.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Animales recibieron atención humanitaria conforme a la guía de principios de los animales de laboratorio, prepararon por el Instituto de recursos de animales laboratorio y publicaron por los institutos nacionales de salud. Animales todos los protocolos fueron aprobados por la autoridad local responsable ('' Amt für Gesundheit und Verbraucherschutz, Hansestadt Hamburgo '' / Animal protocolo # 109/16).
1. obtener animales
- Comercialmente obtener cuyes hembra 500-600 g de peso.
- Alojarlos bajo condiciones convencionales en jaulas animales. Alimentación estándar rata chow y agua esterilizada ad libidum.
2. transtorácica
- El conejillo de Indias en una cámara de inducción y anestesiar el animal con isoflurano (2 – 3%). Verificar la profundidad de la anestesia por la falta de respuesta a la pizca del dedo del pie.
- Coloque el conejillo de Indias anestesiados en una plataforma de calentamiento (40 – 42 ° C) en una posición supina. Continuar la anestesia mediante un cono de nariz (isoflurane 1.5-2%)
- Afeitarse y depilarse el tórax de pig´s de guinea con una afeitadora de pelo eléctrico.
- Aplicar el gel del transductor de ultrasonido precalentado (~ 25 ° C). Utilizar un sistema de ecocardiografía que está equipado con una frecuencia de transductor de 15 MHz.
- Adquirir puntos de vista de eje largo paraesternal bidimensional colocando el transductor sobre el tórax de cerdo guinea´s hacia al cuello derecho hacia la pierna izquierda y eje largo grabar imágenes de modo B en el plano de la válvula aórtica con una visualización simultánea del ápice del LV. Investigar la función ventricular izquierda preoperatoria.
- Girar el transductor 90° grados para obtener una vista de eje corto modo B en el nivel medio-papilar.
Nota: El animal es trasladado inmediatamente a la tabla OR. El animal es continuamente anestesiado con isoflurano de 3%. se inyecta atropina de 0,05 mg/kg (i.m.) para evitar la secreción bronquial aumentada durante la ventilación mecánica.
3. cirugía
-
Inducción de infarto de miocardio
- Inyectar 4 – 5 mg/kg de carprofeno y 0,05 mg/kg de buprenorfina para la analgesia por vía subcutánea con una aguja de 21 G y jeringa de 10 mL. 0.5 mg/kg atropina se inyecta por vía subcutánea con una aguja de 21 G y jeringa de 10 mL.
- Coloque el conejillo de Indias en su espalda y mantener la anestesia con una mascarilla cubriendo boca y nariz. Verificar la profundidad de la anestesia pellizcando los pies traseros (falta del reflejo pedal).
- Separó las piernas de los conejillos de Indias y fijar la posición con cinta.
- Afeitarse el pecho y la región traqueal del animal anestesiado con una afeitadora eléctrica. Desinfectar la zona ampliamente con scrub base de yodo, seguido de etanol al 80%. Repetir dos veces esta pasos de desinfección.
- Realizar una incisión vertical de 1,5 cm en la zona traqueal y sin rodeos, disecar los músculos que cubre la tráquea hasta la tráquea. Punción de la tráquea con cánula i.v. de 18 G e inserte la parte flexible de la cánula como un tubo traqueal.
- Conectar el tubo endotraqueal a un animal respirador para ventilar continuamente el conejillo de indias durante el procedimiento.
Nota: Ahora se mantiene la anestesia con isoflurano 3% a través del tubo traqueal (inspiración asistida ventilación con presión de inspiración máxima, tasa de respiración: 100 – 120/min, presión de inspiración máxima: 18-22 cm Hg usando PEEP-ventilación, mientras que el pecho está abierto ). - Identificar el 5 espacio intercostalth contando los espacios costilla empezando por el primer espacio intercostal. Realizar una incisión horizontal de 2 cm en el 5 º Espacio intercostal en el lado izquierdo del conejillo de Indias con tijera y una pinza. Inserte un retractor de animales pequeños. Diseccionar los músculos con un electrocauterio hasta alcanzaron los músculos intercostales, que pueden verse después de retirar el tejido subcutáneo, se puede llegar.
- Disecan suavemente los músculos intercostales con pinzas hasta que se alcanza el espacio pleural y se puede ver el pulmón izquierdo en frente. Inserte el separador entre las costillas y abrir cuidadosamente hasta obtener una buena vista del corazón.
- Abrir el pericardio aproximadamente 1 cm en la región de la pared ventricular izquierda anterior con las tijeras. Coloque una compresa en el pulmón izquierdo para proteger de daños al inducir la criocauterización del ventrículo izquierdo.
- Coloque la punta de un sello metal erosionado (aluminio) con un diámetro transversal de 0,5 cm en nitrógeno líquido durante 3 minutos.
- Prensa el nitrógeno enfriado por sonda en la pared anterior izquierda del corazón durante 30 s. Luego separar del corazón usando un eléctrico cautín (250 ° C) que se coloca dentro de la estampilla para calentarla. Repita este procedimiento 3 veces para obtener un daño miocárdico transmural. Observar la palidez del miocardio.
- Inflar los pulmones con la máxima presión (de sujeción del tubo de salida del ventilador de 2 s), para evitar la atelectasia del pulmón. Retire el separador el espacio intercostal.
- Cerca de las costillas con dos suturas 3-0. Cerca de la sutura los músculos sobre las costillas con una corriente de 4-0. Para el cierre de la piel usar puntadas solo de la sutura 5-0.
- Reducir el isoflurano al 1%. Cuando el animal está respirando espontáneamente, retire el tubo traqueal y continuar la anestesia con un facemask (isoflurano 2 – 3%).
- Asegurar la ausencia de reflejos pellizcando las extremidades para monitorear suficiente profundidad de la anestesia. Luego utilizar una única 8-0 sutura para cerrar el sitio de punción en la tráquea. Cerrar la herida con tres suturas de stich solo 4-0.
- Uso de buprenorfina (0,05 mg/kg / 12 h) y carprofeno (5 mg/kg / 24 h) de analgésicos para los siguientes 5 días.
-
Implantación de EHT (7 días después de la criocauterización)
- El conejillo de Indias en una cámara de inducción y anestesiar el animal con isoflurano comprobar la profundidad de la anestesia por la falta de respuesta a la pizca del dedo del pie.
- Inyectar 4 – 5 mg/kg de carprofeno y 0,05 mg/kg de buprenorfina por vía subcutánea con una aguja de 21 G y jeringa de 10 mL después de la inducción de la anestesia. Coloque el conejillo de Indias en su espalda y mantener la anestesia con una mascarilla cubriendo boca y nariz.
Nota: Suficiencia de la anestesia debe medirse pellizcando los pies traseros. - Piernas de cerdo de guinea de propagación y fijar la posición con cinta.
- Realizar la preparación pre quirúrgica como se describe en el paso 3.1.4–3.1.6. Realizar una incisión de piel horizontal de 2 cm en el área de la cicatriz del lado lateral izquierdo usando tijeras y pinzas.
- Suavemente disecar las adherencias extrapleural con un electrocauterio. Abra cuidadosamente el espacio pleural con tijeras. Insertar un separador costilla para exponer el corazón.
- Visualmente identificar la región del infarto por su color pálido en comparación con el miocardio circundante saneado. Coloque el parche de tejido de corazón de ingeniería sobre la región del infarto.
- Asegúrelo con dos 8-0 suturas en ambos lados. Asegúrese de fijar el parche en la zona no infartada del corazón (figura 1). Inflar los pulmones con la presión, para evitar la atelectasia del pulmón. Retire el separador el espacio intercostal.
- Cerca de las costillas con dos suturas 3-0. Cerca de la sutura los músculos sobre las costillas con una corriente de 4-0. Para el cierre de la piel usar puntadas solo de la sutura 5-0.
- Reducir el isoflurano al 1%. Cuando el animal está respirando espontáneamente, retire el tubo traqueal y continuar la anestesia con un facemask (isoflurano 2 – 3%).
- Asegurar la ausencia de reflejos pellizcando las extremidades para monitorear suficiente profundidad de la anestesia. Luego utilizar una única 8-0 sutura para cerrar el sitio de punción en la tráquea. Cierre de la herida con solo tres puntada suturas de 4-0.
- Uso de buprenorfina (0,05 mg/kg / 12 h) y carprofeno (5 mg/kg / 24 h) de analgésicos para los siguientes 5 días.
- Cuatro semanas después de la implantación de la EHT realizar una ecocardiografía transtorácica (como se describe en el paso 2) para controlar la función del VI en tiempo.
Nota: La función del LV se controla antes de la implantación de EHT y 4 semanas después de la implantación para controlar para la mejora de la función cardiaca por implantación de EHT - Eutanasia animal que el protocolo aprobado del IACUC y explante quirúrgicamente el corazón para su posterior análisis.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Este modelo de conejillo de Indias es un modelo conveniente para investigar la regeneración cardiaca después de implantación de hiPSC había derivada parches de EHT. Reproducible conduce a lesiones miocardio transmural grande. Tamaño de la cicatriz es evaluado por histología cuatro semanas después de la criocauterización. Tinción tricrómica de Mason revela cicatrices grandes transmural (figura 2). Tamaño de la cicatriz fue similar sobre un gran número de animales heridos, lo que refleja un alto grado de reproducibilidad8. En promedio el 25% del miocardio ventricular izquierdo fue reemplazado por tejido cicatricial. La coloración de la distrofina, demostró grandes injertos miocardio que parcialmente remuscularized la cicatriz (figura 3a). Coloración para Ku80 humano había demostrado el origen humano de este miocardio recién formado (figura 3b). Aumento mayor reveló que estos injertos consistió en miocitos densamente. Función ventricular izquierda fue monitoreada mediante ecocardiografía transtorácica. Una exitosa implantación de EHT se caracteriza por una mejoría en la FEVI, área fraccional acortamiento y una disminución del diámetro telediastólico ventricular izquierdo (figura 4).
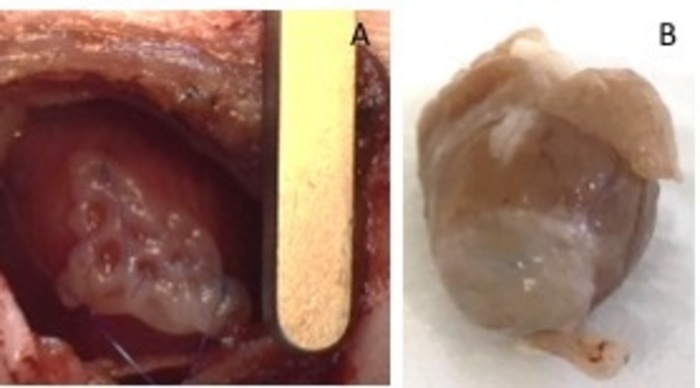
Figura 1: hEHT-parches después de la implantación. Parche (A) inmediatamente después de la implantación. (B) parche cuatro semanas después de la implantación. Haga clic aquí para ver una versión más grande de esta figura.
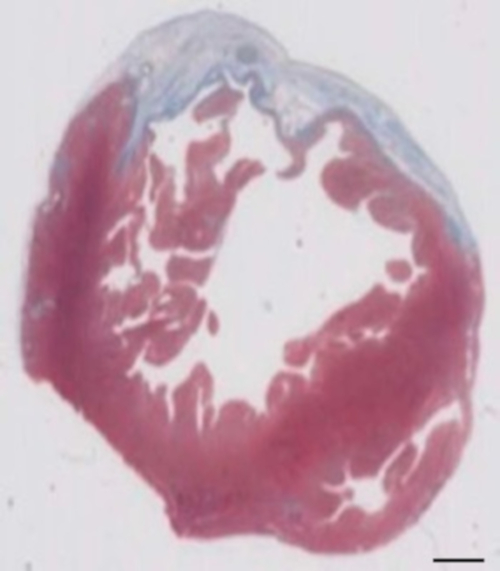
Figura 2: determinación de infarto en Masson de trichrome manchado parafina 28 días después de la criocauterización. El infarto es determinado por el color azul en la tinción tricrómica de Masson, que representa el tejido fibrótico. Barra de escala = 2 mm. haga clic aquí para ver una versión más grande de esta figura.
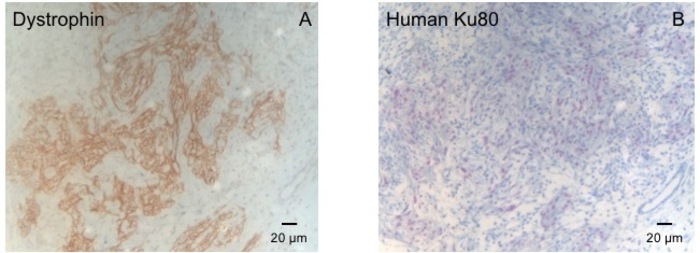
Figura 3: tinción con distrofina y Ku80 humana. (A) Dystrophin coloración muestra músculo grande Islas (marrón) en el área de la cicatriz (B) Ku-manchas de parafina seccionaron corazón. Ku-80 es un anticuerpo específico de humanos. Por lo tanto, las células teñidas positivamente (color marrón) son de origen humano. Haga clic aquí para ver una versión más grande de esta figura.
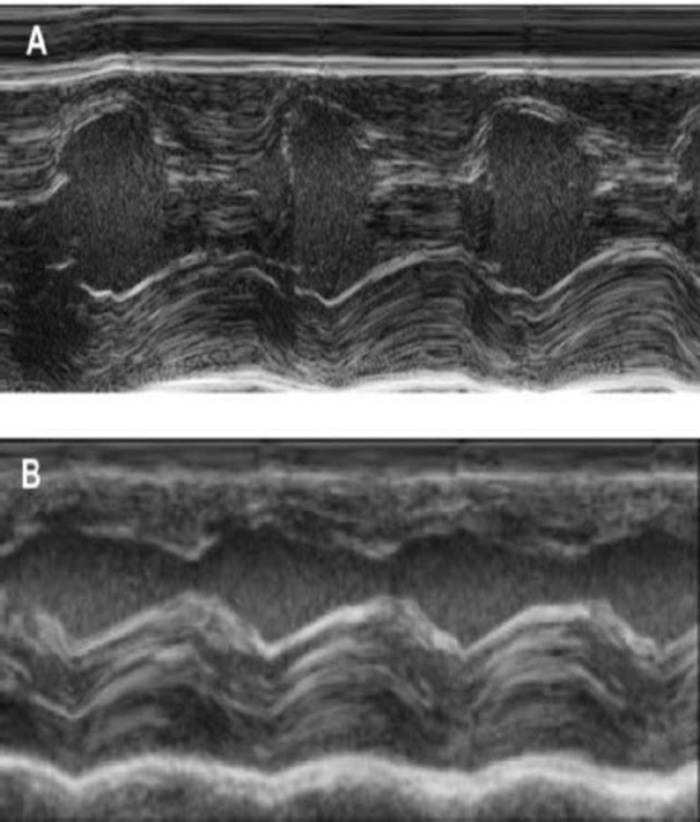
Figura 4: medición del modo M del ventrículo izquierdo mediante ecocardiografía transtorácica. (A) al inicio y (B) una semana después de la criocauterización. (IVS: tabique Intraventricular, LV: ventrículo izquierdo, PW: pared Posterior). Las mediciones se realizan 3 veces. Al inicio, una semana después de cryoinfarction y 4 semanas después de la implantación de la EHT haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Una gran variedad de modelos animales pequeños están disponibles para estudiar el efecto que ejerce el trasplante de células en corazones heridos9,10,11. Elegimos un modelo del conejillo de Indias por todo animal pequeño modelos su (electro) fisiología asemeja más de cerca posible de los seres humanos. Las ventajas de los modelos animales pequeños son vivienda simple, costos manejables y algunas plantillas. En comparación con ratones y ratas, guinea pigs´ cardiaco (electro) fisiología es más similar a los seres humanos. Frecuencia cardiaca es inferior (~250/min), muestra potencial de acción ventricular una fase de meseta y la corriente de potasio Ikr es importante para la repolarización7. Además, el tamaño de los animales facilita las cirugías, que es especialmente importante como una re-toracotomía es necesario una semana después de la inducción de lesiones. Sin embargo, conejillos de Indias son sensibles a la anestesia que requiere cierta experiencia.
Shiba et al., describen el uso de 50 mg/kg ketamina y 2 mg/kg xilacina (i.p.) para anestesiar conejillos de Indias para la criocauterización cardíaca4. También hemos evaluado este regimiento de anestesia. Una de las desventajas es el hecho de que resulta imposible suspender el efecto narcótico de xilacina y ketamina debido a faltar potentes antídotos. Teniendo en cuenta que los conejillos de Indias están en alto riesgo de hipoglucemia durante procedimientos quirúrgicos, decidimos utilizar un gas narcótico, cuyo efecto es fácil de controlar y por lo tanto conduce a una fase de recuperación anestésica muy corto. Una traqueotomía se utiliza para asegurar una ventilación segura durante todo el procedimiento. Una intubación oro-traqueal es técnicamente muy exigente en conejillos de Indias, como la visualización de la apertura de la tráquea es a menudo difícil y no puede garantizarse una intubación segura.
Aunque cryo-lesión induce un daño miocárdico severo no espejo precisamente una enfermedad de arteria coronaria / infarto de miocardio en los seres humanos. En este sentido, la ligadura del joven o incluso un modelo de lesión por isquemia-reperfusión más estrechamente recapitula la fisiopatología humana. Sin embargo, la anatomía coronaria en conejillos de Indias se caracteriza por una extensa colateralización. Por lo tanto, una ligadura de la arteria coronaria descendente anterior izquierda no reproducible produce grandes lesiones miocardio en conejillos de Indias12,13. LAD-ligadura en ratones y ratas conduce a una extensa remodelación y eventualmente adelgazamiento de la pared anterior, una característica que no se ve en los seres humanos en este sentido. El modelo de cryo-lesión de conejillo de Indias induce procesos de remodelación y adelgazamiento de la pared ventricular, pero en una medida, que se parece más a un miocardio lesiones en los seres humanos. Por lo tanto, se eligió un modelo de criocauterización resultando en una lesión del miocardio más confiable13. La mortalidad periprocedimiento es un gran problema con este modelo. Inicialmente, alrededor del 30% de los animales murieron durante la primera operación o dentro de 7 días después de lesión cardíaca. Otro 30% murió durante contabilidad implantación de EHT para una mortalidad global del 60%. Varias modificaciones conducen a una disminución significativa en la mortalidad. Isoflurano induce gran salivación y la secreción bronquial. La atropina reduce la secreción bronquial y era un factor importante para disminuir la mortalidad. El segundo factor que disminuyó fuertemente la mortalidad es el uso de un soldador para liberar el sello metal frío del corazón. Inicialmente se utilizó agua caliente para separar el sello del miocardio. Sin embargo, era difícil sacar el agua de la cavidad torácica. Restante la respiración agua negativamente influenciado y conducen al desarrollo de adherencia que empeoró el pronóstico de animal´s. Otra modificación que influyeron positivamente en el procedimiento era la protección del pulmón izquierdo desde el sello metal frío con una compresa. Después de estas modificaciones fueron implementada mortalidad cayó a 20% para la operación de lesión cardíaca (incluyendo la primera semana postoperatoria) y otro 25% para el trasplante de EHT. Inducción de lesiones cryo representa la operación más fácil técnicamente y resultados se logra después de 5-10 animales han sido operados bajo supervisión. EHT-trasplante es más exigente y se recomiendan unos 20 cirugías bajo supervisión hasta que se obtienen resultados reproducibles.
Al principio, se utilizó solución salina caliente para enjuagar el corazón y, por tanto, separar la sonda de congelado de la pared ventricular izquierda. Este procedimiento es más fácil de manejar, pero siguen siendo unos mililitros de solución salina en el tórax aumenta el riesgo de insuficiencia respiratoria.
En conclusión, el modelo representado conejillo de Indias es reproducible, barato y conduce a resultados consistentes. Ecocardiografía transtorácica ofrece una herramienta factible y no invasivo para evaluar la presencia de lesión cardíaca antes de la operación y se realiza la implantación del injerto.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Ninguno de los autores tiene intereses financieros en competencia u otros conflictos de intereses para declarar.
Acknowledgments
No financiación fue recibida para este estudio
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



