Summary
Aqui nós apresentamos um protocolo para a indução de cryoinjury ventricular esquerdo, seguido da implantação de um patch do músculo cardíaco, derivado de células iPS humana cardiomyocytes em um modelo de cobaia.
Abstract
Devido a capacidade limitada de regeneração do coração em mamíferos adultos, infarto do miocárdio resulta em uma perda irreversível de cardiomyocytes. Esta perda de quantidades relevantes de músculo cardíaco massa pode levar a insuficiência cardíaca. Além do transplante de coração, não há nenhuma opção de tratamento curativo para a insuficiência cardíaca estágio final. Em tempos de escassez de doadores de órgãos, modalidades de tratamento independente de órgãos são necessários. Dispositivos de assistência ventricular esquerda são uma opção de terapia promissora, no entanto, especialmente como terapia de destino, limitada por seus efeitos colaterais como acidente vascular cerebral, infecções e hemorragias. Nos últimos anos, várias estratégias de reparação cardíaca, incluindo a injeção de células-tronco, progenitores cardíacas ou engenharia do tecido do miocárdio têm sido investigadas. Melhorias recentes em biologia celular permitem a diferenciação de grandes quantidades de cardiomyocytes derivadas de células-tronco pluripotentes induzidas humanas (iPSC). Uma das estratégias atualmente sob avaliação cardíaca reparação é transplantar tecido cardíaco artificial. Tecido cardíaco engenharia (EHT) é uma rede tridimensional casos criado in vitro, com propriedades funcionais do tecido do coração nativo. Nós criamos EHT-patches de hiPSC derivado cardiomyocytes. Aqui nós apresentamos um protocolo para a indução de cryoinjury do miocárdio ventricular esquerdo em uma cobaia, seguida de implantação de hiPSC derivado EHT na parede ventricular esquerda.
Introduction
O número de pacientes com insuficiência cardíaca está aumentando na nossa população de envelhecimento. Para insuficiência cardíaca de estágio final, transplante de cardíaco ortotópico é a opção de tratamento curativo apenas. No entanto, especialmente em países europeus, há uma crescente escassez de doadores de órgãos. Portanto, as opções alternativas de tratamento são necessárias. Realizações recentes em suporte circulatório mecânico são promissores, mas, especialmente, a longo prazo corre, limitado por seus efeitos colaterais, como hemorragia, trombose de bomba e complicações infecciosas1.
A capacidade de regeneração endógena do coração humano adulto é extremamente limitada. Portanto, terapias de regeneração cardíaca podem se tornar uma opção alternativa de tratamento para a fase final insuficiência cardíaca pacientes2,3. Diferentes técnicas, incluindo injeção à base de células-tronco célula ou tecido engenharia abordagens têm sido descreveram3,4,5.
Células-tronco pluripotentes induzidas humana (hiPSC), bem como as células-tronco embrionárias humanas (hESC) pode ser efetivamente diferenciada para espontaneamente batendo cardiomyocytes humana6, que tem sido uma grande conquista no campo da regeneração cardíaca terapias.
Para substituir o miocárdio após um infarto do miocárdio e para melhorar a função de um coração fraco, a sobrevivência de um número adequado de cardiomyocytes e suas mecânicas e elétricas de acoplamento com o coração nativo é essencial. Para investigar o potencial de terapias regenerativas cardíacas com iPS humana derivada de célula cardiomyocytes, é necessário um modelo de pesquisa adequada. O modelo ideal deve ser econômico e ter um humano-como fisiologia e Eletrofisiologia. Grandes modelos animais como porcos seria ideais desse ponto de vista, no entanto, essas experiências são muito caras e grandes quantidades de cardiomyocytes seria necessárias substituir um número relevante de cardiomyocytes para ver os efeitos da esquerda ventricular função em um modelo de infarto de porco.
Para responder a questões biológicas elementares para regeneração cardíaca baseada em célula humana, por exemplo, a sobrevivência celular, vascularização e acoplamento elétrico, modelos animais pequenos são mais adequados. Desde os modelos disponíveis de animais pequenos, a cobaia é a espécie mais útil, em comparação com ratos e camundongos, como sua eletrofisiologia mais assemelha-se a situação em seres humanos7. Neste modelo de cobaia, Induzimos uma cryoinjury transmural do ventrículo esquerdo. Uma semana após a indução do infarto do miocárdio da implantação de um tridimensional, espontaneamente, batendo quadris-célula derivada casos remendo foi realizado. Sobrevivência da pilha de casos foi avaliada a 28 dias após o implante por exame histológico.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Os animais receberam atendimento humano em conformidade com o guia para os princípios de animais de laboratório, preparado pelo Instituto de recursos animais de laboratório e publicado pela National Institutes of Health. Todos os protocolos de animais foram aprovados pela autoridade local competente (' Amt für Gesundheit und Verbraucherschutz, Hansestadt Hamburg ' / Animal protocolo # 109/16).
1. obter animais
- Comercialmente obter feminino cobaias pesando 500 – 600 g.
- Colocá-los em condições convencionais em gaiolas animais. Alimente o rato padrão chow e água esterilizada ad libidum.
2. transtorácica ecocardiografia
- Coloque o porco da Guiné em uma câmara de indução e anestesiar o animal com isoflurano (2-3%). Verifique a profundidade da anestesia por falta de resposta para o dedo do pé-pitada.
- Coloque a cobaia anestesiados em uma plataforma de aquecimento (40 a 42 ° C) em posição supina. Continuar a anestesia através de um cone de nariz (isoflurano 1,5-2%)
- Barbear e depilar o tórax de pig´s de Guiné usando um barbeador elétrico pelos.
- Aplica o gel de transdutor de ultrassom escaldadas (~ 25 ° C). Use um sistema de ecocardiografia que está equipado com uma frequência do transdutor superior a 15 MHz.
- Adquira vistas de bidimensional paraesternal eixo longo, colocando o transdutor sobre o tórax de porco guinea´s diante do pescoço direito para a perna esquerda e eixo longo registro imagens de modo-B, no plano da válvula aórtica com uma visualização simultânea do ápice LV. Investiga a função ventricular esquerda pré-operatório.
- Vire o transdutor em graus de 90° para obter uma visão do eixo curto modo-B no nível de meados-papilar.
Nota: O animal é então transferido imediatamente para a mesa de OR. O animal é continuamente anestesiado com isoflurano 3%. 0,05 mg/kg de atropina (i.m.) é injetada para evitar o aumento da secreção brônquico durante a ventilação mecânica.
3. cirurgia
-
Indução de infarto do miocárdio
- Injete carprofeno 4 – 5 mg/kg e a buprenorfina para analgesia 0,05 mg/kg por via subcutânea com uma agulha 21G e uma seringa de 10 mL. 0,5 mg/kg de atropina é injetado por via subcutânea com uma agulha 21G e uma seringa de 10 mL.
- Coloque a cobaia em suas costas e manter a anestesia com uma máscara cobrindo a boca e o nariz. Verifique a profundidade da anestesia por beliscar as patas (falta de reflexo pedal).
- Abra pernas as cobaias e fixar a posição usando a fita.
- Depilar o peito e a região traqueal do animal anestesiado com um barbeador elétrico. Desinfete a área amplamente usando esfoliante à base de iodo, seguido por 80% de etanol. Repita esta etapas de desinfecção duas vezes.
- Realizar uma incisão vertical de 1,5 cm na área traqueal e sem rodeios a dissecar os músculos cobrindo a traqueia até você ver a traqueia. Perfurar a traqueia com cânula i.v. de 18g e inserir a parte flexível da cânula como um tubo endotraqueal.
- Conecte o tubo traqueal para um animal respirador para arejar continuamente a cobaia durante o procedimento.
Nota: Agora mantém-se a anestesia com isoflurano 3% através do tubo traqueal (ventilação com pressão de inspiração máxima, taxa de respiração assistida por inspiração: 100-120/min, pressão de inspiração máxima: 18-22 cm Hg usando PEEP-ventilação enquanto o peito é aberto ). - Identifica o espaço intercostal doth 5 contando os espaços de costela, começando no primeiro espaço intercostal. Realize uma incisão horizontal de 2 cm no 5º espaço intercostal no lado esquerdo da cobaia usando uma tesoura e uma pinça. Inserir um retractor de animais pequeno. Dissecar os músculos com um eletrocautério até se atingirem os músculos intercostais, que pode ser visto após a remoção do tecido subcutâneo, são alcançados.
- Suavemente, disse os músculos intercostais com pinça até atingir o espaço pleural e pode-se ver o pulmão esquerdo na frente. Inserir o retractor entre as costelas e abri-lo com cuidado, até à obtenção de uma boa visão do coração.
- Abra o pericárdio aproximadamente 1 cm na região da parede ventricular esquerda anterior com uma tesoura. Coloque uma compressa no pulmão esquerdo para protegê-lo contra danos quando induzindo o cryoinjury do ventrículo esquerdo.
- Coloca a ponta de uma erosão do carimbo de metal (alumínio) com um diâmetro transversal de 0,5 cm no nitrogênio líquido por 3 min.
- Imprensa o nitrogênio refrigerado a sonda na parede anterior esquerda do coração por 30 s. Então separá-lo do fundo do coração, usando um ferro de solda elétrico (250 ° C), que é colocado dentro do carimbo para aquecê-lo. Repita este procedimento 3 vezes para obter uma lesão do miocárdio transmural. Observe o branqueamento do miocárdio.
- Inflar os pulmões com pressão máxima (apertando o tubo de saída do ventilador para 2 s), para evitar atelectasia do pulmão. Remova o retractor do espaço intercostal.
- Feche as costelas com duas suturas 3-0. Perto da sutura dos músculos sobre as costelas com um 4-0 em execução. Para fechamento da pele use pontos simples de 5-0 sutura.
- Reduza o isoflurano a 1%. Quando o animal está respirando espontaneamente, remover o tubo traqueal e continuar a anestesia com uma máscara (2 – 3% de isoflurano).
- Garantir a ausência de reflexos por beliscar o membro posterior para monitorar suficiente profundidade da anestesia. Em seguida, use um único 8-0 sutura para fechar o local de punção na traqueia. Feche a ferida com três suturas stich simples 4-0.
- Use a buprenorfina (0,05 mg/kg por 12 h) e carprofeno (5 mg/kg por 24 h) para medicação para dor durante os cinco dias seguintes.
-
Implantação de EHT (7 dias após a cryoinjury)
- Coloque o porco da Guiné em uma câmara de indução e anestesiar o animal com isoflurano, cheque a profundidade da anestesia pela falta de resposta para o dedo do pé-pitada.
- Injete carprofeno 4 – 5 mg/kg e buprenorfina 0,05 mg/kg por via subcutânea com uma agulha 21G e uma seringa de 10 mL após a indução da anestesia. Coloque a cobaia em suas costas e manter a anestesia com uma máscara cobrindo a boca e o nariz.
Nota: Suficiência da anestesia deve ser verificada por beliscar as patas. - Pernas de porco da Guiné e fixar a posição usando a fita.
- Execute a preparação pré-cirúrgica, conforme descrito no passo 3.1.4–3.1.6. Realize uma incisão de pele horizontal de 2 cm na área da cicatriz do lado lateral esquerdo, usando uma tesoura e pinça.
- Suavemente, disse as aderências extrapleural usando um eletrocautério. Abra cuidadosamente o espaço pleural com uma tesoura. Inserir um propagador de costela para expor o coração.
- Identifica visualmente a região do infarto por sua cor pálida em comparação com o miocárdio saudável circundante. Coloque o patch de tecido do coração projetado sobre a região de infarto.
- Prenda-o com dois 8-0 suturas em ambos os lados. Certifique-se de fixar o patch na área não-enfartado do coração (Figura 1). Infle os pulmões com pressão, para evitar atelectasia do pulmão. Remova o retractor do espaço intercostal.
- Feche as costelas com duas suturas 3-0. Perto da sutura dos músculos sobre as costelas com um 4-0 em execução. Para fechamento da pele use pontos simples de 5-0 sutura.
- Reduza o isoflurano a 1%. Quando o animal está respirando espontaneamente, remover o tubo traqueal e continuar a anestesia com uma máscara (2 – 3% de isoflurano).
- Garantir a ausência de reflexos por beliscar o membro posterior para monitorar suficiente profundidade da anestesia. Em seguida, use um único 8-0 sutura para fechar o local de punção na traqueia. Feche a ferida com três single stitch suturas de 4-0.
- Use a buprenorfina (0,05 mg/kg por 12 h) e carprofeno (5 mg/kg por 24 h) para medicação para dor durante os cinco dias seguintes.
- Quatro semanas após o implante de EHT executar uma ecocardiografia transtorácica (conforme descrito na etapa 2) para monitorar a função LV ao longo do tempo.
Nota: A função de LV é monitorada antes implantação EHT e 4 semanas após o implante para monitorar a melhora da função cardíaca por implantação EHT - Eutanásia animal qual protocolo IACUC aprovado e explantes cirurgicamente o coração para posterior análise.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Este modelo de cobaia é um modelo adequado para investigar a regeneração cardíaca após implantação de hiPSC derivado EHT-patches. Reproducibly conduz a lesões do miocárdio transmural grande. Tamanho da cicatriz é avaliado pela histologia, quatro semanas após a cryoinjury. Mason de coloração tricromo revela transmural grandes cicatrizes (Figura 2). Tamanho de cicatriz foi semelhante ao longo de um grande número de animais feridos, refletindo um alto grau de reprodutibilidade8. Em média, 25% do miocárdio ventricular esquerdo foi substituído por tecido cicatricial. Distrofina coloração demonstrou grandes enxertos miocárdico que remuscularized parcialmente a cicatriz (Figura 3a). Coloração de Ku80 humana provou a origem humana deste recém-formado miocárdio (Figura 3b). Maior ampliação revelou que esses enxertos consistiam em miócitos densamente. Função ventricular esquerda foi monitorada usando a Ecocardiografia transtorácica. Uma implantação bem sucedida de EHT é caracterizada por uma melhoria na FEVE, área fracionária de encurtamento e uma diminuição no diâmetro final-diástole ventricular esquerda (Figura 4).
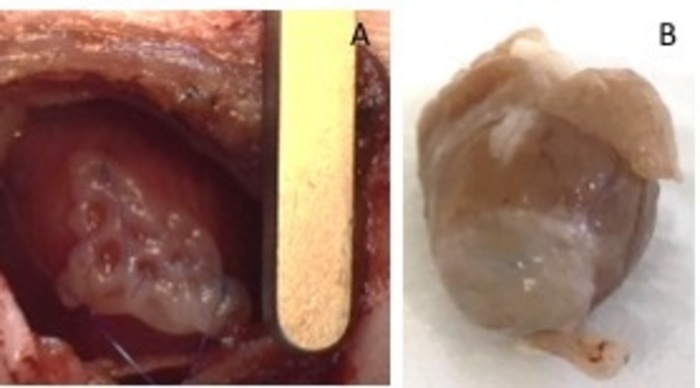
Figura 1: hEHT-patches após implantação. (A) Patch imediatamente após o implante. (B) Patch quatro semanas após o implante. Clique aqui para ver uma versão maior desta figura.
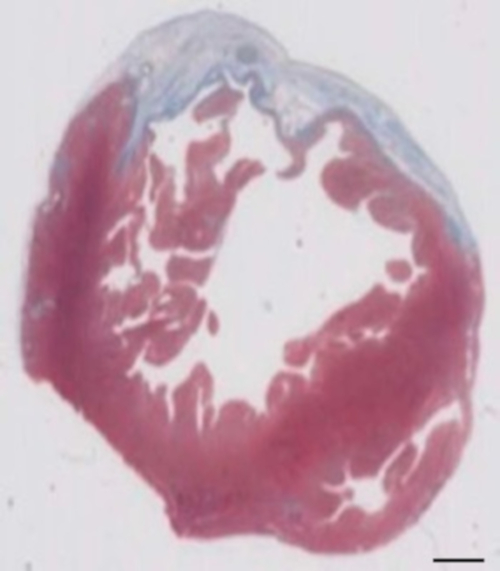
Figura 2: determinação de infarto na Masson corante tricromo de manchado de parafina seção 28 dias após a cryoinjury. O infarto é determinado pela cor azul em coloração tricromo de Masson, representando tecido fibrótico. Barra de escala = 2 mm. clique aqui para ver uma versão maior desta figura.
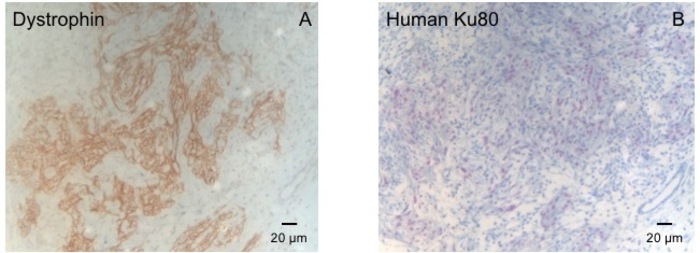
Figura 3: coloração com distrofina e humana Ku80. (A) distrofina coloração mostra músculos grandes ilhas (marrom) na área de cicatriz (B) Ku-mancha de parafina seccionado o coração. Ku-80 é um anticorpo humano específico. Portanto, as células coradas positivamente (cor marrom) são de origem humana. Clique aqui para ver uma versão maior desta figura.
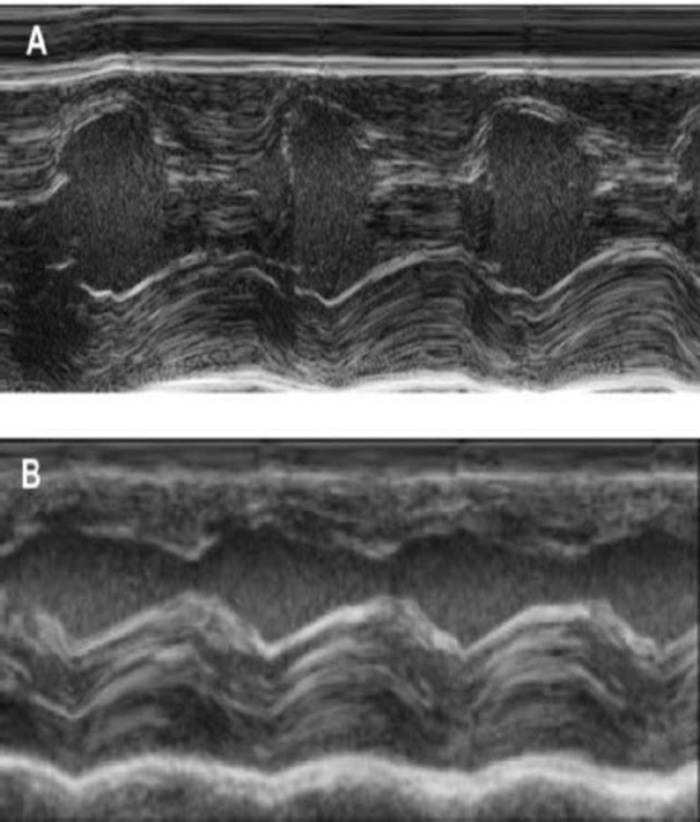
Figura 4: medição de modo M do ventrículo esquerdo usando a Ecocardiografia transtorácica. (A) na linha de base e (B), uma semana após a cryoinjury. (IVS: septo Intraventricular, LV: ventrículo esquerdo, PW: parede Posterior). As medições são realizadas 3 vezes. Na linha de base, 1 semana depois cryoinfarction e 4 semanas após o implante de EHT clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Uma variedade de modelos animais pequenos estão disponíveis para estudar o efeito que o transplante de células exerce em corações feridos9,10,11. Escolhemos um modelo de porquinho da Índia por causa de todos os animais pequenos modelos sua (electro) fisiologia assemelha-se mais perto dos humanos. As vantagens de pequenos modelos animais são simples habitação, custos gerenciáveis e alguns trabalhadores. Em comparação com camundongos e ratos, Guiné pigs´ cardíaco (electro) é mais parecida com os humanos. Em particular a frequência do coração é inferior (~250/min), mostra potenciais de ação ventricular uma fase de platô e o potássio atual eukr é importante para a repolarização7. Além disso, o tamanho maior dos animais facilita a cirurgias, que é especialmente importante como uma re-toracotomia é necessária uma semana após a indução da lesão. No entanto, porquinhos da Índia são sensíveis a anestesia que requerem alguma experiência.
Shiba et al., descreveram o uso de xilazina ketamina e 2 mg/kg 50 mg/kg (i.p.) para anestesiar cobaias para cardíaca cryoinjury4. Nós também avaliamos este Regimento de anestesia. Uma das desvantagens é o fato de que é impossível suspender o efeito narcótico de xilazina e cetamina, devido à falta de potentes antídotos. Considerando que as cobaias são de alto risco de hipoglicemia durante procedimentos cirúrgicos, decidimos utilizar um gás narcótico, cujo efeito é fácil de controlar e, portanto, levando a uma fase de recuperação anestésica muito curto. Uma traqueotomia é usada para garantir uma ventilação segura durante todo o procedimento. Intubação oro-traqueal é tecnicamente muito exigentes em porquinhos da Índia, como a visualização da abertura da traqueia é muitas vezes difícil e uma intubação segura não pode ser garantida.
Embora cryo-lesão induz a uma grave lesão miocárdica faz não precisamente um espelho uma doença arterial coronariana / infarto do miocárdio em seres humanos. A este respeito, a ligadura do rapaz ou até mesmo um modelo de lesões de isquémia-reperfusão mais estreitamente recapitula a fisiopatologia humana. No entanto, a anatomia da artéria coronária em cobaias é caracterizada por uma extensa collateralization. Portanto, uma ligadura da artéria coronária descendente anterior esquerda não reproducibly resulta em grandes lesões do miocárdio em cobaias12,13. RAPAZ-ligadura em ratos e ratos leva a uma extensa remodelação e eventualmente adelgaçamento da parede anterior, uma característica que não é vista em humanos nesta medida. O modelo de cryo-lesão de cobaia induz processos de remodelação e afinamento da parede ventricular, mas até certo ponto, que mais se assemelha do miocárdio lesão nos seres humanos. Portanto, um modelo de cryoinjury, resultando em uma lesão miocárdica mais confiável foi escolhido13. Mortalidade de Periprocedural é um grande problema com este modelo. Inicialmente, cerca de 30% dos animais morreram durante a primeira operação, ou no prazo de 7 dias após a lesão cardíaca. Outros 30% morreu durante a contabilização de implantação EHT de uma mortalidade global de 60%. Várias modificações levam a uma diminuição significativa na mortalidade. Isoflurano induz pesada salivação e secreção brônquica. Atropina reduz a secreção brônquica e foi um fator importante para diminuir a mortalidade. O segundo fator que fortemente diminuído a mortalidade é o uso de um ferro de soldar para liberar o selo metal frio do coração. Água quente foi inicialmente usada para desanexar o carimbo do miocárdio. No entanto, foi difícil de remover a água da cavidade torácica. Restante água influenciada negativamente a respiração e levado ao desenvolvimento de adesão que se agravou o prognóstico animal´s. Outra modificação que influenciaram positivamente o procedimento era a proteção do pulmão esquerdo do carimbo de metal frio com uma compressa. Após essas modificações foram implementada mortalidade caiu para ~ 20% para a operação de lesão cardíaca (incluindo a primeira semana pós-operatória) e mais 25% para transplante EHT. Indução de lesão cryo representa a operação tecnicamente mais fácil e consistentes resultados podem ser obtidos após 5-10 animais tem sido operados sob supervisão. EHT-transplante é mais exigente e cerca de 20 cirurgias sob supervisão são recomendadas até que podem ser obtidos resultados reprodutíveis.
No início, usamos solução salina morna para enxaguar o coração e, portanto, retirar a sonda de congelados da parede ventricular esquerda. Este procedimento é mais fácil de lidar, mas alguns mililitros de solução salina permanecem no tórax aumentando o risco de insuficiência respiratória.
Em conclusão, o modelo de cobaia retratados é reprodutível, barato e leva a resultados consistentes. Ecocardiografia transtorácica oferece uma ferramenta viável e não-invasivo para avaliar a presença de lesão cardíaca antes de re-operação e implantação de enxerto é executada.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Nenhum dos autores tem concorrentes interesses financeiros ou outros conflitos de interesses para declarar.
Acknowledgments
Não há financiamento foi recebido para este estudo
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



