Summary
Her præsenterer vi en protokol til induktion af venstre ventrikel cryoinjury efterfulgt af implantation af en hjertemuskulaturen patch, stammer fra menneskelige iPS-celle cardiomyocytes i et marsvin model.
Abstract
På grund af den begrænsede regenerering kapacitet af hjertet i voksne pattedyr, myokardieinfarkt resulterer i en uoprettelige tab af cardiomyocytes. Dette tab af relevante mængder af hjertemusklen masse kan føre til hjertesvigt. Udover hjertet transplantation er der ingen helbredende behandlingsmulighed for slutstadiet hjertesvigt. I tider med organmangel donor, er orgel uafhængige behandlingsmodaliteter nødvendige. Venstre ventrikel assist enheder er en lovende mulighed for behandling, dog især som destination terapi, begrænset af sine bivirkninger som slagtilfælde, infektioner og blødninger. I de seneste år, er blevet undersøgt flere hjerte reparation strategier herunder stamceller injektion, cardiac ophav eller myokardiets vævsmanipulering. Nylige forbedringer i cellebiologi giver mulighed for differentiering af store mængder af cardiomyocytes stammer fra menneskelige inducerede pluripotente stamceller (iPSC). En af de kardiale reparation strategier i øjeblikket er under evaluering er at transplantation kunstigt hjerte væv. Manipuleret hjerte væv (EHT) er et tre-dimensionelle in vitro-skabt cardiomyocyte netværk, med funktionelle egenskaber af indfødte hjerte væv. Vi har lavet EHT-patches fra hiPSC stammer cardiomyocytes. Her vil vi præsentere en protokol for induktion af venstre ventrikel myokardiets cryoinjury i et marsvin, efterfulgt af implantation af hiPSC afledt EHT på den venstre ventrikel væg.
Introduction
Antallet af patienter med hjertesvigt er stigende i vores aldrende befolkning. For slutstadiet hjertesvigt er orthotopic hjerte transplantation indstillingen kun helbredende behandling. Men især i europæiske lande, der er en stigende donor organmangel. Det er derfor nødvendigt alternative behandlingsmuligheder. De seneste resultater i mekanisk kredsløbssygdomme støtte er lovende, men især på længere sigt køre, begrænset af sine bivirkninger som blødning, pumpe trombose og infektiøse komplikationer1.
Den endogene regenerering kapacitet i den voksne menneskelige hjerte er yderst begrænset. Derfor, cardiac regenerering terapi kan blive en alternativ behandlingsmulighed for slutstadiet hjerteinsufficiens patienter2,3. Forskellige teknikker herunder stamcelle-baseret celle indsprøjtning eller tissue engineering tilgange har været beskrevet3,4,5.
Menneskelige inducerede pluripotente stamceller (hiPSC) samt menneskelige embryonale stamceller (menneskelige stamceller), som kan differentieres effektivt at spontant slå menneskelige cardiomyocytes6, som har været en stor bedrift i feltet af hjertestop regenerativ behandlingsformer.
At erstatte myokardiet efter et myokardieinfarkt og forbedre funktionen af et svigtende hjerte er overlevelse af et passende antal cardiomyocytes og deres mekaniske og elektriske kobling med indfødte hjertet afgørende. For at undersøge potentialet i hjertets regenerative behandlinger med menneskelige iPS celle afledte cardiomyocytes, er en passende forskning model nødvendig. Den ideelle model bør være omkostningseffektive og har en menneske-lignende fysiologi og Elektrofysiologi. Store dyremodeller som svin ville være ideelt fra dette synspunkt, men disse forsøg er meget dyre og store mængder af cardiomyocytes ville være nødvendigt at erstatte et relevant antal cardiomyocytes for at se effekter på venstre ventrikel funktion i en gris infarkt model.
For at besvare elementære biologiske spørgsmål mod menneskelige celle-baserede hjerte regenerering, fx er celle overlevelse, vascularization og elektriske kobling, små dyremodeller mere egnet. Fra de tilgængelige lille dyremodeller er marsvin de mest nyttige arter, sammenlignet med rotter og mus, som deres Elektrofysiologi mere ligner situationen i mennesker7. I denne model, marsvin induceret vi en transmural cryoinjury af venstre ventrikel. En uge efter induktion af myokardieinfarkt implantation af en tredimensionel, blev spontant slå hofter-celle afledte cardiomyocyte patch udført. Cardiomyocyte celle overlevelse blev vurderet 28 dage efter implantation af histologisk undersøgelse.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Dyr modtaget Human pleje i overensstemmelse med Guide for principper af forsøgsdyr, udarbejdet af Institute Laboratory Animal ressourcer og udgivet af National Institutes of Health. Alle dyr protokoller blev godkendt af det ansvarlige lokale myndighed ('' Amt für Gesundheit und Verbraucherschutz, Hansestadt Hamburg'' / Animal protokol # 109/16).
1. få dyr
- Kommercielt få kvindelige marsvin vejer 500 – 600 g.
- Hus dem konventionel betingelser i animalsk bure. Feed standard rotte chow og autoklaveres vand ad libidum.
2. transthoracic ekkokardiografi
- Placer marsvin i en induktion kammer og bedøver dyr med isofluran (2-3%). Kontroller dybden af anæstesi ved manglende respons til tå-knivspids.
- Placer den bedøvede Guinea Gris på en opvarmning platform (40-42 ° C) i en liggende stilling. Fortsætte anæstesi via en næsen kegle (isofluran 1.5-2%)
- Barbering og depilate guinea pig´s thorax ved hjælp af en elektrisk dyrehår shaver.
- Anvende forvarmet (~ 25 ° C) ultralyd transducer gel. Bruge en ekkokardiografi system, der er udstyret med en transducer frekvens højere end 15 MHz.
- Erhverve todimensional parasternal længdeakse visninger ved at placere transduceren guinea´s gris brystkassen vender fra den rigtige hals mod venstre ben og optage længdeakse B-mode billeder på flyet af aortaklappen med en samtidige visualisering af LV apex. Undersøge den præoperativ venstre ventrikulære funktion.
- Slå transduceren ved 90° grader for at opnå en kort akse B-tilstand se på midten af papillære niveau.
Bemærk: Dyret er derefter straks overført til tabellen OR. Dyret er løbende bedøvede med 3% isofluran. 0,05 mg/kg atropin (i.m.) sprøjtes for at undgå øget bronchial sekretion under mekanisk ventilation.
3. kirurgi
-
Induktion af myokardieinfarkt
- Injicere 4 – 5 mg/kg carprofen og 0,05 mg/kg buprenorphin for analgesi subkutant med en 21 G kanyle og en 10 mL sprøjte. 0,5 mg/kg atropin er injiceres subkutant med en 21 G kanyle og en 10 mL sprøjte.
- Placer marsvin på ryggen og holde anæstesi med en ansigtsmaske, der dækker munden og næsen. Check dybden af anæstesi ved at klemme de bagben feet (manglende pedal refleks).
- Sprede forsøgskaniner ben og fastsætte placeringen ved hjælp af tape.
- Barbere brystet og regionen luftrør i de bedøvede dyr med en elektrisk shaver. Desinficere området bredt ved hjælp af jod-baserede scrub, efterfulgt af 80% ethanol. Gentag denne desinfektion trin to gange.
- Udføre en 1,5 cm lodret snit i området luftrør og ligefremt dissekere de muskler, der dækker luftrøret, indtil du ser i luftrøret. Punktere luftrøret med 18 G i.v. kanyle og indsætte den fleksible del af kanylen som en trakeal tube.
- Tilslut den trakeal tube til en animalsk respirator til løbende ventilere marsvin under proceduren.
Bemærk: Nu anæstesi er fastholdt med isofluran 3% via den trakeal tube (inspiration assisteret ventilation med maksimal inspiration pres, åndedræt sats: 100-120/min, peak inspiration pres: 18-22 cm Hg bruger PEEP-ventilation, mens brystet er åben ). - Identificere de 5th interkostale rum ved at tælle de rib rum begynder på den første interkostale rum. Udføre en 2 cm vandret snit på de 5 interkostale rum på venstre side af marsvin ved hjælp af saks og pincet. Indsætte et lille dyr retractor. Dissekere musklerne med en Elektrokauterisation indtil den interkostale muskulatur er nået, som kan ses efter fjernelse af subkutane væv, er nået.
- Forsigtigt dissekere den interkostale muskulatur med pincet, indtil den pleural rummet er nået, og man kan se den venstre lunge i front. Indsæt retractor mellem ribbenene og åben det forsigtigt, indtil der opnås en god udsigt over hjertet.
- Åbn at hjertesækken ca 1 cm i regionen i den forreste venstre ventrikulære væg med en saks. Placer en komprimere på den venstre lunge til at beskytte det mod skader, når overtalelse cryoinjury af venstre ventrikel.
- Placer spidsen af en eroderet metalstempel (aluminium) med en tværsnits diameter på 0,5 cm ind i flydende kvælstof i 3 min.
- Tryk kvælstof afkølet sonde ind på den venstre forreste væg af hjertet for 30 s. Derefter adskille det fra hjertet ved hjælp af en elektrisk loddekolbe (250 ° C), som er placeret inde stempel til at varme det op. Gentag denne procedure 3 gange for at opnå en transmural Myokardie skade. Observere, blegning af myokardiet.
- Puste lungerne med maksimalt pres (ved fastspænding udstrømning røret af ventilator for 2 s), for at undgå atelektase af lungen. Fjerne retractoren fra den interkostale rum.
- Luk ribben med to 3-0 sutur. Tæt muskler over ribben med 4-0 kører sutur. Bruge 5-0 sutur enkelt sting for lukning af huden.
- Reducere isofluran til 1%. Når dyret vejrtrækning spontant, fjerne den trakeal tube og fortsætte anæstesi med en ansigtsmaske (isofluran 2-3%).
- Forsikre manglen reflekser ved at klemme hind lemmer for at overvåge tilstrækkelig dybde af anæstesi. Brug derefter en enkelt 8-0 sutur lukke webstedet punktering på luftrøret. Lukke såret med tre enkelt stich 4-0 sutur.
- Bruge buprenorphin (0,05 mg/kg pr. 12 h) og carprofen (5 mg/kg / 24 h) for smertestillende medicin i de følgende 5 dage.
-
Implantation af EHT (7 dage efter cryoinjury)
- Placer marsvin i en induktion kammer og bedøver dyr med isofluran Check dybden af anæstesi af manglen reaktion til tå-knivspids.
- Injicere 4 – 5 mg/kg carprofen og 0,05 mg/kg buprenorphin subkutant med en 21 G kanyle og en 10 mL sprøjte efter induktion af anæstesi. Placer marsvin på ryggen og holde anæstesi med en ansigtsmaske, der dækker munden og næsen.
Bemærk: Tilstrækkeligheden af anæstesi skal kontrolleres ved at klemme de bagben feet. - Sprede guinea pig's ben og fastsætte placeringen ved hjælp af tape.
- Udføre de pre kirurgisk præparater, som beskrevet i trin 3.1.4–3.1.6. Udføre en 2 cm vandret hud indsnit i området ar i venstre lateral side ved hjælp af saks og pincet.
- Forsigtigt dissekere de extrapleural sammenvoksninger ved hjælp af en Elektrokauterisation. Forsigtigt åbne pleural rummet med en saks. Indsæt en rib sprederen at eksponere hjertet.
- Visuelt identificere regionen i infarkt ved sin blege farve i forhold til den sunde omkringliggende myokardiet. Placer manipuleret hjerte væv patch over regionen infarkt.
- Fastgør det med to 8-0 suturer på begge sider. Sørg for at sikre lappe i den ikke-infarcted område af hjertet (figur 1). Puste lungerne med pres, for at undgå atelektase af lungen. Fjerne retractoren fra den interkostale rum.
- Luk ribben med to 3-0 sutur. Tæt muskler over ribben med 4-0 kører sutur. Bruge 5-0 sutur enkelt sting for lukning af huden.
- Reducere isofluran til 1%. Når dyret vejrtrækning spontant, fjerne den trakeal tube og fortsætte anæstesi med en ansigtsmaske (isofluran 2-3%).
- Forsikre manglen reflekser ved at klemme hind lemmer for at overvåge tilstrækkelig dybde af anæstesi. Brug derefter en enkelt 8-0 sutur lukke webstedet punktering på luftrøret. Lukke såret med tre single sy 4-0 sutur.
- Bruge buprenorphin (0,05 mg/kg pr. 12 h) og carprofen (5 mg/kg / 24 h) for smertestillende medicin i de følgende 5 dage.
- Fire uger efter EHT implantation udføre en transthoracic ekkokardiografi (som beskrevet i trin 2) for at overvåge LV funktion over tid.
Bemærk: Funktionen LV er overvåget før EHT implantation og 4 uger efter implantation overvåge for forbedring af hjertefunktion af EHT implantation - Aflive dyret som IACUC godkendt protokollen og kirurgisk explant hjerte for yderligere analyse.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Denne marsvin model er en velegnet model til at undersøge hjertets regenerering efter implantation af hiPSC afledt EHT-programrettelser. Reproducerbar medfører store transmural Myokardie skader. Scar størrelse vurderes ved histologi fire uger efter cryoinjury. Mason trichrome farvning afslører store transmural ar (figur 2). Scar størrelse var lignende over et stort antal sårede dyr, hvilket afspejler en høj grad af reproducerbarhed8. I gennemsnit blev 25% af den venstre ventrikulære myokardiet erstattet af arvæv. Dystrofin farvning påvist store Myokardie grafts, der delvist remuscularized ar (figur 3a). Farvning for menneskelige Ku80 viste sig at være den menneskelige oprindelsen af denne nydannede myokardiet (figur 3b). Højere forstørrelse viste, at disse grafts bestod af tætpakkede myocytes. Venstre ventrikel funktion var overvåges ved hjælp af transthoracic ekkokardiografi. En vellykket EHT implantation er karakteriseret ved en forbedring af LVEF, fraktioneret område afkortning og et fald i venstre ventrikel ende-diastolisk diameter (figur 4).
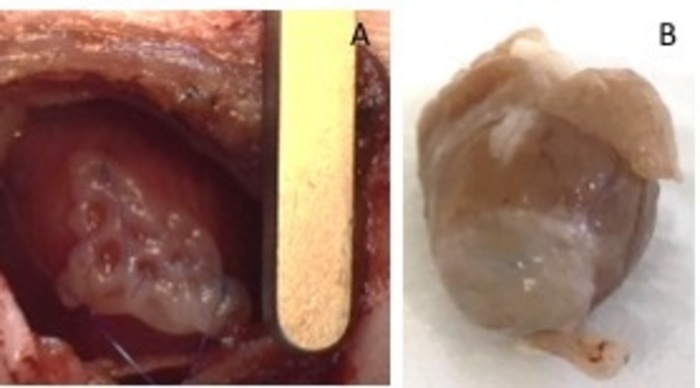
Figur 1: hEHT-programrettelser efter implantation. (A) Patch umiddelbart efter implantation. (B) Patch fire uger efter implantation. Venligst klik her for at se en større version af dette tal.
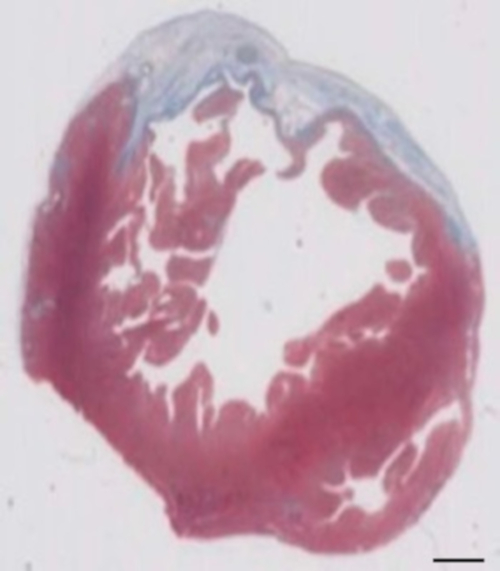
Figur 2: bestemmelse af myokardieinfarkt på Masson's trichrome farves paraffin afsnit 28 dage efter cryoinjury. Infarkt bestemmes af den blå farve i Masson's trichrome farvning, der repræsenterer fibrotisk væv. Skalalinjen = 2 mm. venligst klik her for at se en større version af dette tal.
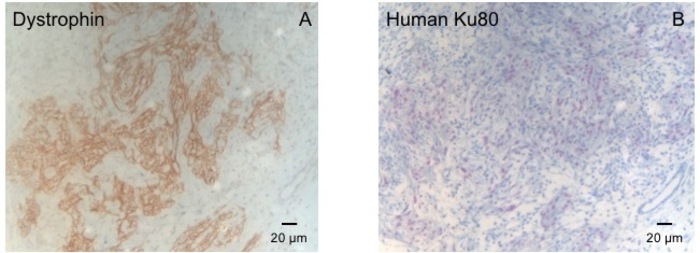
Figur 3: farvning med dystrofin og menneskelige Ku80. (A) dystrofin farvning viser store muskel øer (brun) i området ar (B) Ku-farvning af paraffin sectioned hjerte. KU-80 er et menneske-specifikke antistof. Derfor, de positivt farvede celler (brun farve) er af menneskelig oprindelse. Venligst klik her for at se en større version af dette tal.
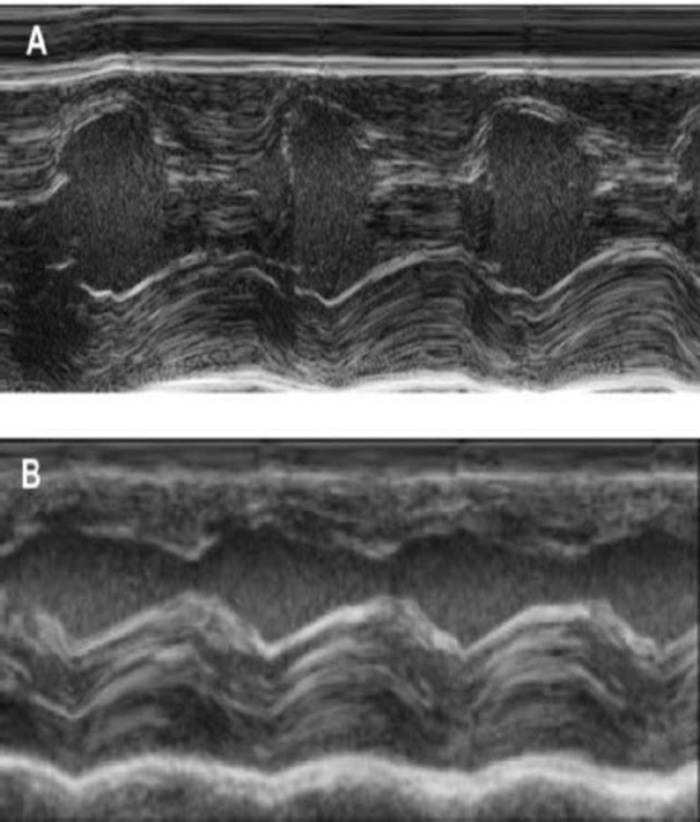
Figur 4: M-tilstand måling af venstre ventrikel ved hjælp af transthoracic ekkokardiografi. (A) ved baseline og (B) en uge efter cryoinjury. (IVS: intraventrikulært septum, LV: venstre hjertekammer, PW: Posterior væg). Målingerne udføres 3 gange. Ved baseline, 1 uge efter cryoinfarction og 4 uger efter EHT implantation venligst klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
En række små dyremodeller er tilgængelige til at studere den effekt, at celle transplantation udøver sårede hjerter9,10,11. Vi valgte et marsvin model på grund af alle små dyr modeller sin (electro) fysiologi minder mest om mennesker. Fordelene ved små dyremodeller er enkle boliger, håndterbar omkostninger og få arbejdsstyrker. Sammenlignet med mus og rotter er guinea pigs´ hjerte (electro) fysiologi mere ligner mennesker. Især hjerte frekvens er lavere (~250/min), ventrikulær handling potentielle viser en plateau fase og kalium nuværende jegkr er vigtigt for repolarisering7. Desuden, den større størrelse af dyrene letter operationer, som er især vigtigt som et re-torakotomi er kræves en uge efter induktion af skade. Marsvin er imidlertid følsom over for anæstesi kræver nogle erfaringer.
Shiba et al., beskrives brugen af 50 mg/kg ketamin og 2 mg/kg xylazin (i.p.) til bedøver forsøgskaniner for hjerte cryoinjury4. Vi har også vurderet denne anæstesi regiment. En af ulemperne er, at det er umuligt at suspendere den narkotiske effekt af xylazin og ketamin på grund af manglende potent modgift. I betragtning af at marsvin er i høj risiko for hypoglykæmi under kirurgiske procedurer, besluttede vi at bruge et narkotiske gas, hvis effekt er let at kontrol og derfor fører til en meget kort bedøvelsesmiddel opvågningsfasen. En tracheotomi bruges til at sikre en sikker ventilation under hele proceduren. En oro-trakeal intubation er teknisk meget krævende i marsvin, som visualisering af åbningen af luftrøret er ofte vanskelige og en sikker intubation kan ikke garanteres.
Selvom cryo-skade inducerer en alvorlig Myokardie skade det ikke netop spejle en koronararteriesygdom / myokardieinfarkt hos mennesker. I denne henseende sammenfatter ligatur af drengen eller endda en iskæmi-reperfusion skade model mere nøje den human patofysiologi. Dog er koronararterie anatomi i guinea-svin karakteriseret af en omfattende collateralization. Derfor, en ligatur af den venstre forreste faldende koronararterie ikke reproducerbar resulterer i store Myokardie skader i marsvin12,13. Lund-ligatur i mus og rotter fører til en omfattende ombygning og i sidste ende udtynding af den forreste væg, en egenskab, som ikke er set hos mennesker i dette omfang. Guinea-gris cryo-skade model inducerer remodeling processer og udtynding af den ventrikulære væg, men i et omfang, der mere ligner en Myokardie skade ses hos mennesker. Derfor var en cryoinjury model resulterer i en mere pålidelig Myokardie skade valgt13. Periprocedural dødelighed er et stort problem med denne model. I første omgang, omkring 30% af dyr, der døde under den første operation eller inden for 7 dage efter hjerte skade. En anden 30% døde under EHT implantation tegner sig for en samlet dødelighed på 60%. Flere ændringer fører til et signifikant fald i dødeligheden. Isofluran inducerer tunge savlen og bronchial sekretion. Atropin reducerer bronchial sekretion og blev en vigtig faktor til at sænke dødeligheden. Den anden faktor, der stærkt reduceret dødelighed er brug af en loddekolbe til at frigive den kolde metal stempel fra hjertet. Varmt vand blev oprindeligt brugt til at frigøre stempel fra myokardiet. Men det var svært at fjerne vandet fra brysthulen. Resterende vand negativt påvirket respiration og føre til udviklingen af friktion, der forværredes animal´s prognose. En anden ændring, der positivt påvirket af proceduren var beskyttelse af den venstre lunge fra det kolde metal stempel med en komprimere. Efter disse ændringer var gennemført dødelighed faldt til ~ 20% for handlingen hjerte skade (herunder den første postoperative uge) og en anden 25% for EHT transplantation. Induktion af cryo skade repræsenterer teknisk lettere drift og ensartede resultater kan opnås efter 5-10 dyr har været drevet under tilsyn. EHT-transplantation er mere krævende og ca. 20 operationer under tilsyn anbefales indtil reproducerbare resultater kan opnås.
I begyndelsen brugte vi varmt saltvand til skyl hjertet og, derfor, løsne frosne sonden fra den venstre ventrikel væg. Denne procedure er nemmere at håndtere, men et par milliliter af saltvand forbliver i brystkassen øger risiko for respiratorisk svigt.
Afslutningsvis den afbillede marsvin model er reproducerbare, billig og fører til ensartede resultater. Transthoracic ekkokardiografi tilbyder en realistisk og ikke-invasive værktøj for at vurdere tilstedeværelsen af hjerte skade før fornyet operation og graft-implantation udføres.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Ingen af forfatterne har konkurrerende finansielle interesser eller andre interessekonflikter at erklære.
Acknowledgments
Ingen midler blev modtaget for denne undersøgelse
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



