Summary
Hier presenteren we een protocol voor de inductie van links ventriculaire cryoinjury gevolgd door de inplanting van een patch van de hartspier, afgeleid van menselijke iPS-cel cardiomyocytes in een cavia-model.
Abstract
Als gevolg van de beperkte regeneratiecapaciteit van het hart in volwassen zoogdieren, myocardinfarct leidt tot een onomkeerbaar verlies van cardiomyocytes. Dit verlies van relevante hoeveelheden hartspier massa kan leiden tot het hartfalen. Naast hart transplantatie is er geen curatieve behandelingsoptie voor de eind-fase hartfalen. In tijden van organ donor tekort, zijn orgel onafhankelijke behandelmodaliteiten nodig. Links-ventriculaire assist apparaten zijn echter een veelbelovende therapie optie, vooral als bestemming therapie, beperkt door de bijwerkingen zoals beroerte, infecties en bloedingen. In de afgelopen jaren zijn verschillende cardiale reparatie strategieën met inbegrip van de injectie van stamcel, cardiale progenitoren of myocardiale weefselengineering onderzocht. Recente verbeteringen in de celbiologie toestaan voor de differentiatie van grote hoeveelheden van cardiomyocytes afgeleid van menselijke geïnduceerde pluripotente stamcellen (iPSC). Een van de strategieën van de cardiale reparatie momenteel onder evaluatie wordt kunstmatige hartweefsel transplantatie. Gemanipuleerde hartweefsel (EHT) is een driedimensionale in vitro gemaakte cardiomyocyte netwerk, met functionele eigenschappen van inheemse hartweefsel. We hebben EHT-patches gemaakt uit hiPSC afgeleid cardiomyocytes. Hier presenteren we een protocol voor de inductie van links ventriculaire myocardiale cryoinjury in een cavia, gevolgd door innesteling van hiPSC afgeleid EHT op de linker ventriculaire muur.
Introduction
Het aantal patiënten met hartfalen groeit in onze vergrijzende bevolking. Voor eind-fase hartfalen is orthotopic hart transplantatie de optie alleen curatieve behandeling. Met name in Europese landen is er echter een toenemende organ donor tekort. Alternatieve behandelingsopties zijn daarom noodzakelijk. Recente prestaties in mechanische bloedsomloop ondersteuning zijn veelbelovend, maar vooral op de lange termijn uitgevoerd, beperkt door de bijwerkingen zoals bloedingen, trombose van de pomp en infectieuze complicaties1.
De endogene regeneratiecapaciteit van de volwassen menselijke hart is zeer beperkt. Daarom zou kunnen cardiale regeneratie therapie worden een alternatieve behandelingsoptie voor einde-fase hartfalen patiënten2,3. Verschillende technieken met inbegrip van de injectie van stamcel gebaseerde cel of tissue engineering benaderingen geweest beschreven3,4,5.
Menselijke geïnduceerde pluripotente stamcellen (hiPSC), evenals menselijke embryonale stamcellen (hESC) kunnen effectief worden gedifferentieerd naar spontaan verslaan menselijke cardiomyocytes6, dat is een mijlpaal op het gebied van regeneratieve cardiale therapieën.
Ter vervanging van myocard na een myocardinfarct en ter verbetering van de functie van een falende hart, is voortbestaan van een geschikt aantal cardiomyocytes en hun mechanische en elektrische koppeling met het eigen hart essentieel. Om te onderzoeken van het potentieel van cardiale regeneratieve therapie met menselijke iPS cel afgeleid cardiomyocytes, is een onderzoeksmodel geschikt nodig. Het ideale model moet kosteneffectief zijn en hebben een mens-achtig fysiologie en electrofysiologie. Grote diermodellen als varkens zou ideaal vanuit dat oogpunt, echter die experimenten zijn erg duur en grote hoeveelheden van cardiomyocytes zou nodig zijn ter vervanging van een relevant aantal cardiomyocytes om te zien van de effecten aan de linkerkant ventriculaire functie in een varken infarct model.
Elementaire biologische om vragen te beantwoorden naar menselijke cel-gebaseerde cardiale regeneratie, bijv zijn overleving van de cel, vascularisatie en elektrische koppeling, kleine dierlijke modellen meer geschikt. Uit de beschikbare kleine dierlijke modellen is de cavia de meest nuttige soort, ten opzichte van ratten en muizen, zoals hun electrofysiologie meer veel overeenkomsten vertoont met de situatie in mensen7. In dit model cavia geïnduceerde we een Transmurale cryoinjury van het linkerventrikel. Een week na inductie myocardiaal infarct innesteling van een drie-dimensionale, spontaan verslaan afgeleid van heupen-cel cardiomyocyte de patch werd uitgevoerd. De overleving van de cel van cardiomyocyte werd 28 dagen na implantatie geëvalueerd door histopathologisch onderzoek.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Dieren ontvangen van humane zorg met inachtneming van de gids voor de beginselen van de proefdieren, opgesteld door het Instituut van laboratorium dierlijke hulpbronnen en gepubliceerd door de National Institutes of Health. Alle dierlijke protocollen werden goedgekeurd door de verantwoordelijke lokale autoriteit ('' Amt für Gesundheit und Verbraucherschutz, Hansestadt Hamburg'' Animal protocol # 109/16).
1. verkrijgen van dieren
- Commercieel verkrijgen vrouwelijke cavia's met een gewicht van 500-600 g.
- Huis hen onder conventionele voorwaarden in dierlijke kooien. Feed standaard rat chow en gesteriliseerde met autoclaaf water ad libidum.
2. transthoracic echocardiografie
- Plaats de cavia in een zaal van de inductie en anesthetize van het dier met Isofluraan (2-3%). Controleer of de diepte van de verdoving door gebrek aan respons op de teen-snuifje.
- Plaats de narcose cavia op een opwarming van de aarde platform (40-42 ° C) in een liggende positie. Blijven verdoving via een neus kegel (Isofluraan 1.5-2%)
- Scheren en ontharen van de Guinese pig´s thorax met behulp van een elektrische dierlijk haar scheerapparaat.
- Toepassing voorverwarmde (~ 25 ° C) echografie transducer gel. Gebruik een echocardiografie-systeem dat is uitgerust met een transducer frequentie hoger is dan 15 MHz.
- Tweedimensionale parasternal lengteas uitzicht door het plaatsen van de transducer op de guinea´s varken thorax geconfronteerd met vanaf de juiste nek naar het linkerbeen en record lange as B-modus beelden op het vlak van de aortaklep met een gelijktijdige visualisatie van de apex van de LV te verwerven. Onderzoeken van de pre-operatieve links-ventriculaire functie.
- Draai de transducer 90° graden om een beeld van de korte as B-modus op de mid-papillaire niveau te krijgen.
Opmerking: Het dier wordt dan onmiddellijk overgebracht naar de OR-tabel. Het dier is continu met 3% Isofluraan verdoofd. 0,05 mg/kg atropine (i.m.) wordt geïnjecteerd om te voorkomen dat verhoogde bronchiale secretie tijdens beademing.
3. operatie
-
Inductie van myocardinfarct
- Injecteren subcutaan 4 – 5 mg/kg carprofen en 0,05 mg/kg buprenorfine voor analgesie met een naald 21 G en een 10 mL spuit. 0,5 mg/kg Atropine wordt subcutaan geïnjecteerd met een naald 21 G en een 10 mL spuit.
- Plaats de cavia op zijn rug en anesthesie met een gelaatsmasker voor mond en neus houden. Controleer de diepte van de verdoving door te knijpen de achtervoeten (gebrek pedaal reflex).
- Verspreid de cavia's benen en monteren van de positie met behulp van tape.
- De borst en de tracheale regio van de narcose dier scheren met een scheerapparaat. Desinfecteer het gebied algemeen gebruik van jodium gebaseerde scrub, gevolgd door 80% ethanol. Herhaal deze stappen van desinfectie tweemaal.
- Het uitvoeren van een verticale incisie van 1,5 cm in de trachea gebied en bot ontleden de spieren die betrekking hebben op de luchtpijp totdat u in de luchtpijp ziet. Punctie van de luchtpijp met 18 G i.v. canule en het flexibele gedeelte van de canule als een tracheale buis invoegen.
- De tracheale buis verbinden met een dierlijke gasmasker te ventileren voortdurend de cavia tijdens de procedure.
Opmerking: Nu de verdoving wordt gehandhaafd met Isofluraan 3% via de trachea buis (inspiratie bijgestaan ventilatie met maximale inspiratie druk, ademhalingsfrequentie: 100-120/min, piek inspiratie druk: 18-22 cm Hg met PEEP-ventilatie, terwijl de borst geopend is ). - Het identificeren van de 5th intercostale ruimte door het tellen van de ruimten van de rib beginnen bij de eerste intercostale ruimte. Het uitvoeren van een horizontale snede van 2 cm op de 5de intercostale ruimte aan de linkerzijde van de cavia met schaar en een pincet. Plaats een kleine dierlijke oprolmechanisme. Ontleden van de spieren met een elektrocauterisatie totdat de intercostale spieren zijn bereikt, die na het verwijderen van het subcutane weefsel, kunnen worden gezien zijn bereikt.
- Ontleden de intercostale spieren voorzichtig met een pincet totdat de pleurale ruimte is bereikt en de linker long vooraan men kan. Invoegen van het oprolmechanisme tussen de ribben en open het zorgvuldig, totdat een goede weergave van het hart wordt verkregen.
- Open het hartzakje ongeveer 1 cm in de regio van de voorste linker ventriculaire muur met een schaar. Plaats een kompres op de linker long te beschermen tegen schade als de cryoinjury van het linkerventrikel inducerende.
- Plaats het puntje van een geërodeerde metalen stempel (aluminium) met een transversale diameter van 0,5 cm in vloeibare stikstof gedurende 3 minuten.
- Druk op de stikstof gekoeld sonde op de linker anterior wand van het hart voor 30 s. Het weer worden gescheiden van het hart met een elektrische soldeerbout (250 ° C) die binnen de stempel geplaatst is aan het opwarmen. Herhaal deze procedure 3 keer te verkrijgen van een Transmurale myocardiale blessure. Observeer het Blancheren van het myocardium.
- Opblazen van de longen met maximale druk (door de buis van de uitstroom van de ventilator voor 2 klemmen s), om te voorkomen dat atelectase van de longen. Verwijder het oprolmechanisme uit de intercostale ruimte.
- Sluit de ribben met twee 3-0 hechtingen. Dicht de spieren over de ribben met een 4-0 met hechtdraad. Gebruik 5-0 hechtdraad enkele steken voor sluiting van de huid.
- Verklein de Isofluraan naar 1%. Wanneer het dier spontaan ademt, verwijdert u de tracheale buis en verder verdoving met een gelaatsmasker (Isofluraan 2-3%).
- De afwezigheid van reflexen verzekeren door knijpen de hind-limb als u wilt controleren op voldoende diepte van de verdoving. Gebruik vervolgens een honkslag 8-0 Sutuur (geologie) om te sluiten van de website van de lekke band op de luchtpijp. Sluit de wond met drie enkele stich 4-0 hechtingen.
- Het gebruik van buprenorfine (0,05 mg/kg per 12 h) en carprofen (5 mg/kg per 24 h) voor pijn medicatie voor de volgende 5 dagen.
-
Implantatie van EHT (7 dagen na cryoinjury)
- Plaats de cavia in een zaal van de inductie en anesthetize van het dier met Isofluraan Check de diepte van de verdoving door het ontbreken van een reactie op de teen-snuifje.
- Injecteren 4 – 5 mg/kg carprofen en 0,05 mg/kg buprenorfine subcutaan met een naald 21 G en een 10 mL spuit na de inductie van de anesthesie. Plaats de cavia op zijn rug en anesthesie met een gelaatsmasker voor mond en neus houden.
Opmerking: Toereikendheid van de verdoving moet worden gecontroleerd door het knijpen van de achtervoeten. - Verspreid de cavia benen en monteren van de positie met behulp van tape.
- Voert de vooraf chirurgische voorbereidingen zoals beschreven in stap 3.1.4–3.1.6. Het uitvoeren van een horizontale huid incisie van 2 cm op het litteken-gebied van de laterale linkerzijde met schaar en pincet.
- Zachtjes ontleden de Verklevingen van de extrapleural met behulp van een elektrocauterisatie. Voorzichtig open de pleurale ruimte met een schaar. Plaats een rib strooier om het hart bloot te stellen.
- Visueel definiëren de regio van het infarct door haar bleke kleur in vergelijking met het gezonde omringende myocardium. Plaats de patch weefsel gemanipuleerde hart over de regio infarct.
- Veilig met twee 8-0 hechtingen aan beide zijden. Zorg ervoor dat het beveiligen van de patch op het niet-infarcted gebied van het hart (Figuur 1). Opblazen van de longen met druk, om te voorkomen dat atelectase van de longen. Verwijder het oprolmechanisme uit de intercostale ruimte.
- Sluit de ribben met twee 3-0 hechtingen. Dicht de spieren over de ribben met een 4-0 met hechtdraad. Gebruik 5-0 hechtdraad enkele steken voor sluiting van de huid.
- Verklein de Isofluraan naar 1%. Wanneer het dier spontaan ademt, verwijdert u de tracheale buis en verder verdoving met een gelaatsmasker (Isofluraan 2-3%).
- De afwezigheid van reflexen verzekeren door knijpen de hind-limb als u wilt controleren op voldoende diepte van de verdoving. Gebruik vervolgens een honkslag 8-0 Sutuur (geologie) om te sluiten van de website van de lekke band op de luchtpijp. Sluit de wond met drie single steek 4-0 hechtingen.
- Het gebruik van buprenorfine (0,05 mg/kg per 12 h) en carprofen (5 mg/kg per 24 h) voor pijn medicatie voor de volgende 5 dagen.
- Vier weken na implantatie van EHT uitvoeren een transthoracic echocardiografie (zoals beschreven in stap 2) om te controleren van LV functie na verloop van tijd.
Opmerking: De LV-functie wordt gecontroleerd voordat EHT implantatie en 4 weken na implantatie te controleren voor verbetering van de hartfunctie door EHT implantatie - Euthanaseren van het dier welk protocol IACUC goedgekeurd en operatief explant het hart voor verdere analyse.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Deze cavia-model is een geschikt model te onderzoeken van cardiale regeneratie na implantatie van hiPSC afgeleid EHT-patches. Het leidt reproducibly tot grote Transmurale myocardiale verwondingen. De grootte van het litteken wordt geëvalueerd door histologie vier weken na de cryoinjury. Mason trichrome kleuring blijkt grote Transmurale littekens (Figuur 2). Litteken grootte was gelijk over een groot aantal gewonde dieren als gevolg van een hoge graad van reproduceerbaarheid8. Gemiddeld werd 25% van het linker ventriculaire myocardium vervangen door littekenweefsel. Dystrofine kleuring aangetoond grote myocardiale protheses die gedeeltelijk remuscularized het litteken (Figuur 3a). Kleuring voor menselijke Ku80 bleek de menselijke oorsprong van deze nieuw gevormde myocard (Figuur 3b). Hogere vergroting bleek dat deze protheses bestond uit dicht opeen gepakte myocytes. Linker ventriculaire functie werd gecontroleerd met behulp van transthoracic echocardiografie. Een succesvolle EHT implantatie wordt gekenmerkt door een verbetering van LVEF, fractionele gedeelte te verkorten en een afname van de linker ventriculaire einde-diastolische diameter (Figuur 4).
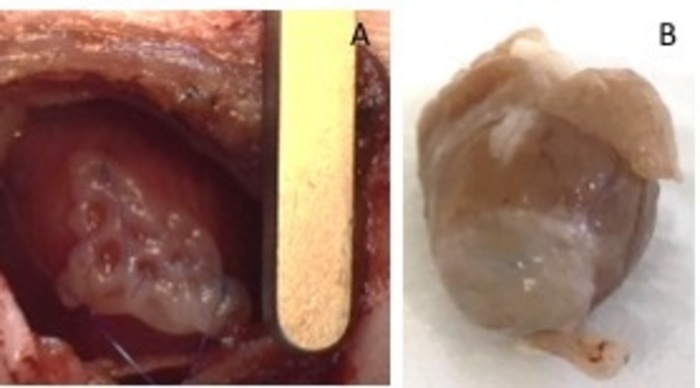
Figuur 1: hEHT-patches na implantatie. (A) de Patch onmiddellijk na implantatie. (B) Patch vier weken na implantatie. Klik hier voor een grotere versie van dit cijfer.
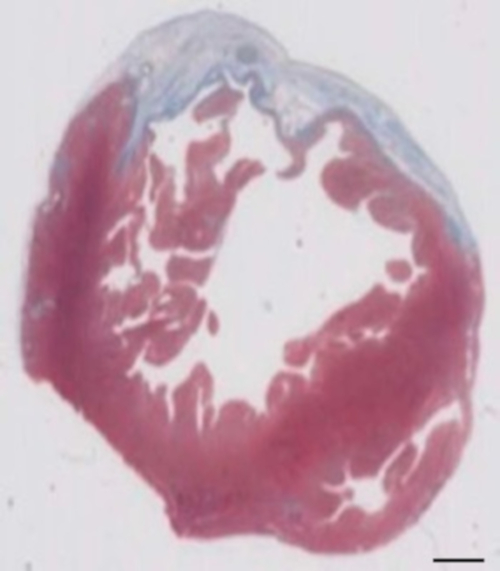
Figuur 2: bepaling van infarct op Masson de trichrome gekleurd paraffine sectie 28 dagen na cryoinjury. Het infarct wordt bepaald door de blauwe kleur in de Masson trichrome kleuring, vertegenwoordigen fibrotische weefsel. Schaal bar = 2 mm. Klik hier voor een grotere versie van dit cijfer.
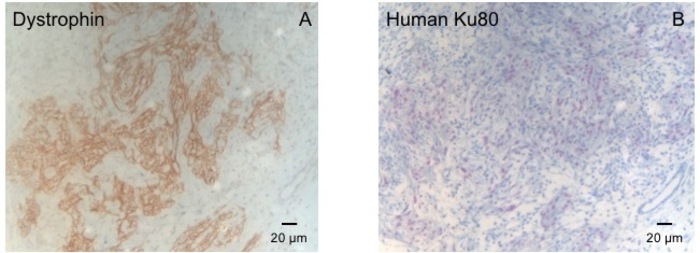
Figuur 3: kleuring met Dystrofine en menselijke Ku80. (A) Dystrofine kleuring toont grote spier eilanden (bruin) op het litteken-gebied (B) Ku-kleuring van paraffine gesegmenteerd hart. Ku-80 is een mens-specifieke antilichaam. Daarom zijn de positief gekleurde cellen (bruine kleur) van menselijke oorsprong. Klik hier voor een grotere versie van dit cijfer.
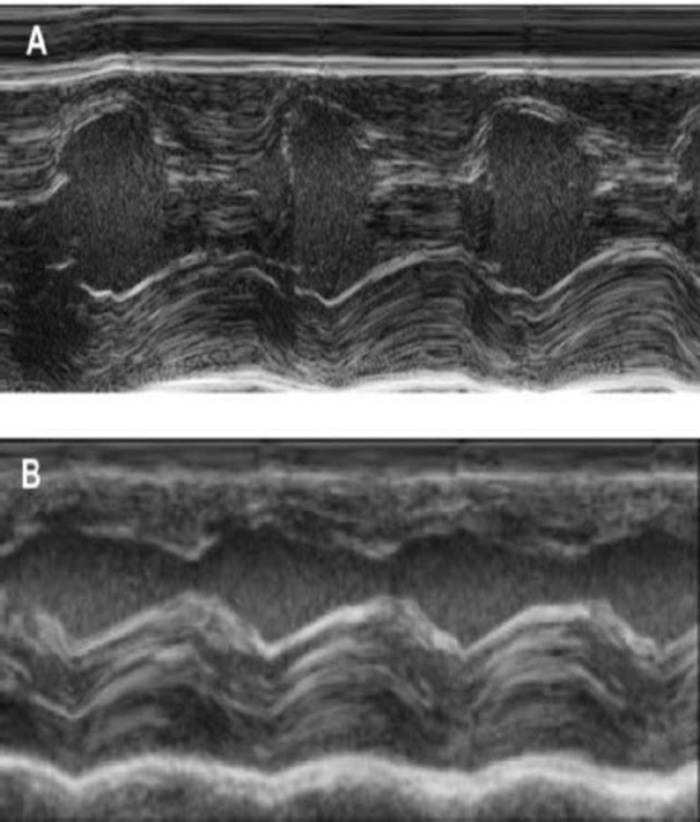
Figuur 4: M-Mode meting van de linker ventrikel met behulp van transthoracic echocardiografie. (A) op basislijn en (B) een week na de cryoinjury. (IVS: Intraventricular septum, LV: linkerventrikel, PW: Posterior muur). De metingen zijn verricht 3 keer. Op de basislijn, 1 week na cryoinfarction en 4 weken na implantatie van EHT Klik hier voor een grotere versie van dit cijfer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Allerlei kleine dierlijke modellen zijn beschikbaar voor de studie van het effect dat cel transplantatie op gewonde harten9,10,11 oefent. We kozen voor een cavia model vanwege alle klein dier modellen zijn (electro) fysiologie lijkt meest nauw die van de mens. De voordelen van kleine dierlijke modellen zijn eenvoudige behuizing, beheersbare kosten en weinig arbeidskrachten. In vergelijking met muizen en ratten is Guinee pigs´ cardiale (electro) fysiologie meer vergelijkbaar met mensen. Met name hart frequentie is lager (~250/min), ventriculaire actie potentiële shows a plateau fase en het huidige kalium ikkr is belangrijk voor de repolarisatie7. Bovendien vergemakkelijkt de grotere omvang van de dieren chirurgie, die is zeer belangrijk omdat een re-Thoracotomie vereist een week na de inductie van letsel is. Cavia's zijn echter gevoelig voor anesthesie vereist enige ervaring.
Shiba et al., beschreef het gebruik van 50 mg/kg ketamine en 2 mg/kg xylazine (i.p.) te anesthetize cavia's voor cardiale cryoinjury4. We hebben ook deze verdoving regiment geëvalueerd. Een van de nadelen is het feit dat het onmogelijk is te schorten het verdovende effect van xylazine en ketamine als gevolg van ontbrekende potente antidota. Gezien het feit dat cavia's met een hoog risico van hypoglykemie tijdens chirurgische ingrepen, besloten hebben we om een verdovend gas waarvan het effect is gemakkelijk te controle en dus leidt tot een zeer korte verdoving herstelfase te gebruiken. Een tracheotomie wordt gebruikt om te zorgen voor een veilige ventilatie tijdens de gehele procedure. Een oro-tracheale intubatie is technisch zeer veeleisende in cavia's, zoals de visualisatie van de opening van de luchtpijp vaak moeilijk is en een veilige intubatie kan niet worden gegarandeerd.
Hoewel cryo-blessure een ernstige myocardiale blessure induceert het doet niet precies een mirror van een coronaire hartziekte / myocardinfarct bij de mens. In dit opzicht recapituleert de afbinding van de LAD of zelfs een ischemie-reperfusie letsel model meer nauw de menselijke pathofysiologie. De anatomie van de kransslagader in cavia's wordt echter gekenmerkt door een uitgebreide zekerheidsstelling. Daarom resulteert een Afbinding van de linker anterior aflopende coronaire reproducibly niet in grote myocardiale verwondingen in cavia's12,13. LAD-afbinding in muizen en ratten leidt tot een uitgebreide verbouwing en uiteindelijk dunner worden van de voorste muur, een kenmerk dat niet bij de mens in deze mate wordt gezien. De cavia cryo-blessure model induceert remodelleert processen en dunner worden van de ventriculaire muur, maar tot op zekere hoogte, dat nauwer lijkt op een myocardiale letsel gezien bij de mens. Daarom werd een cryoinjury model, wat resulteert in een meer betrouwbare myocardiale letsel13gekozen. Periprocedural sterfte is een groot probleem met dit model. Aanvankelijk, ongeveer 30% van de dieren stierf tijdens de eerste operatie of binnen 7 dagen na cardiale letsel. Nog eens 30% stierf tijdens EHT implantatie accounting voor een totale sterfte van 60%. Verschillende wijzigingen leiden tot een aanzienlijke afname van de mortaliteit. Isofluraan induceert zware speekselvloed en bronchiale secretie. Atropine vermindert bronchiale secretie en was een belangrijke factor om te verminderen van sterfte. De tweede factor die zwaar de sterfte daalde is het gebruik van een soldeerbout om vrij van de koude metalen stempel uit het hart. Warm water werd aanvankelijk gebruikt om het loskoppelen van de stempel van het myocardium. Het was echter moeilijk te verwijderen van het water van de borstholte. Resterende water negatief beïnvloed ademhaling en leiden tot de ontwikkeling van hechting dat nog verergerd de prognose van de animal´s. Een andere wijziging die positief beïnvloed de procedure was de bescherming van de linker long van de koude metalen stempel met een kompres. Nadat deze wijzigingen geïmplementeerd sterfte gedaald tot ~ 20% voor de werking van de cardiale schade zijn (met inbegrip van de eerste postoperatieve week) en nog eens 25%, voor transplantatie van het EHT. Inductie van cryo letsel vertegenwoordigt de technisch makkelijker werking en consistente resultaten kunnen worden bereikt na 5-10 dieren hebben geopereerd onder toezicht. EHT-transplantatie is veeleisender en ongeveer 20 operaties onder toezicht worden aanbevolen tot reproduceerbare resultaten kunnen worden verkregen.
In het begin gebruikten we warme zoutoplossing te spoelen van het hart en, derhalve, het loskoppelen van de bevroren sonde van de linker ventriculaire muur. Deze procedure is makkelijker te hanteren maar een paar milliliter zoutoplossing blijven in de thorax, waardoor het risico van respiratoire insufficiëntie.
Kortom, de afgebeelde cavia model is reproduceerbaar, goedkope en leidt tot consistente resultaten. Transthoracic echocardiografie biedt een haalbaar en niet-invasieve instrument om te evalueren van de aanwezigheid van cardiale schade voordat opnieuw werking en graft-implantatie wordt uitgevoerd.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Geen van de auteurs heeft concurrerende financiële belangen of andere belangenconflicten te verklaren.
Acknowledgments
Voor deze studie werd geen financiering ontvangen
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



