Summary
Hier präsentieren wir ein Protokoll für die Induktion der linken Herzkammer Cryoinjury gefolgt von der Implantation eines Herzmuskels Patches, Menschliche iPS-Zellen Herzzellen in einem Meerschweinchen-Modell abgeleitet.
Abstract
Aufgrund der begrenzten Regenerationsvermögen des Herzens bei Erwachsenen Säugetieren führt Myokardinfarkt in einem irreversiblen Verlust der Herzmuskelzellen. Dieser Verlust der entsprechenden Beträge des Herzmuskels Masse zu Herzinsuffizienz führen kann. Neben Herztransplantation gibt es keine kurative Behandlungsoption für die terminaler Herzinsuffizienz. In Zeiten der Spender Organmangel sind unabhängige Behandlungsmodalitäten Orgel erforderlich. Links-ventrikuläre Assist Geräte sind eine vielversprechende Therapieoption, jedoch vor allem als Reiseziel Therapie, begrenzt durch seine Nebenwirkungen wie Schlaganfall, Infektionen und Blutungen. In den letzten Jahren wurden mehrere kardiale Reparaturstrategien einschließlich Stammzell-Injektion, kardiale Stammväter oder myokardiale Gewebetechnik untersucht. Jüngste Verbesserungen in der Zellbiologie erlauben die Unterscheidung von großen Mengen von Herzzellen von menschlichen induzierten pluripotenten Stammzellen (iPSC) abgeleitet. Die kardiale Reparaturstrategien derzeit unter Auswertung gehört, künstliches Herzgewebe zu verpflanzen. Veränderter Herzgewebe (EHT) ist ein dreidimensionales in vitro erzeugten Cardiomyocyte-Netzwerk mit funktionellen Eigenschaften des nativen Herzgewebe. Wir haben EHT-Patches aus HiPSC abgeleitet Kardiomyozyten geschaffen. Hier präsentieren wir ein Protokoll für die Induktion der linken ventricular myokardiale Cryoinjury in ein Meerschweinchen, gefolgt von Implantation von HiPSC EHT auf die linke Ventrikelwand abgeleitet.
Introduction
In unserer alternden Bevölkerung steigt die Zahl der Patienten mit Herzinsuffizienz. Für terminaler Herzinsuffizienz ist orthotopen Herztransplantation die nur kurative Behandlungsmöglichkeit. Vor allem in europäischen Ländern ist jedoch eine zunehmende Organmangel Spender. Deshalb sind alternative Behandlungsmöglichkeiten notwendig. Jüngste Erfolge in mechanischen Kreislaufunterstützung sind vielversprechend, aber vor allem langfristig laufen, begrenzt durch seine Nebenwirkungen wie Blutungen, Thrombose der Pumpe und infektiösen Komplikationen1.
Das endogene Regenerationsvermögen des Erwachsenen menschlichen Herzens ist äußerst begrenzt. Kardialen Regeneration Therapien könnte daher eine alternative Behandlungsmöglichkeit für terminaler Herzinsuffizienz Patienten2,3geworden. Verschiedene Techniken, einschließlich stammzellbasierte Zelle Injektion oder Tissue engineering Ansätze wurden beschrieben,3,4,5.
Menschlichen induzierten pluripotenten Stammzellen (HiPSC), als auch menschliche embryonale Stammzellen (hESC) kann effektiv differenziert werden, um spontan gegen menschliche Kardiomyozyten6, das bisher eine Errungenschaft im Bereich der kardialen regenerativen Therapien.
Herzmuskel nach einem Herzinfarkt zu ersetzen und die Funktion einer Herzinsuffizienz zu verbessern, ist Überleben eine geeignete Anzahl von Kardiomyozyten und mechanische und elektrische Kopplung mit dem nativen Herzen unerlässlich. Um das Potenzial der kardialen regenerative Therapien mit menschlichen IPS-Zellen abgeleitet Kardiomyozyten zu untersuchen, braucht man einen geeigneten Forschungsmodell. Das ideale Modell sollte kostengünstig sein und haben eine menschenähnliche Physiologie und Elektrophysiologie. Großen Tiermodellen wie Schweine ideal unter diesem Gesichtspunkt wäre jedoch diese Experimente sind sehr teuer und große Mengen von Kardiomyozyten müsste eine relevante Anzahl von Kardiomyozyten zu ersetzen, um die Auswirkungen auf die linke Herzkammer zu sehen Funktion in einem Schwein Infarkt Modell.
Um elementare biologische Fragen menschlichen Zell-basierte kardialen Regeneration zu beantworten, sind z. B. Zelle überleben, Vaskularisierung und elektrischen Kopplung kleiner Tiermodelle besser geeignet. Aus den verfügbaren kleiner Tiermodelle ist das Meerschweinchen die nützlichsten Arten, verglichen mit Ratten und Mäusen, wie ihre Elektrophysiologie mehr die Situation im Menschen7 ähnelt. In diesem Modell Meerschweinchen induzierte wir eine Transmural Cryoinjury des linken Ventrikels. Eine Woche nach Induktion der Myokardinfarkt Implantation einer dreidimensionalen, wurde spontan schlagen Hüften-Zelle abgeleitet Cardiomyocyte Patch durchgeführt. Cardiomyocyte Zelle Überleben war 28 Tage nach der Implantation durch eine histologische Untersuchung ausgewertet.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tiere erhalten humane Pflege in Einklang mit dem Leitfaden für die Prinzipien der Versuchstiere, vorbereitet durch das Labor Tier Ressourcen Instituts und veröffentlicht von der National Institutes of Health. Alle tierischen Protokolle wurden von der zuständigen örtlichen Behörde genehmigt ('' Amt Für Gesundheit Und Verbraucherschutz, Hansestadt Hamburg'' / Tier Protokoll # 109/16).
1. besorgen Sie Tiere
- Im Handel erhalten Sie weibliche Meerschweinchen mit einem Gewicht von 500-600 g.
- Beherbergen sie unter herkömmlichen Bedingungen in Tierkäfigen. Füttern Sie standard Ratte Chow und autoklaviert Wasser Ad Libidum.
(2) transthorakalen Echokardiographie
- Setzen Sie das Meerschweinchen in einer Induktion Kammer und betäuben Sie das Tier mit Isofluran (2 – 3 %). Prüfen Sie die Tiefe der Narkose durch fehlende Reaktion auf die Zehe-Prise.
- Platzieren Sie den narkotisierten Meerschweinchen auf einer Erwärmung Plattform (40 – 42 ° C) in Rückenlage. Weiter Anästhesie über eine Nase Kegel (Isofluran 1,5-2 %)
- Rasieren und Guinea Pig´s Thorax mit einen elektrischen Tierhaare Rasierer enthaaren.
- Vorgewärmte (~ 25 ° C) Ultraschall-Wandler Gel auftragen. Verwenden Sie eine Echokardiographie-System, die ausgestattet ist mit einem Wandler Frequenz höher als 15 MHz.
- Zweidimensionale Parasternal lange Achse Ansichten zu erwerben, indem Sie den Schallkopf auf dem Guinea´s Schwein Thorax mit Blick vom richtigen Hals in Richtung linkes Bein und Rekord lange Achse B-Mode-Bilder auf der Ebene der Aortenklappe mit einer gleichzeitigen Visualisierung des LV-Apex. Die präoperative links-ventrikulären Funktion zu untersuchen.
- Drehen Sie den Schallkopf von 90° Grad zur Ebene der Mitte papillären eine kurze Achse B-Modus zu erhalten.
Hinweis: Das Tier wird dann sofort auf den OP-Tisch übertragen. Das Tier wird kontinuierlich mit 3 % Isofluran betäubt. 0,05 mg/kg Atropin (i.m.) wird eingespritzt, um erhöhte bronchiale Sekretion bei der mechanischen Beatmung zu vermeiden.
(3) Chirurgie
-
Induktion von Myokardinfarkt
- Injizieren Sie 4 – 5 mg/kg Carprofen und 0,05 mg/kg Buprenorphin für Analgesie mit einer Nadel 21 G und eine 10 mL Spritze subkutan. Atropin 0,5 mg/kg wird mit einer Nadel 21 G und eine 10 mL Spritze subkutan injiziert.
- Legen Sie das Meerschweinchen auf den Rücken und halten Sie Anästhesie mit einer Gesichtsmaske, die über Mund und Nase zu. Prüfen Sie die Tiefe der Narkose durch Kneifen die Hinterfüße (mangelnde Pedal Reflex).
- Die Meerschweinchen Beine breit und die Position mit Klebeband fixieren.
- Die Brust und die trachealen Region narkotisierten Tier mit einen elektrischen Rasierer zu rasieren. Desinfizieren Sie den Bereich allgemein mit Jod-basierte Peeling, gefolgt von 80 % Ethanol. Wiederholen Sie diese Desinfektion Schritte zweimal.
- Führen Sie einen vertikalen Schnitt 1,5 cm im Bereich trachealen und unverblümt sezieren Sie die Muskeln, die die Luftröhre abdeckt, bis Sie die Luftröhre sehen. Punktion der Trachea mit 18 G i.v. Kanüle und setzen Sie den flexiblen Teil der Kanüle als trachealen Rohr.
- Schließen Sie die Trachealkanüle Schlauch an ein Tier Atemgerät, das Meerschweinchen kontinuierlich während des Verfahrens zu lüften.
Hinweis: Jetzt die Narkose mit Isofluran 3 % über den trachealen Schlauch beibehalten wird (Inspiration assistierte Beatmung mit maximale Inspiration Druck, Atemfrequenz: 100 – 120/min, Spitzendruck Inspiration: 18-22 cm Hg mit PEEP-Beatmung, während die Brust geöffnet ist ). - Identifizieren Sie die 5th Intercostalneuralgie Raum durch die Rippe Räume, beginnend mit dem ersten Intercostalneuralgie Leerzeichen zählen. Führen Sie einen horizontalen Schnitt 2 cm auf den 5. Intercostalneuralgie Raum auf der linken Seite des Meerschweinchens mit Schere und eine Pinzette. Legen Sie ein kleines Tier Aufrollvorrichtung. Sezieren die Muskeln mit einem Elektrokauter, bis die Zwischenrippenmuskeln erreicht werden, die gesehen werden kann, nach Entfernung des subkutanen Gewebes erreicht werden.
- Sezieren Sie sanft die Zwischenrippenmuskeln mit einer Pinzette, bis der Pleuraraum erreicht ist und man sieht die linke Lunge vor. Legen Sie die Aufrollvorrichtung zwischen den Rippen und öffnen Sie es vorsichtig, bis man ein guter Blick auf das Herz erhält.
- Öffnen Sie das Perikard ca. 1 cm in der Region des vorderen linken Ventrikelwand mit einer Schere. Legen Sie eine Kompresse auf die linke Lunge um es vor Beschädigungen zu schützen, wenn die Cryoinjury des linken Ventrikels zu induzieren.
- Legen Sie die Spitze des einen erodierten Metall Stempel (Aluminium) mit einem Querschnitt Durchmesser von 0,5 cm in flüssigem Stickstoff für 3 min.
- Drücken Sie den Stickstoff gekühlt Sonde auf der linken vorderen Wand des Herzens für 30 s. Dann trennen Sie ihn von Herzen mit einer elektrischen Lötkolben (250 ° C) erteilte innerhalb der Stempel um es aufzuwärmen. Wiederholen Sie diesen Vorgang 3-Mal um eine Transmural-Myokard-Schädigung zu erhalten. Das Blanchieren der Herzmuskel zu beobachten.
- Die Lungen mit einem maximalen Druck aufpumpen (klemmend Abfluss Rohr des Ventilators für 2 s), Atelektase der Lunge zu vermeiden. Entfernen Sie die Aufrollvorrichtung aus der Intercostalneuralgie Raum.
- Schließen Sie die Rippen mit zwei 3-0 Nahtmaterial. Naht schließen die Muskeln über die Rippen mit einem 4: 0 ausgeführt. Verwenden Sie für die Schließung der Haut 5-0 Nahtmaterial Einzelstiche.
- Die Isofluran auf 1 % reduzieren. Wenn das Tier spontan atmet, die trachealen Rohr zu entfernen, und weiter Anästhesie mit einer Gesichtsmaske (Isofluran 2 – 3 %).
- Sichern Sie das Fehlen von Reflexen durch Kneifen die Hind Gliedmaßen um ausreichende Tiefe der Narkose überwachen. Verwenden Sie dann eine einzelne 8-0 Naht, die Punktionsstelle in der Luftröhre zu schließen. Schließen Sie die Wunde mit drei einzelnen Stich 4-0 Nahtmaterial.
- Verwenden Sie Buprenorphin (0,05 mg/kg / 12 h) und Carprofen (5 mg/kg / 24 h) für Schmerzmittel für die kommenden 5 Tage.
-
Implantation von EHT (7 Tage nach Cryoinjury)
- Setzen Sie das Meerschweinchen in einer Induktion Kammer und betäuben Sie das Tier mit Isofluran Check die Tiefe der Narkose durch den Mangel an Reaktion auf die Zehe-Prise.
- Spritzen Sie 4 – 5 mg/kg Carprofen und Buprenorphin 0,05 mg/kg subkutan mit einer Nadel 21 G und eine 10 mL Spritze nach Induktion der Anästhesie. Legen Sie das Meerschweinchen auf den Rücken und halten Sie Anästhesie mit einer Gesichtsmaske, die über Mund und Nase zu.
Hinweis: Angemessenheit der Narkose sollte überprüft werden, durch Kneifen die Hinterfüße. - Das Meerschweinchen Beine breit und die Position mit Klebeband fixieren.
- Führen Sie die präoperative Vorbereitung, wie in Schritt 3.1.4–3.1.6 beschrieben. Führen Sie eine horizontale Hautinzision 2 cm im Narbenbereich der linken seitlichen mit Schere und Pinzette.
- Sezieren Sie sanft die Extrapleural Verwachsungen mit einem Elektrokauter. Öffnen Sie vorsichtig den Pleuraraum mit einer Schere. Legen Sie eine Rippe Streuer, die das Herz aussetzen.
- Identifizieren Sie visuell den Infarkt und Umgebung durch seine helle Farbe im Vergleich zu umliegenden gesunden Myokard. Platzieren Sie das technische Herz Gewebe Pflaster über der Infarkt-Region.
- Sichern Sie es mit zwei 8-0 Nähte auf beiden Seiten. Sichern Sie sich den Patch im Bereich des Herzens (Abbildung 1) nicht nach. Aufblasen der Lunge mit Druck, Atelektase der Lunge zu vermeiden. Entfernen Sie die Aufrollvorrichtung aus der Intercostalneuralgie Raum.
- Schließen Sie die Rippen mit zwei 3-0 Nahtmaterial. Naht schließen die Muskeln über die Rippen mit einem 4: 0 ausgeführt. Verwenden Sie für die Schließung der Haut 5-0 Nahtmaterial Einzelstiche.
- Die Isofluran auf 1 % reduzieren. Wenn das Tier spontan atmet, die trachealen Rohr zu entfernen, und weiter Anästhesie mit einer Gesichtsmaske (Isofluran 2 – 3 %).
- Sichern Sie das Fehlen von Reflexen durch Kneifen die Hind Gliedmaßen um ausreichende Tiefe der Narkose überwachen. Verwenden Sie dann eine einzelne 8-0 Naht, die Punktionsstelle in der Luftröhre zu schließen. Nähe der Wunde mit drei einzelnen Nähen 4-0 Nahtmaterial.
- Verwenden Sie Buprenorphin (0,05 mg/kg / 12 h) und Carprofen (5 mg/kg / 24 h) für Schmerzmittel für die kommenden 5 Tage.
- Vier Wochen nach der Implantation EHT durchführen einer transthorakalen Echokardiographie (wie in Schritt 2 beschrieben) um die LV-Funktion im Laufe der Zeit zu überwachen.
Hinweis: Die LV-Funktion wird vor der Implantation EHT und 4 Wochen nach der Implantation, zur Verbesserung der Herzfunktion zu überwachen durch EHT Implantation überwacht. - Einschläfern des Tieres welches Protokoll IACUC genehmigt und chirurgisch explant Herzen zur weiteren Analyse.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Dieses Meerschweinchen-Modell ist ein geeignetes Modell zur kardialen Regeneration zu untersuchen, nach Implantation von HiPSC EHT-Patches abgeleitet. Es führt reproduzierbar zu großen Transmural myokardialen Verletzungen. Größe der Narbe wird von Histologie vier Wochen nach Cryoinjury bewertet. Mason trichrome Färbung zeigt große Transmural Narben (Abbildung 2). Größe der Narbe war über eine große Anzahl von verletzten Tieren spiegelt ein hohes Maß an Reproduzierbarkeit8ähnlich. Im Durchschnitt wurde 25 % von der linken Herzkammer Myokard durch Narbengewebe ersetzt. Dystrophin Färbung zeigte große myokardialen Transplantate, die teilweise die Narbe (Abbildung 3a) remuscularized. Färbung für menschliche Ku80 erwies sich als die menschlichen Ursprungs dieser neu gegründeten Myokard (Abb. 3 b). Höherer Vergrößerung ergab, dass diese Transplantate aus dicht gepackten Myozyten bestand. Linke ventricular Funktion wurde mit der transthorakalen Echokardiographie überwacht. Eine erfolgreiche Implantation EHT zeichnet sich durch eine Verbesserung der LVEF, gebrochene Bereich verkürzen und eine Abnahme der linken ventricular End-diastolischen Durchmesser (Abbildung 4).
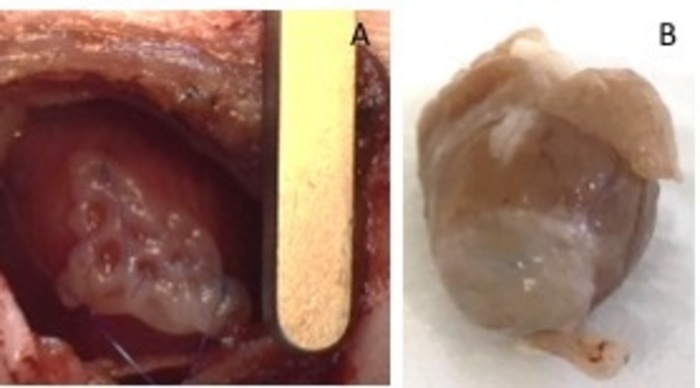
Abbildung 1: hEHT-Patches nach der Implantation. (A) Patch sofort nach der Implantation. (B) Patch vier Wochen nach der Implantation. Bitte klicken Sie hier für eine größere Version dieser Figur.
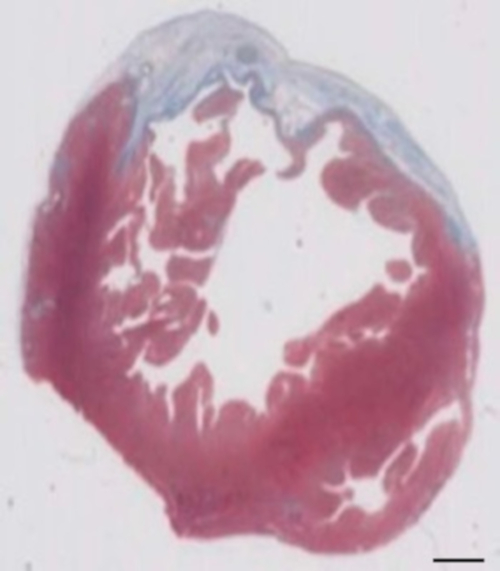
Abbildung 2: Ermittlung der Infarkt auf Masson ist trichrome gebeizt Paraffin Abschnitt 28 Tage nach Cryoinjury. Die Infarktbildung richtet sich nach der blauen Farbe in Masson trichrome Färbung, fibrotische Gewebe darstellt. Maßstabsleiste = 2 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
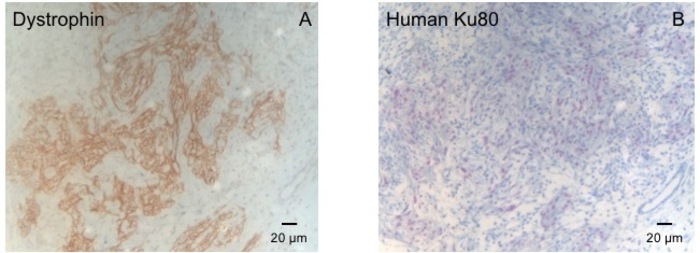
Abbildung 3: Färbung mit Dystrophin und menschlichen Ku80. (A) Dystrophin Färbung zeigt große Muskel Inseln (braun) in den Narbenbereich (B) Ku-Färbung des Paraffins Herz geschnitten. Ku-80 ist ein Mensch-spezifische Antikörper. Daher sind die positiv gefärbten Zellen (braune Farbe) von menschlichen Ursprungs. Bitte klicken Sie hier für eine größere Version dieser Figur.
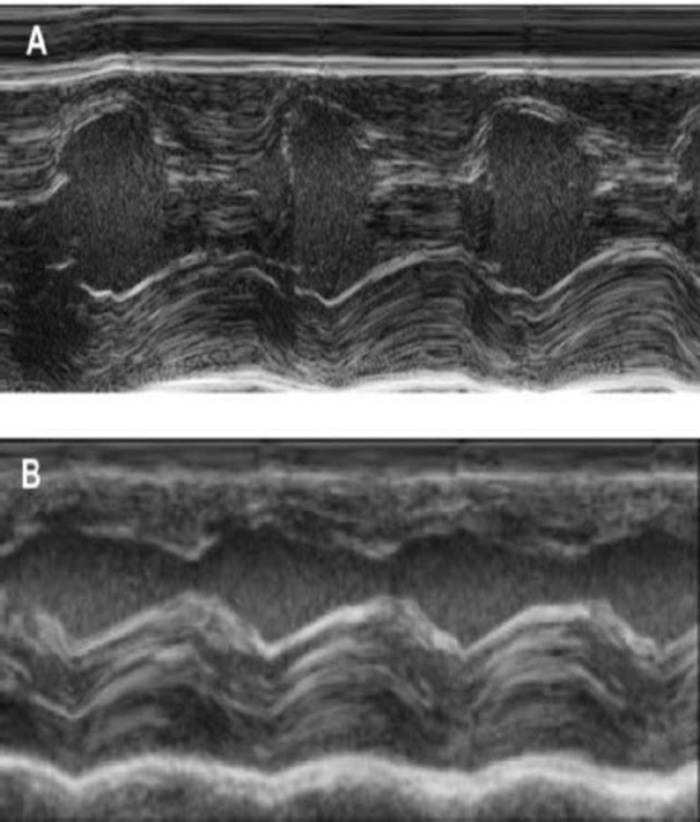
Abbildung 4: M-Modus Messung des linken Ventrikels mit der transthorakalen Echokardiographie. (A) bei Baseline und (B) eine Woche nach Cryoinjury. (IVS: intraventrikulären Septum, LV: linke Herzkammer, PW: hintere Wand). Messungen sind 3 Mal durchgeführt. Bei Studienbeginn, 1 Woche nach Cryoinfarction und 4 Wochen nach der Implantation EHT Klicken Sie bitte hier, um eine größere Version dieser Figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Eine Vielzahl kleiner Tiermodelle stehen zur Verfügung, um die Wirkung zu untersuchen, die Zelltransplantation verletzten Herzen9,10,11ausübt. Wir entschieden uns für ein Meerschweinchen Modell wegen alle Kleintiere Modelle seiner (Elektro) Physiologie ähnelt am meisten der Menschen. Die Vorteile kleiner Tiermodelle sind einfache Gehäuse, überschaubare Kosten und einige Belegschaften. Im Vergleich zu Mäusen und Ratten ist Guinea Pigs´ Herz (Elektro) Physiologie mehr ähnlich wie beim Menschen. Insbesondere Herzfrequenz ist geringer (~250/min), ventrikuläre Aktion potenzielle zeigt eine Plateau-Phase und das Kalium aktuelle ichKr ist wichtig für die Repolarisation7. Darüber hinaus ermöglicht die größere Größe der Tiere Operationen, das ist besonders wichtig, da eine Rück-Thorakotomie erforderlich eine Woche nach der Induktion der Verletzung ist. Meerschweinchen sind jedoch empfindlich auf Anästhesie erfordert einige Erfahrung.
Shiba Et Al., beschrieb den Einsatz von 50 mg/kg Ketamin und 2 mg/kg Xylazin (i.p.) um Meerschweinchen für kardiale Cryoinjury4zu betäuben. Wir haben auch dieses Regiment Anästhesie ausgewertet. Ein Nachteil ist die Tatsache, dass es unmöglich ist, die narkotische Wirkung von Xylazin und Ketamin aufgrund fehlender potente Gegenmittel auszusetzen. Wenn man bedenkt, dass Meerschweinchen mit hohem Risiko einer Hypoglykämie bei chirurgischen Eingriffen sind, haben wir beschlossen eine betäubende Gas zu verwenden, deren Wirkung ist einfach zu steuern und führt daher zu einer Narkose sehr kurze Erholungsphase. Eine Tracheotomie wird verwendet, um eine sichere Belüftung während des Verfahrens zu gewährleisten. Eine Oro-trachealen Intubation ist technisch sehr anspruchsvoll bei Meerschweinchen, wie die Visualisierung der Öffnung der Luftröhre oft schwierig ist und eine sichere Intubation nicht garantiert werden.
Obwohl Cryo-Verletzung eine schwere myokardiale Verletzung induziert es genau spiegelt keine koronare Herzkrankheit / Herzinfarkt beim Menschen. In dieser Hinsicht rekapituliert der Ligatur der Bursche oder sogar ein Ischämie-Reperfusion Verletzungen Modell mehr eng die menschlichen Pathophysiologie. Allerdings zeichnet sich die Koronararterien Anatomie bei Meerschweinchen durch eine umfangreiche Besicherung. Daher führt eine Ligatur der linken vorderen absteigenden Koronararterie nicht reproduzierbar in großen myokardialen Verletzungen bei Meerschweinchen12,13. LAD-Ligatur bei Mäusen und Ratten führt zu einer umfangreichen Umgestaltung und schließlich Ausdünnung der vorderen Wand, ein Merkmal, das beim Menschen in diesem Ausmaß nicht gesehen wird. Das Meerschweinchen Cryo-Verletzung Modell induziert umgestaltet Prozesse und Ausdünnung der Ventrikelwand, sondern in einem Ausmaß, das eher ähnelt einer myokardialen Schädigung in Menschen gesehen. Daher wurde ein Cryoinjury-Modell ein zuverlässiger myokardialen Verletzungen13gewählt. Periprocedural Mortalität ist ein großes Problem mit diesem Modell. Anfangs starben etwa 30 % der Tiere während der ersten Operation oder innerhalb von 7 Tagen nach kardialen Schädigung. Weiteres 30 % starben während EHT Implantation Bilanzierung eine Mortalität von 60 %. Mehrere Änderungen führen zu einem deutlichen Rückgang der Sterblichkeit. Isofluran induziert schwere Speichelfluss und bronchiale Sekretion. Atropin vermindert bronchiale Sekretion und war ein wichtiger Faktor um Sterblichkeit zu verringern. Der zweite Faktor, die stark Sterblichkeit verringerte ist die Verwendung eines Lötkolbens, lassen Sie den kalte Metall Stempel aus dem Herzen. Warmes Wasser war zunächst verwendet, um den Stempel aus dem Herzmuskel zu lösen. Jedoch war es schwierig, das Wasser aus der Brusthöhle zu entfernen. Verbleibende Wasser negativ beeinflusst Atmung und führen zu die Entwicklung der Haftung, die die Futtersorten Prognose verschlechtert. Eine weitere Modifikation, die das Verfahren positiv beeinflusst war der Schutz der linken Lunge aus dem kalten Metall Stempel mit einer Kompresse. Nach diesen Änderungen wurden implementiert Sterblichkeit sank auf ~ 20 % für die kardiale Schädigung Betrieb (einschließlich der ersten postoperativen Woche) und weitere 25 % für EHT Transplantation. Induktion von Cryo Verletzung stellt die technisch einfachere Bedienung und konsistente Ergebnisse erreicht werden, nach 5-10 Tiere unter Aufsicht betrieben wurden. EHT-Transplantation ist anspruchsvoller und ca. 20 Operationen unter Aufsicht empfohlen bis reproduzierbare Ergebnisse erzielt werden können.
Am Anfang haben wir warme Kochsalzlösung spülen Herzen und deshalb lösen die gefrorenen Sonde aus der linken Ventrikelwand. Dieses Verfahren ist einfacher zu handhaben, aber ein paar Milliliter Kochsalzlösung bleiben im Thorax erhöht das Risiko von Atemstillstand.
Abschließend das abgebildete Meerschweinchen-Modell ist reproduzierbar, kostengünstig und führt zu konsistenten Ergebnissen. Transthorakalen Echokardiographie bietet ein Machbare und nicht-invasive Werkzeug, um das Vorhandensein von kardialen Schädigung vor Re-Operation zu bewerten und Graft-Implantation erfolgt.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Keiner der Autoren hat finanzielle Interessenkonflikte oder andere Interessenkonflikte zu erklären.
Acknowledgments
Keine Finanzierung wurde für diese Studie aufgenommen.
Materials
| Name | Company | Catalog Number | Comments |
| Ventilator (VetFlo Dual Mode) | Kent Scientific | ||
| Forene | abbvie | 1000009819 | |
| Carprofen | Zoetis | 256692 | |
| Atropin | Braun | PZN 00648037 | |
| Buprenorphin | Sigma | ||
| Metal stamp | |||
| Electric soldering iron | Claytools | ||
| 3-0 prolene suture | Ethicon | ||
| 4-0 prolene suture | Ethicon | 662SLH | |
| 5-0 prolene suture | Ethicon | 8710H | |
| 8-0 prolene suture | Ethicon | 8841H | |
| Tungsten Carbide Scissor | FST | No. 14568-12 | |
| Stainless sterilization Container | FST | No. 20890-51 | |
| Graefe Forceps | FST | No.11652-10 | |
| Extra fine Graefe Forceps | FST | No.11150-10 | |
| Forceps | FST | No. 11022-15 | |
| Halsted- Mosquito | FST | No. 13009-12 | |
| Forceps | FST | No.13003-10 | |
| Baby Mixter | FST | No. 13013-14 | |
| Needle holder (Castroviejo with Tungsten Casbide Jaws) | FST | No. 12565-14 | |
| Needle Holder (Halsey) | FST | No. 12501-13 | |
| Alm Retractor with Blumt Teeth | FST | No. 17008-07 | |
| Spring Scissor | FST | No. 15000-00 | |
| Compress 5x5 | Fink + Walter | PZN 08821417 | |
| Venflon Pro Safety | Becton Dickinson | PZN11123964 | |
| Cautery High Temp 2" | Bovie Medical Corporation | 0100607151011055 |
References
- Kirklin, J. K., et al. Seventh INTERMACS annual report: 15,000 patients and counting. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 34, 1495-1504 (2015).
- Soonpaa, M. H., Field, L. J. Survey of studies examining mammalian cardiomyocyte DNA synthesis. Circulation research. 83, 15-26 (1998).
- Shiba, Y., Hauch, K. D., Laflamme, M. A. Cardiac applications for human pluripotent stem cells. Current pharmaceutical design. 15, 2791-2806 (2009).
- Shiba, Y., et al. Human ES-cell-derived cardiomyocytes electrically couple and suppress arrhythmias in injured hearts. Nature. 489, 322-325 (2012).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510, 273-277 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell stem cell. 8, 228-240 (2011).
- Watanabe, T., Rautaharju, P. M., McDonald, T. F. Ventricular action potentials, ventricular extracellular potentials, and the ECG of guinea pig. Circulation research. 57, 362-373 (1985).
- Weinberger, F., et al. Cardiac repair in guinea pigs with human engineered heart tissue from induced pluripotent stem cells. Science translational medicine. 8, 363ra148 (2016).
- Shiba, Y., et al. Electrical Integration of Human Embryonic Stem Cell-Derived Cardiomyocytes in a Guinea Pig Chronic Infarct Model. Journal of Cardiovascular Pharmacology and Therapy. 19, 368-381 (2014).
- van Laake, L. W., et al. Human embryonic stem cell-derived cardiomyocytes survive and mature in the mouse heart and transiently improve function after myocardial infarction. Stem cell research. 1, 9-24 (2007).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature medicine. 12, 452-458 (2006).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of surgery. 140, 675-682 (1954).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. Heart and circulatory physiology. , H1291-H1300 (2005).



