ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
En protokol til forberedelse af poly (pentafluorophenyl acrylat) (poly(PFPA)) podet silica perler er præsenteret. Poly(PFPA) functionalized overflade er derefter immobiliseret med antistoffer og anvendt med succes til protein adskillelse gennem immunoprecipitation.
Abstract
Vi demonstrere en enkel metode til at forberede poly (pentafluorophenyl acrylat) (poly(PFPA)) podet silica perler for antistof immobilisering og efterfølgende immunoprecipitation (IP) program. Den podede poly(PFPA) overflade er forberedt via en simpel to-trins proces. I det første trin, er 3-aminopropyltriethoxysilane (APTES) deponeret som en linker molekyle overfladen, silica. I andet trin af poly(PFPA) homopolymer, syntetiseres via reversible addition og fragmentering kæde overførsel (TØMMERFLÅDE) polymerisering, er podet til linker molekyle gennem exchange reaktion mellem pentafluorophenyl (PFP) enheder på den polymer og amine grupper på APTES. Aflejring af APTES og poly(PFPA) på silica partikler er bekræftet af X-ray photoelectron spektroskopi (XPS), samt overvåges af partikel størrelse ændring målt via dynamisk lysspredning (DLS). For at forbedre den overflade hydrofiliciteten af perler, delvise substitution af poly(PFPA) med Amin-functionalized poly(ethylene glycol) (amino-PLØK) udføres også. Den PIND-substituerede poly(PFPA) podet silica perler er derefter immobiliseret med antistoffer for IP ansøgningen. For demonstration, et antistof mod protein kinase RNA-aktiveret (PKR) er ansat og IP er bestemt af Western blotting. Analyseresultaterne viser, at antistof immobiliseret perler faktisk kan bruges til at berige PKR, mens uspecifikke protein interaktioner er minimal.
Introduction
Reaktiv polymer pensler har modtaget megen interesse i de seneste år. De kan bruges til at immobilisere funktionelle molekyler på uorganiske eller organiske materialer til at skabe aktiveret overflader med applikationer på områder som afsløring og adskillelse1,2,3,4, 5. Blandt de reaktive polymerer rapporteret, er dem, der indeholder pentafluorophenyl ester enheder især nyttigt på grund af deres høje reaktivitet med aminer og modstand mod hydrolyse6. En sådan polymer er poly(PFPA), og det kan være let functionalized efter polymerisering med molekyler, der indeholder primære eller sekundære aminer7,8,9,10. I et eksempel, var poly(PFPA) pensler reagerede med amino-spiropyrans til at skabe lys-responderende overflader7.
Forberedelse af poly(PFPA) og dens anvendelse er blevet beskrevet i en række tidligere publikationer6,7,8,9,10,11,12 ,13,14,15,16,17. Især rapporterede Theato og kollegaer syntesen af poly(PFPA) pensler via både "podning til" og "podning fra" metoder7,8,10,11,12 . I "podning til" tilgang, en poly (methylsilsesquioxane)-poly (pentafluorophenyl acrylat) (poly(MSSQ-PFPA)) hybrid polymer blev syntetiseret8,10,11,12. Komponenten poly(MSSQ) kunne form stærk vedhæftning med en række forskellige organiske og uorganiske overflader, således at poly(PFPA) komponent til at danne en børste lag på den coatede materiale overflade. I "podning fra" tilgang, overflade indledt reversible tilsætning og fragmentering kæde overførsel (SI-TØMMERFLÅDE) polymerisering var ansat til at forberede poly(PFPA) pensler7. I dette tilfælde blev en overflade immobiliseret kæde transfer agent (SI-CTA) først kovalent knyttet til underlaget via silica-silan reaktion. Immobiliseret SI-CLU deltog derefter i SI-TØMMERFLÅDE polymerisering af PFPA monomerer, genererer tæt pakket poly(PFPA) pensler med stabil kovalente kobling til underlaget.
Ved at udnytte poly(PFPA) pensler syntetiseres via SI-TØMMERFLÅDE polymerisering, viste vi for nylig immobilisering af antistoffer på poly(PFPA) podet silica partikler og deres efterfølgende anvendelse i protein oprensning18. Brugen af poly(PFPA) pensler til antistof immobilisering blev fundet til at løse en række problemer forbundet med aktuelle protein adskillelse gennem IP. Konventionelle IP er baseret på brugen af Protein A/G som en linker til antistof immobilisering19,20,21. Da brugen af Protein A/G giver antistoffer til at være forbundet med en bestemt orientering, er højt mål antigen nyttiggørelse effektivitet opnået. Men brugen af Protein A/G lider af ikke-specifik protein interaktion samt tab af antistoffer under protein opsving, som begge bidrager til et højt niveau af baggrundsstøj. Du kan løse disse mangler ved har direkte crosslinking af antistoffer mod en solid støtte været udforsket22,23,24. Effektiviteten af sådanne teknikker er typisk lav på grund af den tilfældige orientering af crosslinked antistoffer. For poly(PFPA) podet substrat er immobilisering af antistoffer permanent, opnået gennem exchange reaktion mellem PFP enheder og Amin funktionaliteter på antistoffer. Selvom antistof orientering er stadig tilfældig, systemet nyder godt af at have mange reaktive PFP websteder, styres af graden af polymerisering. Desuden, vi viste, at af delvise substitution af PFP enheder med amino-PEG, overflade hydrofiliciteten kan indstilles, yderligere forbedre protein opsving effektivitet af systemet18. Samlet set blev poly(PFPA) podet silica partikler vist sig at være et effektivt alternativ til traditionel IP med rimeligt energieffektivitet samt meget renere baggrund.
I dette bidrag rapporterer vi en alternativ metode til at forberede antistof immobilisering og IP ansøgningen poly(PFPA) podede overflade. I en simpel to-trins proces, som illustreret i figur 1, en APTES linker molekyle er først deponeres overfladen, silica, så poly(PFPA) polymer er kovalent knyttet til linker molekyle ved reaktion mellem PFP enheder på den polymer og Amin funktioner på APTES. Denne forberedelse metode giver mulighed for den permanente crosslinking af poly(PFPA) til et substrat overflade, men undgår mange komplikationer forbundet med SI-CTA syntese og SI-TØMMERFLÅDE polymerisering af poly(PFPA) børster. Delvise substitution af PFP enheder med amino-PIND kan stadig udføres, giver mulighed for finjustering af polymer børste overfladen egenskaber. Vi viser poly(PFPA) podet silica perlerne således forberedt kan immobiliseret med antistoffer og anvendes til protein berigelse via IP. Detaljerede perle forberedelse procedure, antistof immobilisering og IP test er dokumenteret i denne artikel, for læserne interesseret i søger et alternativ til konventionelle Protein A/G baseret IP.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. forberedelse af Poly(PFPA) Homopolymer
- Omkrystallisation af AIBN
- Kombiner 5 g 2,2'-azobis(2-methylpropionitrile) (AIBN) med 25 mL methanol i et 250 mL bægerglas. Fordyb bægerglas på en 60 ° C oliebad, så kraftigt Rør blandingen med en røre bar indtil AIBN er helt opløst.
- Filter til varme løsning gennem filtrerpapir (5-8 μm partikel fastholdelse) og gemme filtratet ved 4 ° C at tillade krystaller form langsomt.
- Indsamle de recrystallized AIBN ved filtrering. Kombinere de indsamlede produkt med 25 mL frisk methanol og Gentag omkrystallisering proces.
- Tørre 2 x recrystallized AIBN i et vakuum ovn ved stuetemperatur (RT) natten over. Gemme produktet i mørke ved <-10 ° C.
- Syntese af benzyl dithiobenzoate25
- Forberede en 500 mL tre-hals runde-bunden kolbe forsynet med en magnetisk røre bar, en refluxerende kondensator, en tragt og en gummi septum. Kolben nitrogen gas linje gennem refluxerende kondensatoren og skylle indersiden luft med kvælstof. Indsæt et termometer gennem septum. Tilføje 41 mL (0.041 mol) 1 M opløsning af phenylmagnesium bromid i tetrahydrofuran (THF) via en sprøjte gennem den samme septum.
- Varm phenylmagnesium bromid løsning til 40 ° C i et oliebad. Derefter tilsættes 3.1 g (0.041 mol) carbondisulfid gennem en tragt langsomt, opretholde løsning temperaturen på 40 ° C.
- Tilføje 7,1 g (0,042 mol) af benzyl methylbromid til den resulterende blandingen gennem tragt over 15 min. stigning i reaktion temperatur til 50 ° C. Fortsæt omrøring ved denne temperatur i 45 min.
- Overføre reaktionsblandingen til en skilletragt og fortyndes med 15 mL koldt vand. Uddrag produktet ved at tilføje 15 mL dietylaeter og fjerne den lavere vand lag. Gentag ekstraktion med diethylether to gange mere.
- Vask de kombinerede økologiske faser med rigelige mængder af vand, så saltlage (løsning på 50% (w/v) NaCl i vand) og tør produktet over vandfri magnesium sulfat.
- Fjerne opløsningsmidlet i vakuum ved 35 ° C ved hjælp af en rotationsfordamper.
- Rense produktet af kolonne kromatografi med 400 mL af silica gel (porestørrelse 60 Å, 63-200 mesh partikelstørrelse) og petroleumsether som elueringsvæsken, giver 5 g af benzyl dithiobenzoate (BDB) som rød olie. Bekræfte produktets renhed af 1H NMR (400 MHz, CDCl3): δ 8.02-7.99 (2 H, m), 7,55-7,50 (1 H, m), 7,41-7.29 (7 H, m), 4,60 (2 H, s).
- Syntese af poly(PFPA) via TØMMERFLÅDE polymerisering9,26
- Kommercielt tilgængelig PFPA monomer indeholder små beløb af hæmmere. Før polymerisering, skal du fjerne hæmmere af passerer en engangs sprøjte fyldt med grundlæggende alumina monomeren.
- Tilføje 0,4 mg (0.0024 mmol) af recrystallized AIBN, 4,3 mg (0,018 mmol) BDB, 1012 mg (4,25 mmol) af inhibitorfri PFPA og 0,7 mL af vandfri anisole til en 20 mL Schlenk kolbe.
- Kolben Schlenk linje og degas blanding med mindst tre fryse-pumpe-tø cykler. Kort, fryse reaktionsblandingen i et bad med flydende kvælstof. Anvende vakuum for at fjerne gassen i headspace. Seal kolben derefter fjerne fra flydende kvælstof til at tillade indhold at tø på RT.
- Kolben anbringes i et oliebad 70 ° C, og reagere for 4 h under N2 purge.
- For at afslutte reaktionen, Fjern kolben fra oliebad og udsætte reaktion indhold til luft.
- Bundfald polymer i kolde methanol og derefter tørre det gendannede polymer i et vakuum ovn ved 40 ° C natten over.
- For at måle polymer molekylvægt, bruge gel gennemtrængning kromatografi (GPC). Bruge THF, som den mobile fase ved 35 ° C med en 1 mL/min. flow sats og konstruere kalibreringskurven ved hjælp af monodisperse polystyren standarder. For at erhverve GPC måling, opløse polymer i THF (1-2 mg/mL) og filtreres gennem 0,2 μm engangs polytetrafluorethylen (PTFE) filter. Indsprøjtes 100 μL af prøven i GPC instrument. Konverter den målte prøve retentionstid til Molekylær vægt ved hjælp af polystyren kalibreringskurven.
2. forberedelse af Poly(PFPA) Functionalized SiO2 perler
- Behandling af SiO2 perler med APTES
- SiO2 partikler er tilgængelige i form af en 5% (w/v) vandig suspension. Kombinere 0,8 mL af SiO2 suspension med 40 mg APTES og 8 mL methanol i en 20 mL scintillation hætteglas udstyret med en røre bar.
- Tillad reaktion til at fortsætte på RT for 5 h med kraftig omrystning.
- Opløsningen overføres til en konisk slange. For at isolere APTES functionalized SiO2 perler, centrifugeres løsning på 10.000 x g i 5 min, så Fjern supernatanten. Vaske perlerne af igen at sprede dem i 3 mL frisk methanol. Ryst glasset i hånden til at blande, men hvis det er nødvendigt, forbedre spredningen af sonikering i et vandbad i et par sekunder. Der centrifugeres perler på 10.000 x g i 5 min. Fjern supernatanten og Gentag trinnet vask en gang mere.
- Kombinere methanol vasket SiO2 perler med 3 mL af dimethylsulfoxid (DMSO). Ryst blandingen i hånden, eller hvis nødvendigt sonikeres et par sekunder, indtil perlerne er fuldt spredt i DMSO. Centrifugeres perler på 10.000 x g i 5 min, så Fjern supernatanten. Gentag trinnet for at sikre fuldstændig opløsningsmiddel udveksling af methanol til DMSO.
NOTE: Den endelige suspension indeholder APTES functionalized SiO2 perler spredt i 4 mL af DMSO. - Hvis du vil kontrollere partikelstørrelsesfordeling, udføre DLS analyse. Tage en dråbe af suspensionen udarbejdet i trin 2.1.4 og sted i en engangs UV kuvette. Fortyndes prøven ved at udfylde kuvette med friske DMSO, indtil det er 2/3 fuld. Indsæt eksemplet i celle indehaveren til at begynde dataopsamling. For partikel størrelse måling, bruger følgende konfiguration parametre: temperatur: 25 ° C; Ekvilibreringstid: 120 s; Måling varighed: automatisk.
- For at kontrollere overfladen sammensætning, udføre XPS analyse. Tørre en lille prøve fra suspensionen forberedt i trin 2.1.4 i vakuum ovn ved 40 ° C natten over. Tage de tørrede polymer og pack jævnt på en 0,5 cm x 0,5 cm prøveholderen. Læg prøven i den høje vakuumkammer (10-8 torr) og begynde dataopsamling. Til det særlige XPS instrument bruges, generere photoelectrons ved hjælp af en monokromatisk Al Kα X-ray drives på 15 kV og 6,7 mA, og indsamle bruger hybrid mode forstørrelse med analyzer på en 50 eV passere energi til høj opløsning spektre, og en 100 eV passere energi for elementært undersøgelser.
- Podning poly(PFPA) til APTES functionalized SiO2 perler
- Forberede poly(PFPA) løsning ved at opløse 20 mg af poly(PFPA) i 2 mL af DMSO i en 20 mL scintillation hætteglas.
Bemærk: I denne undersøgelse, en relativt lav Molekylær vægt poly(PFPA) (20 kg/mol) er brugt. Således, trods den høje polymer koncentration (10 mg/mL), ingen beviser for polymer crosslinking er observeret. Hvis en højere molekylvægt polymer er anvendt, muligvis polymer opløsningens koncentration skal justeres for at undgå mulige crosslinking. - Tilsæt 1 mL af APTES functionalized SiO2 perler suspenderet i DMSO (fra trin 2.1.4) til poly(PFPA) løsning. Reagere på RT for 1 h med kraftig omrystning.
- Isolere poly(PFPA) podet SiO2 perler ved centrifugering ved 10.000 x g i 5 min, efterfulgt af fjernelse af supernatanten. Vaske perlerne ved tilsætning af 3 mL af DMSO og mix af enten omrystning med hånden eller få sekunder af sonikering. Centrifugeres perler på 10.000 x g i 5 min, så Fjern supernatanten. Gentag vask af poly(PFPA) podet SiO2 perler med DMSO to gange.
- Vaske perlerne to gange mere med tredobbelt destilleret vand (TDW). I dette trin skal kombinere perlerne med 3 mL af TDW, hvorefter der blandes ved omrystning med hånden eller få sekunder af sonikering. Centrifugeres perler på 10.000 x g i 5 min, så Fjern supernatanten.
- Hvis du vil kontrollere partikelstørrelsesfordeling, udføre DLS følge fremgangsmåden i trin 2.1.5. Hvis du vil kontrollere den overfladekemi, udføre XPS følge fremgangsmåden i trin 2.1.6.
- Forberede poly(PFPA) løsning ved at opløse 20 mg af poly(PFPA) i 2 mL af DMSO i en 20 mL scintillation hætteglas.
3. forberedelse af SiO2 perler podet med PIND-substituerede Poly(PFPA)
- For at forberede poly(PFPA) løsningen, 20 mg af poly(PFPA) i 2 mL af DMSO i en 20 mL scintillation hætteglas opløses.
- For at forberede PIND løsning, opløse Amin-functionalized PIND i 1 mL af DMSO. Det nøjagtige beløb af PLØK anvendes bestemmes af den ønskede grad af PFP substitution, bestemmes af ligningen vist nedenfor:
Mængden af amino-PEG (g/g-poly(PFPA)) = (N_poly(PFPA) x % PIND-Sub) x (MW_PEG / MW_poly(PFPA))
hvor N_poly(PFPA) = poly(PFPA) grad polymerisering
% PIND-Sub = procent PIND substitution
MW_PEG = molekylevægt af amino-PEG
MW_ poly(PFPA) = molekylevægt af poly(PFPA) - PIND opløsning overføres til en poly(PFPA) løsning. Reagere på RT for 1 h med kraftig omrystning.
- For at forberede APTES functionalized SiO2 perler suspenderet i DMSO, Følg de samme trin, vist i trin 2.1. Der overføres 1 mL af perle suspension oploesningen PIND-substituerede poly(PFPA) udarbejdet i trin 3.3. Tillad podning mellem poly(PFPA) og APTES functionalized SiO2 perler for at fortsætte på RT for 1 h med kraftig omrystning.
- Isolere perlerne ved centrifugering ved 10.000 x g i 5 min, efterfulgt af fjernelse af supernatanten. Vaske perlerne ved tilsætning af 3 mL af DMSO og mix af enten omrystning med hånden eller få sekunder af sonikering. Centrifugeres perler på 10.000 x g i 5 min, så Fjern supernatanten. Gentag DMSO vaskes to gange.
- Vaske perlerne to gange mere med TDW. I dette trin skal kombinere perlerne med 3 mL TDW, hvorefter der blandes ved omrystning med hånden eller få sekunder af sonikering. Centrifugeres perler på 10.000 x g i 5 min, så Fjern supernatanten.
- Tør perler ved 40 ° C i et vakuum ovn natten over.
4. antistof immobilisering på Poly(PFPA) podet SiO2 perler
Bemærk: Samme fremgangsmåde bruges uanset procent PIND substitution på poly(PFPA). Forberede fosfatbufferet saltopløsning (PBS) ved at opløse PBS tablet i TDW. Forbered 0,1% (v/v) fosfatbufferet saltopløsning med Tween-20 (PBST) ved at tilføje 1/1000 af Tween-20 til PBS.
- Tilføj 5 mg af poly(PFPA) podet SiO2 perler til en 1,5 mL microcentrifuge tube.
- Vaske perlerne ved at tilføje 800 µL af PBS og bland godt ved vortexing. Der centrifugeres perler på 10.000 x g på RT i 1 min. Fjern supernatanten og Gentag trinnet vaskes tre gange.
- Tilføje 350 µL af frisk PBS, 50 µL 0,1% (v/v) PBST og 6,67 µg af antistoffet. Inkuber ~ 20 h på en rotator ved 4 ° C.
- Vaske perlerne til at fjerne ubundne antistoffer. Centrifugeres perler på 400 x g og 4 ° C i 1 min. Fjern supernatanten og tilføje 400 µL af lysisbuffer omhyggeligt. Forsigtigt genopslæmmes perlerne af pipettering op og ned til fem gange.
Bemærk: Lysisbuffer bruges til at vaske perlerne skal være den samme som brugte under celle lysis og IP, bortset fra at tilsætning af dithiothreitol og protease-hæmmer er valgfri, (Se trin 5). - Gentag trinnet vaskes tre gange. Efter den sidste vask, Fjern supernatanten så meget som muligt.
5. celle Lysis og Immunoprecipitation
- Forberedelse af lysisbuffer og vaskebuffer
- Forberede lysisbuffer (50 mM Tris-HCl (pH 8.0), 100 mM KCl, 0,5% (v/v) NP-40, 10% (v/v) glycerol, 1 mM dithiothreitol (DTT) og protease hæmmer cocktail).
- Forberede vaskebuffer (50 mM Tris-HCl (pH 8.0), 100 mM KCl, 0,1% (v/v) NP-40, og 10% (v/v) glycerol).
- Gemme buffer løsninger ved 4 ° C.
- Forberedelse af celler
- Seed celler (HeLa celler) en eller to dage før IP eksperiment, og vokse cellerne ved 37 ° C og 5% CO2.
- Indsamle omkring 1,4 x 107 celler med celle skraber og overførsel i en 15 mL konisk slange. Centrifuge celler på 380 x g på RT for 3 min. Fjern supernatanten og genopslæmmes med 1 mL koldt PBS og overførsel til en 1,5 mL microcentrifuge tube.
- Der centrifugeres celler på 10.000 x g ved 4 ° C i 30 s. Fjern supernatanten renlig. Celle pellets kan opbevares ved-80 ° C efter fjernelse af supernatanten.
- Forberedelse af cellelysater
- Genopslæmmes celle pellet med 400 µL af lysisbuffer. Der sonikeres celler ved hjælp af en ultrasonicator.
- Efter ultralydbehandling, vortex kort og centrifuger den lysate på 20.000 x g ved 4 ° C i 10 min.
- Overføre supernatanten til en ny 1,5 mL-centrifugerør.
- Immunoprecipitation
- Overføre 300 µL af celle lysate til tidligere forberedt antistof inkuberes poly(PFPA) podet SiO2 perler. Fastholde 30 µL af cellen lysate som input prøven i et nyt microcentrifuge-rør. Butik input prøven ved 4 ° C.
Bemærk: Den samlede mængde af protein i cellen lysate skal være ca 4 mg. - Inkubér lysate/perler blanding til 3 h på en rotator ved 4 ° C.
- Der centrifugeres blandingen på 400 x g ved 4 ° C i 1 min. Fjern supernatanten og tilføje 400 µL af vaskebuffer omhyggeligt. Forsigtigt genopslæmmes perlerne af pipettering op og ned omkring fem gange.
- Gentag trinnet vaskes tre gange. Efter den sidste vask, Fjern supernatanten så meget som muligt.
- Forberede 2 x sodium dodecyl sulfat (SDS) indlæsning farvestof (25% (v/v) glycerol, 0,1% (w/v) bromo phenol blå (BPB), 60 mM Tris-HCl (pH 6,8), 2% (w/v) SDS, og 2,75 mM 2-mercaptoethanol). Butik 2 x SDS lastning farvestof ved-20 ° C. Tilsæt 30 µL af 2 x SDS lastning farvestof til perlerne og gemte input prøven, og varme dem i 10 min. ved 95 ° C.
- Efter opvarmning, analysere prøven ved hjælp af Western blotting27eller opbevares prøven ved-20 ° C.
- Overføre 300 µL af celle lysate til tidligere forberedt antistof inkuberes poly(PFPA) podet SiO2 perler. Fastholde 30 µL af cellen lysate som input prøven i et nyt microcentrifuge-rør. Butik input prøven ved 4 ° C.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
En skematisk for udarbejdelsen af poly(PFPA) podet SiO2 perler, med eller uden PIND substitution er vist i figur 1. For at overvåge APTES og poly(PFPA) podning proces, nøgne SiO2 perler, APTES functionalized SiO2 perler, og poly(PFPA) podet SiO2 perler er karakteriseret ved både DLS (figur 2) og XPS (figur 3). IP effektivitetsgevinster af perlerne bestemmes af Western blotting. Figur 4 viser Western blotting resultater for IP bruger 1% PIND-substituerede poly(PFPA) podet perler, hvor perlerne er inkuberes med ingen antistof, en ikke-specifik antistof eller anti-PKR antistof. Figur 5 viser de Western blotting resultater for IP bruger 0% PIND-substituerede poly(PFPA) podet perler og 1% PIND-substituerede poly(PFPA) podet perler, begge inkuberes med anti-PKR antistoffer.

Figur 1: Skematisk forberedelsen af poly(PFPA) podet SiO2 perler ved hjælp af APTES som en linker molekyle. (en) Poly(PFPA) podet perler. (b) delvist PLØK-substituerede poly(PFPA) podet perler. Venligst klik her for at se en større version af dette tal.

Figur 2: DLS målinger for a nøgne SiO2 perler (SiO2), (b) APTES functionalized SiO2 perler (APTES-SiO2) og (c) poly(PFPA) podet SiO2 perler (poly (PFPA)-SiO2), spredt i DMSO. Z-gennemsnitlig diameter (d) og polydispersity indeks (PDI) af hver prøve er rapporteret. Venligst klik her for at se en større version af dette tal.

Figur 3: XPS spektre for nøgne SiO2 perler (SiO2), APTES functionalized SiO2 perler (APTES-SiO2), og poly(PFPA) podet SiO2 perler (poly (PFPA)-SiO2). Toppene undersøgt svarer til (en) Si 2 p, (b) O 1s, (c) N 1s, og (d) F 1s. Venligst klik her for at se en større version af dette tal.

Figur 4: Western blotting resultater for IP ved hjælp af 1% PIND-substituerede poly(PFPA) podet perler, behandlet med ingen antistof (lane 2), en ikke-specifik antistof blanding, normal kanin IgG (lane 3) eller anti-PKR antistof (lane 4). Lane 1 viser input protein blandingen før Undersøgelsesperioden. Venligst klik her for at se en større version af dette tal.

Figur 5: Western blotting resultater for IP bruger 0% PIND-substituerede poly(PFPA) podet perler (lane 2) og 1% PIND-substituerede poly(PFPA) podet perler (lane 3), begge er behandlet med anti-PKR antistoffer. Lane 1 viser input protein blandingen før Undersøgelsesperioden. Venligst klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Syntesen af poly(PFPA) podet SiO2 perler er illustreret i figur 1. Ved at ansætte APTES som en linker molekyle, kan poly(PFPA) børster kovalent podet til SiO2 substrat forberedes via en simpel to-trins proces. Selv om nogle af PFP enheder er ofret for reaktionen med APTES, forventes et stort antal PFP enheder skal forblive tilgængelig for senere reaktion med enten amino-PIND eller antistoffer. PFP-grupper er kendt for at danne lavenergi overflader, så poly(PFPA) børster gøre ikke solvat godt i vand28. For IP ansøgningen, antistoffer skal være immobiliseret på poly(PFPA) børster, og denne udveksling reaktion sker i vandig stødpudeopløsning for at bevare aktiviteten af antistoffer. Som rapporteret i vores tidligere publikation, kan delvise substitution af PFP enheder med hydrofile molekyler såsom Amin-functionalized PIND forbedre overfladen hydrofiliciteten, fører til øget antistof immobilisering effektivitet18. I denne undersøgelse, delvist PIND substituerede poly(PFPA) er også forberedt, så podede SiO2 overflade ved hjælp af den samme APTES linker molekyle. Samlet set tillade de metoder, der er illustreret i figur 1 forberedelse af poly(PFPA) podet overflader med forskellige grader af PIND substitution. Disse polymer pensler med afstemmelige overflade egenskaber giver en ideel platform for antistof immobilisering og efterfølgende IP ansøgningen.
Perle forberedelse proces er overvåget af både DLS og XPS. DLS resultater for forskellige functionalized SiO2 perler i DMSO er sammenfattet i figur 2. De nøgne SiO2 perler udstiller hydrodynamiske diameter 666 nm, i samråd med fabrikanten rapporterede perle størrelse (0.676 μm; SD = 0,03 μm). Efter APTES behandling, perle diameter stiger til 740 nm; og med poly(PFPA) behandling, perle diameter yderligere øges til 1889 nm. Det er vigtigt at påpege, at polydispersity indeks (PDI) for poly(PFPA) podet perler er temmelig store (PDI = 0,76), hvilket er tegn på dårlig kvalitet prøve, der indeholder store aggregater. Selvom DLS kurve viser kun en nano-størrelse peak, kan små beløb af nationalregnskabsaggregater være til stede i suspensionen. Functionalized SiO2 perler er også undersøgt af XPS til at bestemme overflade sammensætning (figur 3). Efter APTES behandling, N 1s peak tilknyttet amine grupper på APTES registreres. Og følgende poly(PFPA) behandling, F 1s peak forbundet med PFP enheder på polymeren er opdaget. Sammen viser disse data den succesfulde functionalization SiO2 overflade, først med APTES, derefter med poly(PFPA).
For at vise, at poly(PFPA) podet perler kan bruges til protein berigelse gennem IP, vi brugte 1% PIND-substituerede poly(PFPA) podet perler, og inkuberes dem med ingen antistof, en ikke-specifik kanin IgG antistof blanding eller anti-PKR antistof. Celle lysate indeholdende mål PKR blev udvundet fra celle, og PKR berigelse blev derefter gennemført gennem IP ved hjælp af de tre slags perler. For at bestemme IP effektivitet, blev elueres protein prøver analyseret mod to forskellige antistoffer via Western blotting. Anti-PKR antistof blev brugt til at visualisere mængden af PKR inddrevet. Og anti-GAPDH (glyceraldehyd-3-fosfat dehydrogenase) antistof blev brugt som en negativ kontrol som GAPDH er en rigeligt protein, der ikke interagerer med PKR. Som vist i figur 4, perler immobiliseret uden antistof eller ikke-specifikke antistof blanding resultat i gentilvejebringe PKR. Derimod kan perlerne inkuberes med anti-PKR antistof med held berige PKR, som angivet ved tilstedeværelsen af en stærk PKR band og fraværet af GAPDH band. Disse resultater tyder på PIND-substituerede poly(PFPA) pensler kan faktisk functionalized med antistoffer og anvendes til selektiv berigelse af target protein. Bemærk sammenlignet protein opsving effektivitet af forskellige perle systemer, IP eksperimenter samt den efterfølgende Western blotting analyser bør ske samtidig. På grund af de iboende variationer i udførelsen af disse eksperimenter, bør oplysninger indhentet på separate forsøg ikke direkte sammenlignes.
Som rapporteret før den overflade hydrofiliciteten poly(PFPA) pensler spiller en nøglerolle i IP effektivitet18. Figur 5 viser Western blotting data for IP inddrives protein prøver ved hjælp af 0% PIND-substituerede poly(PFPA) podet perler og 1% PIND-substituerede poly(PFPA) podet perler. I begge tilfælde var perlerne immobiliseret med anti-PKR antistoffer. Mens brugen af 0% PIND-substituerede poly(PFPA) resulterer i lave PKR nyttiggørelse effektivitet, viser 1% PIND-substituerede poly(PFPA) betydelig forbedring, anført af den selektive berigelse af target PKR over ikke-målarter GAPDH. I samarbejde med vores tidligere publikation18øget PIND behandling den overflade hydrofiliciteten af poly(PFPA) børste, så mere PFP enheder skal være tilgængelige for antistof immobilisering, fører til den observerede forbedring i IP effektivitet. Bemærk, procent PIND substitution rapporteret i denne undersøgelse ikke kan sammenlignes direkte med som rapporteret i vores tidligere undersøgelse, som brugte SI-TØMMERFLÅDE syntetiseret poly(PFPA) børster. De to tilfælde anvender meget forskellige polymer børste forberedelse metoder, så mængden af PFP enheder til rådighed med lige PIND lastning forventes at være meget forskellige. Dog er bemærkningerne fra de to undersøgelser enig kvalitativt, begge peger overflade hydrofiliciteten som en nøgle kontrol parameter for at opnå høje IP effektivitet.
Mens overflade hydrofiliciteten påvirkninger af beløbet af antistof tilknytning til poly(PFPA) pensler, har det også en betydelig indvirkning på IP baggrund på grund af ikke-specifik berigelse. I en typisk IP eksperiment udføres mange vaske trin for at fjerne ubundne proteiner. Når perlerne er meget hydrofobe, såsom dem med 0% PIND substitution, de har tendens til at form store aggregater, der er svære at bryde fra hinanden. I dette tilfælde, ikke-specifikke proteiner kan være fanget i de samlet strukturer, og vask tilstrækkeligt fjerne ikke dem, fører til en stigning i baggrunden. Derfor, når du udfører IP, det er vigtigt at optimere egenskaben perle overflade, og bør lægges vægt på at sikre, at perlerne er rimeligt fordelt.
Samlet set viste en simpel to-trins proces til at forberede poly(PFPA) podet SiO2 perler, og viste, at den overflade hydrofiliciteten af perlerne kan finjusteres med delvise substitution af PFP enheder med amino-PIND. Disse polymer pensler var med held anvendes til target protein berigelse gennem IP, præsenterer sig selv som et alternativ til traditionelle Protein A/G baseret IP teknik. Vi forventer poly(PFPA) pensler til at finde anvendelse på mange andre områder, der kræver biomolekyle immobilisering.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
Dette arbejde blev støttet af agenturet for forsvar udvikling (Grant nr. UD170039ID).
Materials
| Name | Company | Catalog Number | Comments |
| 2,2-Azobisisobutyronitrile, 99% | Daejung Chemicals | 1102-4405 | |
| Methyl alcohol for HPLC, 99.9% | Duksan Pure Chemicals | d62 | |
| Phenylmagnesium bromide solution 1.0 M in THF | Sigma-Aldrich | 331376 | |
| Carbon disulfide anhydrous, ≥99% | Sigma-Aldrich | 335266 | |
| Benzyl bromide, 98% | Sigma-Aldrich | B17905 | |
| Petroleum ether, 90% | Samchun Chemicals | P0220 | |
| Ethyl ether, 99% | Daejung Chemicals | 4025-4404 | |
| Magnesium sulfate anhydrous, powder, 99% | Daejung Chemicals | 5514-4405 | |
| Pentafluorophenyl acrylate | Santa Cruz Biotechnology | sc-264001 | contains inhibitor |
| Aluminium oxide, activated, basic, Brockmann I | Sigma-Aldrich | 199443 | |
| Sodium Chloride (NaCl) | Daejung Chemicals | 7548-4400 | |
| Anisole anhydrous, 99.7% | Sigma-Aldrich | 296295 | |
| Silica nanoparticle | Microparticles GmbH | SiO2-R-0.7 | 5% w/v aqueous suspension |
| 3-Aminopropyltrimethoxysilane, >96.0% | Tokyo Chemical Industry | T1255 | |
| Dimethyl sulfoxide for HPLC, ≥99.7% | Sigma-Aldrich | 34869 | |
| Amino-terminated poly(ethylene glycol) methyl ether | Polymer Source | P16082-EGOCH3NH2 | |
| Phosphate buffered saline tablet | Takara | T9181 | |
| Tween-20 | Calbiochem | 9480 | |
| Tris-HCl (pH 8.0) | Invitrogen | AM9855G | |
| KCl | Invitrogen | AM9640G | |
| NP-40 | VWR | E109-50ML | |
| Glycerol | Invitrogen | 15514-011 | |
| Dithiothreitol | Biosesang | D1037 | |
| Protease inhibitor | Merck | 535140-1MLCN | |
| Bromo phenol blue | Sigma-Aldrich | B5525-5G | |
| Tris-HCl (pH 6.8) | Biosolution | BT033 | |
| Sodium dodecyl sulfate | Biosolution | BS003 | |
| 2-Mercaptoethanol | Gibco | 21985-023 | |
| PKR Antibody | Cell Signaling Technology | 12297S | |
| GAPDH Antibody | Santa Cruz Biotechnology | sc-32233 | |
| Normal Rabbit IgG | Cell Signaling Technology | 2729S | |
| HeLa | Korea Cell Line Bank | 10002 | |
| Sonicator | DAIHAN Scientific | WUC-D10H | |
| Ultrasonicator | BMBio | BR2006A | |
| Centrifuge I | Eppendorf | 5424 R | |
| Centrifuge II | LABOGENE | 1736R | |
| Rotator | FINEPCR | ROTATOR/AG | |
| Vacuum oven | DAIHAN Scientific | ThermoStable OV-30 | |
| Gel permeation chromatography (THF) | Agilent Technologies | 1260 Infinity II | |
| X-ray photoelectron spectrometer | Thermo VG Scientific | Sigma Probe | |
| Dynamic light scattering | Malvern Instruments | ZEN 3690 |
References
- Johnsson, B., Löfås, S., Lindquist, G. Immobilization of proteins to a carboxymethyldextran-modified gold surface for biospecific interaction analysis in surface plasmon resonance sensors. Analytical Biochemistry. 198 (2), 268-277 (1991).
- Kurzawa, C., Hengstenberg, A., Schuhmann, W. Immobilization method for the preparation of biosensors based on pH shift-induced deposition of biomolecule-containing polymer films. Analytical Chemistry. 74 (2), 355-361 (2002).
- You, C. C., et al. Detection and identification of proteins using nanoparticle-fluorescent polymer 'chemical nose' sensors. Nature Nanotechnology. 2 (5), 318-323 (2007).
- Roberts, M. W., Ongkudon, C. M., Forde, G. M., Danquah, M. K. Versatility of polymethacrylate monoliths for chromatographic purification of biomolecules. Journal of Separation Science. 32 (15-16), 2485-2494 (2009).
- Sandison, M. E., Cumming, S. A., Kolch, W., Pitt, A. R. On-chip immunoprecipitation for protein purification. Lab on a Chip. 10 (20), 2805-2813 (2010).
- Das, A., Theato, P. Activated Ester Containing Polymers: Opportunities and Challenges for the Design of Functional Macromolecules. Chemical Reviews. 116 (3), 1434-1495 (2016).
- Choi, J., et al. Functionalization and patterning of reactive polymer brushes based on surface reversible addition and fragmentation chain transfer polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 50 (19), 4010-4018 (2012).
- Kessler, D., Jochum, F. D., Choi, J., Char, K., Theato, P. Reactive surface coatings based on polysilsesquioxanes: universal method toward light-responsive surfaces. ACS Applied Materials & Interfaces. 3 (2), 124-128 (2011).
- Son, H., et al. Penetration and exchange kinetics of primary alkyl amines applied to reactive poly(pentafluorophenyl acrylate) thin films. Polymer Journal. 48 (4), 487-495 (2016).
- Kessler, D., Roth, P. J., Theato, P. Reactive surface coatings based on polysilsesquioxanes: controlled functionalization for specific protein immobilization. Langmuir. 25 (17), 10068-10076 (2009).
- Kessler, D., Theato, P. Reactive surface coatings based on polysilsesquioxanes: defined adjustment of surface wettability. Langmuir. 25 (24), 14200-14206 (2009).
- Kessler, D., Nilles, K., Theato, P. Modular approach towards multi-functional surfaces with adjustable and dual-responsive wettability using a hybrid polymer toolbox. Journal of Materials Chemistry. 19 (43), 8184-8189 (2009).
- Eberhardt, M., Mruk, R., Zentel, R., Theato, P. Synthesis of pentafluorophenyl(meth)acrylate polymers: new precursor polymers for the synthesis of multifunctional materials. European Polymer Journal. 41 (7), 1569-1575 (2005).
- Jochum, F. D., Forst, F. R., Theato, P. PNIPAM copolymers containing light-responsive chromophores: a method toward molecular logic gates. Macromolecular Rapid Communications. 31 (16), 1456-1461 (2010).
- Schattling, P., Pollmann, I., Theato, P. Synthesis of CO2-responsive polymers by post-polymerization modification. Reactive & Functional Polymers. 75, 16-21 (2014).
- He, L., Szameit, K., Zhao, H., Hahn, U., Theato, P. Postpolymerization modification using less cytotoxic activated ester polymers for the synthesis of biological active polymers. Biomacromolecules. 15 (8), 3197-3205 (2014).
- Arnold, R. M., McNitt, C. D., Popik, V. V., Locklin, J. Direct grafting of poly(pentafluorophenyl acrylate) onto oxides: versatile substrates for reactive microcapillary printing and self-sorting modification. Chemical Communications. 50 (40), 5307-5309 (2014).
- Son, H., Ku, J., Kim, Y., Li, S., Char, K. Amine-Reactive Poly(pentafluorophenyl acrylate) Brush Platforms for Cleaner Protein Purification. Biomacromolecules. 19 (3), 951-961 (2018).
- Cullen, S. E., Schwartz, B. D. An improved method for isolation of H-2 and Ia alloantigens with immunoprecipitation induced by protein A-bearing staphylococci. The Journal of Immunology. 117 (1), 136-142 (1976).
- Sisson, T. H., Castor, C. W. An improved method for immobilizing IgG antibodies on protein A-agarose. Journal of Immunology Methods. 127 (2), 215-220 (1990).
- Peritz, T., et al. Immunoprecipitation of mRNA-protein complexes. Nature Protocols. 1 (2), 577-580 (2006).
- Zhang, Z., Chen, S., Jiang, S. Dual-functional biomimetic materials: nonfouling poly (carboxybetaine) with active functional groups for protein immobilization. Biomacromolecules. 7 (12), 3311-3315 (2006).
- Yao, Y., et al. NHS-ester functionalized poly(PEGMA) brushes on silicon surface for covalent protein immobilization. Colloids and Surfaces B: Biointerfaces. 66 (2), 233-239 (2008).
- Ma, J., et al. Facile fabrication of microsphere-polymer brush hierarchically three-dimensional (3D) substrates for immunoassays. Chemical Communications. 51 (31), 6749-6752 (2015).
- Chong, Y., et al. Thiocarbonylthio compounds [SC (Ph) S− R] in free radical polymerization with reversible addition-fragmentation chain transfer (RAFT Polymerization). Role of the free-radical leaving group (R). Macromolecules. 36 (7), 2256-2272 (2003).
- Jochum, F. D., Theato, P. Temperature- and Light-Responsive Polyacrylamides Prepared by a Double Polymer Analogous Reaction of Activated Ester Polymers. Macromolecules. 42 (16), 5941-5945 (2009).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. JoVE. , Cambridge, MA. (2018).
- Chua, G. B. H., Roth, P. J., Duong, H. T. T., Davis, T. P., Lowe, A. B. Synthesis and Thermoresponsive Solution Properties of Poly[oligo(ethylene glycol) (meth)acrylamide]s: Biocompatible PEG Analogues. Macromolecules. 45 (3), 1362-1374 (2012).
Tags
Kemi sag 141 Poly (pentafluorophenyl acrylat) 3-aminopropyltriethoxysilane reaktive polymer pensel efter polymerisering functionalization antistof immobilisering immunoprecipitationErratum
Formal Correction: Erratum: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification
Posted by JoVE Editors on 04/30/2019.
Citeable Link.
An erratum was issued for: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification. Throughout the article, the term "3-aminopropyltriethoxysilane" has been replaced with "3-aminopropyltrimethoxysilane", and "APTES" with "APTMS".
The Keywords were updated from:
Poly(pentafluorophenyl acrylate), 3-aminopropyltriethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
to:
Poly(pentafluorophenyl acrylate), 3-aminopropyltrimethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
The Abstract was updated from:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltriethoxysilane (APTES) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTES. The deposition of APTES and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
to:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltrimethoxysilane (APTMS) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTMS. The deposition of APTMS and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
The fourth paragraph of the Introduction was updated from:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTES linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTES. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
to:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTMS linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTMS. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
Step 2.1 of the Protocol was updated from:
Treatment of SiO2 beads with APTES
to:
Treatment of SiO2 beads with APTMS
Step 2.1.1 of the Protocol was updated from:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTES and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
to:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTMS and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
Step 2.1.3 of the Protocol was updated from:
Transfer the solution to a conical tube. To isolate the APTES functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
to:
Transfer the solution to a conical tube. To isolate the APTMS functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
Step 2.1.4 of the Protocol was updated from:
NOTE: The final suspension contains the APTES functionalized SiO2 beads dispersed in 4 mL of DMSO.
to:
Combine the methanol washed SiO2 beads with 3 mL of dimethyl sulfoxide (DMSO). Shake the mixture by hand, or if necessary sonicate for a few seconds, until the beads are fully dispersed in DMSO. Centrifuge the beads at 10,000 x g for 5 min, then remove the supernatant. Repeat the step to ensure complete solvent exchange from methanol to DMSO.
NOTE: The final suspension contains the APTMS functionalized SiO2 beads dispersed in 4 mL of DMSO.
Step 2.2 of the Protocol was updated from:
Grafting poly(PFPA) to APTES functionalized SiO2 beads
to:
Grafting poly(PFPA) to APTMS functionalized SiO2 beads
Step 2.2.2 of the Protocol was updated from:
Add 1 mL of APTES functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
to:
Add 1 mL of APTMS functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
Step 3.4 of the Protocol was updated from:
To prepare APTES functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTES functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
to:
To prepare APTMS functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTMS functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
The first paragraph of the Representative Results was updated from:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTES and poly(PFPA) grafting process, bare SiO2 beads, APTES functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
to:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTMS and poly(PFPA) grafting process, bare SiO2 beads, APTMS functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
Figure 1 was updated from:
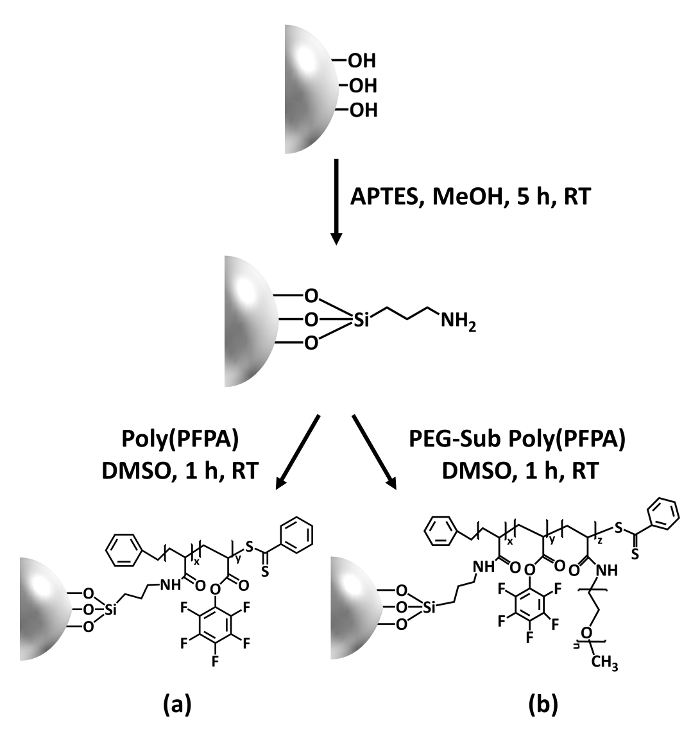
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTES as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
to:
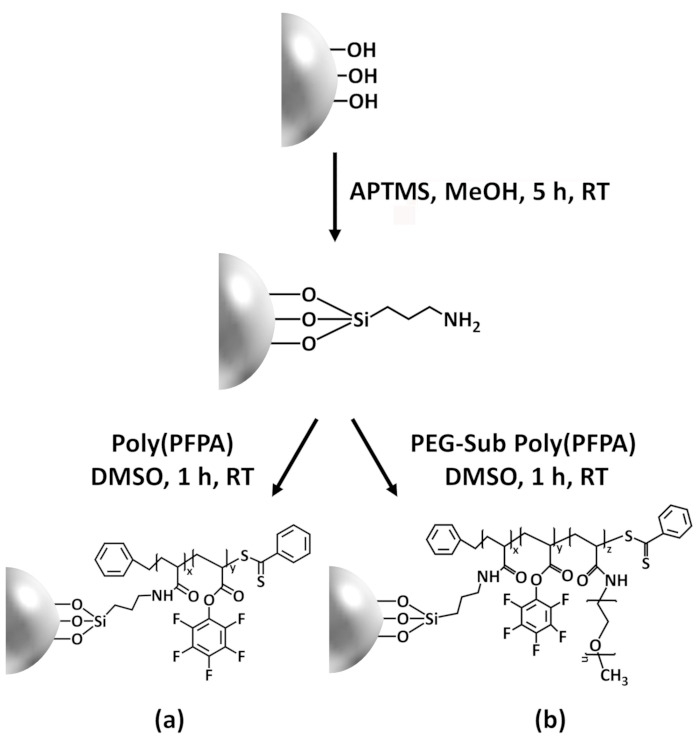
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTMS as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
Figure 2 was updated from:
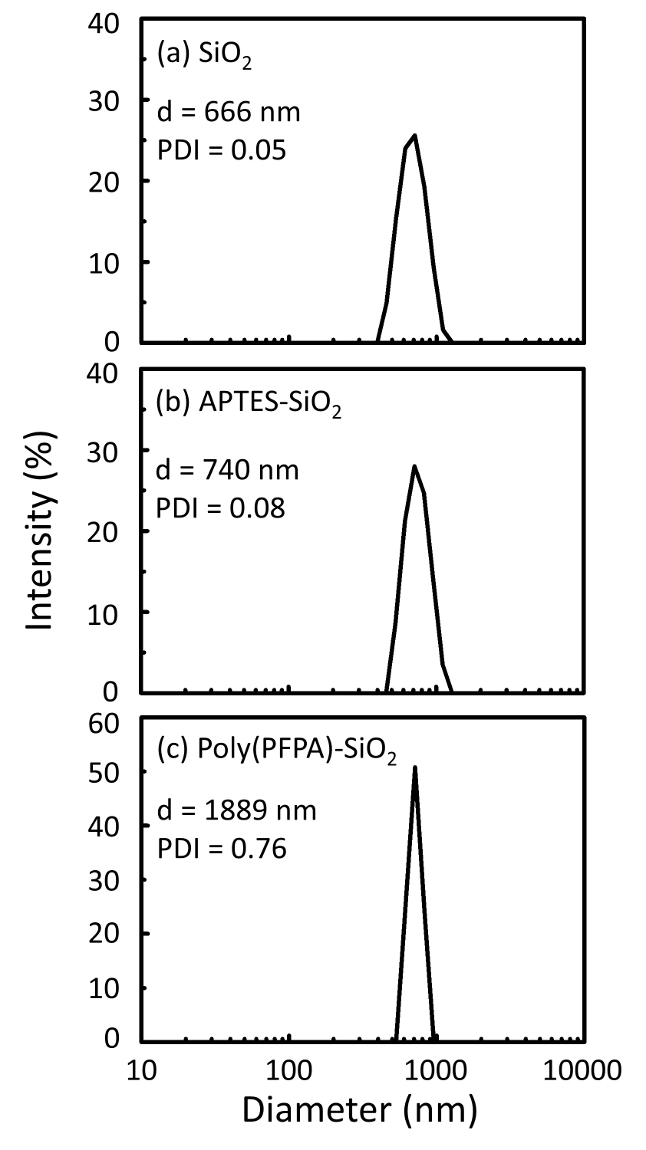
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTES functionalized SiO2 beads (APTES-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
to:
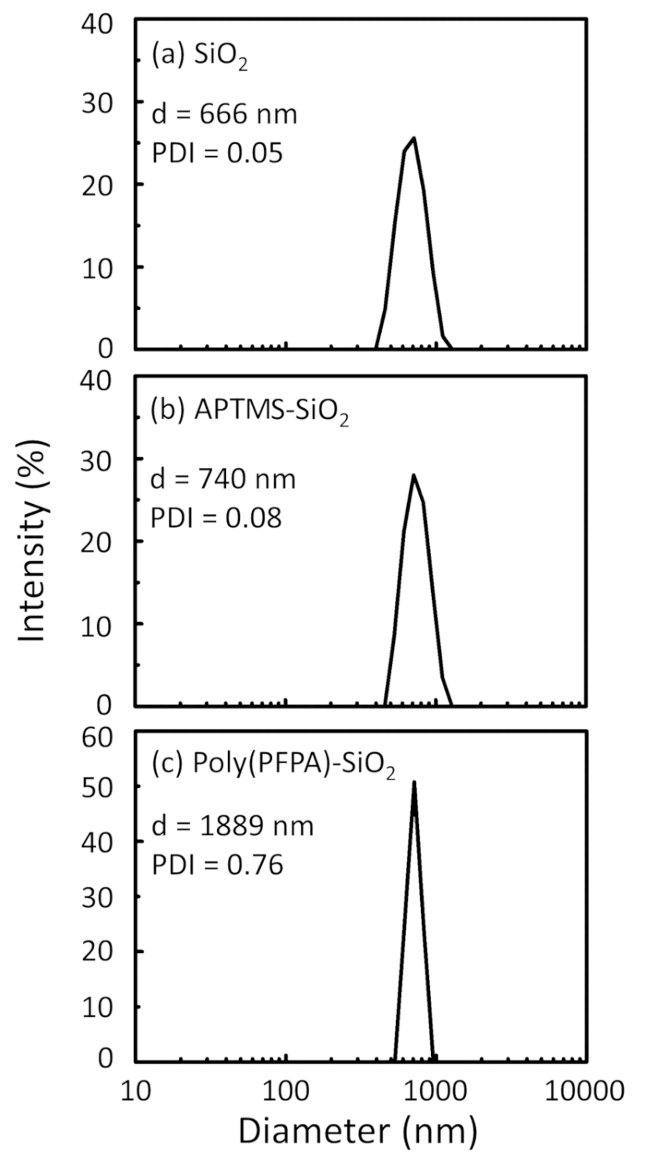
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTMS functionalized SiO2 beads (APTMS-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
Figure 3 was updated from:
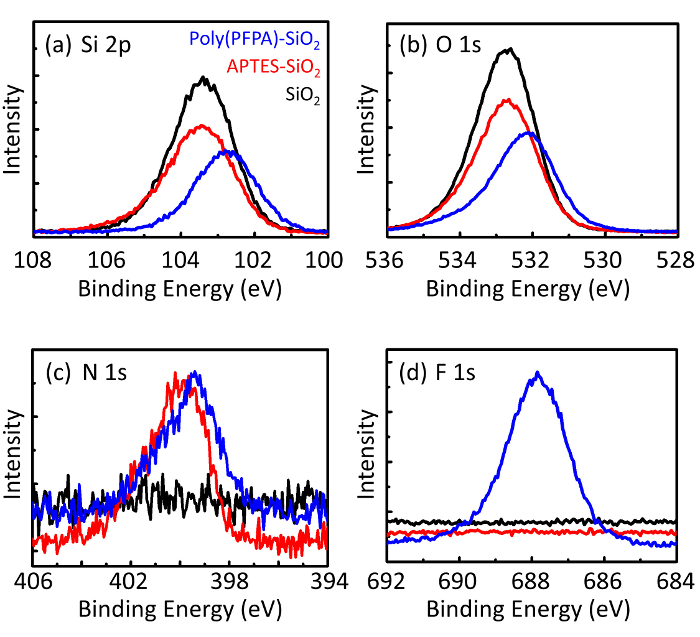
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTES functionalized SiO2 beads (APTES-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
to:
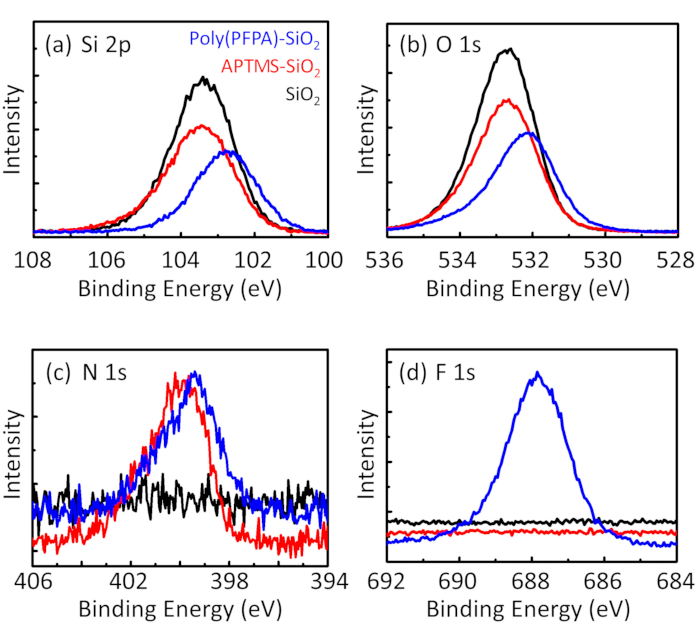
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTMS functionalized SiO2 beads (APTMS-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
The first and second paragraphs of the Discussion were updated from:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTES as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTES, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTES linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTES treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTES treatment, N 1s peak associated with the amine groups on APTES is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTES, then with poly(PFPA).
to:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTMS as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTMS, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTMS linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTMS treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTMS treatment, N 1s peak associated with the amine groups on APTMS is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTMS, then with poly(PFPA).



