ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Un protocolo para la preparación de poli (acrilato del pentafluorophenyl) (granos de sílice poly(PFPA)) injertado se presenta. La superficie de poly(PFPA) funcionalizados es inmovilizada con anticuerpos y utilizada con éxito para la separación de proteínas por inmunoprecipitación.
Abstract
Demostrar un método simple para preparar polivinílico (acrilato del pentafluorophenyl) (poly(PFPA)) injertado granos de sílice para la inmovilización de anticuerpos y aplicación posterior de inmunoprecipitación (IP). La superficie injertada poly(PFPA) es preparada mediante un proceso de dos pasos simples. En el primer paso, 3 aminopropyltriethoxysilane (APTES) se deposita como una molécula de vinculador en la superficie de la sílice. En el segundo paso, poly(PFPA) homopolímero, sintetizado mediante la adición reversible y fragmentación cadena transferencia (balsa) la polimerización, se injerta a la molécula del vinculador mediante la reacción de intercambio entre las unidades del pentafluorophenyl (PFP) en el polímero y los grupos de la amina de APTES. La deposición de APTES y poly(PFPA) en el sílice partículas son confirmadas por espectroscopia de fotoelectrones de rayos x (XPS), así como supervisadas por el cambio de tamaño de partícula medido por dispersión dinámica de la luz (DLS). (Amino-PEG) también se realiza para mejorar el hydrophilicity superficial de los granos, sustitución parcial de poly(PFPA) con poly(ethylene glycol) amine functionalized. La poly(PFPA) PEG-sustituido injertado silicona granos luego se inmovilizan con anticuerpos para el uso de IP. Para la demostración, se emplea un anticuerpo contra la proteína quinasa RNA-activado (PKR) y eficiencia IP se determina por borrar occidental. Los resultados del análisis muestran que los granos de anticuerpo inmovilizado de hecho pueden utilizarse para enriquecer PKR mientras que las interacciones entre proteínas no específicas son mínimas.
Introduction
Cepillos poliméricos reactivos han recibido mucho interés en los últimos años. Pueden ser utilizados para inmovilizar moléculas funcionales en materiales orgánicos o inorgánicos para crear superficies activadas con aplicaciones en áreas tales como detección y separación1,2,3,4, 5. Entre los polímeros reactivos registrados, los que contienen unidades de ester pentafluorophenyl son particularmente útiles debido a su alta reactividad con aminas y resistencia hacia la hidrólisis6. Un tal polímero es poly(PFPA), y puede ser fácilmente funcionalizada polimerización posterior con moléculas que contienen aminas primaria o secundaria7,8,9,10. Ejemplo, poly(PFPA) cepillos fueron reaccionados con amino-spiropyrans para crear superficies sensibles a la luz7.
La preparación de poly(PFPA) y sus aplicaciones se han descrito en un número de anteriores publicaciones6,7,8,9,10,11,12 ,13,14,15,16,17. En particular, Theato y colaboradores informaron la síntesis de poly(PFPA) cepillos a través de "injerto a" tanto "injerto de" métodos7,8,10,11,12 . En el "injerto a" enfoque, un poli (methylsilsesquioxane)-polivinílico (acrilato del pentafluorophenyl) (polímero híbrido de poly(MSSQ-PFPA)) fue sintetizado8,10,11,12. El componente de poly(MSSQ) fue capaz de adherencia fuerte forma con un número de diferentes superficies orgánicas e inorgánicas, permitiendo así que el componente poly(PFPA) formar una capa de pincel sobre la superficie del material cubierta. En el "injerto de" enfoque de superficie inició además reversible y polimerización de fragmentación cadena transferencia (SI-balsa) se empleó para preparar poly(PFPA) cepillos7. En este caso, un agente de transferencia de cadena inmovilizada de la superficie (SI-CTA) primero fue unido covalentemente al sustrato por reacción sílice-silano. El inmovilizado SI-CTA participó entonces en la polimerización de la SI-balsa de monómeros de la PFPA, generando poly(PFPA) densamente cepillos con enlace covalente estable al sustrato.
Mediante la utilización de los cepillos de poly(PFPA) sintetizados mediante polimerización SI-balsa, hemos demostrado recientemente la inmovilización de anticuerpos en las partículas de sílice poly(PFPA) injertado y su posterior aplicación en la purificación de la proteína18. El uso de cepillos poly(PFPA) para inmovilización de anticuerpos fue encontrado para resolver una serie de problemas asociados con la actual separación de las proteínas a través de IP. Convencional IP se basa en el uso de la proteína A/G como un enlazador para anticuerpo inmovilización19,20,21. Dado que el uso de la proteína A/G permite a los anticuerpos que se unirán con una orientación específica, se logra eficiencia de recuperación de antígeno blanco alto. Sin embargo, el uso de la proteína A/G sufre de interacción de la proteína no específica, así como la pérdida de anticuerpos durante la recuperación de la proteína, los cuales contribuyen a un alto nivel de ruido de fondo. Para resolver estas deficiencias, reticulación directo de los anticuerpos a un soporte sólido ha sido explorado22,23,24. La eficacia de estas técnicas es generalmente baja debido a la orientación aleatoria de los anticuerpos de reticulado. Para el substrato poly(PFPA) injertado, la inmovilización de anticuerpos es permanente, mediante la reacción de intercambio entre las unidades de la PFP y funcionalidad de Amina en anticuerpos. Aunque la orientación de anticuerpo es todavía aleatoria, el sistema se beneficia de tener muchos sitios PFP reactivos, controlables por el grado de polimerización. Además, demostramos que por sustitución parcial de unidades de la PFP con amino-PEG, hydrophilicity superficial puede ajustarse, mejorar la eficiencia de recuperación de proteína del sistema18. En general, las partículas de sílice poly(PFPA) injertadas mostraron ser una alternativa eficaz a IP tradicional con razonable eficiencia como mucho limpiador de fondo.
En esta contribución, se presenta un método alternativo para preparar superficie injertada poly(PFPA) para inmovilización de anticuerpos y la aplicación de la propiedad intelectual. En un proceso de dos pasos simples, como se ilustra en la figura 1, una molécula de vinculador APTES se deposita primero sobre la superficie de sílice, a continuación, el polímero de poly(PFPA) se une covalentemente a la molécula del vinculador mediante la reacción entre las unidades de la PFP en la polímero y las funciones de la amina en APTES. Este método de preparación permite el entrecruzamiento permanente de poly(PFPA) a una superficie del sustrato, pero evita muchas complicaciones asociadas a CTA SI síntesis y polimerización de la SI-balsa de poly(PFPA) cepillos. Sustitución parcial de las unidades de la PFP con amino-PEG puede aún realizarse, permitiendo ajuste de las propiedades superficiales del cepillo de polímeros. Nos muestran los granos de sílice poly(PFPA) injertado así preparados pueden ser inmovilizados con anticuerpos y utilizados para el enriquecimiento de proteínas vía IP. El procedimiento de una preparación detallada del grano, inmovilización de anticuerpos y pruebas de IP se documentan en este artículo, para los lectores interesados en la búsqueda de una alternativa a la proteína convencional A/G basado en IP.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. preparación de homopolímero de Poly(PFPA)
- Recristalización de AIBN
- 5 g de 2,2'-azobis(2-methylpropionitrile) (AIBN) se combinan con 25 mL de metanol en un matraz de 250 mL. Sumerja el vaso en un baño de aceite de 60 ° C, luego agitar vigorosamente la mezcla con una barra de agitación hasta que se haya disuelto completamente AIBN.
- Filtrar la solución caliente a través de papel filtro (retención de partículas de 5-8 μm) y guardar el filtrado a 4 ° C para permitir que los cristales que forma lentamente.
- Recoger el AIBN recristalizada por filtración. Combinar el producto recogido con 25 mL de metanol fresco y repita el proceso de recristalización.
- Seco durante la noche 2 x AIBN recristalizado en una estufa de vacío a temperatura ambiente (RT). Almacenar el producto en la oscuridad a <-10 ° C.
- Síntesis de benzyl dithiobenzoate25
- Preparar un matraz de fondo redondo 500 mL cuello tres equipado con una barra de agitación magnética, un condensador de temperatura, un embudo y una membrana de goma. Conectar el matraz a la línea de gas de nitrógeno a través del condensador temperatura y enjuague el interior aire con nitrógeno. Inserte un termómetro a través del tabique. Añadir (0.041 mol) de 41 mL de solución de 1 M de bromuro del phenylmagnesium en tetrahidrofurano (THF) a través de una jeringa a través del mismo tabique.
- Caliente la solución de bromuro del phenylmagnesium a 40 ° C en baño de aceite. Añadir a continuación 3,1 g (0.041 mol) de disulfuro de carbono a través del embudo poco a poco, manteniendo la temperatura de la solución a 40 ° C.
- Añadir a la mezcla resultante en el embudo más 15 min aumento de la temperatura de reacción a 50 ° C. g 7,1 (0.042 mol) de bromuro de bencilo Continúe revolviendo a esta temperatura durante 45 minutos.
- Transferir la mezcla de reacción a un embudo de separatory y diluir con 15 mL de agua helada. Extraer el producto añadiendo 15 mL de éter dietílico y quitar la capa más baja de agua. Repetir la extracción con éter dietílico dos veces más.
- Las fases orgánicas combinadas con abundante cantidad de agua y salmuera (solución de 50% (p/v) de NaCl en agua) de lavar y secar el producto sobre el sulfato de magnesio anhidro.
- Eliminar el disolvente en vacío a 35 ° C utilizando un evaporador rotatorio.
- Purifique el producto por cromatografía en columna con 400 mL de gel de silicona (tamaño de poro 60 Å, tamaño de partícula de malla de 63-200) y éter de petróleo como eluyente, rendimiento 5 g de benzyl dithiobenzoate (BDB) como aceite rojo. Confirmar la pureza de producto por 1H NMR (400 MHz, CDCl3): δ 8.02 7.99 (2 H, m), 7,55 7,50 (1 H, m), 7,29 de 7.41 (7 H, m), 4.60 (2 H, s).
- Síntesis de poly(PFPA) via balsa polimerización9,26
- Monómero PFPA disponible comercialmente contiene pequeña cantidad de inhibidores. Antes de la polimerización, remover los inhibidores pasando el monómero a través de una jeringa desechable llena de alúmina básica.
- Agregar 0,4 mg (0.0024 mmol) de AIBN recristalizada, 4,3 mg (0.018 mmol) de BDB, 1012 mg (4,25 mmol) de PFPA inhibidor libre y 0,7 mL de anisole anhidro en un matraz Schlenk de 20 mL.
- Conectar el matraz a la línea de Schlenk y desgasificar la mezcla con al menos tres ciclos de congelación-descongelación de la bomba. Brevemente, congelación de la mezcla de reacción en un baño de nitrógeno líquido. Se aplica vacío para eliminar el gas en el espacio. Sellar el frasco y luego retire del nitrógeno líquido para permitir que el contenido se descongele a TA.
- Colocar el matraz en un baño de aceite de 70 ° C y reacciona durante 4 horas en purga de2 N.
- Para terminar la reacción, retirar el matraz del baño de aceite y exponer el contenido de la reacción al aire.
- Precipitar el polímero en metanol frío, luego secar el polímero recuperado en una estufa de vacío a 40 ° C durante la noche.
- Para medir el peso molecular de polímero, utiliza cromatografía de gel permeación (GPC). Uso de THF como tasa de flujo de la fase móvil a 35 ° C con un 1 mL/min y construir la curva de calibración utilizando patrones de poliestireno monodispersa. Para obtener medición de GPC, disolver el polímero en THF (1-2 mg/mL) y el filtro a través del filtro de desechables politetrafluoroetileno (PTFE) de 0,2 μm. Inyectar 100 μL de la muestra en el instrumento de la GPC. Convertir el tiempo de retención de muestra medidos en peso molecular usando la curva de calibración de poliestireno.
2. preparación de Poly(PFPA) funcionalizados SiO2 granos
- Tratamiento de SiO2 granos con APTES
- SiO2 partículas están disponibles en forma de una suspensión acuosa al 5% (w/v). 0,8 mL de SiO2 suspensión se combinan con 40 mg de APTES y 8 mL de metanol en un vial de centelleo 20 mL equipado con una barra de agitación.
- Permitir la reacción proceder a temperatura ambiente durante 5 horas con agitación vigorosa.
- Transferir la solución a un tubo cónico. Para aislar las APTES funcionalizados SiO2 granos, centrifugar la solución a 10.000 x g durante 5 minutos, luego quite el sobrenadante. Lavar los granos por volver a los dispersantes en 3 mL de metanol fresco. Agite el tubo con la mano para mezclar, pero si es necesario, mejorar la dispersión por sonicación en un baño de agua durante unos segundos. Centrifugue los granos a 10.000 x g durante 5 minutos retirar el sobrenadante y repetir el lavado una vez más.
- Combinar el metanol lavado SiO2 granos con 3 mL de dimetilsulfóxido (DMSO). Agite la mezcla a mano, o si es necesario someter a ultrasonidos durante unos segundos, hasta que los granos están totalmente dispersas en DMSO. Centrifugue los granos a 10.000 x g durante 5 minutos, luego retire el sobrenadante. Repita el paso para asegurar el completo intercambio de solvente de metanol a DMSO.
Nota: La suspensión final contiene las APTES funcionalizados SiO2 granos dispersión en 4 mL de DMSO. - Para comprobar la distribución de tamaño de partícula, realizar análisis DLS. Tomar una gota de la suspensión preparada en el paso 2.1.4 y lugar en una cubeta UV desechable. Diluir la muestra llenando la cubeta con DMSO fresco hasta que esté 2/3 completo. Introduzca la muestra en el soporte de celular para comenzar la adquisición de datos. Para la medición de tamaño de partícula, utilice los siguientes parámetros de configuración: temperatura: 25 ° C; Tiempo de equilibrado: 120 s; Duración de medición: automático.
- Para comprobar la composición superficial, realizar análisis XPS. Seco una pequeña muestra de la suspensión preparada en el paso 2.1.4 en estufa de vacío a 40 ° C durante la noche. Tome el paquete y polímero seca uniformemente sobre un portamuestras de 0,5 x 0,5 cm. Cargar la muestra en la cámara de alto vacío (10-8 torr) y comenzar la adquisición de datos. Para el particular XPS instrumento, generar los fotoelectrones usando un monocromático Al Kα radiografía funcionados en 15 kV y mA 6,7 y recoger mediante ampliación de modo híbrido con el analizador en un eV 50 pasan energía para espectros de alta resolución, y un eV 100 pasar energía para los estudios elementales.
- Injerto poly(PFPA) de APTES funcionalizados SiO2 granos
- Preparar la solución poly(PFPA) 20 mg de poly(PFPA) en 2 mL de DMSO en un vial de centelleo 20 mL de disolución.
Nota: En este estudio, se utiliza un poly(PFPA) de relativamente bajo peso molecular (20 kg/mol). Así, a pesar de la concentración de polímero de alta (10 mg/mL), no se observa ninguna evidencia de la reticulación del polímero. Si se utiliza un polímero de peso molecular mayor, concentración de la solución de polímero deba ajustarse para evitar entrecruzamiento posible. - Añadir 1 mL de APTES funcionalizados SiO2 cuentas suspendidas en DMSO (del paso 2.1.4) para la solución de poly(PFPA). Reaccionan a temperatura ambiente durante 1 h con agitación vigorosa.
- Aislar los poly(PFPA) injertado SiO2 granos por centrifugación a 10.000 x g durante 5 min, seguida de la eliminación del sobrenadante. Lavar los granos mediante la adición de 3 mL de DMSO y mezclar bien agitando con la mano o algunos segundos de sonicación. Centrifugue los granos a 10.000 x g durante 5 minutos, luego retire el sobrenadante. Repita el lavado de los granos de2 SiO poly(PFPA) injertado con DMSO dos veces.
- Lavar los granos dos veces más con agua destilada triple (TDW). En este paso, combinar las perlas con 3 mL de capacidad, entonces la mezcla agitando con la mano o algunos segundos de sonicación. Centrifugue los granos a 10.000 x g durante 5 minutos, luego retire el sobrenadante.
- Para comprobar la distribución de tamaño de partícula, realizar siguiendo el procedimiento descrito en el paso 2.1.5 DLS. Para comprobar la química de superficies, realizar XPS siguiendo el procedimiento descrito en el paso 2.1.6.
- Preparar la solución poly(PFPA) 20 mg de poly(PFPA) en 2 mL de DMSO en un vial de centelleo 20 mL de disolución.
3. preparación de SiO2 granos injertan con PEG-Substituted Poly(PFPA)
- Para preparar la solución poly(PFPA), disolver 20 mg de poly(PFPA) en 2 mL de DMSO en un vial de centelleo de 20 mL.
- Para preparar la solución de PEG, disolver amine functionalized PEG en 1 mL de DMSO. La cantidad exacta de PEG utilizado está determinado por el grado deseado de la sustitución de la PFP, determinada por la ecuación se muestra a continuación:
Cantidad de amino-PEG (g/g-poly(PFPA)) = (N_poly(PFPA) x % PEG-Sub) x (MW_PEG / MW_poly(PFPA))
donde N_poly(PFPA) = poly(PFPA) grado de polimerización
% Sub PEG = sustitución de PEG por ciento
MW_PEG = peso molecular de amino-PEG
MW_ poly(PFPA) = peso molecular de poly(PFPA) - Transferir la solución de PEG a la solución de poly(PFPA). Reaccionan a temperatura ambiente durante 1 h con agitación vigorosa.
- Para preparar APTES funcionalizados SiO2 cuentas suspendidas en DMSO, la misma seguir instrucciones indicadas en el paso 2.1. Transfiera 1 mL de la suspensión de grano en la solución de PEG-substituted poly(PFPA) preparada en el paso 3.3. Permitir que el injerto entre poly(PFPA) y APTES funcionalizados SiO2 cuentas para proceder a temperatura ambiente durante 1 h con agitación vigorosa.
- Aislar los granos por centrifugación a 10.000 x g durante 5 min, seguida de la eliminación del sobrenadante. Lavar los granos mediante la adición de 3 mL de DMSO y mezclar bien agitando con la mano o algunos segundos de sonicación. Centrifugue los granos a 10.000 x g durante 5 minutos, luego retire el sobrenadante. Repetir el lavado de DMSO dos veces.
- Lavar los granos dos veces más con el TDW. En este paso, combinar las perlas con 3 mL de capacidad, entonces la mezcla agitando con la mano o algunos segundos de sonicación. Centrifugue los granos a 10.000 x g durante 5 minutos, luego retire el sobrenadante.
- Secar los granos a 40 ° C en una estufa de vacío durante la noche.
4. anticuerpo inmovilización en Poly(PFPA) injertado SiO2 granos
Nota: Se utiliza el mismo procedimiento independientemente de la sustitución de PEG por ciento en poly(PFPA). Preparar el tampón fosfato salino (PBS) por disolución de la tableta de PBS en TDW. Preparar solución salina tamponada fosfato 0,1% (v/v) con Tween-20 (SAFT) mediante la adición de 1/1000 de Tween-20 en PBS.
- Añadir 5 mg de poly(PFPA) injertado SiO2 bolas a un tubo de microcentrífuga de 1,5 mL.
- Lavar los granos al añadir 800 μl de PBS y mezclar bien todo con un vórtex. Centrifugue los granos a 10.000 x g a temperatura ambiente durante 1 minuto, retirar el sobrenadante y repetir el lavado tres veces.
- Añadir 350 μl de PBS fresco, 50 μl 0,1% (v/v) Saft y 6.67 μg de anticuerpo. Incubar 20 h en un rotador a 4 ° C.
- Lavar los granos para eliminar los anticuerpos no Unidos. Centrifugue los granos a 400 x g y 4 ° C por 1 min Quite el sobrenadante y añadir 400 μL de tampón de lisis con cuidado. Suavemente, vuelva a suspender las cuentas mediante pipeteo arriba y abajo por cinco veces.
Nota: Tampón de lisis utilizado para lavar los granos debe ser la misma utilizada durante la lisis celular y la propiedad intelectual, excepto que la adición de Ditiotreitol y proteasa inhibidor son opcional, (ver paso 5). - Repetir este lavado tres veces. Después del último lavado, eliminar el sobrenadante tanto como sea posible.
5. la célula Lysis e inmunoprecipitación
- Preparación de buffer de lisis y tampón de lavado
- Preparar el tampón de lisis (50 mM Tris-HCl (pH 8,0), 100 mM KCl, 0.5% (v/v) NP-40, glicerol al 10% (v/v), 1 mM Ditiotreitol (DTT) y proteasa inhibidor de cóctel).
- Preparar el tampón de lavado (50 mM Tris-HCl (pH 8,0), 100 mM KCl, 0.1% (v/v) NP-40 y 10% (v/v) glicerol).
- Almacenar las soluciones a 4 º C.
- Preparación de las células
- Semilla (células HeLa) uno o dos días antes del experimento IP y crecen las células a 37 ° C y 5% CO2.
- Recoger aproximadamente 1.4 x 107 células con un raspador celular y transferencia en un tubo cónico de 15 mL. Centrifugar las células a 380 x g a temperatura ambiente durante 3 minutos Retire el sobrenadante y resuspender con 1 mL de PBS frío y la transferencia en un tubo de microcentrífuga de 1,5 mL.
- Centrifugar las células a 10.000 x g a 4 ° C durante 30 s. Retire el sobrenadante limpio. Gránulos de células pueden almacenarse a-80 ° C después de retirar el sobrenadante.
- Preparación de lysates de la célula
- Resuspenda el sedimento celular con 400 μL del buffer de lisis. Someter a ultrasonidos las células usando un ultrasonicador.
- Después de la sonicación, vortex brevemente y centrifugar el lisado a 20.000 x g a 4 ° C durante 10 minutos.
- Transferir el sobrenadante a un nuevo tubo de centrífuga de 1.5 mL.
- Inmunoprecipitación
- Transferir 300 μL de lisado de célula a anticuerpo previamente preparadas se incubaron poly(PFPA) injertado SiO2 granos. Conservar 30 μl de la célula lisada como la muestra de entrada en un nuevo tubo de microcentrífuga. Tienda la entrada muestra a 4 ° C.
Nota: La cantidad total de proteína en lisado de célula debe ser aproximadamente de 4 mg. - Incubar la mezcla del lisado cuentas por 3 h en un rotador a 4 ° C.
- Centrifugar la mezcla a 400 x g a 4 ° C durante 1 minuto, retirar el sobrenadante y añadir 400 μL de tampón de lavado cuidadosamente. Suavemente, vuelva a suspender las cuentas mediante pipeteo arriba y abajo unas cinco veces.
- Repetir este lavado tres veces. Después del último lavado, eliminar el sobrenadante tanto como sea posible.
- Preparar 2 x sodio dodecil sulfato (SDS) carga del tinte (glicerol al 25% (v/v), 0.1% (p/v) bromo fenol azul (BPB), 60 mM Tris-HCl (pH 6.8), 2% (p/v) de SDS y 2,75 mM 2-Mercaptoetanol). Tienda 2 x tinte de carga SDS a-20 ° C. Añadir 30 μl de 2 x tinte de carga SDS a los granos y la muestra de entrada almacenada y calentarlas durante 10 minutos a 95 ° C.
- Después de calentar, analizar la muestra utilizando Western Blot27, o almacenar la muestra a-20 ° C.
- Transferir 300 μL de lisado de célula a anticuerpo previamente preparadas se incubaron poly(PFPA) injertado SiO2 granos. Conservar 30 μl de la célula lisada como la muestra de entrada en un nuevo tubo de microcentrífuga. Tienda la entrada muestra a 4 ° C.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Un esquema para la preparación de poly(PFPA) había injertado SiO2 granos, con o sin PEG sustitución se muestra en la figura 1. Para controlar las APTES y poly(PFPA) proceso de pelado SiO2 granos, el injerto APTES funcionalizados SiO2 granos y poly(PFPA) injertado SiO2 granos se caracterizan por DLS (figura 2) y XPS (figura 3). Eficiencias IP de las cuentas son determinadas por Western blot. La figura 4 muestra el Western Blot resultados para IP usando 1% PEG-substituted poly(PFPA) injertado granos, donde los granos se someten a ningún anticuerpo, anticuerpos no específicos o anticuerpo anti-PKR. La figura 5 muestra los resultados Western blot para el uso de IP 0% PEG-substituted poly(PFPA) injertado granos y granos 1% PEG-substituted poly(PFPA) injertado, ambos se incubaron con anticuerpos anti-PKR.

Figura 1: Esquema para la preparación de poly(PFPA) había injertado SiO2 granos con APTES como molécula de vinculador. (una) Poly(PFPA) injertado granos. (b) parcialmente PEG-substituted poly(PFPA) injertado granos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: medidas de DLS para (a) pelado SiO2 granos (SiO2), (b) APTES funcionalizados SiO2 granos (APTES-SiO2) y (c) poly(PFPA) injertado SiO2 granos (poly (PFPA)-SiO2), dispersos en DMSO. El diámetro promedio Z (d) y el índice de polidispersidad (PDI) de cada muestra se divulgan. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Espectro XPS para pelado SiO2 granos (SiO2), APTES funcionalizados SiO2 granos (APTES-SiO2), y poly(PFPA) injertado SiO2 granos (poly (PFPA)-SiO2). Los picos examinados corresponden a (a) Si 2 p, (b) O 1s, (c) N 1s y (d) F 1s. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Western Blot resultados para IP usando 1% PEG-substituted poly(PFPA) injertado granos, tratados con ningún anticuerpo (carril 2), una mezcla de anticuerpos no específicos, normal de conejo IgG (carril 3) o anti-PKR anticuerpo (carril 4). Carril 1 se muestra la mezcla de proteína de entrada antes de IP. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Western Blot resultados de IP con 0% PEG-substituted poly(PFPA) injertado granos (carril 2) y 1% PEG-substituted poly(PFPA) injertado granos (carril 3), ambos son tratados con anticuerpos anti-PKR. Carril 1 se muestra la mezcla de proteína de entrada antes de IP. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La síntesis de poly(PFPA) injertado SiO2 cuentas se ilustra en la figura 1. Mediante el empleo de APTES como molécula de vinculador, cepillos de poly(PFPA) covalente injertados a SiO2 substrato pueden prepararse mediante un proceso de dos pasos simples. Aunque algunas de las unidades de la PFP son sacrificados por la reacción con APTES, se espera que un gran número de las unidades de la PFP permanecer disponible para la reacción posterior con amino-PEG o anticuerpos. Se conocen los grupos de la PFP para formar superficies de baja energía para que poly(PFPA) cepillos hacen no solvato en agua28. Para el uso de IP, los anticuerpos deben ser inmovilizada en los cepillos de poly(PFPA), y esta reacción de intercambio se realiza en solución acuosa tamponada para preservar la actividad de los anticuerpos. Como se informó en nuestra publicación anterior, sustitución parcial de las unidades de la PFP con moléculas hidrofílicas como amine functionalized PEG puede mejorar hydrophilicity superficial, conduce a la inmovilización de anticuerpos mayor eficacia18. En este estudio, parcialmente PEG sustituido poly(PFPA) es preparado, entonces injertados a la superficie de SiO2 usando la misma molécula de vinculador APTES. En general, los métodos que muestra en la figura 1 permiten la preparación de las superficies poly(PFPA) injertados con diferentes grados de sustitución de la clavija. Estos cepillos poliméricos con propiedades ajustables superficie proporcionan una plataforma ideal para la inmovilización de anticuerpos y posterior aplicación de IP.
El proceso de preparación de grano es controlado por la DLS y XPS. Los resultados DLS para varios funcionalizados SiO2 granos en DMSO se resumen en la figura 2. El pelado SiO2 granos presentan diámetro hidrodinámico de 666 nm, de acuerdo con el fabricante informó el tamaño del grano (0.676 μm; SD = 0.03 μm). Después del tratamiento de APTES, el diámetro de grano aumenta a 740 nm; y con tratamiento de poly(PFPA), el diámetro de grano más aumenta a 1889 nm. Es importante señalar que el índice de polidispersidad (PDI) para las cuentas poly(PFPA) injertado es bastante grande (PDI = 0.76), que es indicativo de muestra de mala calidad que contienen agregados grandes. Aunque la curva DLS solo muestra un pico de tamaño nanométrico, pequeña cantidad de agregados puede estar presente en la suspensión. También se examinan los funcionalizados SiO2 granos por XPS para determinar composición superficial (figura 3). Después del tratamiento de APTES, N 1s pico asociado con los grupos amina APTES es detectado. Y se detectaron después del tratamiento poly(PFPA), pico F 1s asociado con las unidades de la PFP en el polímero. Juntos, estos datos muestran el éxito funcionalización de la superficie de SiO2 , primero con APTES, luego a poly(PFPA).
Para mostrar que los granos de poly(PFPA) injertado pueden utilizarse para el enriquecimiento de proteína a través de IP, se utilizan 1% PEG-substituted poly(PFPA) injertado granos e incubados con ningún anticuerpo, una mezcla de anticuerpos de IgG de conejo no específicas o anticuerpos anti-PKR. Celular que contiene el objetivo PKR lisado fue extraído de la célula, y enriquecimiento de PKR entonces fue realizada a través de IP utilizando los tres tipos de granos. Para determinar la eficiencia de la IP, las muestras de proteínas eluídas se analizaron contra dos diferentes anticuerpos por Western blot. Anticuerpo anti-PKR fue utilizado para visualizar la cantidad de PKR recuperado. Y anticuerpo anti-GAPDH (gliceraldehído-3-fosfato deshidrogenasa) se utilizó como control negativo como GAPDH es una proteína abundante que no interactúa con PKR. Como se muestra en la figura 4, cuentas de inmovilizado sin anticuerpos o resultado de mezcla de anticuerpos no específicos en la no recuperación PKR. En contraste, los granos se incubaron con el anticuerpo anti-PKR pueden enriquecer con éxito PKR, tal como se indica por la presencia de una fuerte banda PKR y la ausencia de banda GAPDH. Estos resultados sugieren poly(PFPA) PEG-sustituido escobillas de hecho pueden ser funcionalizados con anticuerpos y utilizados para el enriquecimiento selectivo de la proteína diana. Nota Cuando se comparan con eficiencias de recuperación de proteínas de sistemas diferentes de grano, los experimentos IP así como el posterior Western Blot análisis debe realizarse al mismo tiempo. Debido a las variaciones inherentes en la realización de estos experimentos, datos obtenidos en ensayos separados deben no ser directamente en comparación.
Como se informó antes, el hydrophilicity superficial de los cepillos de poly(PFPA) desempeña un papel clave en IP eficacia18. La figura 5 muestra el Western Blot datos para IP recuperado muestras proteína 0% PEG-substituted poly(PFPA) injertado granos y granos de poly(PFPA) PEG-sustituido injertado de 1%. En ambos casos, los granos fueron inmovilizados con anticuerpos anti-PKR. Mientras que el uso de 0% PEG-substituted poly(PFPA) resultados en la baja eficiencia de recuperación PKR, la poly(PFPA) PEG-sustituido 1% muestra una mejoría significativa, indicada por el enriquecimiento selectivo de la blanco PKR sobre GAPDH no objetivo. De acuerdo con nuestra anterior publicación18, el PEG el tratamiento aumentó el hydrophilicity superficial del cepillo poly(PFPA), permitiendo que más unidades de la PFP sean accesibles para la inmovilización de anticuerpos, conduce a la mejora observada en la eficacia IP. Tenga en cuenta, la sustitución de PEG por ciento reportada en este estudio no es directamente comparable a la reportado en nuestro estudio anterior que usó SI balsa sintetizado poly(PFPA) cepillos. Los dos casos emplean métodos de preparación de cepillo de polímeros muy diversos, por lo que la cantidad de unidades de la PFP con PEG igual carga se espera que sea muy diferente. Sin embargo, las observaciones de los dos estudios coinciden cualitativamente, ambos señalando a hydrophilicity superficial como un parámetro de control clave para el logro de alta eficiencia IP.
Mientras hydrophilicity superficial influye en la cantidad de fijación de anticuerpos a los cepillos de poly(PFPA), también tiene un efecto significativo sobre fondo IP por enriquecimiento no específicos. En un experimento típico de IP, se realizan muchos pasos de lavado para eliminar las proteínas no Unidas. Cuando los granos son muy hidrofóbicos, tales como los que tienen 0% sustitución de PEG, tienden a formar grandes agregados que son difíciles de romperse aparte. En este caso, proteínas no específicas pueden quedar atrapadas dentro de las estructuras globales y lavado no puede ser suficiente para quitar, llevando a un incremento de fondo. Por lo tanto, al realizar la IP, es importante optimizar la propiedad superficial del grano, y debe prestarse atención para asegurar que razonablemente se dispersan los granos.
En general, hemos demostrado un proceso de dos pasos sencillos para preparar poly(PFPA) injertado SiO2 cuentas y demostró que el hydrophilicity superficial de los granos puede afinarse con sustitución parcial de las unidades de la PFP con amino-PEG. Estos pinceles de polímero fueron utilizados con éxito para el enriquecimiento de proteína blanco a través de IP, presentándose como una alternativa a la tradicional proteína A/g había basado IP técnica. Esperamos que poly(PFPA) cepillos para encontrar aplicación en muchas otras áreas que requieran inmovilización de biomoléculas.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Este trabajo fue financiado por la Agencia para el desarrollo de defensa (Grant no. UD170039ID).
Materials
| Name | Company | Catalog Number | Comments |
| 2,2-Azobisisobutyronitrile, 99% | Daejung Chemicals | 1102-4405 | |
| Methyl alcohol for HPLC, 99.9% | Duksan Pure Chemicals | d62 | |
| Phenylmagnesium bromide solution 1.0 M in THF | Sigma-Aldrich | 331376 | |
| Carbon disulfide anhydrous, ≥99% | Sigma-Aldrich | 335266 | |
| Benzyl bromide, 98% | Sigma-Aldrich | B17905 | |
| Petroleum ether, 90% | Samchun Chemicals | P0220 | |
| Ethyl ether, 99% | Daejung Chemicals | 4025-4404 | |
| Magnesium sulfate anhydrous, powder, 99% | Daejung Chemicals | 5514-4405 | |
| Pentafluorophenyl acrylate | Santa Cruz Biotechnology | sc-264001 | contains inhibitor |
| Aluminium oxide, activated, basic, Brockmann I | Sigma-Aldrich | 199443 | |
| Sodium Chloride (NaCl) | Daejung Chemicals | 7548-4400 | |
| Anisole anhydrous, 99.7% | Sigma-Aldrich | 296295 | |
| Silica nanoparticle | Microparticles GmbH | SiO2-R-0.7 | 5% w/v aqueous suspension |
| 3-Aminopropyltrimethoxysilane, >96.0% | Tokyo Chemical Industry | T1255 | |
| Dimethyl sulfoxide for HPLC, ≥99.7% | Sigma-Aldrich | 34869 | |
| Amino-terminated poly(ethylene glycol) methyl ether | Polymer Source | P16082-EGOCH3NH2 | |
| Phosphate buffered saline tablet | Takara | T9181 | |
| Tween-20 | Calbiochem | 9480 | |
| Tris-HCl (pH 8.0) | Invitrogen | AM9855G | |
| KCl | Invitrogen | AM9640G | |
| NP-40 | VWR | E109-50ML | |
| Glycerol | Invitrogen | 15514-011 | |
| Dithiothreitol | Biosesang | D1037 | |
| Protease inhibitor | Merck | 535140-1MLCN | |
| Bromo phenol blue | Sigma-Aldrich | B5525-5G | |
| Tris-HCl (pH 6.8) | Biosolution | BT033 | |
| Sodium dodecyl sulfate | Biosolution | BS003 | |
| 2-Mercaptoethanol | Gibco | 21985-023 | |
| PKR Antibody | Cell Signaling Technology | 12297S | |
| GAPDH Antibody | Santa Cruz Biotechnology | sc-32233 | |
| Normal Rabbit IgG | Cell Signaling Technology | 2729S | |
| HeLa | Korea Cell Line Bank | 10002 | |
| Sonicator | DAIHAN Scientific | WUC-D10H | |
| Ultrasonicator | BMBio | BR2006A | |
| Centrifuge I | Eppendorf | 5424 R | |
| Centrifuge II | LABOGENE | 1736R | |
| Rotator | FINEPCR | ROTATOR/AG | |
| Vacuum oven | DAIHAN Scientific | ThermoStable OV-30 | |
| Gel permeation chromatography (THF) | Agilent Technologies | 1260 Infinity II | |
| X-ray photoelectron spectrometer | Thermo VG Scientific | Sigma Probe | |
| Dynamic light scattering | Malvern Instruments | ZEN 3690 |
References
- Johnsson, B., Löfås, S., Lindquist, G. Immobilization of proteins to a carboxymethyldextran-modified gold surface for biospecific interaction analysis in surface plasmon resonance sensors. Analytical Biochemistry. 198 (2), 268-277 (1991).
- Kurzawa, C., Hengstenberg, A., Schuhmann, W. Immobilization method for the preparation of biosensors based on pH shift-induced deposition of biomolecule-containing polymer films. Analytical Chemistry. 74 (2), 355-361 (2002).
- You, C. C., et al. Detection and identification of proteins using nanoparticle-fluorescent polymer 'chemical nose' sensors. Nature Nanotechnology. 2 (5), 318-323 (2007).
- Roberts, M. W., Ongkudon, C. M., Forde, G. M., Danquah, M. K. Versatility of polymethacrylate monoliths for chromatographic purification of biomolecules. Journal of Separation Science. 32 (15-16), 2485-2494 (2009).
- Sandison, M. E., Cumming, S. A., Kolch, W., Pitt, A. R. On-chip immunoprecipitation for protein purification. Lab on a Chip. 10 (20), 2805-2813 (2010).
- Das, A., Theato, P. Activated Ester Containing Polymers: Opportunities and Challenges for the Design of Functional Macromolecules. Chemical Reviews. 116 (3), 1434-1495 (2016).
- Choi, J., et al. Functionalization and patterning of reactive polymer brushes based on surface reversible addition and fragmentation chain transfer polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 50 (19), 4010-4018 (2012).
- Kessler, D., Jochum, F. D., Choi, J., Char, K., Theato, P. Reactive surface coatings based on polysilsesquioxanes: universal method toward light-responsive surfaces. ACS Applied Materials & Interfaces. 3 (2), 124-128 (2011).
- Son, H., et al. Penetration and exchange kinetics of primary alkyl amines applied to reactive poly(pentafluorophenyl acrylate) thin films. Polymer Journal. 48 (4), 487-495 (2016).
- Kessler, D., Roth, P. J., Theato, P. Reactive surface coatings based on polysilsesquioxanes: controlled functionalization for specific protein immobilization. Langmuir. 25 (17), 10068-10076 (2009).
- Kessler, D., Theato, P. Reactive surface coatings based on polysilsesquioxanes: defined adjustment of surface wettability. Langmuir. 25 (24), 14200-14206 (2009).
- Kessler, D., Nilles, K., Theato, P. Modular approach towards multi-functional surfaces with adjustable and dual-responsive wettability using a hybrid polymer toolbox. Journal of Materials Chemistry. 19 (43), 8184-8189 (2009).
- Eberhardt, M., Mruk, R., Zentel, R., Theato, P. Synthesis of pentafluorophenyl(meth)acrylate polymers: new precursor polymers for the synthesis of multifunctional materials. European Polymer Journal. 41 (7), 1569-1575 (2005).
- Jochum, F. D., Forst, F. R., Theato, P. PNIPAM copolymers containing light-responsive chromophores: a method toward molecular logic gates. Macromolecular Rapid Communications. 31 (16), 1456-1461 (2010).
- Schattling, P., Pollmann, I., Theato, P. Synthesis of CO2-responsive polymers by post-polymerization modification. Reactive & Functional Polymers. 75, 16-21 (2014).
- He, L., Szameit, K., Zhao, H., Hahn, U., Theato, P. Postpolymerization modification using less cytotoxic activated ester polymers for the synthesis of biological active polymers. Biomacromolecules. 15 (8), 3197-3205 (2014).
- Arnold, R. M., McNitt, C. D., Popik, V. V., Locklin, J. Direct grafting of poly(pentafluorophenyl acrylate) onto oxides: versatile substrates for reactive microcapillary printing and self-sorting modification. Chemical Communications. 50 (40), 5307-5309 (2014).
- Son, H., Ku, J., Kim, Y., Li, S., Char, K. Amine-Reactive Poly(pentafluorophenyl acrylate) Brush Platforms for Cleaner Protein Purification. Biomacromolecules. 19 (3), 951-961 (2018).
- Cullen, S. E., Schwartz, B. D. An improved method for isolation of H-2 and Ia alloantigens with immunoprecipitation induced by protein A-bearing staphylococci. The Journal of Immunology. 117 (1), 136-142 (1976).
- Sisson, T. H., Castor, C. W. An improved method for immobilizing IgG antibodies on protein A-agarose. Journal of Immunology Methods. 127 (2), 215-220 (1990).
- Peritz, T., et al. Immunoprecipitation of mRNA-protein complexes. Nature Protocols. 1 (2), 577-580 (2006).
- Zhang, Z., Chen, S., Jiang, S. Dual-functional biomimetic materials: nonfouling poly (carboxybetaine) with active functional groups for protein immobilization. Biomacromolecules. 7 (12), 3311-3315 (2006).
- Yao, Y., et al. NHS-ester functionalized poly(PEGMA) brushes on silicon surface for covalent protein immobilization. Colloids and Surfaces B: Biointerfaces. 66 (2), 233-239 (2008).
- Ma, J., et al. Facile fabrication of microsphere-polymer brush hierarchically three-dimensional (3D) substrates for immunoassays. Chemical Communications. 51 (31), 6749-6752 (2015).
- Chong, Y., et al. Thiocarbonylthio compounds [SC (Ph) S− R] in free radical polymerization with reversible addition-fragmentation chain transfer (RAFT Polymerization). Role of the free-radical leaving group (R). Macromolecules. 36 (7), 2256-2272 (2003).
- Jochum, F. D., Theato, P. Temperature- and Light-Responsive Polyacrylamides Prepared by a Double Polymer Analogous Reaction of Activated Ester Polymers. Macromolecules. 42 (16), 5941-5945 (2009).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. JoVE. , Cambridge, MA. (2018).
- Chua, G. B. H., Roth, P. J., Duong, H. T. T., Davis, T. P., Lowe, A. B. Synthesis and Thermoresponsive Solution Properties of Poly[oligo(ethylene glycol) (meth)acrylamide]s: Biocompatible PEG Analogues. Macromolecules. 45 (3), 1362-1374 (2012).
Tags
Química número 141 polivinílico (acrilato del pentafluorophenyl) 3 aminopropyltriethoxysilane cepillo de polímeros reactivos polimerización posterior funcionalización inmovilización de anticuerpos inmunoprecipitaciónErratum
Formal Correction: Erratum: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification
Posted by JoVE Editors on 04/30/2019.
Citeable Link.
An erratum was issued for: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification. Throughout the article, the term "3-aminopropyltriethoxysilane" has been replaced with "3-aminopropyltrimethoxysilane", and "APTES" with "APTMS".
The Keywords were updated from:
Poly(pentafluorophenyl acrylate), 3-aminopropyltriethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
to:
Poly(pentafluorophenyl acrylate), 3-aminopropyltrimethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
The Abstract was updated from:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltriethoxysilane (APTES) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTES. The deposition of APTES and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
to:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltrimethoxysilane (APTMS) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTMS. The deposition of APTMS and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
The fourth paragraph of the Introduction was updated from:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTES linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTES. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
to:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTMS linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTMS. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
Step 2.1 of the Protocol was updated from:
Treatment of SiO2 beads with APTES
to:
Treatment of SiO2 beads with APTMS
Step 2.1.1 of the Protocol was updated from:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTES and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
to:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTMS and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
Step 2.1.3 of the Protocol was updated from:
Transfer the solution to a conical tube. To isolate the APTES functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
to:
Transfer the solution to a conical tube. To isolate the APTMS functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
Step 2.1.4 of the Protocol was updated from:
NOTE: The final suspension contains the APTES functionalized SiO2 beads dispersed in 4 mL of DMSO.
to:
Combine the methanol washed SiO2 beads with 3 mL of dimethyl sulfoxide (DMSO). Shake the mixture by hand, or if necessary sonicate for a few seconds, until the beads are fully dispersed in DMSO. Centrifuge the beads at 10,000 x g for 5 min, then remove the supernatant. Repeat the step to ensure complete solvent exchange from methanol to DMSO.
NOTE: The final suspension contains the APTMS functionalized SiO2 beads dispersed in 4 mL of DMSO.
Step 2.2 of the Protocol was updated from:
Grafting poly(PFPA) to APTES functionalized SiO2 beads
to:
Grafting poly(PFPA) to APTMS functionalized SiO2 beads
Step 2.2.2 of the Protocol was updated from:
Add 1 mL of APTES functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
to:
Add 1 mL of APTMS functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
Step 3.4 of the Protocol was updated from:
To prepare APTES functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTES functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
to:
To prepare APTMS functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTMS functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
The first paragraph of the Representative Results was updated from:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTES and poly(PFPA) grafting process, bare SiO2 beads, APTES functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
to:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTMS and poly(PFPA) grafting process, bare SiO2 beads, APTMS functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
Figure 1 was updated from:
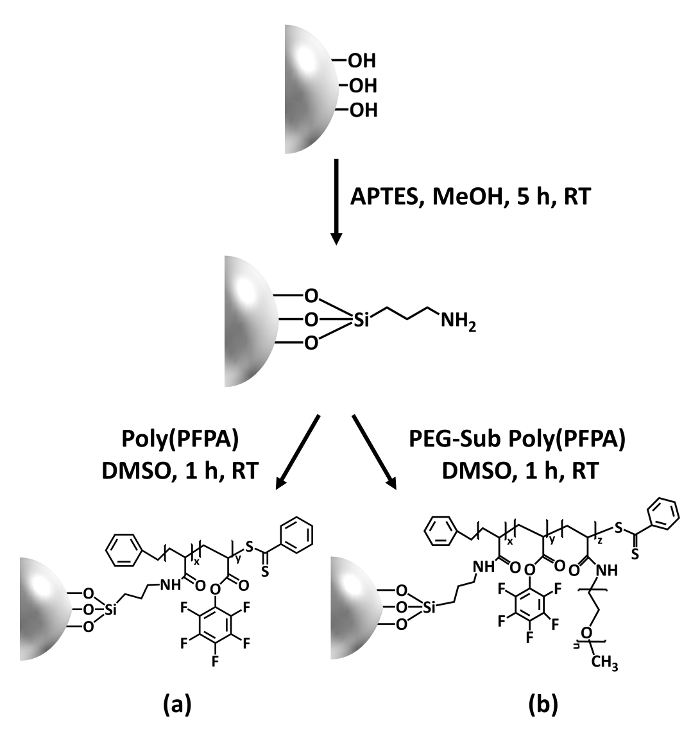
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTES as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
to:
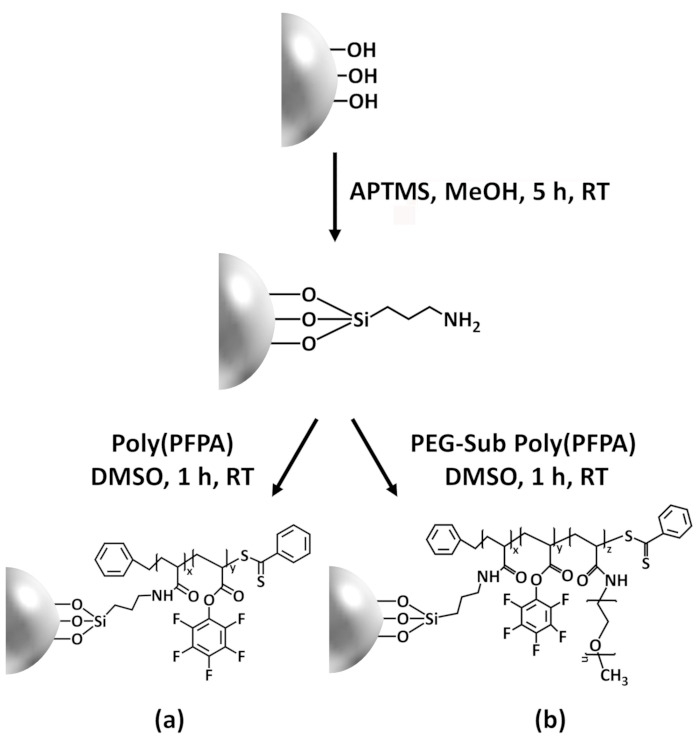
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTMS as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
Figure 2 was updated from:
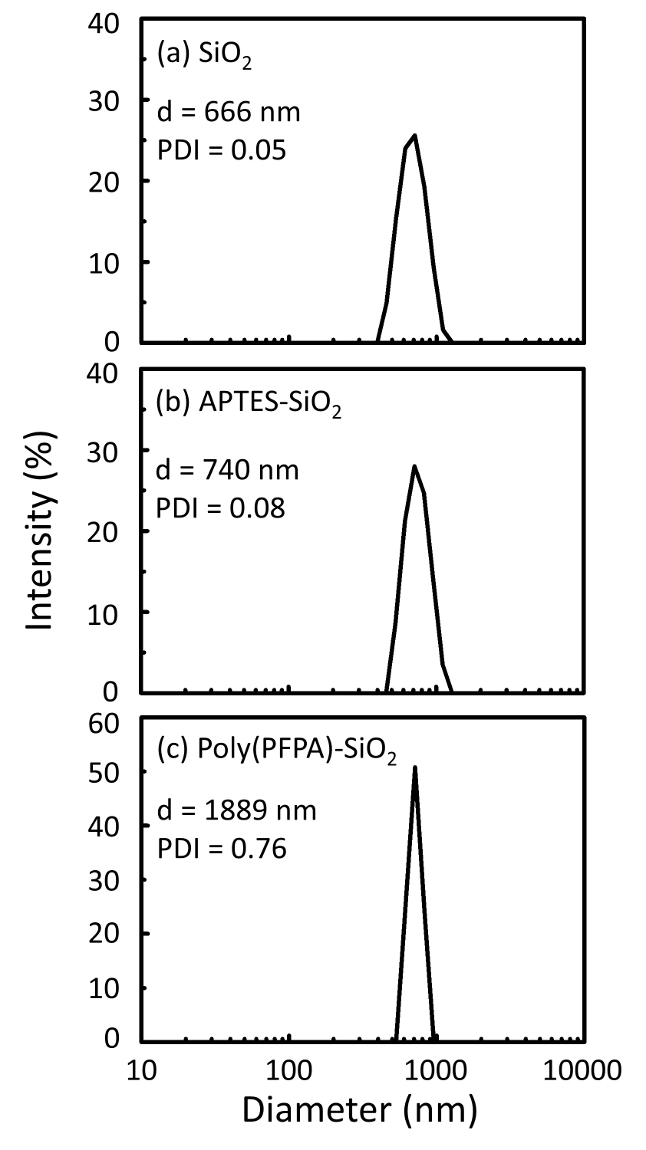
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTES functionalized SiO2 beads (APTES-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
to:
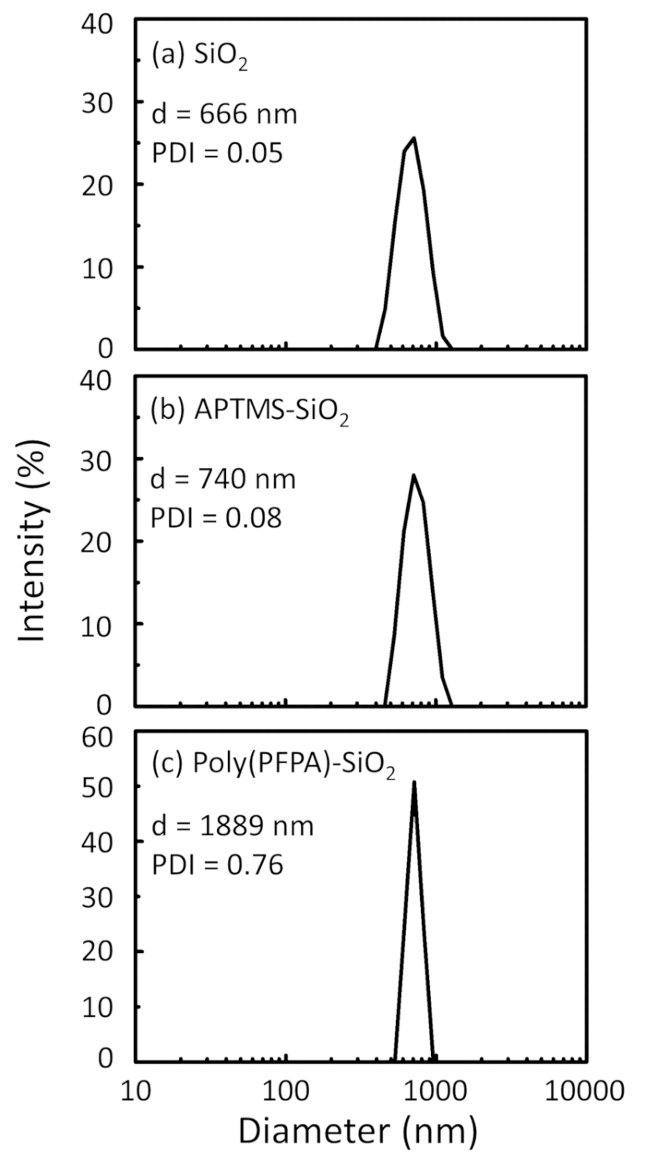
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTMS functionalized SiO2 beads (APTMS-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
Figure 3 was updated from:
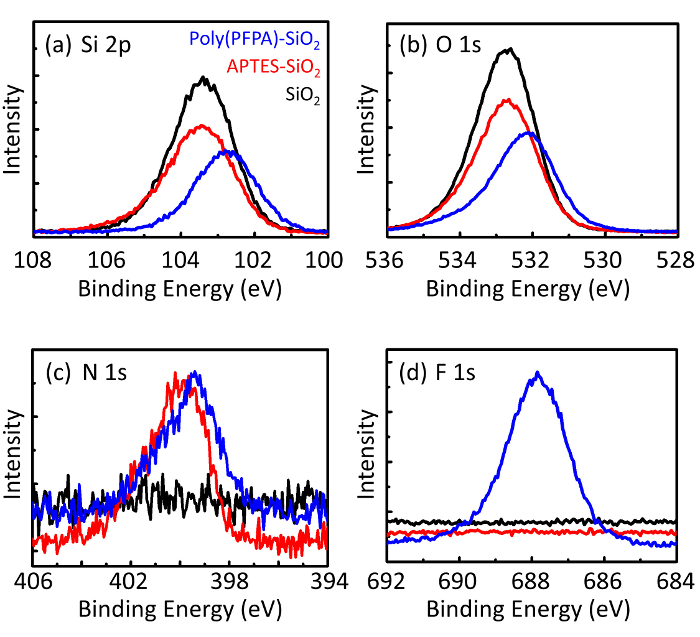
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTES functionalized SiO2 beads (APTES-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
to:
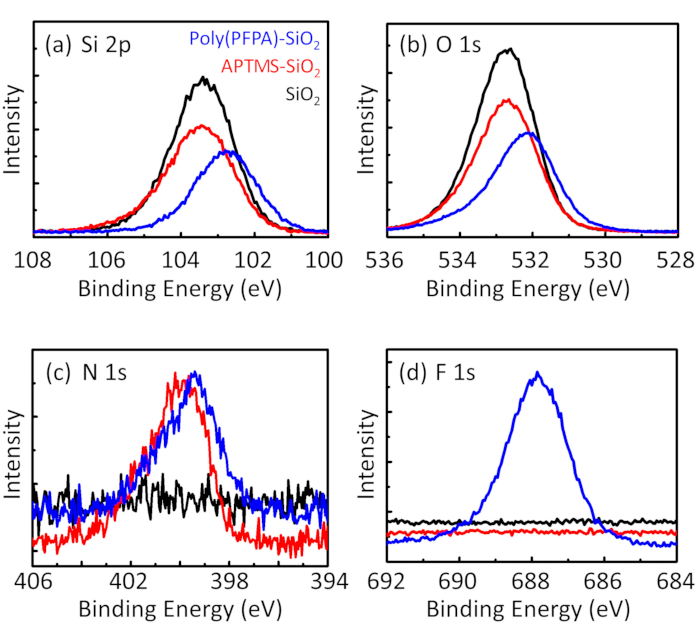
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTMS functionalized SiO2 beads (APTMS-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
The first and second paragraphs of the Discussion were updated from:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTES as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTES, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTES linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTES treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTES treatment, N 1s peak associated with the amine groups on APTES is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTES, then with poly(PFPA).
to:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTMS as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTMS, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTMS linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTMS treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTMS treatment, N 1s peak associated with the amine groups on APTMS is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTMS, then with poly(PFPA).



