ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
En protokoll for utarbeidelse av poly (pentafluorophenyl acrylate) (poly(PFPA)) podet silica perler er presentert. Poly(PFPA) functionalized overflaten er så immobilisert med antistoffer og brukt med hell i protein separasjon gjennom immunoprecipitation.
Abstract
Vi viser en enkel metode for å forberede poly (pentafluorophenyl acrylate) (poly(PFPA)) podet silica perler for antistoff immobilisering og påfølgende immunoprecipitation (IP) program. Poly(PFPA) podet overflaten forberedes via en enkel prosess. I det første trinnet, settes 3-aminopropyltriethoxysilane (APTES) inn som et koblingsfunksjonalitet molekyl på silica overflaten. I det andre trinnet er poly(PFPA) homopolymer, syntetisert via reversibel tillegg og fragmentering kjeden overføring (FLÅTEN) polymerisasjon, podet til koblingsfunksjonalitet molekylet gjennom exchange reaksjonen pentafluorophenyl (PFP)-enheter på den polymer og Amin gruppene i APTES. Avsetning av APTES og poly(PFPA) på silika partikler er bekreftet av X-ray photoelectron spektroskopi (XPS), samt overvåket av partikkel størrelse endringen målt via dynamisk lysspredning (DLS). Forbedre den overflaten hydrophilicity av perler, delvis substitusjon av poly(PFPA) med Amin-functionalized poly(ethylene glycol) (amino-PEG) er også utført. PEG-substituert poly(PFPA) podet silica perler er så immobilisert med antistoffer for IP-programmet. For demonstrasjon, et antistoff mot protein kinase RNA-aktivert (PKR) er ansatt og IP effektivitet bestemmes av vestlige blotting. Analyseresultatene viser at antistoff immobilisert perlene kan faktisk brukes til å berike PKR mens uspesifisert protein interaksjoner er minimal.
Introduction
Reaktiv polymer børster har mottatt stor interesse i de senere år. De kan brukes til nakkens funksjonelle molekyler på organisk eller uorganisk materiale å lage aktivert overflater med programmer innenfor områder som gjenkjenning og separasjon1,2,3,4, 5. Blant de reaktive polymerer rapportert, er som inneholder pentafluorophenyl ester enheter spesielt nyttig på grunn av deres høye kryssreaksjon med aminer og motstand mot hydrolyse6. En slik polymer er poly(PFPA), og det kan være lett functionalized etter polymerisasjon med molekyler som inneholder primære eller sekundære aminer7,8,9,10. I ett eksempel var poly(PFPA) børster reagert med amino-spiropyrans å lage lys svarer overflatene7.
Utarbeidelse av poly(PFPA) og tilhørende programmer er beskrevet i flere tidligere publikasjoner6,7,8,9,10,11,12 ,,13,,14,,15,,16,,17. Spesielt rapporterte Theato og medarbeidere syntese av poly(PFPA) børster via både "pode til" og "pode fra" metoder7,8,10,11,12 . I den "pode å" tilnærming, en poly (methylsilsesquioxane)-poly (pentafluorophenyl acrylate) (poly(MSSQ-PFPA)) hybrid polymer ble syntetisert8,10,11,12. Komponenten poly(MSSQ) kunne skjemaet sterk vedheft med en rekke ulike organiske og uorganiske overflater, slik at poly(PFPA) komponenten til en pensel laget på bestrøket materialoverflaten. I den "pode fra" tilnærming, overflate initiert reversibel tillegg og fragmentering kjeden overføring (SI-FLÅTEN) polymerisasjon var ansatt å forberede poly(PFPA) børster7. I dette tilfellet ble en overflate immobilisert kjeden forflytning agent (SI-CTA) først covalently knyttet til underlaget via silika-silane reaksjon. Immobilisert SI-CTA deltok i SI-FLÅTEN polymerisasjon av PFPA monomerer, genererer tettpakkede poly(PFPA) børster stabil kovalente kobling til underlaget.
Ved å benytte poly(PFPA) børster syntetisert via SI-FLÅTEN polymerisasjon, viste vi nylig immobilisering av antistoffer poly(PFPA) podet silika partikler og deres anvendelse i protein rensing18. Bruk av poly(PFPA) børster for antistoff immobilisering fant for å løse mange problemer forbundet med dagens protein skille gjennom IP. Konvensjonelle IP er avhengig av bruken av Protein A/G som et linker for antistoff immobilisering19,20,21. Siden bruken av Protein A/G kan antistoffer skal festes i en bestemt retning, er høye målet antigen utvinning effektivitet oppnådd. Men lider bruk av Protein A/G av ikke-spesifikk protein samhandling samt tap av antistoffer under protein utvinning, begge bidrar til høy bakgrunnsstøy. Du kan løse disse svakhetene ved har direkte crosslinking av antistoffer mot en solid støtte vært utforsket22,23,24. Effektiviteten av slike teknikker er vanligvis lav på grunn av tilfeldig orienteringen av krysskoblet antistoffer. Av poly(PFPA) podet underlaget er immobilisering av antistoffer permanent, oppnådd gjennom exchange reaksjon mellom PFP enheter og Amin funksjonaliteten på antistoffer. Selv om antistoff retningen er fortsatt tilfeldig, fordeler systemet av å ha mange reaktive PFP områder, kontrollerbar av graden av polymerisasjon. Videre vi viste at ved delvis substitusjon av PFP enheter med amino-pinne, overflate hydrophilicity stilles, ytterligere forbedre protein utvinning effektiviteten av systemet18. Samlet ble poly(PFPA) podet silika partikler vist å være et effektivt alternativ til tradisjonelle IP med rimelig effektivitet samt mye renere bakgrunnen.
I denne bidrag rapportere vi en alternativ metode å forberede poly(PFPA) podet overflaten antistoff immobilisering og IP søknad. I en enkelt prosess, som vist i figur 1, en APTES koblingsfunksjonalitet molekyl er først avsatt på silica overflaten, så poly(PFPA) polymer er covalently knyttet til koblingsfunksjonalitet molekylet gjennom reaksjonen PFP enhetene på den polymer og Amin funksjonene på APTES. Denne forberedelse metoden tillater permanent crosslinking av poly(PFPA) til et substrat overflate, men unngår mange komplikasjoner knyttet til SI-CTA syntese og SI-FLÅTEN polymerisering av poly(PFPA) børster. Delvis substitusjon av PFP-enheter med amino-pinne kan fremdeles utføres, slik at finjustering av polymer børste overflaten egenskapene. Vi viser poly(PFPA) podet silica perlene dermed forberedt kan immobilisert med antistoffer og brukt for protein berikelse IP. Den detaljerte perle forberedelse prosedyren antistoff immobilisering og IP testing er dokumentert i denne artikkelen, for leserne interessert i søker et alternativ til konvensjonelle Protein A/G basert IP.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. forberedelse av Poly(PFPA) Homopolymer
- Recrystallization av SHTS
- Kombiner 5 g av 2,2'-azobis(2-methylpropionitrile) (SHTS) med 25 mL av metanol i en 250 mL kanne. Fordype begeret i en 60 ° C olje bad og kraftig rør blandingen med en røre bar til SHTS er fullstendig oppløst.
- Filtrere varm løsningen gjennom filter papir (5-8 μm partikkel oppbevaring) og lagre filtratet på 4 ° C tillate krystaller form sakte.
- Samle inn den recrystallized SHTS ved filtrering. Kombiner samlet produktet med 25 mL av fersk metanol og gjenta recrystallization prosessen.
- Tørr 2 x recrystallized SHTS i et vakuum ovn ved romtemperatur (RT) over natten. Produktet skal oppbevares i mørket på <-10 ° C.
- Syntese av benzyl dithiobenzoate25
- Forberede en 500 mL tre-hals runde bunn kolbe utstyrt med magnetic røre bar, en refluxing kondensator, slippe trakt og en gummi septum. Koble kolbe til nitrogen gass-linje gjennom refluxing kondensatoren og skylle ut innsiden air med nitrogen. Sette inn et termometer gjennom septum. Legge til 41 mL (0.041 mol) i 1 M løsning av phenylmagnesium bromide i tetrahydrofuran (THF) via en sprøyte gjennom den samme septum.
- Varme phenylmagnesium bromide løsningen til 40 ° C i et bad av olje. Deretter legge 3.1 g (0.041 mol) av carbon disulfide gjennom slippe trakten sakte, opprettholde løsning temperaturen på 40 ° C.
- Legge til 7.1 g (0.042 mol) benzyl bromide resulterende blandingen gjennom slippe trakten over 15 min. økning reaksjon temperaturen til 50 ° C. Fortsett omrøring ved denne temperaturen i 45 minutter.
- Overføre reaksjonsblandingen til separatory trakt og fortynn med 15 mL iskaldt vann. Ekstra produktet ved å legge til 15 mL diethyl Ether og fjerne det nedre vann laget. Gjenta utvinning med diethyl ether to ganger.
- Vask kombinert organisk faser med rikelig med vann, deretter saltlake (løsning av 50% (w/v) NaCl i vann) og tørr produktet over vannfri magnesium sulfat.
- Fjerne løsemiddelet vakuum ved 35 ° C med en roterende fordamperen.
- Rense produktet av kolonnen kromatografi med 400 mL silica gel (porestørrelse 60 Å, 63-200 mesh partikkelstørrelse) og petroleum Eter som eluent, gir 5 g av benzyl dithiobenzoate (BDB) som røde olje. Bekrefte produktet renheten av 1H-NMR (400 MHz, CDCl3): ses 8.02-7,99 (2 H, m) 7.55-7,50 (1 H, m), 7.41-7.29 (7 H, m) 4.60 (2 H, s).
- Syntese av poly(PFPA) via FLÅTEN polymerisasjon9,26
- Tilsvarede PFPA monomer inneholder lite hemmere. Før polymerisasjon, fjerne hemmere av monomer passerer en engangs sprøyte fullpakket med grunnleggende alumina.
- Legge til 0,4 mg (0.0024 mmol) av recrystallized SHTS, 4,3 mg (0.018 mmol) av BDB 1012 mg (4,25 mmol) inhibitor-fri PFPA og 0,7 mL vannfri anisole en 20 mL Schlenk kolbe.
- Koble kolbe til Schlenk linje og degas blandingen med minst tre fryse-pumpe-Tin sykluser. Kort, fryse reaksjonsblandingen i flytende nitrogen. Bruke vakuum å fjerne gassen i headspace. Seal kolbe Fjern fra flytende nitrogen å tillate innholdet til tine på RT.
- Plasser flasken i en 70 ° C olje bad, og reagere 4 h under N2 purge.
- For å avslutte reaksjonen, Fjern flasken fra olje bad og utsette reaksjon innholdet til luft.
- Utløse polymer i kalde metanol og tørk den gjenopprettede polymer i et vakuum ovn ved 40 ° C over natten.
- For å måle molekylvekt polymer, bruk gel gjennomtrengning kromatografi (GPC). Bruk THF som den mobile fasen på 35 ° C med en 1 mL/min væskemengde og konstruere kalibreringskurven benytter monodisperse polystyren standarder. For å erverve GPC måling, løses polymer i THF (1-2 mg/mL) og filtrere gjennom 0,2 μm disponibel polytetrafluoroethylene (PTFE). Injisere 100 μL prøven i GPC instrumentet. Konvertere oppbevaringsperioden målt prøven til molekylvekt bruke polystyren kalibreringskurven.
2. forberedelse av Poly(PFPA) Functionalized SiO2 perler
- Behandling av SiO2 perler med APTES
- SiO2 partiklene er tilgjengelig i form av en 5% (w/v) vandig suspensjon. Kombiner 0,8 mL SiO2 suspensjon med 40 mg av APTES og 8 mL av metanol i 20 mL scintillation ampuller utstyrt med rør bar.
- At reaksjonen å fortsette i RT 5 h med energisk omrøring.
- Overføre løsningen til et konisk rør. Å isolere APTES functionalized SiO2 perler, sentrifuge løsningen på 10.000 x g i 5 min og fjerne nedbryting. Vask perler ved å spre dem i 3 mL frisk metanol. Riste røret for hånd for å blande, men eventuelt bedre spredning av sonication i et vannbad i noen sekunder. Gjenta wash trinn én gang sentrifuge perler på 10.000 x g for 5 min. Fjern nedbryting.
- Kombinere metanol vasket SiO2 perler med 3 mL dimethyl sulfoxide (DMSO). Riste blandingen for hånd, eller hvis nødvendig sonicate i noen sekunder til perlene er helt spredt i DMSO. Sentrifuge perler på 10.000 x g i 5 minutter, og deretter fjerner nedbryting. Gjenta trinn for å sikre fullstendig løsemiddel exchange fra metanol å DMSO.
Merk: Siste suspensjon inneholder APTES functionalized SiO2 perler spredt i 4 mL DMSO. - For å sjekke størrelsesDistribusjon partikkel, utføre DLS analyse. Ta en dråpe suspensjon forberedt i trinn 2.1.4 og sted i disponibel UV søppel. Fortynne prøven ved å fylle cuvette med fersk DMSO til det er 2/3 full. Prøven inn celle innehaveren å begynne datainnsamling. Bruk følgende oppsettparameterne for partikkel størrelse måling: temperatur: 25 ° c. Balanse tid: 120 s; Måling varighet: automatisk.
- For å sjekke overflaten sammensetningen, utføre XPS analyse. Tørr noen smakebiter fra suspensjon forberedt i trinn 2.1.4 i vakuum ovn ved 40 ° C over natten. Ta tørket polymer og pack jevnt på 0,5 cm x 0,5 cm eksempel innehaver. Laste inn prøven i høy vakuum kammeret (10-8 torr) og begynne datainnsamling. Bestemt XPS instrumentet brukes, genererer photoelectrons ved hjelp av en monokromatisk Al Kα X-ray operert på 15 kV og 6,7 mA, og samle hybrid modus forstørrelse med analyserer på en 50 eV passerer energi for høy oppløsning spectra, og en 100 eV passere energi elementær undersøkelser.
- Pode poly(PFPA) å APTES functionalized SiO2 perler
- Forbered den poly(PFPA) løsningen ved oppløsning 20 mg av poly(PFPA) i 2 mL DMSO i 20 mL scintillation ampuller.
Merk: I denne studien, en relativt lav molekylvekt poly(PFPA) (20 kg/mol) brukes. Derfor, til tross for den høye polymer konsentrasjonen (10 mg/mL), ingen bevis for polymer crosslinking er observert. Hvis en høyere molekylvekt polymer, deretter må polymer løsning konsentrasjon justeres for å unngå mulig crosslinking. - Legg 1 mL av APTES functionalized SiO2 perler suspendert i DMSO (fra trinn 2.1.4) til poly(PFPA) løsning. Reagere på RT 1t med energisk omrøring.
- Isolere poly(PFPA) podet SiO2 perler med sentrifugering 10.000 x g i 5 min, etterfulgt av fjerning av nedbryting. Vask perler ved å legge til 3 mL DMSO og blanding av enten risting med hånden eller sekundene av sonication. Sentrifuge perler på 10.000 x g i 5 minutter, og deretter fjerner nedbryting. Gjenta vask av poly(PFPA) podet SiO2 perler med DMSO to ganger.
- Vask perlene to ganger mer med triple destillert vann (TDW). I dette trinnet kombinere perler med 3 mL TDW, deretter blande ved å riste hånden eller sekundene av sonication. Sentrifuge perler på 10.000 x g i 5 minutter, og deretter fjerner nedbryting.
- For å sjekk størrelsesDistribusjon partikkel, utfører du må følge fremgangsmåten i trinn 2.1.5. For å sjekke overflatekjemi, utføre XPS etter fremgangsmåten i trinn 2.1.6.
- Forbered den poly(PFPA) løsningen ved oppløsning 20 mg av poly(PFPA) i 2 mL DMSO i 20 mL scintillation ampuller.
3. forberedelse av SiO2 perler podet med PEG-erstattet Poly(PFPA)
- For å forberede poly(PFPA) løsningen, løses 20 mg av poly(PFPA) i 2 mL DMSO i 20 mL scintillation ampuller.
- For å forberede PEG løsning, løses Amin-functionalized pinne i 1 mL av DMSO. Den nøyaktige mengden PEG brukes bestemmes av ønsket grad av PFP substitusjon, bestemt av formelen nedenfor:
Mengden av amino-pinne (g/g-poly(PFPA)) = (N_poly(PFPA) x % PEG-Sub) x (MW_PEG / MW_poly(PFPA))
hvor N_poly(PFPA) = poly(PFPA) grad av polymerisasjon
% PEG-Sub = prosent PEG substitusjon
MW_PEG = molekylvekt av amino-pinne
MW_ poly(PFPA) = molekylvekt av poly(PFPA) - Overføre PEG løsningen til poly(PFPA) løsning. Reagere på RT 1t med energisk omrøring.
- For å forberede APTES functionalized SiO2 perler suspendert i DMSO, følger den samme fremgangsmåten i trinn 2.1. Overføre 1 mL av perle suspensjon i PEG-substituert poly(PFPA) løsningen i trinn 3.3. Tillate pode mellom poly(PFPA) og APTES functionalized SiO2 perler for å fortsette på RT 1t med energisk omrøring.
- Isolere perler med sentrifugering 10.000 x g i 5 min, etterfulgt av fjerning av nedbryting. Vask perler ved å legge til 3 mL DMSO og blanding av enten risting med hånden eller sekundene av sonication. Sentrifuge perler på 10.000 x g i 5 minutter, og deretter fjerner nedbryting. Gjenta DMSO vask to ganger.
- Vask perlene to ganger mer med TDW. I dette trinnet kombinere perler med 3 mL TDW, deretter blande ved å riste hånden eller sekundene av sonication. Sentrifuge perler på 10.000 x g i 5 minutter, og deretter fjerner nedbryting.
- Tørr perler på 40 ° C i vakuum ovn over natten.
4. antistoff immobilisering på Poly(PFPA) podet SiO2 perler
Merk: Den samme fremgangsmåten brukes uansett prosent PEG substitusjon på poly(PFPA). Klargjør fosfat bufret saltvann (PBS) ved oppløsning PBS tavle i TDW. Forberede 0,1% (v/v) fosfat bufret saline med Tween-20 (PBST) ved å legge til 1/1000 Tween-20 PBS.
- Legge til 5 mg poly(PFPA) podet SiO2 perler til en 1,5 mL microcentrifuge tube.
- Vask perler ved å legge til 800 µL av PBS og bland godt av vortexing. Gjenta wash trinn tre ganger sentrifuge perler på 10.000 x g ved RT i 1 Fjern nedbryting.
- Legge til 350 µL av fersk PBS, 50 µL 0,1% (v/v) PBST og 6,67 µg av antistoffer. Inkuber ~ 20 h på et rotator på 4 ° C.
- Vask perler for å fjerne ubundet antistoffer. Sentrifuge perler på 400 x g og 4 ° C i 1 fjerne nedbryting og legge til 400 µL av lyseringsbuffer nøye. Forsiktig å suspendere perler av pipettering opp og ned på fem ganger.
Merk: Lyseringsbuffer brukes å vaske perler bør være den samme som brukes i cellen lyse og IP, bortsett fra at tillegg av dithiothreitol og protease hemmer er valgfritt (se trinn 5). - Gjenta denne wash trinn tre ganger. Etter siste vask, fjerne nedbryting som mulig.
5. celle Lysis og Immunoprecipitation
- Utarbeidelse av lyseringsbuffer og vaskebuffer
- Forberede lyseringsbuffer (50 mM Tris-HCl (pH 8.0), 100 mM KCl, 0,5% (v/v) NP-40, 10% (v/v) glyserol, 1 mM dithiothreitol (DTT) og protease hemmer cocktail).
- Forberede vaskebuffer (50 mM Tris-HCl (pH 8.0), 100 mM KCl, 0,1% (v/v) NP-40, og 10% (v/v) glyserol).
- Lagre buffer løsninger på 4 ° C.
- Utarbeidelse av cellene
- Frø cellene (HeLa celler) en eller to dager før IP eksperimentet, og vokser cellene på 37 ° C og 5% CO2.
- Samle ca 1.4 x 107 celler med cellen skraper og overføring i en 15 mL konisk rør. Sentrifuger cellene på 380 x g ved RT for 3 min. fjerne nedbryting og å suspendere med 1 mL kaldt PBS og overføre til en 1,5 mL microcentrifuge tube.
- Sentrifuge cellene på 10.000 x g ved 4 ° C for 30 s. fjerne nedbryting rent. Cellen pellets kan lagres ved-80 ° C etter fjerner nedbryting.
- Utarbeidelse av cellen lysates
- Nytt suspendere celle pellets med 400 µL av lyseringsbuffer. Sonicate celler ved hjelp av en ultrasonicator.
- Etter sonication, vortex kort og sentrifuger lysate 20.000 x g på 4 ° C i 10 min.
- Overføre nedbryting til en ny 1,5 mL sentrifuge tube.
- Immunoprecipitation
- Overføre 300 µL av celle lysate til tidligere utarbeidet antistoff ruges poly(PFPA) podet SiO2 perler. Behold 30 µL av cellen lysate som inndata prøven i en ny microcentrifuge tube. Lagre inn prøven på 4 ° C.
Merk: Den totale mengden protein i celle lysate bør være ca 4 mg. - Inkuber lysate/perler blandingen for 3t på et rotator på 4 ° C.
- Sentrifuge blandingen på 400 x g på 4 ° C i 1 Fjern nedbryting og legge til 400 µL av vaskebuffer nøye. Forsiktig å suspendere perler av pipettering opp og ned fem ganger.
- Gjenta denne wash trinn tre ganger. Etter siste vask, fjerne nedbryting som mulig.
- Forberede 2 x natrium dodecyl sulfate (SDS) lasting fargestoff (25% (v/v) glyserol, 0,1% (w/v) bromo fenol blå (BPBEN), 60 mM Tris-HCl (pH 6.8), 2% (w/v) SDS og 2,75 mM 2-mercaptoethanol). Lagre 2 x SDS lasting fargestoff på 20 ° C. Legg til 30 µL av 2 x SDS lasting fargestoff perler og lagrede inn prøven, og varme dem for 10 min på 95 ° C.
- Etter oppvarming, analysere prøven ved hjelp av Western blotting27eller lagre prøven på 20 ° C.
- Overføre 300 µL av celle lysate til tidligere utarbeidet antistoff ruges poly(PFPA) podet SiO2 perler. Behold 30 µL av cellen lysate som inndata prøven i en ny microcentrifuge tube. Lagre inn prøven på 4 ° C.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
En skjematisk for utarbeidelsen av poly(PFPA) podet SiO2 perler, med eller uten PEG substitusjon er vist i figur 1. For å overvåke APTES og poly(PFPA) pode prosessen, nakne SiO2 perler, APTES functionalized SiO2 perler og poly(PFPA) podet SiO2 perler er preget av både DLS (figur 2) og XPS (Figur 3). IP effektiviteten av perler bestemmes av vestlige blotting. Figur 4 viser den vestlige blotting resultater for IP med 1% PEG-substituert poly(PFPA) podet perler, der perlene er ruges med ingen antistoff, ikke-spesifikke antistoffer eller anti-PKR antistoff. Figur 5 viser vestlige blotting resultatene for IP bruker 0% PEG-substituert poly(PFPA) podet perler og 1% PEG-substituert poly(PFPA) podet perler, både inkubert med anti-PKR antistoffer.

Figur 1: Skjematisk for utarbeidelsen av poly(PFPA) podet SiO2 perler med APTES som et koblingsfunksjonalitet molekyl. (en) Poly(PFPA) podet perler. (b) delvis PEG-substituert poly(PFPA) podet perler. Klikk her for å se en større versjon av dette tallet.

Figur 2: DLS mål for (a) bare SiO2 perler (SiO2) (b) APTES functionalized SiO2 perler (APTES-SiO2) og (c) poly(PFPA) podet SiO2 perler (poly (PFPA)-SiO2), spredt i DMSO. Z-gjennomsnittlig diameter (d) og polydispersity indeksen (PDI) for hvert utvalg rapporteres. Klikk her for å se en større versjon av dette tallet.

Figur 3: XPS spectra for nakne SiO2 perler (SiO2), APTES functionalized SiO2 perler (APTES-SiO2), og poly(PFPA) podet SiO2 perler (poly (PFPA)-SiO2). Toppene undersøkt tilsvarer (en) Si 2 p, (b) O 1s, (c) N 1s, og (d) F 1s. Klikk her for å se en større versjon av dette tallet.

Figur 4: Western blotting resultater for IP med 1% PEG-substituert poly(PFPA) podet perler, behandlet med ingen antistoff (lane 2), en ikke-spesifikke antistoffer blanding, normal kanin IgG (lane 3) eller anti-PKR antistoff (lane 4). Lane 1 viser input protein blandingen før IP. Klikk her for å se en større versjon av dette tallet.

Figur 5: Western blotting resultater for IP med 0% PEG-substituert poly(PFPA) podet perler (lane 2) og 1% PEG-substituert poly(PFPA) podet perler (lane 3), begge er behandlet med anti-PKR antistoffer. Lane 1 viser input protein blandingen før IP. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Syntese av poly(PFPA) podet SiO2 perler er illustrert i figur 1. Ved å bruke APTES som et koblingsfunksjonalitet molekyl, kan poly(PFPA) børster covalently podet til SiO2 underlaget tilberedes via en enkel prosess. Selv om noen av PFP enhetene er ofret for reaksjon med APTES, er et stort antall PFP enhetene forventet å være tilgjengelig for senere reaksjon med amino-pinne eller antistoffer. PFP-grupper er kjent til lav energi overflater poly(PFPA) børster gjøre ikke solvate i vann28. Antistoffer må bli immobilisert på poly(PFPA) børster for IP-program, og denne exchange reaksjonen er gjort i vandig buffer løsning for å bevare aktiviteten av antistoffer. Som rapportert i våre tidligere publikasjoner, kan delvis substitusjon av PFP-enheter med hydrofile molekyler som Amin-functionalized pinne forbedre overflate hydrophilicity, fører til økt antistoff immobilisering effektivitet18. I denne studien delvis PEG erstattet poly(PFPA) også er forberedt, og podet på SiO2 overflaten med samme APTES koblingsfunksjonalitet molekyl. Samlet tillate metodene illustrert i figur 1 utarbeidelsen av poly(PFPA) podet overflater med forskjellige grader av PEG substitusjon. Disse polymer børster tunable overflateegenskaper gir en ideell plattform for antistoff immobilisering og IP anvendelse.
Perle forberedelsesprosessen overvåkes av både DLS og XPS. DLS resultatene for ulike functionalized SiO2 perler i DMSO oppsummeres i figur 2. Nakne SiO2 perler utstillingen etter diameteren på 666 nm, med produsenten rapportert bead størrelse (0.676 μm; SD = 0,03 μm). Etter APTES behandling, øker perle diameteren til 740 nm; og med poly(PFPA) behandling, perle diameter ytterligere øker til 1889 nm. Det er viktig å påpeke at polydispersity indeksen (PDI) for poly(PFPA) podet perlene er ganske store (PDI = 0.76), som er et tegn på dårlig kvalitet utvalg som inneholder store mengder. Selv om DLS kurven viser bare en nano-størrelse topp, kan liten mengde aggregater finnes i suspensjon. Functionalized SiO2 perler er også undersøkt av XPS å bestemme overflaten komposisjon (Figur 3). Etter APTES behandling, N 1s peak tilknyttet Amin gruppene i APTES er oppdaget. Og følgende poly(PFPA) behandling, F 1s peak tilknyttet PFP enheter i polymer oppdages. Sammen viser disse dataene den vellykkede functionalization av SiO2 overflaten, først med APTES, med poly(PFPA).
Slik viser at poly(PFPA) podet perlene kan bli brukt for protein berikelse gjennom IP, vi brukte 1% PEG-substituert poly(PFPA) podet perler, og inkubert dem med ingen antistoff, ikke-spesifikk kanin IgG antistoff blanding eller anti-PKR antistoff. Celle lysate som inneholder målet PKR var Hentet fra cellen, og PKR berikelse ble deretter utført gjennom IP bruke tre type perler. For å bestemme IP effektivitet, ble elut protein prøvene analysert mot to forskjellige antistoffer via Western blotting. Anti-PKR antistoff ble brukt til å visualisere hvor mye PKR utvinnes. Og anti-GAPDH (glyceraldehyde-3-fosfat dehydrogenase) antistoff ble brukt som en negativ kontroll som GAPDH er en rikelig protein som ikke påvirker PKR. Som vist i Figur 4, perler immobilisert uten antistoff eller uspesifisert antistoff blanding resultere i noen PKR utvinning. Perlene inkubert med anti-PKR antistoff kan derimot vellykket berike PKR, som indikert av tilstedeværelsen av et sterkt PKR band og fravær av GAPDH band. Disse resultatene tyder PEG-substituert poly(PFPA) børster kan faktisk functionalized med antistoffer og brukes for selektiv anriking av målet protein. Merk sammenlignet protein utvinning effektiviteten av forskjellige perle systemer, IP eksperimentene i tillegg til den påfølgende vestlige blotting analyser bør gjøres samtidig. På grunn av iboende variasjoner i å utføre disse eksperimentene, bør innhentet på separate forsøk ikke være direkte forhold.
Som rapportert tidligere, spiller den overflaten hydrophilicity poly(PFPA) børster en nøkkelrolle i IP effektivitet18. Figur 5 viser den vestlige blotting data for IP gjenopprettet protein prøver ved 0% PEG-substituert poly(PFPA) podet perler og 1% PEG-substituert poly(PFPA) podet perler. I begge tilfeller var perlene immobilisert med anti-PKR antistoffer. Mens bruken av 0% PEG-substituert poly(PFPA) resulterer i lav PKR utvinning effektivitet, viser 1% PEG-substituert poly(PFPA) betydelig forbedring, angitt med selektiv anriking av målet PKR over ikke-målet GAPDH. Med vår forrige publikasjonen18økt PEG behandling av overflaten hydrophilicity av poly(PFPA) penselen, slik at flere PFP enheter være tilgjengelig for antistoff immobilisering, fører til registrert forbedring i IP effektivitet. Merk prosent PEG substitusjon rapportert i denne studien ikke kan sammenlignes direkte som rapportert i vår forrige studie som SI-FLÅTEN syntetisert poly(PFPA) børster. De to tilfellene ansette svært ulike polymer pensel forberedelse metoder, så hvor mye PFP enheter tilgjengelig med lik PEG lasting forventes å være svært forskjellige. Men godtar observasjonene fra de to studiene kvalitativt, begge peker til overflaten hydrophilicity som nøkkel kontroll parameter for å oppnå høy IP effektivitet.
Mens overflaten hydrophilicity påvirker mengden antistoff vedlegg til poly(PFPA) børster, har det også en betydelig effekt på IP bakgrunn på grunn av ikke-spesifikk berikelse. I et typisk IP eksperiment utføres mange vask trinn for å fjerne ubundet proteiner. Når perlene er veldig hydrofobe, for eksempel de med 0% PEG substitusjon, de har tendens til skjemaet stor Sammendrag som er vanskelig å bryte. I dette tilfellet ikke-spesifikke proteiner kan være fanget i de samlede strukturene og vasking tilstrekkelig fjerne ikke dem, fører til en økning i bakgrunnen. Derfor, når du utfører IP, er det viktig å optimalisere egenskapen perle overflaten, og oppmerksomhet bør vies å sikre perlene rimelig spres.
Samlet viste vi en enkel prosess å forberede poly(PFPA) podet SiO2 perler, og viste at overflaten hydrophilicity av perlene kan være finjustert med delvis substitusjon av PFP-enheter med amino-pinne. Disse polymer børster ble brukt for målet protein berikelse gjennom IP, presenterer seg som et alternativ til tradisjonelle Protein A/G basert IP teknikk. Vi forventer poly(PFPA) børster å finne programmet i mange andre områder som krever biomolecule immobilisering.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Dette arbeidet ble støttet av byrået for Defense utvikling (Grant nr. UD170039ID).
Materials
| Name | Company | Catalog Number | Comments |
| 2,2-Azobisisobutyronitrile, 99% | Daejung Chemicals | 1102-4405 | |
| Methyl alcohol for HPLC, 99.9% | Duksan Pure Chemicals | d62 | |
| Phenylmagnesium bromide solution 1.0 M in THF | Sigma-Aldrich | 331376 | |
| Carbon disulfide anhydrous, ≥99% | Sigma-Aldrich | 335266 | |
| Benzyl bromide, 98% | Sigma-Aldrich | B17905 | |
| Petroleum ether, 90% | Samchun Chemicals | P0220 | |
| Ethyl ether, 99% | Daejung Chemicals | 4025-4404 | |
| Magnesium sulfate anhydrous, powder, 99% | Daejung Chemicals | 5514-4405 | |
| Pentafluorophenyl acrylate | Santa Cruz Biotechnology | sc-264001 | contains inhibitor |
| Aluminium oxide, activated, basic, Brockmann I | Sigma-Aldrich | 199443 | |
| Sodium Chloride (NaCl) | Daejung Chemicals | 7548-4400 | |
| Anisole anhydrous, 99.7% | Sigma-Aldrich | 296295 | |
| Silica nanoparticle | Microparticles GmbH | SiO2-R-0.7 | 5% w/v aqueous suspension |
| 3-Aminopropyltrimethoxysilane, >96.0% | Tokyo Chemical Industry | T1255 | |
| Dimethyl sulfoxide for HPLC, ≥99.7% | Sigma-Aldrich | 34869 | |
| Amino-terminated poly(ethylene glycol) methyl ether | Polymer Source | P16082-EGOCH3NH2 | |
| Phosphate buffered saline tablet | Takara | T9181 | |
| Tween-20 | Calbiochem | 9480 | |
| Tris-HCl (pH 8.0) | Invitrogen | AM9855G | |
| KCl | Invitrogen | AM9640G | |
| NP-40 | VWR | E109-50ML | |
| Glycerol | Invitrogen | 15514-011 | |
| Dithiothreitol | Biosesang | D1037 | |
| Protease inhibitor | Merck | 535140-1MLCN | |
| Bromo phenol blue | Sigma-Aldrich | B5525-5G | |
| Tris-HCl (pH 6.8) | Biosolution | BT033 | |
| Sodium dodecyl sulfate | Biosolution | BS003 | |
| 2-Mercaptoethanol | Gibco | 21985-023 | |
| PKR Antibody | Cell Signaling Technology | 12297S | |
| GAPDH Antibody | Santa Cruz Biotechnology | sc-32233 | |
| Normal Rabbit IgG | Cell Signaling Technology | 2729S | |
| HeLa | Korea Cell Line Bank | 10002 | |
| Sonicator | DAIHAN Scientific | WUC-D10H | |
| Ultrasonicator | BMBio | BR2006A | |
| Centrifuge I | Eppendorf | 5424 R | |
| Centrifuge II | LABOGENE | 1736R | |
| Rotator | FINEPCR | ROTATOR/AG | |
| Vacuum oven | DAIHAN Scientific | ThermoStable OV-30 | |
| Gel permeation chromatography (THF) | Agilent Technologies | 1260 Infinity II | |
| X-ray photoelectron spectrometer | Thermo VG Scientific | Sigma Probe | |
| Dynamic light scattering | Malvern Instruments | ZEN 3690 |
References
- Johnsson, B., Löfås, S., Lindquist, G. Immobilization of proteins to a carboxymethyldextran-modified gold surface for biospecific interaction analysis in surface plasmon resonance sensors. Analytical Biochemistry. 198 (2), 268-277 (1991).
- Kurzawa, C., Hengstenberg, A., Schuhmann, W. Immobilization method for the preparation of biosensors based on pH shift-induced deposition of biomolecule-containing polymer films. Analytical Chemistry. 74 (2), 355-361 (2002).
- You, C. C., et al. Detection and identification of proteins using nanoparticle-fluorescent polymer 'chemical nose' sensors. Nature Nanotechnology. 2 (5), 318-323 (2007).
- Roberts, M. W., Ongkudon, C. M., Forde, G. M., Danquah, M. K. Versatility of polymethacrylate monoliths for chromatographic purification of biomolecules. Journal of Separation Science. 32 (15-16), 2485-2494 (2009).
- Sandison, M. E., Cumming, S. A., Kolch, W., Pitt, A. R. On-chip immunoprecipitation for protein purification. Lab on a Chip. 10 (20), 2805-2813 (2010).
- Das, A., Theato, P. Activated Ester Containing Polymers: Opportunities and Challenges for the Design of Functional Macromolecules. Chemical Reviews. 116 (3), 1434-1495 (2016).
- Choi, J., et al. Functionalization and patterning of reactive polymer brushes based on surface reversible addition and fragmentation chain transfer polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 50 (19), 4010-4018 (2012).
- Kessler, D., Jochum, F. D., Choi, J., Char, K., Theato, P. Reactive surface coatings based on polysilsesquioxanes: universal method toward light-responsive surfaces. ACS Applied Materials & Interfaces. 3 (2), 124-128 (2011).
- Son, H., et al. Penetration and exchange kinetics of primary alkyl amines applied to reactive poly(pentafluorophenyl acrylate) thin films. Polymer Journal. 48 (4), 487-495 (2016).
- Kessler, D., Roth, P. J., Theato, P. Reactive surface coatings based on polysilsesquioxanes: controlled functionalization for specific protein immobilization. Langmuir. 25 (17), 10068-10076 (2009).
- Kessler, D., Theato, P. Reactive surface coatings based on polysilsesquioxanes: defined adjustment of surface wettability. Langmuir. 25 (24), 14200-14206 (2009).
- Kessler, D., Nilles, K., Theato, P. Modular approach towards multi-functional surfaces with adjustable and dual-responsive wettability using a hybrid polymer toolbox. Journal of Materials Chemistry. 19 (43), 8184-8189 (2009).
- Eberhardt, M., Mruk, R., Zentel, R., Theato, P. Synthesis of pentafluorophenyl(meth)acrylate polymers: new precursor polymers for the synthesis of multifunctional materials. European Polymer Journal. 41 (7), 1569-1575 (2005).
- Jochum, F. D., Forst, F. R., Theato, P. PNIPAM copolymers containing light-responsive chromophores: a method toward molecular logic gates. Macromolecular Rapid Communications. 31 (16), 1456-1461 (2010).
- Schattling, P., Pollmann, I., Theato, P. Synthesis of CO2-responsive polymers by post-polymerization modification. Reactive & Functional Polymers. 75, 16-21 (2014).
- He, L., Szameit, K., Zhao, H., Hahn, U., Theato, P. Postpolymerization modification using less cytotoxic activated ester polymers for the synthesis of biological active polymers. Biomacromolecules. 15 (8), 3197-3205 (2014).
- Arnold, R. M., McNitt, C. D., Popik, V. V., Locklin, J. Direct grafting of poly(pentafluorophenyl acrylate) onto oxides: versatile substrates for reactive microcapillary printing and self-sorting modification. Chemical Communications. 50 (40), 5307-5309 (2014).
- Son, H., Ku, J., Kim, Y., Li, S., Char, K. Amine-Reactive Poly(pentafluorophenyl acrylate) Brush Platforms for Cleaner Protein Purification. Biomacromolecules. 19 (3), 951-961 (2018).
- Cullen, S. E., Schwartz, B. D. An improved method for isolation of H-2 and Ia alloantigens with immunoprecipitation induced by protein A-bearing staphylococci. The Journal of Immunology. 117 (1), 136-142 (1976).
- Sisson, T. H., Castor, C. W. An improved method for immobilizing IgG antibodies on protein A-agarose. Journal of Immunology Methods. 127 (2), 215-220 (1990).
- Peritz, T., et al. Immunoprecipitation of mRNA-protein complexes. Nature Protocols. 1 (2), 577-580 (2006).
- Zhang, Z., Chen, S., Jiang, S. Dual-functional biomimetic materials: nonfouling poly (carboxybetaine) with active functional groups for protein immobilization. Biomacromolecules. 7 (12), 3311-3315 (2006).
- Yao, Y., et al. NHS-ester functionalized poly(PEGMA) brushes on silicon surface for covalent protein immobilization. Colloids and Surfaces B: Biointerfaces. 66 (2), 233-239 (2008).
- Ma, J., et al. Facile fabrication of microsphere-polymer brush hierarchically three-dimensional (3D) substrates for immunoassays. Chemical Communications. 51 (31), 6749-6752 (2015).
- Chong, Y., et al. Thiocarbonylthio compounds [SC (Ph) S− R] in free radical polymerization with reversible addition-fragmentation chain transfer (RAFT Polymerization). Role of the free-radical leaving group (R). Macromolecules. 36 (7), 2256-2272 (2003).
- Jochum, F. D., Theato, P. Temperature- and Light-Responsive Polyacrylamides Prepared by a Double Polymer Analogous Reaction of Activated Ester Polymers. Macromolecules. 42 (16), 5941-5945 (2009).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. JoVE. , Cambridge, MA. (2018).
- Chua, G. B. H., Roth, P. J., Duong, H. T. T., Davis, T. P., Lowe, A. B. Synthesis and Thermoresponsive Solution Properties of Poly[oligo(ethylene glycol) (meth)acrylamide]s: Biocompatible PEG Analogues. Macromolecules. 45 (3), 1362-1374 (2012).
Tags
Kjemi problemet 141 Poly (pentafluorophenyl acrylate) 3-aminopropyltriethoxysilane reaktive polymer pensel etter polymerisasjon functionalization antistoff immobilisering immunoprecipitationErratum
Formal Correction: Erratum: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification
Posted by JoVE Editors on 04/30/2019.
Citeable Link.
An erratum was issued for: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification. Throughout the article, the term "3-aminopropyltriethoxysilane" has been replaced with "3-aminopropyltrimethoxysilane", and "APTES" with "APTMS".
The Keywords were updated from:
Poly(pentafluorophenyl acrylate), 3-aminopropyltriethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
to:
Poly(pentafluorophenyl acrylate), 3-aminopropyltrimethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
The Abstract was updated from:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltriethoxysilane (APTES) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTES. The deposition of APTES and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
to:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltrimethoxysilane (APTMS) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTMS. The deposition of APTMS and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
The fourth paragraph of the Introduction was updated from:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTES linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTES. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
to:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTMS linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTMS. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
Step 2.1 of the Protocol was updated from:
Treatment of SiO2 beads with APTES
to:
Treatment of SiO2 beads with APTMS
Step 2.1.1 of the Protocol was updated from:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTES and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
to:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTMS and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
Step 2.1.3 of the Protocol was updated from:
Transfer the solution to a conical tube. To isolate the APTES functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
to:
Transfer the solution to a conical tube. To isolate the APTMS functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
Step 2.1.4 of the Protocol was updated from:
NOTE: The final suspension contains the APTES functionalized SiO2 beads dispersed in 4 mL of DMSO.
to:
Combine the methanol washed SiO2 beads with 3 mL of dimethyl sulfoxide (DMSO). Shake the mixture by hand, or if necessary sonicate for a few seconds, until the beads are fully dispersed in DMSO. Centrifuge the beads at 10,000 x g for 5 min, then remove the supernatant. Repeat the step to ensure complete solvent exchange from methanol to DMSO.
NOTE: The final suspension contains the APTMS functionalized SiO2 beads dispersed in 4 mL of DMSO.
Step 2.2 of the Protocol was updated from:
Grafting poly(PFPA) to APTES functionalized SiO2 beads
to:
Grafting poly(PFPA) to APTMS functionalized SiO2 beads
Step 2.2.2 of the Protocol was updated from:
Add 1 mL of APTES functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
to:
Add 1 mL of APTMS functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
Step 3.4 of the Protocol was updated from:
To prepare APTES functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTES functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
to:
To prepare APTMS functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTMS functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
The first paragraph of the Representative Results was updated from:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTES and poly(PFPA) grafting process, bare SiO2 beads, APTES functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
to:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTMS and poly(PFPA) grafting process, bare SiO2 beads, APTMS functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
Figure 1 was updated from:
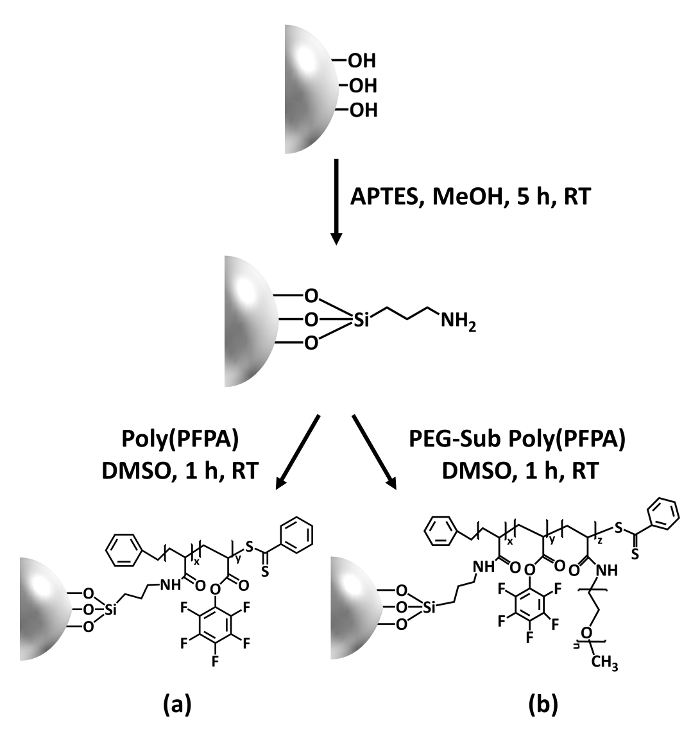
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTES as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
to:
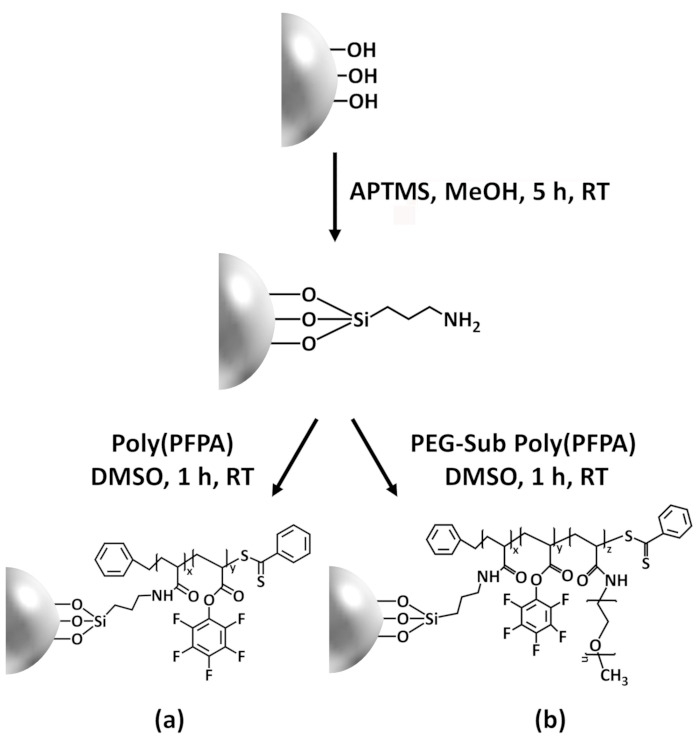
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTMS as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
Figure 2 was updated from:
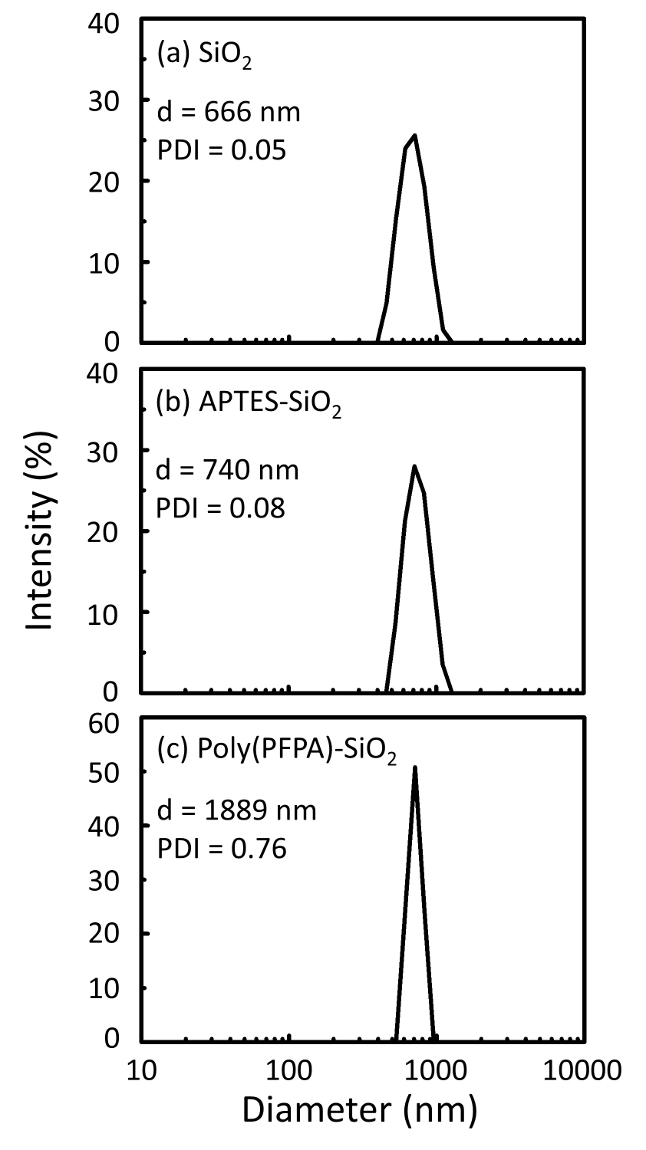
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTES functionalized SiO2 beads (APTES-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
to:
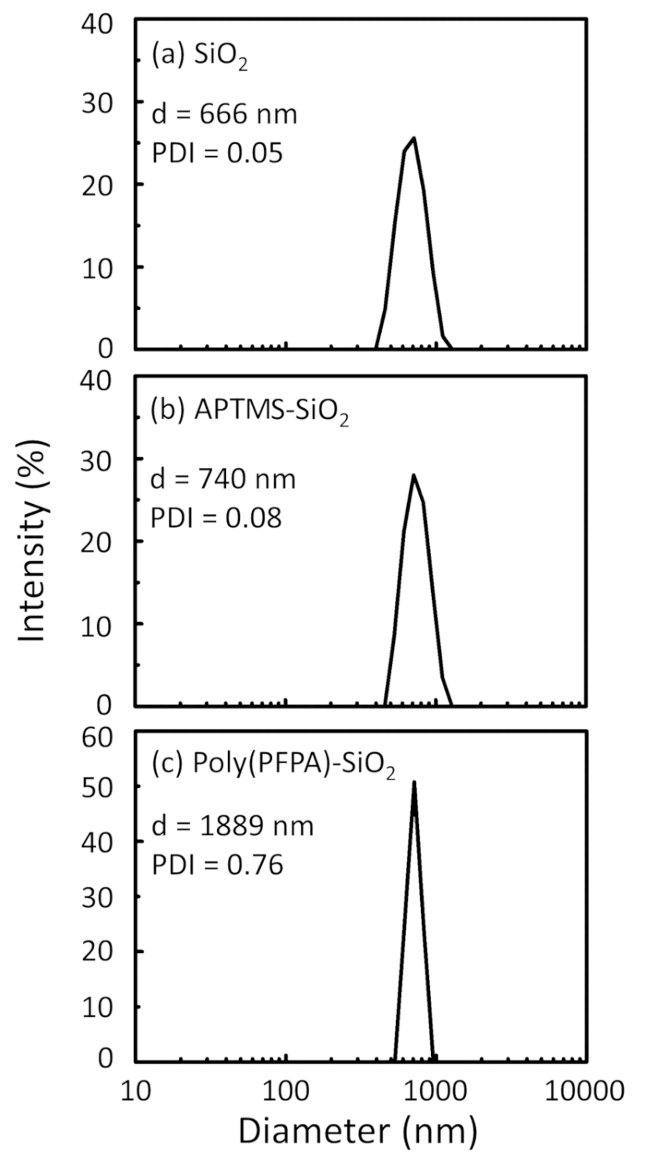
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTMS functionalized SiO2 beads (APTMS-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
Figure 3 was updated from:
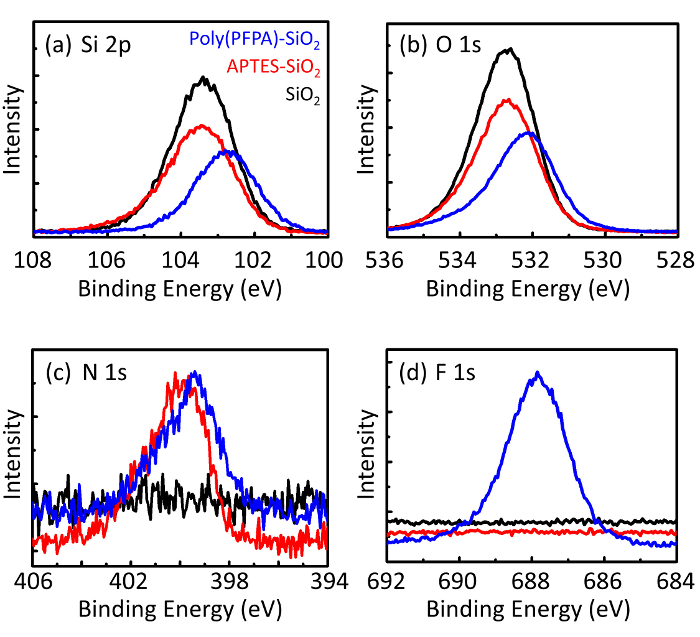
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTES functionalized SiO2 beads (APTES-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
to:
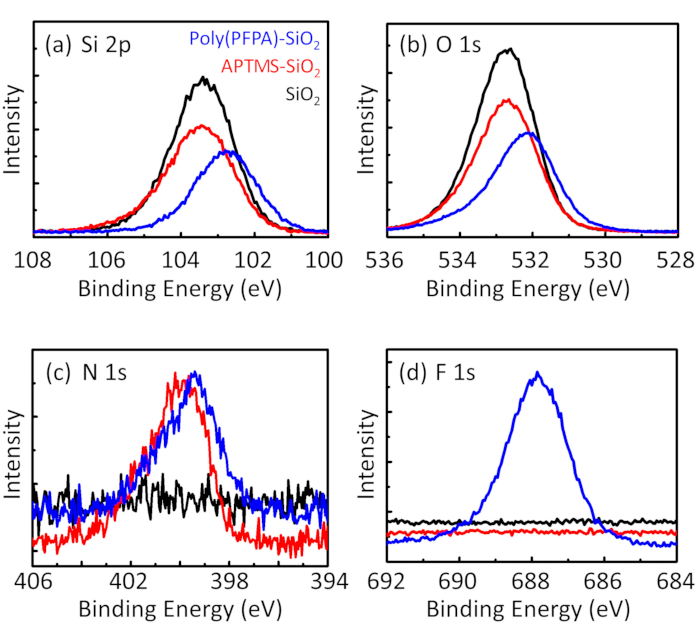
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTMS functionalized SiO2 beads (APTMS-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
The first and second paragraphs of the Discussion were updated from:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTES as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTES, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTES linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTES treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTES treatment, N 1s peak associated with the amine groups on APTES is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTES, then with poly(PFPA).
to:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTMS as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTMS, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTMS linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTMS treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTMS treatment, N 1s peak associated with the amine groups on APTMS is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTMS, then with poly(PFPA).



