Summary
近赤外蛍光剤や生物学的プローブに組み込まれて染料からの画像データを利用した、ラットの尾静脈注射を検証する方法をご紹介します。尾の前にイメージを作成し、蛍光シグナルの定量化、注入後、注射の品質の評価をしました。
Abstract
ラットの尾静脈に薬剤の静脈内投与 (IV) の投与は困難と矛盾することができます。尾静脈注射を最適化すると、試薬が血流中に直接導入する必要がある、多くの実験プロシージャの重要な部分です。無意識のうちに、注射は皮下、おそらく科学的な成果を変更することができます。法人の近赤外蛍光 (NIRF) 色素をナノエマルション ベースの生物学的プローブを利用して、このメソッドはイメージングに成功した尾静脈注射体内.の機能を提供していますNIRF 撮像素子を使って、エージェントの注入の前後に画像を撮影します。許容の静脈注射は、質的または量的に基づいて決定されます注射部位における NIRF 信号の強度。
Introduction
小動物に薬剤の投与経路は、多くの実験の重要なポイントとして機能します。エージェントが配信され、その後、エージェントにその後どうなるかを決定します。エージェント管理1のため、他のルートを使用できますが、配信の静脈内のルートは特定のエージェントの優先ルートです。IV 注入では、エージェントが組織初回通過効果と無関係な溶質の absorption1 の必要性のバイパス、血流に直接注入することができます。これは、ターゲット細胞の血流2,3循環システム内のすべての組織への直接配信。齧歯類で、頸、伏在、尾静脈など、いくつかの静脈を考えることが。
このメソッドで、NIRF は、生物学的プローブを含む染料-この場合、ナノエマルション (図 1 a)3,4,5,6-ラットの外側尾静脈に注入されます。この特定の NIRF を含むナノエマルションを以前画像し、体内と神経因性疼痛2,3,4、ラット モデル9 vivo7, 8 ex neuroinflammation を追跡に使用されています 5,10,11。前に、と前臨床の近赤外蛍光イメージャの注射後にイメージングを実施 (材料の表を参照してください)。これは、エージェントの管理の品質を検証するためのツールとして提供しています。基準画像を得るための基礎として尾静脈注射で前にイメージングします。
ますます動物実験で投与ナノエマル ジョンが生物学的プローブおよびターゲット エージェント12,13,14,15として使用されています。それは尾静脈16,17を介してエージェントを管理する実績のある挑戦-薬、ウイルスのベクトルまたは別のプローブ-注入の内容全体が血流を正常に入力したことを確認するではなく、周囲組織17。したがって、視覚化および成功した注入の品質評価法は有益です。
通常、熱ランプまたは暖かい水は注入前にその可視化を許可、静脈の拡張を引き起こす尾を暖めるために使用されます。これにより静脈への参入容易、化合物がその全体18,19,20,21に血流を入力したかどうかを識別する定量的な方法はないです。これは、静脈とは対照的かすかに皮膚など黒いマウスで動物の系統でまだより困難になります。通常、調査官は抵抗噴射時と、エージェント22,23の皮下漏出を示す尻尾の膨らみを可視化するいくつかのケースを体験することで失敗した注入を測ることができます。
小動物 NIRF イメージング システムに本研究で生きているラットの外側尾静脈に注射したナノエマルションの NIRF イメージングの実行 (材料の表を参照してください)。ラットが、特別な精製 (材料の表を参照) をダイエット腸の非特異蛍光を抑える。白い光と 800 nm の蛍光の同時画像集録は、NIRF 撮像素子と関連ソフトウェアを使用してキャプチャされます。プレ噴射やポスト噴射状態で尻尾に相対的な蛍光強度を測定します。注入のサイトで利益 (率 ROI) の領域の蛍光強度を記録および投資収益率の面積で割った値します。注射が許容される定性的な評価が可能です。さらに必要に応じて、許容可能な注射のためのしきい値を設定し、その時点で統計的有意性を計算することができますグループに投資収益率の測定を割り当てることによっては定量分析を実行できます。
尾静脈注射の後この検証戦略を活用することにより研究の標準がエージェント管理の整合性の向上により向上します。尾静脈注射の品質を評価するためのこのメソッドは、いくつかの企業によって商業的に提供される赤外線蛍光プローブを含むように異なる注射剤の簡単にカスタマイズできます。
Protocol
すべてのプロトコルをケアと国立衛生研究と制度動物ケアおよび使用委員会 (IACUC) デュケイン大学での実験動物の使用のため、ガイドのガイドラインに従って行った。
1. 準備と麻酔
注:無菌技術は、プロシージャの全体に使用されます。のみ新しい滅菌材料とオートクレーブ滅菌器が使用されます。(滅菌手袋、髪ボンネット、サージカル マスク、スクラブ) 個人用保護具の汚染を避けるために着用する必要があります。
- 成人男性 Sprague-dawley ラット 250-300 グラムの重さは、このプロトコルで使用されました。標準的な生きている条件にラットを順応、12 h 光/12 h 暗いサイクルでそれらを保つ、アドリブの水と食料を与えます。社会的動物の家、紙寝具のそれらを保つし、特別な提供 (材料の表を参照) をイメージング中に蛍光を避けるためにダイエットします。
- 適切に配置された加熱パッドを使って、動物ウェイク アップや気持ちを保持しない限り、1.5% イソフルランと 3% 以上のメンテナンス レベルに続いて 20% 酸素の初期 5% イソフルラン麻酔下の動物を麻酔します。
- つまみを尻尾に反応の欠如によって適切な麻酔を確認します。バイタル サインの手順を介してだけでなく血流を監視します。
2. プレ噴射画像獲得
- 横尾 (図 1C, E) の蛍光のベースラインを確立する水平尾翼に注射部位を公開に動物を配置することで臨床の近赤外蛍光イメージャで動物をイメージします。両方白い光 (体ビュー) とでリンクされたルックアップ テーブル (LUT) NIRF 撮像素子と関連するソフトウェアを使用して赤外線チャンネル近く同時画像の取得を実行します。
- 次の画像、動物の移動手術台に戻るし、尾静脈注射の麻酔下に配置。
注:動物のバイタル サインの監視を継続し、尾ピンチを介して適切な anesthetization を再確認します。
3 エージェントの NIRF を含む尾静脈注射
-
腹臥位での動物との尾を背側を上に向けます。1 分東洋尾静脈側 (右または左) は (時計回りまたは反時計回り) 右または左の尾静脈 (図 1B) を公開に 30 ° になっているので最低限のぬるま湯で尻尾の血管を拡張させます。
- 外側尾静脈が見つかったら (暗い色に表示される拡張時)、アルコール パッド、2 x を繰り返し全体の尾を消毒します。
- 研究デザインに基づく、適切な用量で適切な針の配置が失敗した場合は尾の移動より近位遠位尾椎領域で注射を開始します。
- 25-27 G 滅菌針を挿入し、リフトの尻尾と平行の針を挿入、180 ° の角度で尾を持つ、外側尾静脈に、ベベルします。適切な配置を確保するために針の縁で血液のフラッシュ バックを確認します。(尾からそれを削除する) せずに針の先端がゆっくりと移動明白なフラッシュ バックしない場合、静脈挿入を見つけよう。皮下に配置されている場合、血液のフラッシュ バックは行われません。
- 針の縁に注射器注射材を挿入します。適切な配置を達成したとき、注射液は注入時に抵抗を発生しません。注射は、スムーズかつ簡単に進めます。一度注入すると、針と注射器を削除、凝固、確保するため、少なくとも 1 分の滅菌ガーゼで圧迫し、尾、白の光のイメージで目に見えるであることを確認の上にペンでインジェクションのスポットをマークします。
注:血腫または病変がない表示される注射部位。 - 針の先端は、注射器の挿入時に移動した場合、針を除去し、同側の尾静脈により近位の針のエントリのプロシージャを再試行してください。別再入ポイントがしようとした場合は、同じ針を再利用しません。
注:血流の指標と IV カテーテルで注入を実行できるまたは、(材料の表を参照してください)。これはカテーテルの穿刺時に視覚的に確認の利益を持っています。前述の角度で、ベベル側のカテーテルを挿入します。適切な配置を確保するため血流指標の全体の長さでプロンプトのフラッシュ バックを確認します。わずかな背圧は、注射器を注入する前に船の適切な位置を確認するために血液をプルする使用できます。また、抵抗は感じてないです。
4. 投与後画像の取得
- 品質評価基準プレ噴射画像と同じ向きで前臨床近赤外蛍光イメージャの尾静脈注射を次を実行します。動物の麻酔はまだ正しくことを確認-イメージングの間されるので、-撮像素子にそれを置く前に。
注:引き出し housingwith 麻酔接続と動物のマスクを含むイメージング システムは、利用可能な場合に使用ください。 - 水平尾翼に注射部位 (マーク) として公開するその横側に動物を向けます。NIRF 信号が注入のサイトでしか存在を確認します。これは成功した尾静脈注射 (図 1D) を示します。
注:尾全体を通して信号を分散している場合は、皮下と、それゆえ失敗すると見なされます (図 1F)。図 2は、失敗した注射の追加例を示します。
5 画像の定量化
注:この関数が使用可能な場合、近赤外イメージャに付属するイメージング ソフトウェアのイメージ定量化を実行できます。また、他の市販の画像解析ソフトウェア使用の24があります。
- 投与後イメージでインジェクション サイト2,6蛍光周辺関心領域を描画します。
- エリアと相対蛍光強度とレコードを地域/強度として測定します。質的か投与後およびベースラインのプレ噴射画像を比較または適切な統計分析 (研究グループおよび条件に依存) を使用して、曲率。
注:研究者は、良い悪い注射から差別または注入する品質の割合を割り当てる閾値に決めることができます。
Representative Results
ラットは NIRF 含むナノエマルションを外側尾静脈に注入したし、プロトコルで説明されているように前および投与後画像が小動物イメージャ (材料表) で撮影されました。投与後画像の質的注入品質評価し、'良いインジェクション' に配置 (n = 7)、'悪いインジェクション' (n = 4) グループ。投与後領域の蛍光を観察することによって定性的評価を行った。最適な注射で NIRF 信号は注射部位に限定されます。エージェントは、血流に完全に避難されているため注入が成功した場合、信号は見てないです。品質の悪いインジェクションには、尾の長さに沿って分散 NIRF 信号が表示されます。
画像は、付属 NIRF 撮像素子ソフトウェアで解析されました。関心の領域は、プレ噴射画像 (図 1C, E) の投与後の画像 (図 1D, F) で蛍光の周辺サイトで描かれました。蛍光は尾の長さ全体表示画像は受け入れられないと判断され、分析 (図 2) から削除されます。エリアと蛍光強度の測定を記録しました。エリア/蛍光強度の値は、計算された、(図 1G) をプロットします。有意差 (対になっていないt-テスト) 蛍光前および投与後の画像間の輝度は、'悪いインジェクション' グループ (図 1G) で観察された (p = 0.0024)。
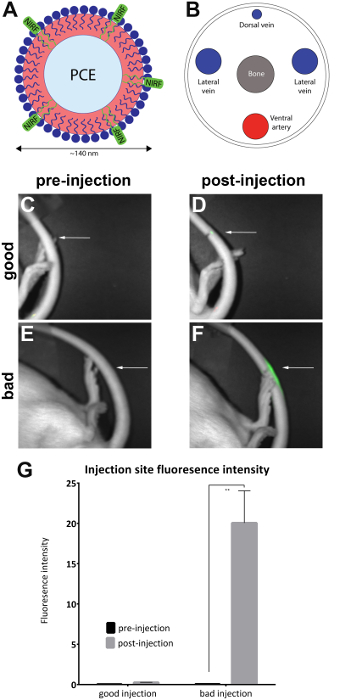
図 1: NIRF ベース ナノエマルションと尾静脈のイメージ。(A) A ナノエマルション ベース生物学的プローブ NIRF 染料含有だった (B) 外側尾静脈に注入し、NIRF 撮像素子のイメージします。(CとD) 前と注射後の画像良い注入。(EおよびF) 前と注射後の画像悪いインジェクション。白い矢印の挿入ポイントを示します。質的注射部位における NIRF 信号の程度を評価することによって悪い注入と比較して良い注入の成功を評価することが可能です。容認できない注射尾の全長にわたって蛍光表示し、分析 (図 2) から削除されました。(G) 画像は調査官によって割り当てられた注入品質のしきい値との蛍光強度の定量的測定を明らかにする分析も可能します。グラフの誤差範囲を反映 SEM'良いインジェクション' グループ、 n = 7。'悪いインジェクション' グループ、 n = 4。前と注射後の画像を比較する '悪いインジェクション' グループの蛍光強度の統計的な差がある (対になっていないt-テスト;p = 0.0024)。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 悪い注射の例。(A) 蛍光信号の尾の一部に見られます。(B) 蛍光信号の尾の全長にわたって見られます。(C) 蛍光信号は全体の尾と尾側部動物の体に重く分散。この図の拡大版を表示するのにはここをクリックしてください。
Discussion
研究所には、テスト エージェントの失政の結果として大幅なコストがかかります。尾静脈注射は、最もしばしば失政のエラーを負う技術者の経験との一貫した成功率を達成するためにマスターに難しい手法です。成功した注入を確認する確実な方法はありません。このプロトコルは、研究者のマウス尾静脈注射の成功を検証する質的および量的な方法を与えることによってこの問題を解決を提供しています。NIRF ラベル ナノエマルション7,8,25に (薬) この場合は、選択のエージェントが組み込まれていますここでは、NIRF 小動物イメージャの注入のサイトでイメージを作成するとします。また、非ナノエマルション ベース エージェントを開発し、市販の赤外線染料を組み込むことにより NIRF イメージングのと同じ原理を使用するオプションです。さらに、腫瘍イメージング、代謝などのアプリケーションの様々 な準備ができて使用するイメージング エージェントの人身売買、イメージング、細胞し、アポトーシスも市販されています。滅菌針あるいは IV カテーテルでは; を使用して、インジェクションを行うこれは研究者の好みに依存します。さらに、自動化された尾静脈注射26はこのプロセスを支援する使用されている、この方法論と互換性が。しかし、この技術はまだならない市販。
正しいエージェント管理のより高い率を確保する尾静脈注入法の重要なステップがあります。尾はまず、汚れや破片、静脈を視覚化より研究者を許可するを削除するエタノールで洗浄してください。暖かい水でテールを水没によって静脈を拡張はまた方法では、非常に重要なステップ注入の表面積。複数回の試行が必要な場合に、いくつかのエラーより遠位の時点で尾静脈注射します。注射は、動物の体内の尾の側面に近づくと、サイズは尾静脈が大きくなりますと尾のより近位の位置で試みられるべき。さらに、同側の尾静脈よりも 3 〜 5 サイトで針の配置が失敗した場合、対側の尾静脈を使用できます。
テスト エージェントの成功した管理の注射の時点で信号がない NIRF はほとんどの結果します。注入の管理中に抵抗を感じなかったし、尾のない蛍光する少しがある、成功、射出を記録できます。注入時に抵抗が感じられるある場合、テールのいくつかの長さに沿って歩道の NIRF 信号注入は失敗として記録され、可能性が高いし、部分的に皮下。蛍光画像撮影前と後の注入と噴射の質が定性的観察したり、注射部位での蛍光信号の定量的分析による評価。近赤外蛍光イメージャに付属するソフトウェアはこの分析を実行することがしばしばです。
メソッドは、複数の方法で合わせることができます。マウスおよびラットの静脈注射を尻尾に適用されます。ほとんど小動物近赤外蛍光イメージャーはマウスの齧歯動物を収容できます。麻酔のレベルは研究所の IACUC プロトコルに従い、動物の体重に応じて調整する必要があります。研究員の作り出されたエージェントに赤外光吸収色素を組み込むことによって、または特定の生物学的応用に合わせて使えるにイメージング エージェントを購入することによって、別の可能な変更はナノエマルション ベース以外のプローブの準備です。
ネズミが比較的大きい場合に小動物の固体撮像素子の配置が難しいことがあります。テスト画像は、注入前に引き出しの中に動物で撮影、視野確認尾は表示をこのようにお勧めします。画像の中にそれを確保するため、撮像素子の引き出しに尻尾が動かないテープに便利です。
小動物に注射が実験プロシージャを同時に干渉していない動物これらの安楽死が必要な試薬のラベルの利用に限られている尾静脈の品質を評価する方法12,13。いくつかの試薬は、実験的なデザインでのケアをお勧めしますので研究成果と、動物の治療評価影響があります。
このメソッドは、将来的に、小動物イメージング技術として赤外線蛍光プローブの改善で進歩と洗練されたあります。この方法2,3 に記載されている別注射の品質を検証する研究デザインのエージェント管理段階で法人の赤外光吸収色素は、様々 な異なるアプリケーション用に設計された生物学的プローブを使用できます。 ,27,28,29,30,31,32。
Disclosures
著者が明らかに何もありません。
Acknowledgments
J.A.P. と J.M.J. は、神経因性疼痛に対する効果のため慢性的な狭窄損傷ラットモデルにおけるナノエマル ジョンを評価するための実験的アプローチを共同でデザインしました。J.M.J.、ナノエマル ジョン、ナノエマルションの組成、微細加工技術と全体的なマクロファージ標的薬配信方法に設計されています。J.M.J. は、J.M.J. の指導の下でさらに l. l. によって作製したナノエマルションを生産J.M.J. や s. p. 動物のケア、手術、行動、尾静脈注射によって、ナノエマルションの安定性が評価された、NIRF イメージングを行った共同修士号およびつ J.A.P. の指導の下で原稿が書かれ、理学修士、作製し、プロトコルは、つによって書かれました。
近赤外光イメージングは、デュケイン大学 (ピッツバーグ組織工学イニシアティブ シード補助金サポート) で小動物イメージング システムで実行されました。J.M.J. は、国防総省受賞番号 FA8650-17-2-6836、NIDA 受賞番号 1R21DA039621-01、NIBIB 受賞番号 R21EB023104 02、AFMSA 賞を受賞番号 FA8650-17-2-6836 からサポートを認めています。J.A.P. と J.M.J は、ピッツバーグ組織工学イニシアティブ種子グラントからのサポートを認めます。J.A.P. は、連邦のユニバーサル研究強化賞」とチャールズ ・ ヘンリー ・ リーチ II 基金、エマ冬財団、サミュエル ・ Hunkele 恐ろしい病賞にも認めています。J.A.P. および J.M.J. は、デュケイン大学就任学長の学際的研究コンソーシアム ・ グラント、慢性の痛み研究コンソーシアムを支えるサポートを認めます。
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



