Summary
Her vil vi præsentere en metode til at validere hale vene injektioner i rotter ved at udnytte nær-infrarødt fluorescens billeddiagnostiske data fra farvestoffer indarbejdet i agenter eller biologiske prober. Halen er afbildet før og efter injektionen, den fluorescerende signal er kvantificeret, og en vurdering af injektion kvalitet.
Abstract
Intravenøs (IV) administration af agenter i halen vene af rotter kan være både svært og inkonsekvent. Optimere hale vene injektioner er en central del af mange eksperimentelle procedurer hvor reagenser skal være indført direkte ind i blodbanen. Uforvarende, kan indsprøjtning være subkutane, muligvis ændre de videnskabelige resultater. Udnytte en nanoemulsion-baserede biologiske sonde med en indbygget nær-infrarødt fluorescerende (NIRF) farvestof, giver denne metode mulighed for imaging en vellykket hale vene injektion in vivo. Med brugen af en NIRF imager tages billeder før og efter indsprøjtning af agenten. En acceptabel IV injektion bestemmes kvalitativt eller kvantitativt derefter baseret på intensiteten af NIRF signal på injektionsstedet.
Introduction
Indgiftsmåde af agenter i små dyr tjener som et kritisk punkt i mange eksperimenter. Det bestemmer hvor agenten er der skal leveres, og efterfølgende, hvad vil der ske med agenten derefter. Selv om andre ruter kan bruges til agent administration1, er ruten intravenøs levering en foretrukken rute for visse agenser. IV injektion giver agenter sprøjtes direkte ind i blodbanen, omgåelse first-pass væv effekter og behovet for uvedkommende opløste absorption1. Dette giver også mulighed for målretning celler i blodet2,3 og direkte levering til alle væv inden for kredsløbssygdomme. I gnavere, kan flere vener overvejes, herunder jugularis, den saphenous og hale vene.
I denne metode, en NIRF farvestof, der indeholder en biologisk sonde — i dette tilfælde, en nanoemulsion (figur 1A)3,4,5,6— indsprøjtes i den laterale hale vene af rotter. Denne særlige NIRF-holdige nanoemulsion er tidligere blevet brugt til billede og spore neuroinflammation in vivo og ex vivo7,8 i en rotte model9 af neuropatisk smerte2,3,4, 5,10,11. Imaging er udført før og efter indsprøjtning med et prækliniske NIR fluorescens imager (Se Tabel af materialer). Dette tjener som et redskab til at validere kvaliteten af agent administration. Imaging før hale vene injektion tjener som grundlag for at opnå en baseline billede.
I stigende grad i dyreforsøg, er intravenøst administreret nanoemulsions ved at blive udnyttet som biologiske prober og målretning agenter12,13,14,15. Det er en gennemprøvet udfordring til at administrere en agent via hale vene16,17– et stof, en viral vektor eller en anden sonde — og at sikre, at hele indholdet af injektion med succes har indtastet i blodbanen og ikke den omkringliggende væv17. Derfor, en metode til at visualisere og evaluere kvaliteten af en vellykket indsprøjtning er gavnlige.
Typisk, en varmelampe eller varmt vand der bruges til at varme hale, der forårsager dilatation af vene, tillader dens visualisering inden injektionen. Mens dette sikrer lettere indrejse i venen, er der ikke en kvantitativ måde at skelne, om stoffet er trådt i blodbanen i sin helhed18,19,20,21. Dette bliver vanskeligere stadig i stammer af dyr hvor venen kontraster svagt med huden, såsom i sorte mus. Typisk, investigator kan måle en mislykket injektion ved at opleve modstand under injektion, og i nogle tilfælde, visualisere en bule på halen, der angiver en subkutan lækage af agent22,23.
I denne undersøgelse, NIRF billedbehandling af nanoemulsion injiceres i den laterale hale vene af levende rotter er udført på en små-dyrs NIRF imaging system (Se Tabel af materialer). Rotter fodres en særlig renset kost (Se Tabel af materialer) for at reducere uspecifik gut fluorescens. Samtidige billede erhvervelse af hvidt lys og 800 nm Fluorescens er fanget ved hjælp af NIRF imager og tilhørende software. Relative fluorescens intensitet måles på halen på de før injektion og efter indsprøjtning stater. Fluorescens-intensiteten for region af interesse (ROI) på injektionsstedet er registreret og divideret med området af ROI. Kvalitative vurderinger kan laves som injektioner er acceptabel. Eventuelt kan yderligere kvantitative analyser udføres ved at opstille grænseværdier for acceptable injektioner og tildele ROI målinger i grupper, hvorefter der kan beregnes Statistisk signifikans.
Ved at udnytte denne validering strategien efter hale vene injektioner, forbedrer standarden for en forskningsundersøgelse på grund af øget konsistens af agent administration. Denne metode til vurdering af kvaliteten af hale vene injektion kan tilpasses nemt til forskellige injicerbare agenter til at omfatte infrarød fluorescerende sonder leveret kommercielt af flere virksomheder.
Protocol
Alle protokoller blev udført i overensstemmelse med retningslinjerne i vejledningen for pleje og anvendelse af forsøgsdyr af National Institutes of Health og institutionelle Animal Care og brug udvalg (IACUC) på Duquesne Universitet.
1. forberedelse og anæstesi
Bemærk: Aseptisk teknik anvendes under hele proceduren. Kun der nye sterile materialer og autoklaveres sterile instrumenter skal anvendes. Personlige værnemidler (sterile handsker, hår motorhjelm, kirurgisk maske, scrubs) skal bæres for at undgå kontaminering.
- Voksen mandlig Sprague-Dawley rotter vejer 250-300 g blev brugt i denne protokol. Acclimate rotter til standard levevilkår, holde dem på en 12-timers lys/12 h mørke cyklus, og sørge for mad og vand ad libitum. Hus dyret socialt, holde dem på papir sengetøj og giver en særlig kost (Se Tabel af materialer) for at undgå autofluorescence under imaging.
- Med brugen af en korrekt placerede varmepude, bedøver dyr under en indledende 5% isofluran i 20% ilt, efterfulgt af en vedligeholdelse niveau af ikke mindre end 1,5% isofluran og ikke mere end 3%, medmindre dyret vågner op eller bevarer følelse.
- Bekræfte ordentlig anæstesi via en manglende respons til hale pinches. Overvåge blodgennemstrømning samt via vitale tegn under hele proceduren.
2. før injektion Image Acquisition
- Image dyret i en prækliniske NIR fluorescens imager ved at placere dyret lateralt for at udsætte injektionsstedet på den laterale hale til at etablere en baseline af fluorescens i halen (figur 1C, E). Udføre en samtidige billede erhvervelse af både et hvidt lys (kroppen Se) og nær infrarøde kanaler ved hjælp af NIRF imager og tilhørende software, med sammenkædede opslagstabeller (LUT).
- Følgende imaging, flytte dyret tilbage til tabellen kirurgisk, og placere den under anæstesi til hale vene injektion.
Bemærk: Fortsætte overvågning dyrets vitale tegn og recheck ordentlig anesthetization via hale knivspids.
3. hale vene injektion med NIRF-holdige Agent
-
Med dyr i den liggende stilling, orientere halen med den dorsale side opad. Spile hale Vaskulaturen i varmt vand i mindst 1 min. Orient halen vene så den lateral side (enten højre eller venstre) er vendte 30° (med eller mod uret) for at udsætte den højre eller venstre hale vene (figur 1B).
- Når en lateral hale vene er blevet placeret (der vises mørk-farvet ved dilatation), desinficere hele halen med alkohol puder, gentage 2 x.
- En passende dosis baseret på undersøgelse design, begynde injektioner i regionen distale halebenshvirvel ryghvirvler af halen og bevæger sig mere proksimale undlader ordentlig nålen placering.
- Indsæt en 25-27 G steril kanyle, facet op, i den laterale hale vene, med halen i en vinkel på 180°, indsætte nålen parallelt med løftet hale. Observere blod flashback i randen af nål til at sikre korrekt placering. Hvis ingen flashback er tilsyneladende, langsomt flytte nålen tip (uden at fjerne det fra halen) at finde vene indsættelse. Hvis placeret subkutant, opstår der ingen blod flashback.
- Indsæt sprøjte med de injicerbare materialer i randen af nålen. Når korrekt placering er opnået, injicerbar væske vil ikke pådrage sig modstand ved injektion. Injektionen vil forhånd glat og let. Når injiceres, fjerne kanylen og sprøjten, anvende pres med steril gaze for mindst 1 min til at sikre koagulation og markere stedet af injektion med en pen på halen, sikre det er synlig på den hvide lys billede.
Bemærk: Ingen hæmatom eller læsion vil være synlig på injektionsstedet. - Hvis nålen spidsen bevæger sig under sprøjte indsættelse, fjerne nålen og prøve den nål indlæsningsprocedure mere proksimalt på ipsilaterale hale vene. Genbrug ikke den samme nål, hvis en anden reentry punkt er forsøgt.
Bemærk: Alternativt, injektion kan udføres med en IV kateter med en blod-flow indikator (Se Tabel af materialer). Dette har fordelen af visuel bekræftelse af kateteret under venepunktur. Indsæt kateter, facet side op, i den vinkel, som tidligere beskrevet. Observere hurtig flashback i hele længden af blodgennemstrømningen indikator til at sikre korrekt placering. Lille modtryk kan bruges til at trække blod ind i sprøjten bekræfter korrekt placering i skibet før injektion. Igen, ingen modstand vil kunne mærkes.
4. efter injektion billede erhvervelse
- Udføre vurdering efter hale vene injektion i en prækliniske NIR fluorescens imager i den samme retning som baseline før injektion billede. Sikre, at dyret er stadig korrekt bedøvede — og vil være det til varigheden af imaging — før placere det i imager.
Bemærk: Et billedbehandlingssystem, der indeholder en skuffe housingwith anæstesi forbindelser og en maske for dyret bør anvendes, hvis den er tilgængelig. - Orientere dyr på sin laterale side at eksponere injektionsstedet (som markeret) på den laterale hale. Kontrollere, om et NIRF signal findes kun på injektionsstedet. Dette indikerer en vellykket hale vene injektion (fig. 1D).
Bemærk: Hvis signalet er spredt over hele hele halen, det anses for at være subkutane og dermed mislykket (figur 1F). Figur 2 viser yderligere eksempler på mislykkede injektioner.
5. billede kvantificering
Bemærk: Billede kvantificering kan udføres med den billedbehandling software, der følger af NIR imager, hvis denne funktion er tilgængelig. Alternativt, andre kommercielt tilgængelige billede analyse software være brugte24.
- I Post injektion billedet, skal du trække en region af interesse rundt i området af fluorescens ved indsprøjtning arbejdsplads2,6.
- Måle område og relative fluorescens intensitet og post som område/intensitet. Sammenlign efter injektion og baseline før injektion billeder enten kvalitativt eller kvantitativt ved hjælp af passende statistiske analyse (afhængig af studiegrupper og betingelser).
Bemærk: Forskeren kan beslutte på tærskler, der diskriminerer godt fra dårlig injektioner eller tildele en procentdel af kvalitet til injektion.
Representative Results
Rotter blev sprøjtet med NIRF-holdige nanoemulsion i laterale hale vene, og før og efter indsprøjtning billeder blev taget med små dyr imager (Table of Materials) som beskrevet i protokollen. Post injektion billeder kvalitativt vurderes til injektion kvalitet og placeret i god injektion (n = 7) og 'dårlige injektion' (n = 4) grupper. Kvalitativ vurdering blev foretaget ved at observere efter injektion område fluorescens intensitet. I en optimal injektion, er NIRF signal begrænset til injektionsstedet. Intet signal vil ses, hvis injektion er vellykket, fordi agenten har fordrevet fuldt ind i blodbanen. En dårlig kvalitet injektion viser et NIRF signal, der er spredt langs længden af halen.
Billeder blev analyseret med ledsagende NIRF imager software. Regioner af interesse blev trukket på webstedet før injektion billeder (figur 1C, E) og rundt i området af fluorescens i Post injektion billeder (figur 1D, F). Billeder hvor fluorescens var synlig i hele længden af halen blev anset for uacceptable og fjernet fra analyse (figur 2). Målinger af området og fluorescens-intensiteten blev registreret. Værdier for området/fluorescens intensitet blev beregnet og afbildet (figur 1G). En signifikant forskel (parrede t-test) i fluorescens intensitet mellem før og efter indsprøjtning billeder blev observeret i gruppen 'dårlig indsprøjtning' (figur 1G) (p = 0.0024).
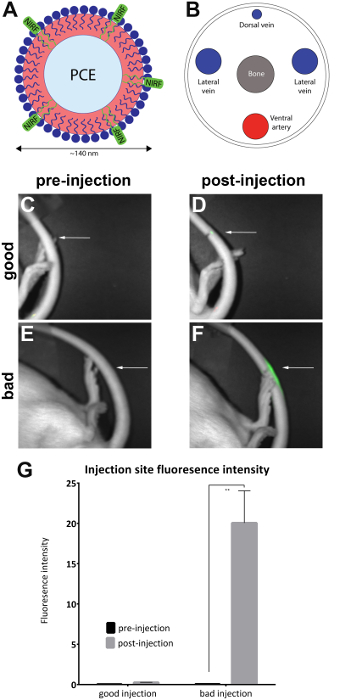
Figur 1 : NIRF baseret nanoemulsion og billeder af hale vene. (A) A nanoemulsion-baserede biologiske sonde indeholdende NIRF dye blev sprøjtes ind (B) lateralt hale vene og afbildet i en NIRF imager. (C og D) pre- og postinjection billeder af en god injektion. (E og F) pre- og postinjection billeder af en dårlig indsprøjtning. Hvide pile angiver punktet, injektion. Det er muligt at vurdere kvalitativt succes af en god injektion sammenlignet med en dårlig indsprøjtning ved at vurdere omfanget af NIRF signalet på injektionsstedet. Uacceptabel injektioner vise fluorescens i hele længden af halen og blev fjernet fra analyse (figur 2). (G) billederne kan også analyseres for at afsløre en kvantitativ måling af fluorescens intensitet, med tærskler for injektion kvalitet tildelt investigator. Fejllinjer på grafen afspejler SEM. For 'god injektion' gruppe, n = 7. For 'dårlig indsprøjtning' gruppe, n = 4. Der er en statistisk forskel i fluorescens intensitet i gruppen 'dårlig indsprøjtning' når man sammenligner pre- og postinjection billeder (parrede t-test; p = 0.0024). Venligst klik her for at se en større version af dette tal.

Figur 2 : Eksempler på dårlig injektioner. (A) fluorescerende signal set i del af halen. (B) fluorescerende signal set over hele længden af halen. (C) fluorescerende signal spredt stærkt i hele halen og caudale område af dyrets krop. Venligst klik her for at se en større version af dette tal.
Discussion
Forskningslaboratorier pådrage sig betydelige omkostninger som følge af tager af test agenter. Hale vene injektioner er en vanskelig teknik at mestre at opnå ensartet succesrate, med den mest erfarne af teknikere ofte pådrage tager fejl. Der er ingen pålidelig måde at bekræfte en vellykket injektion. Denne protokol tilbyder en løsning på dette problem ved at give forskere en kvalitativ og kvantitativ metode til at validere en murine hale vene injektion succes. Her, en NIRF-mærket nanoemulsion7,8,25 inkorporerer agent af valg (i dette tilfælde, et lægemiddel) og er afbildet på injektionsstedet i en NIRF lille dyr imager. Der er også mulighed for at udvikle en ikke-nanoemulsion-baserede agent og bruge det samme princip for NIRF billeddannelse ved at indarbejde kommercielt tilgængelige infra-røde farvestoffer. Derudover klar-til-brug imaging agenter med en bred vifte af applikationer, såsom tumor imaging, metabolisk imaging, celle, menneskehandel, og apoptose er også kommercielt tilgængelige. En injektion udføres enten ved hjælp af en steril nål eller, alternativt, en IV kateter; Dette afhænger af præferencen af forskeren. Derudover automatiseret hale vene injektorer26 har været brugt til at hjælpe i denne proces og er kompatible med denne metode. Dog er denne teknologi ikke endnu blevet kommercielt tilgængelige.
Der er vigtige skridt i halen vene injektion metode, der sikrer en højere sats af korrekte agent administration. Først, halen skal rengøres med ethanol til at fjerne snavs eller snavs, giver forskerne bedre visualisere venen. Dilatere venen ved nedsænkning halen i varmt vand er også et meget vigtigt skridt i metoden, da det giver mulighed for et større areal til injektion. Injektion på en mere distale punkt på halen vene giver mulighed for nogle fejl, at flere forsøg er nødvendige. Injektion bør forsøges på en mere proksimale position i halen som hale vene stiger i størrelse som den caudale aspekt af dyrets krop er kontaktet. Derudover kan de kontralaterale hale vene bruges hvis nålen placering ikke i mere end tre til fem websteder på ipsilaterale hale vene.
En vellykket forvaltning af en test agent resulterer i lidt at ingen NIRF signal ved injektion. Hvis ingen modstand er følte under administration af injektion og der er lidt at ingen fluorescens på halen, kan derefter injektion registreres som vellykket. Hvis modstand er følte under injektion, og der er et spor af NIRF signal langs nogle længden af halen, så indsprøjtning er registreret som mislykket og sandsynligvis dels subkutane. Fluorescens billeder er taget før og efter injektion, og kvaliteten af injektion er vurderet af observere kvalitativt eller kvantitativt analysere fluorescens signal på injektionsstedet. Softwaren ledsager NIR fluorescens imager er ofte i stand til at udføre denne analyse.
Metoden kan tilpasses på flere måder. Det gælder til hale vene injektion i både mus og rotter. De fleste små-dyrs NIR fluorescens kameraer vil være i stand til at rumme murine gnavere. Niveauer af anæstesi skal justeres afhængigt af vægten af dyr, i overensstemmelse med forskningslaboratoriums IACUC protokol. En anden eventuel ændring er forberedelsen af en ikke-nanoemulsion-baserede sonde, enten ved at indarbejde en infrarød farvestof i forskerens formulerede agent eller ved at købe en klar-til-brug imaging agent, skræddersyet til en bestemt biologiske program.
Hvis en rotte er relativt store, kan det ofte være svært at placere det i små-dyrs imager. Det anbefales således, at en test billede er taget med dyret i skuffen før injektion, og et synsfelt opgøres hvor halen er synlige. Det er nyttigt at tape hale til skuffe af imager, til at sikre, at den ikke bevæger sig under imaging.
Alternative metoder forsøger at vurdere kvaliteten af hale vene injektioner i små dyr er begrænset til udnyttelse af mærkning reagenser, der ikke forstyrrer samtidige eksperimentelle procedurer og kræver aflivning af dyr postinjection 12,13. Nogle reagenser kan påvirke undersøgelse resultater og den terapeutiske vurdering af dyr, så pleje i eksperimentelle design anbefales.
Denne metode kan i fremtiden være forfinet med fremskridt i små-dyrs imaging-teknologi, samt forbedringer i infrarød fluorescerende sonder. Biologiske sonder med en indbygget infrarød farvestof, designet til en række forskellige applikationer, kan bruges på stadiet agent administration af et forsøgsdesign for at validere kvaliteten af en indsprøjtning, som skitseret i denne metode2,3 ,27,28,29,30,31,32.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
J.A.P. og J.M.J. designet i fællesskab den eksperimentelle tilgang til at vurdere Nanoemulsions i kronisk konstriktion skade rotte model for effekter på neuropatiske smerter. J.M.J. udtænkt og designet samlede makrofag-målrettet drug levering tilgang med nanoemulsions, nanoemulsion sammensætning og processer for fabrikation. J.M.J. produceret nanoemulsion, som blev yderligere fabrikeret af ll under vejledning af J.M.J. Stabiliteten i nanoemulsion blev vurderet af J.M.J., ll og S.P. Animal care, kirurgi, adfærd, hale vene injektioner, og NIRF imaging blev udført i fællesskab af M.S. og A.M.S. under vejledning af J.A.P. Manuskriptet blev skrevet og udarbejdet af M.S., og protokollen blev skrevet af A.M.S.
NIR optiske billeddannelse blev udført på den lille dyr Imaging System på Duquesne Universitet (støttet af Pittsburgh Tissue Engineering initiativ frø Grant). J.M.J. anerkender støtte fra DOD award nummer FA8650-17-2-6836, NIDA award nummer 1R21DA039621-01, NIBIB award nummer R21EB023104-02 og AFMSA Award nummer FA8650-17-2-6836. J.A.P. og J.M.J anerkender støtte fra Pittsburgh Tissue Engineering initiativ frø Grant. J.A.P. anerkender også Hunkele frygtede sygdom Award, Samuel og Emma vintre Foundation, Charles Henry Leach II fond og Commonwealth Universal forskning Enhancement Award. J.A.P. og J.M.J. anerkender støtte fra Duquesne Universitet konstituerende Provst tværfaglig forskning konsortier Grant, som understøtter den kroniske smerter forskningskonsortium.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



