Summary
Här presenterar vi en metod för att validera svans ven injektioner hos råttor genom att utnyttja infrarött fluorescens imaging data från färgämnen införlivas med agenter eller biologiska sonder. Svansen är avbildade före och efter injektionen, fluorescerande signalen kvantifieras, och görs en bedömning av injektion kvalitet.
Abstract
Intravenös (IV) administrering av agenter i svansen ven av råttor kan vara både svårt och inkonsekvent. Optimera svans ven injektioner är en viktig del av många experimentella rutiner där reagenser måste införas direkt i blodomloppet. Injektionen kan omedvetet, subkutan, möjligen förändra de vetenskapliga resultat. Denna metod använder en nanoemulsion-baserade biologiska sond med en införlivad infrarött fluorescerande (NIRF) färgämne, och erbjuder förmåga imaging en framgångsrik svans ven injektion i vivo. Med användning av en NIRF imager, är bilder tagna före och efter injektion av agenten. En godtagbar IV injektion sedan bestäms kvalitativt eller kvantitativt sett baserat på intensiteten i NIRF signalen på injektionsstället.
Introduction
Administreringsvägen av agenter till små djur fungerar som en kritisk punkt för många experiment. Det bestämmer där agenten är att levereras och, därefter, vad kommer att hända med agenten därefter. Även om andra vägar kan användas för agent administration1, är intravenös administreringsväg leverans en Rekommenderad rutt för vissa agenter. IV injektion tillåter agenter att injiceras direkt in i blodomloppet, förbi första-passage vävnad effekter och behovet av ovidkommande koncentrationsgradient absorption1. Detta möjliggör också inriktning celler i blodomloppet2,3 och direktleverans till alla vävnader inom cirkulationssystemet. Hos gnagare, kan flera vener övervägas, inklusive jugular, den ytlig och svans venen.
Den här metoden färga en NIRF som innehåller en biologiskt sond — i detta fall, en nanoemulsion (figur 1A)3,4,5,6— injiceras i laterala svans ven hos råttor. Denna särskilda NIRF-innehållande nanoemulsion har använts tidigare bild och spåra neuroinflammation in vivo och ex vivo7,8 i en råtta modell9 av neuropatisk smärta2,3,4, 5,10,11. Imaging utförs före och efter injektion med en preklinisk NIR fluorescens imager (se Tabell för material). Detta fungerar som ett verktyg för att verifiera kvaliteten på agent administrationen. Imaging före svans ven injektion tjänar som grund för att erhålla en baseline-bild.
I djurstudier är alltmer intravenöst administrerade nanoemulsions utnyttjades som biologiska sonder och inriktning agenter12,13,14,15. Det är en beprövad utmaning att administrera en agent via svans ven16,17— vare sig det är en drog, en viral vektor eller en annan sond — och se till att hela innehållet i injektionen framgångsrikt har angett blodomloppet och inte den omgivande vävnader17. En metod för visualisering och utvärdera kvaliteten på en framgångsrik injektion är därför fördelaktigt.
Vanligtvis används en värmelampa eller varmt vatten att värma svansen, vilket orsakar dilatation av venen, som tillåter dess visualisering före injektion. Medan detta säkerställer lättare inträde i venen, finns det inte ett kvantitativa sätt att urskilja huruvida föreningen har angett blodomloppet i dess helhet18,19,20,21. Detta blir svårare fortfarande i stammar av djur där kontraster venen svagt med huden, såsom i svart möss. Vanligtvis kan utredaren gauge en misslyckad injektion genom att uppleva motstånd under injektionen och, i vissa fall kan visualisera en utbuktning på svansen, vilket indikerar en subkutan läckage av agent22,23.
I denna studie NIRF avbildning av den nanoemulsion injiceras i laterala svans ven av levande råttor utförs på en liten-djur NIRF imaging system (se Tabell för material). Råttor är matade en speciell renat kost (se Tabell för material) för att minska ospecifik gut fluorescens. Samtidiga bild förvärv av vitt ljus och 800 nm fluorescens fångas med hjälp av NIRF imager och tillhörande programvara. Relativa fluorescensintensiteten mäts på svansen på staterna i före injektion och efter injektion. Fluorescensintensiteten för regionen av intresse (ROI) på injektionsstället registreras och dividerat med området av ROI. Kvalitativa bedömningar kan göras som injektioner är acceptabla. Eventuellt kan ytterligare kvantitativ analys utföras genom att bestämma gränsvärden för acceptabelt injektioner och tilldela ROI mätningar i grupper, varvid statistisk signifikans kan beräknas.
Genom att utnyttja denna validering strategi efter svans ven injektioner, förbättrar standarden på en forskningsstudie på grund av ökad konsekvens i agent administration. Denna metod för att bedöma kvaliteten på svansen ven injektion kan enkelt anpassas för olika injicerbara agenter att inkludera infra-röd fluorescerande sonder som tillhandahålls kommersiellt av flera företag.
Protocol
Alla protokoll har utförts i enlighet med riktlinjerna i Guide för skötsel och användning av laboratoriedjur av National Institutes of Health och institutionella djur vård och användning kommittén (IACUC) på Duquesne universitetar.
1. beredning och anestesi
Obs: Aseptisk teknik används för hela förfarandet. Endast skall nya sterila material och autoklaveras sterila instrument användas. Personlig skyddsutrustning (sterila handskar, hår bonnet, kirurgisk mask, scrubs) behöver bäras för att undvika kontaminering.
- Vuxna manlig Sprague-Dawley-råttor som väger 250 – 300 g användes i detta protokoll. Vänja råttorna till standard livsvillkor, hålla dem på en 12 h ljus/12 h mörka cykel och ge mat och vatten ad lib. Hus djuret socialt, hålla dem på papper sängkläder och ger en speciell kost (se Tabell för material) för att undvika autofluorescens under imaging.
- Med användning av en korrekt placerade värmedyna, söva djuret under en inledande 5% isofluran i 20% syre, följt av en underhåll nivå av inte mindre än 1,5% isofluran och inte mer än 3%, om inte djuret vaknar upp eller behåller känslan.
- Bekräfta rätt anestesi via en brist på svar till svans nypor. Övervaka blodflödet samt via vitala tecken under hela förfarandet.
2. före injektion bild förvärv
- Bild djuret i en preklinisk NIR fluorescens imager genom att placera djuret sidled för att exponera injektionsstället på laterala svansen för att etablera en baslinje på fluorescens i svansen (figur 1C, E). Utföra en samtidig bild förvärvandet av både ett vitt ljus (kroppen view) och nära infraröda kanaler med NIRF imager och tillhörande programvara, med länkade uppslagstabeller (LUT).
- Efter imaging, flytta djuret tillbaka till tabellen kirurgiska och placera den under narkos för svans ven injektion.
Obs: Fortsätta att övervaka djurets vitala tecken och dubbelgranska korrekt anesthetization via svans nypa.
3. svansen ven injektion med NIRF-innehållande Agent
-
Med djuret i liggande position, orientera svansen med ryggsidan uppåt. Vidga svans kärlsystemet i varmt vatten i minst 1 min. Orient svansen ven så den laterala sidan (antingen höger eller vänster) är vände 30° (medurs eller moturs) för att exponera höger eller vänster svans ven (figur 1B).
- När en lateral svans ven har lokaliserats (som visas mörk vid dilatation), desinficera hela svansen med alkohol pads, upprepa 2 x.
- Vid en lämplig DOS baserat på studiedesign, börja injektioner i regionen distala svans Kotor av svansen och flytta mer proximalt om fast rätt nål placering misslyckas.
- Infoga en 25 – 27 G steril nål, avfasning, ven de laterala svans, med svansen i 180° vinkel, du för in nålen parallellt med Upplyft svans. Iaktta blod flashback i kanten av nålen att säkerställa korrekt placering. Om ingen flashback är uppenbart, långsamt flytta nålspetsen (utan att ta bort den från svansen) att hitta ven införande. Om placeras subkutant, sker ingen blod flashback.
- För in sprutan med injicerbara material i kanten av nålen. När lämplig placering uppnås, den injicerbara vätskan kommer inte att drabbas motstånd vid injektion. Injektionen kommer avancera smidigt och enkelt. När injiceras, ta bort nålen och sprutan, applicera tryck med steril gasbinda för minst 1 min att säkerställa koagulering och markera platsen för injektionen med en penna på svansen, att det syns på bildens vita ljus.
Obs: Ingen hematom eller lesionen syns på injektionsstället. - Om nålspetsen flyttar under spruta insättningspunkten, ta bort nålen och försök igen nål post förfarandet mer proximala på ipsilaterala svans venen. Återanvänd inte samma nålen om en olika reentry punkt är provat.
Obs: Alternativt kan injektionen kan utföras med en IV-kateter med blodflödet indikator (se Tabell för material). Detta har fördelen att visuell bekräftelse av katetern under venpunktion. Sätt in katetern, avfasning sida upp, på den vinkel som tidigare beskrivits. Observera snabb flashback i hela längden av indikatorn blodtillförsel för att säkerställa korrekt placering. Liten mottryck kan användas för att dra blod i sprutan att bekräfta lämplig placering i fartyget innan du injicerar. Igen, inget motstånd kommer att märkas.
4. efter injektionen bild förvärv
- Utföra kvalitetsbedömning efter svans ven injektion i en preklinisk NIR fluorescens imager i samma riktning som baslinje före injektion bilden. Se till att djuret är fortfarande ordentligt sövda — och kommer att vara så länge imaging — före att placera den i kameran.
Obs: En tänkbar system som innehåller en låda housingwith anestesi anslutningar och en mask för djuret bör användas om den är tillgänglig. - Orient djuret på dess laterala sidan att exponera injektionsstället (enligt märkning) på laterala svansen. Kontrollera om en NIRF signal är närvarande endast vid injektionsstället. Detta indikerar en framgångsrik svans ven injektion (figur 1D).
Obs: Om signalen är spridda över hela svansen, det anses vara subkutan och, därmed misslyckade (figur 1F). Figur 2 visar ytterligare exempel på misslyckade injektioner.
5. bilden kvantifiering
Obs: Bild kvantifiering kan utföras med den imaging programvara som medföljer NIR kameran, om funktionen är tillgänglig. Alternativt kan andra kommersiellt tillgängliga bild analys programvara vara begagnade24.
- I bilden efter injektion, rita en region-of-intresse runt området av fluorescens vid injektion webbplats2,6.
- Mät område och relativa fluorescensintensiteten och posten som område/intensitet. Jämföra efter injektion och baslinje före injektion bilder antingen kvalitativt eller kvantitativt med hjälp av lämplig statistisk analys (beroende på studiegrupper och villkor).
Obs: Forskaren kan besluta om tröskelvärden som diskriminerar bra från dåliga injektioner eller tilldela en procentandel av kvalitet till injektionen.
Representative Results
Råttor injicerades med NIRF innehållande nanoemulsion i laterala svans ven och före och efter injektion bilder är tagna med små djur kameran (Tabell för material) som beskrivs i protokollet. Efter injektion bilder kvalitativt bedöms för injektion kvalitet och placeras i 'bra injektion' (n = 7) och 'dålig injektion' (n = 4) grupper. Kvalitativ bedömning utfördes genom att observera efter injektion området fluorescensintensiteten. I en optimal injektion, är NIRF signalen begränsad till injektionsstället. Ingen signal kommer att ses om injektionen är framgångsrik eftersom agenten har fördrivits fullt ut i blodomloppet. En dålig kvalitet injektion visar en NIRF signal som är spridda längs längden på svansen.
Bilderna analyseras med den medföljande NIRF imager programvaran. Regioner-av-intressera drogs på platsen före injektion bilder (figur 1C, E) och runt området av fluorescens i efter injektion bilder (figur 1D, F). Bilder där fluorescens var synlig under hela längden på svansen var anses godtagbar och bort från analysen (figur 2). Mätningar av området och fluorescens intensiteten registrerades. Värden för området/fluorescensintensiteten beräknades och ritade (figur 1G). En signifikant skillnad (oparade t-test) i fluorescens intensitet mellan före och efter injektion bilder observerades i gruppen 'dålig injektion' (figur 1G) (p = 0,0024).
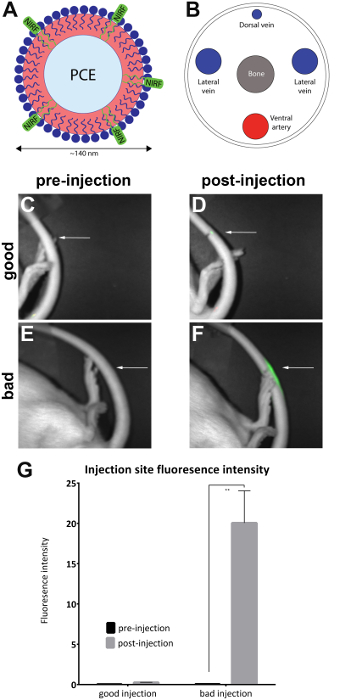
Figur 1 : NIRF baserat nanoemulsion och bilder av svans ven. (A), A nanoemulsion-baserade biologiska sond som innehåller NIRF dye var injiceras i (B), lateralen svans ven och avbildas i en NIRF imager. (C och D) pre- och postinjection bilder av en bra injektion. (E och F) pre- och postinjection bilder av en dålig injektion. Vita pilar visar poängen med injektion. Det är möjligt att kvalitativt bedöma framgången för en bra injektion jämfört med en dålig injektion genom att bedöma omfattningen av NIRF signalen på injektionsstället. Oacceptabla injektioner Visa fluorescens i hela längden på svansen och togs bort från analysen (figur 2). (G) bilderna kan även analyseras för att avslöja ett kvantitativt mått på fluorescensintensiteten, med tröskelvärden för injektion kvalitet tilldelas av prövaren. Felstaplar på grafen återspeglar SEM. För gruppen 'bra injektion', n = 7. För gruppen 'dålig injektion', n = 4. Det finns en statistiskt säkerställd skillnad i fluorescensintensiteten i gruppen 'dålig injektion' när man jämför pre- och postinjection bilder (oparade t-test; p = 0,0024). Klicka här för att se en större version av denna siffra.

Figur 2 : Exempel på dålig injektioner. (A) fluorescerande signalen sett delvis av svansen. (B) fluorescerande signalen sett över hela längden på svansen. (C) fluorescerande signal sprids kraftigt i området hela svansen och kaudalt av djurets kropp. Klicka här för att se en större version av denna siffra.
Discussion
Forskningslaboratorier ådrar sig betydande kostnader till följd av misskötsel av testning agenter. Svans ven injektioner är en svår teknik att bemästra att uppnå konsekvent framgång, med de mest erfarna av teknologer som ofta drabbas av förvaltningsinformation fel. Det finns inget tillförlitligt sätt att bekräfta en framgångsrik injektion. Detta protokoll erbjuder en lösning på detta problem genom att ge forskare en kvalitativ och kvantitativ metod för att validera framgången av en murin svans ven injektion. Här, en NIRF-märkt nanoemulsion7,8,25 innehåller agent för val (i detta fall en drog) och är avbildad på injektionsstället i en NIRF liten-djur imager. Det finns också möjlighet att utveckla en icke-nanoemulsion-baserade agent och använda samma princip om NIRF avbildning genom att införliva kommersiellt tillgängliga infraröd färgämnen. Dessutom ready-to-use imaging agenter med en mängd olika applikationer, såsom tumör imaging, metabola imaging, cell människohandel, och apoptos är också kommersiellt tillgängliga. En injektion utförs antingen med hjälp av en steril nål eller, alternativt, en IV-kateter; Detta beror på önskemål av forskaren. Dessutom automatiserade svans ven spridare26 har använts för att bistå i denna process och är kompatibla med denna metod. Denna teknik har dock inte ännu blivit kommersiellt tillgängliga.
Det finns viktiga steg i metoden svans ven injektion som säkerställer en högre frekvens av rätt agent administration. Svansen ska först rengöras med etanol att ta bort smuts eller skräp, så att forskare att bättre visualisera venen. Dilating venen genom att dränka svansen i varmt vatten är också ett mycket viktigt steg i metoden, eftersom det tillåter en större yta för injektion. Injicera en mer distala punkt på svansen venen tillåter några fel, i händelse av att flera försök krävs. Injektionen bör utföras på ett mer proximala position i svansen som svans venen ökar i storlek när den caudal aspekten av djurets kropp är närmade sig. Kontralaterala svans ven kan dessutom användas om nålen placering misslyckas i mer än tre till fem platser på ipsilaterala svans venen.
En framgångsrik förvaltning av en test-agent resulterar i lite att ingen NIRF signal vid tidpunkten för injektion. Om inget motstånd känns under administreringen av injektionen och det finns lite att ingen fluorescens på svansen, kan sedan injektionen registreras som lyckad. Om motstånd känns under injektionen och det finns ett spår av NIRF signal längs vissa längden på svansen, sedan injektionen bokförs som misslyckade och sannolikt delvis subkutan. Fluorescens är tagna före och efter injektion, och kvaliteten på injektionen bedöms av observation kvalitativt eller kvantitativt analysera fluorescens signalen på injektionsstället. Programmet som medföljer NIR fluorescens kameran är ofta kan utföra denna analys.
Metoden kan anpassas på flera sätt. Den är tillämplig till svans ven injektion hos både möss och råttor. De flesta små-djur NIR fluorescens imagers kommer att kunna ta emot murina gnagare. Nivåer av anestesi måste justeras beroende på vikten av djur, i enlighet med laboratoriets forskning IACUC protokoll. En annan möjlig ändring är utarbetandet av en icke-nanoemulsion-baserade sond antingen genom att införliva en infraröd färgämne i forskarens formulerade agent eller genom att köpa en ready-to-use avbildning agent, anpassade till ett visst biologiskt program.
Om en råtta är relativt stor, kan det ofta vara svårt att placera det i små-djur kameran. Det rekommenderas således att en testbild är tagen med djuret i lådan innan du injicerar, och ett synfält konstaterat där svansen är synlig. Det är bra att tejp svansen för att lådan av kameran, så att den inte rör sig under imaging.
Alternativa metoder syftar till att bedöma kvaliteten på svansen ven injektioner i små djur begränsas till användningen av märkning reagens som inte störa samtidiga experimentella rutiner och kräver avlivning av djur postinjection 12,13. Vissa reagenser kan påverka studieresultat och terapeutiska bedömningen av djur som är inblandade, så vård i experimentell design rekommenderas.
Denna metod kan i framtiden vara raffinerade med framsteg i små djur bildteknik, liksom förbättringar i infraröd fluorescerande sonder. Biologiska sonder med en inbyggd infraröd färgämne, avsedd för en mängd olika applikationer, kan användas i skede administration agent av en studiedesign för att validera kvaliteten på en injektion, som beskrivs i denna metod2,3 ,27,28,29,30,31,32.
Disclosures
Författarna har något att avslöja.
Acknowledgments
J.A.P. och J.M.J. utformade gemensamt den experimentella metoden för att utvärdera Nanoemulsions i kronisk förträngning skada råtta modellen för effekter på neuropatisk smärta. J.M.J. utformade och konstruerade den övergripande makrofag-targeted drug postförskott synsätt med nanoemulsions, nanoemulsion sammansättning och processer för tillverkning. J.M.J. produceras av nanoemulsion, som var ytterligare tillverkade av L.L. under ledning av J.M.J. Stabiliteten i nanoemulsion bedömdes genom J.M.J., L.L. och S.P. djur vård, kirurgi, beteende, svans ven injektioner och NIRF imaging genomfördes gemensamt av M.S. och A.M.S. under ledning av J.A.P. Manuskriptet skrevs och utarbetats av M.S. och protokollet skrevs av A.M.S.
NIR optisk imaging utfördes på små djur Imaging System på Duquesne universitetar (stöds av Pittsburgh Tissue Engineering initiativ utsäde bidraget). J.M.J. erkänner stöd från DOD award nummer FA8650-17-2-6836, NIDA award nummer 1R21DA039621-01, NIBIB award nummer R21EB023104-02 och AFMSA Award nummer FA8650-17-2-6836. J.A.P. och J.M.J erkänner stöd från Pittsburgh Tissue Engineering initiativ utsäde bidraget. J.A.P. erkänner också utmärkelsen Hunkele fruktade sjukdom, Samuel och Emma vintrar Foundation, Charles Henry Leach II fonden och the Commonwealth Universal forskning Enhancement Award. J.A.P. och J.M.J. erkänner stöd från Duquesne universitetar konstituerande Profossens tvärvetenskaplig forskning konsortier Grant, som stöder kronisk smärta forskningskonsortiet.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



