Summary
Burada kuyruk ven enjeksiyonları Sıçanlarda yakın kızılötesi floresan boyalar görüntüleme verileri ajanlar veya biyolojik probları dahil kullanarak doğrulamak için bir yöntem mevcut. Kuyruk daha önce görüntüsü ve enjeksiyon sonra floresan sinyali sayılabilir ve enjeksiyon kalite bir değerlendirmesini yaptı.
Abstract
İntravenöz (IV) yönetim aracılarının sıçan kuyruk ven içine zor ve tutarsız olabilir. Kuyruk ven enjeksiyonları optimize birçok deneysel yordamlar önemli bir parçası burası doğrudan kan dolaşımına sunulmasına olanak reaktifler ihtiyaç vardır. Farkında olmadan, enjeksiyon subkutan, muhtemelen bilimsel sonuçları değiştirme olabilir. Bir anonim yakın kızılötesi floresan (NIRF) boya ile nanoemulsion tabanlı biyolojik probe kullanmak, bu yöntem bir başarılı kuyruk ven enjeksiyon içinde vivo. görüntüleme yeteneği sunar NIRF Imager kullanımıyla, görüntüleri önce ve sonra aracı enjeksiyon alınır. Kabul edilebilir IV enjeksiyonu ardından niteliksel veya kantitatif enjeksiyon yerinde NIRF sinyalin yoğunluğunu göre belirlenir.
Introduction
Küçük hayvanların içine ajanların yönetim rotanın kritik bir noktaya birçok deney ve hizmet vermektedir. Nerede aracı teslim edilir ve daha sonra aracıya bundan sonra ne olacağını belirler. Diğer güzergah için aracı yönetim1kullanılabilse teslimat intravenöz yol bazı ajanlar için tercih edilen bir yoldur. IV enjeksiyon doğrudan kan dolaşımına, ilk geçiş doku efektleri ve yabancı çözünen absorption1 ihtiyacını atlayarak enjekte edilir ajanları sağlar. Bu da kan dolaşımına2,3 ve dolaşım sistemi içinde tüm dokulara doğrudan teslim hedefleme hücreler için sağlar. Kemirgen, birkaç damarlar, juguler, Safen ve kuyruk damar gibi düşünülebilir.
Bu yöntemde, bir NIRF boya biyolojik bir sonda içeren — bu durumda, bir nanoemulsion (şekil 1A)3,4,5,6— fareler yanal kuyruk damar içine enjekte edilir. Bu belirli NIRF içeren nanoemulsion görüntü ve neuroinflammation içinde vivo ve ex vivo7,8 nöropatik ağrı2,3,4bir fare modeli9 izlemek için daha önce kullanılmış, 5,10,11. Görüntüleme yürütülen önce ve sonra enjeksiyon ile preklinik NIR Floresans Imager ( Tablo malzemelerigörmek). Bu Ajan yönetim kalitesini doğrulamak için bir araç olarak hizmet vermektedir. Kuyruk ven enjeksiyon hizmet önce temel görüntü elde etmek için bir temel olarak görüntüleme.
Giderek hayvan çalışmalarında, intravenöz yönetilen nanoemulsions biyolojik probları ve hedefleme ajanlar12,13,14,15kullanılmaktadır. Bir ajan kuyruk damar16,17üzerinden yönetmek için kanıtlanmış bir mücadeledir — bir ilaç, bir viral vektör veya başka bir robot olması — ve enjeksiyon tüm içeriğini kan dolaşımına başarılı bir şekilde girdiniz emin olmak için değil çevreleyen dokular17. Bu nedenle, görselleştirme ve bir başarılı enjeksiyon kalitesini değerlendirmek için bir yöntem faydalıdır.
Genellikle, bir ısı lamba veya sıcak su enjeksiyon önce onun görselleştirme izin damar otu neden olan kuyruk ısıtmak için kullanılır. Bu ven içine daha kolay giriş sağlar iken, bileşik onun tamamını18,19,20,21' kan dolaşımına girmiş bulunmakta olup olmadığını ayırt etmek nicel bir yolu yoktur. Bu hayvanlar nerede ven hafifçe cilt ile gibi siyah fareler tezat suşları içinde hala daha zor olur. Tipik olarak, araştırmacı direnç enjeksiyon sırasında ve bazı durumlarda, Ajan22,23subkutan bir kaçağı gösteren kuyruk üzerinde bir çıkıntı görselleştirme yaşandığı tarafından başarısız bir enjeksiyon ölçebiliyor.
Bu çalışmada, canlı fareler yanal kuyruk damar içine enjekte nanoemulsion NIRF görüntüleme görüntüleme sistemi bir küçük-hayvan NIRF üzerinde gerçekleştirilir ( Tablo malzemelerigörmek). Fareler saf bir özel beslenen nonspesifik gut Floresans azaltmak için (bkz. Tablo reçetesi) diyet. Aynı anda resim alma beyaz ışık ve 800 nm floresan NIRF Imager ve ilişkili yazılım kullanarak yakalanır. Enjeksiyon öncesi ve sonrası enjeksiyon Devletlere kuyruk üzerinde göreli floresan yoğunluğu ölçülür. Floresan yoğunluğu faiz (ROI) enjeksiyon yerinde bölge için kaydedilir ve ROI alanına göre bölünmüş. Nitel değerlendirmeler üzerinde enjeksiyonları kabul edilebilir yapılabilir. İsteğe bağlı olarak, daha fazla nicel analiz için kabul edilebilir enjeksiyonları eşikler ayarlama ve ROI ölçümleri bu noktada istatistiksel anlamlılık hesaplanabilir gruplara atayarak gerçekleştirilir.
Kuyruk ven enjeksiyonları takip Bu doğrulama yöntemi kullanarak, bir araştırma standartları agent yönetimi nedeniyle artan tutarlılığını artırır. Kuyruk ven enjeksiyon kalitesini değerlendirirken bu yöntem farklı enjekte edilebilir ajanlar kızıl ötesi floresan problar ticari olarak çeşitli şirketler tarafından sağlanan dahil etmek için kolayca özelleştirebilirsiniz.
Protocol
Tüm iletişim kuralları Kılavuzu'ndaki yönergeleri uyarınca bakım ve kullanım laboratuvar hayvanları Ulusal Sağlık enstitüleri ve kurumsal hayvan bakım ve kullanım Komitesi (IACUC) Duquesne Üniversitesi'nde yapıldı.
1. hazırlık ve anestezi
Not: Aseptik teknikler yordamın tamamı için kullanılır. Sadece yeni steril malzeme ve autoclaved steril aletlerin kullanılmak üzere vardır. Kişisel koruyucu donanım (steril eldiven, saç kaporta, cerrahi maske, scrubs) kirlenmesini önlemek için giyilmelidir gerekiyor.
- Yetişkin erkek Sprague-Dawley Rat 250-300 g ağırlığındaki bu protokol için kullanılmıştır. Standart yaşam koşulları için fareler acclimate, onları bir 12 h ışık/12 s karanlık döngüsü tutmak ve yiyecek ve su ad libitum sağlamak. Özel bir sosyal hayvan ev, onları kağıt yatak üzerinde tutmak ve onlar autofluorescence görüntüleme sırasında önlemek için (bkz. Tablo reçetesi) diyet.
- Düzgün yerleştirilmiş Isıtma yastığını kullanımıyla, ilk %5 isoflurane % 20 oksijen, hayvan uyanır ya da duygu korur sürece % 1.5 isoflurane ve fazla % 3 daha az bakım düzeyini takip altında hayvan anestezi.
- Uygun anestezi ile Pinch kuyruk yanıt alınamaması onaylayın. Hayati boyunca yordamı ile de kan akışını izlemek.
2. ön enjeksiyon görüntü rütbe
- Preklinik NIR Floresans Imager hayvan hayvan yanal Floresans kuyruk (şekil 1C, E) bir temel kurmak için yanal kuyruk üzerinde enjeksiyon izi ortaya çıkarmak için konumlandırma tarafından görüntü. Her iki beyaz bir ışık (vücut görünümü) ve yakın kızılötesi kanallar NIRF Imager ve ilişkili yazılım, bağlantılı arama tabloları (LUT) kullanarak aynı anda resim alma gerçekleştirmek.
- Görüntüleme, hayvan hareket takip için cerrahi masa örtüsü ve kuyruk ven enjeksiyon için anestezi altında yerleştirin.
Not: Hayvanın yaşam belirtileri izleme devam edin ve uygun anesthetization kuyruk tutam üzerinden yeniden denetleyin.
3. kuyruk ven enjeksiyon NIRF içeren maddesi ile
-
Yüzükoyun hayvanla kuyruk dorsal yüzü yukarı bakacak şekilde yönlendirmek. 1 dk. kuyruk damar yan yana (sağ veya sol) 30 ° sağ veya sol kuyruk ven (şekil 1B) ortaya çıkarmak için (saat yönünde veya saat yönünün tersine) açtım ve Orient en az sıcak suda kuyruk damarlara genişletmek.
- Yanal kuyruk ven bulunduğu edildikten sonra (koyu renk görüntülendiği genişleme üzerine), 2 x yinelenen alkol yastıkları ile tüm kuyruk dezenfekte.
- Uygun iğne yerleştirme başarısız olursa çalışma tasarımı üzerinde temel alan bir uygun doz kuyruk ve daha proksimal taşıma distal Koksigeal vertebra bölgesi enjeksiyonları başlar.
- 25-27 G steril iğne eklemek, kuyruğunu kaldırdı kuyruğuna paralel iğne ekleme bir 180 ° açıyla yan kuyruk ven içine, eğim. Doğru yerleşim sağlamak için iğne kenarında kan flashback gözlemlemek. Hiçbir flashback görünen ise, yavaş yavaş iğne ucu (kuyruk çıkarmadan) hareket damar ekleme bulmak için. Subkutan yerleştirilen hiçbir kan flashback ortaya çıkar.
- Enjekte edilebilir malzemelerle şırınga iğne RIM yerleştirin. Ne zaman uygun yerleşim elde enjekte edilebilir sıvı enjeksiyon üzerine direnç uğramak değil. Enjeksiyon sorunsuz ve kolay bir şekilde ilerler. Bir zamanlar enjekte iğne ve şırınga çıkarın, pıhtılaşma emin olmak en az 1 dk. için steril gazlı bez ile basınç uygulayın ve enjeksiyon fincan beyaz ışık görüntü görünür olduğunu kontrol ettikten kuyruk üzerinde kalemle işaretlemek.
Not: Hiçbir hematom veya lezyon enjeksiyon yerinde görünür hale gelir. - İğne ucu şırınga ekleme sırasında hareket ederse, iğne kaldırın ve iğne giriş yordamı Ipsilateral kuyruk damar daha proksimal yeniden deneyin. Farklı giriş noktası denediyseniz aynı iğneyi tekrar kullanmayın.
Not: Alternatif olarak, enjeksiyon ile bir IV sonda kan akış göstergesi ile gerçekleştirilebilir (bkz. Tablo malzeme). Bu kateter görsel doğrulama sırasında iz yararı vardır. Kateter, eğim yan, daha önce açıklanan açıyla yerleştirin. Komut istemi flashback tüm uzunluğu boyunca doğru yerleşim sağlamak için kan akış göstergesi olarak görüyoruz. Hafif geri dönüş basıncı kan enjekte önce gemi uygun yerleştirme onaylamak için şırınga içine çekmek için kullanılabilir. Yine, hiçbir direniş hissedilecektir.
4. sonrası enjeksiyon resim alma
- Kuyruk ven yerleştirmeye preklinik NIR Floresans Imager temel ön enjeksiyon resmi olarak aynı yönde takip kalite değerlendirmesi gerçekleştir. Hayvan hala düzgün anestezi emin olun — ve böylece görüntüleme süresi için olacak — Imager yerleştirerek önce.
Not: Bir çekmece housingwith anestezi bağlantıları ve hayvan için bir maske içeren bir görüntüleme sistemi varsa kullanılmalıdır. - Hayvan gibi (işaretli) enjeksiyon sitesinde yanal kuyruk ortaya çıkarmak için kendi yan tarafında gelecek şekilde yönlendirin. Bir NIRF sinyal sadece enjeksiyon yerinde olup olmadığını görmek için kontrol edin. Bu başarılı kuyruk ven enjeksiyon (şekil 1D) gösterir.
Not: Sinyal tüm kuyruk devredilerek bu subkutan ve dolayısıyla başarısız olarak kabul edilir (şekil 1F). Şekil 2 başarısız enjeksiyonları ek örnekler gösterir.
5. resim miktar
Not: Bu işlev kullanılabilir durumdaysa görüntü miktar NIR Imager eşlik eden görüntüleme yazılımı ile gerçekleştirilebilir. Alternatif olarak, diğer ticari olarak mevcut görüntü analiz yazılımı-ebilmek var olmak kullanılmış24.
- Sonrası enjeksiyon görüntüsünün, bölge--ilgi çekici bir Enjeksiyon Makinası2,6, floresan çevresinde çizin.
- Alan ve göreli floresan yoğunluğu ve kayıt alan/yoğunluk ölçmek. Temel ve sonrası enjeksiyon öncesi enjeksiyon görüntüleri de niteliksel karşılaştırmak veya uygun istatistiksel analiz (çalışma grupları ve koşullar bağımlı) kullanarak quantitively.
Not: Araştırmacı iyi kötü enjeksiyonları ayırımcılık veya kalite yüzdesi için enjeksiyon atamak eşiklerine karar verebilirsiniz.
Representative Results
Fareler NIRF içeren nanoemulsion ile yanal kuyruk damar içine enjekte edildi ve öncesi ve sonrası enjeksiyon görüntüleri iletişim kuralında tanımlandığı gibi küçük hayvan Imager (Malzemeler tablo) ile alındı. Sonrası enjeksiyon görüntüleri niteliksel enjeksiyon kalitesi için değerlendirildi ve 'içine iyi enjeksiyon' yerleştirilir (n = 7) ve 'kötü enjeksiyon' (n = 4) gruplar. Nitel değerlendirme sonrası enjeksiyon alanı floresan yoğunluğu gözlemci tarafından gerçekleştirilmiştir. En uygun iğne NIRF sinyal enjeksiyon siteye sınırlı olduğunu. Enjeksiyon aracı tamamen kana yerlerinden olmuştur çünkü başarılı olursa sinyal yok görülecektir. Kötü kaliteli enjeksiyon kuyruk uzunluğu boyunca dağınık bir NIRF sinyal görüntüler.
Görüntüleri eşlik eden NIRF Imager yazılım ile analiz edildi. Faiz bölgeleri sitesinde ön enjeksiyon görüntülerin (şekil 1C, E) ve sonrası enjeksiyon görüntüler (şekil 1D, F) floresan çevresinde çizildi. Nerede Floresans kuyruk uzunluğu görünür görüntüleri kabul edilemez kabul ve analizi (Şekil 2) çıkarıldı. Alan ve floresan yoğunluk ölçümleri kaydedildi. Alan/floresan yoğunluğu değerleri hesaplanır ve (şekil 1G) çizilen. Önemli bir fark (unpaired t-test) içinde floresan yoğunluğu öncesi ve sonrası enjeksiyon görüntüler arasında 'kötü enjeksiyon' grubu (şekil 1G) gözlenmiştir (p = 0.0024).
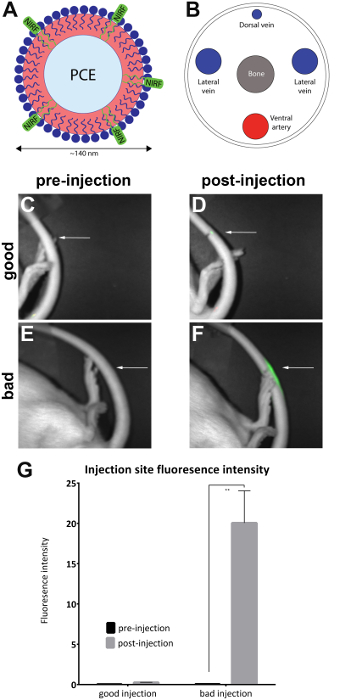
Resim 1 : NIRF dayalı nanoemulsion ve kuyruk ven görüntülerini. NIRF boya içeren (A) A nanoemulsion tabanlı biyolojik sonda (B) lateral kuyruk damar içine enjekte ve bir NIRF Imager görüntüsü. (C ve D) öncesi ve postinjection görüntüleri iyi bir enjeksiyon. (E ve F) öncesi ve postinjection imge kötü bir enjeksiyon. Beyaz okları enjeksiyon turistik gösterir. Niteliksel enjeksiyon yerinde NIRF sinyal ölçüde değerlendirmek için kötü bir enjeksiyon karşılaştırıldığında iyi bir enjeksiyon başarısını değerlendirmek mümkündür. Kabul edilemez enjeksiyonları Floresans kuyruk uzunluğu boyunca görüntülemek ve analizi (Şekil 2) çıkarıldı. (G) görüntüleri da floresan yoğunluğu, araştırmacı tarafından atanan enjeksiyon kalite için eşikler ile kantitatif bir ölçüsü ortaya çıkarmak için analiz edilebilir. Hata çubukları grafikte SEM yansıtacak 'İyi enjeksiyon' grup, n = 7. İçin 'kötü enjeksiyon' grup, n = 4. Öncesi ve postinjection görüntüleri karşılaştırarak floresan yoğunluğu 'kötü enjeksiyon' grubunda istatistiksel bir fark yoktur (unpaired t-test; p 0.0024 =). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2 : Kötü enjeksiyonları örnekleri. (A)floresan sinyal kısmen kuyruğunu gördüm. (B) floresan sinyal kuyruk tam uzunlukta üzerinde gördüm. (C) floresan sinyal ağır tüm kuyruk ve Kaudal hayvanın vücut bölgesinin içinde dağınık. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Discussion
Araştırma laboratuvarları test aracıları misadministration sonucunda önemli masraf. Kuyruk ven enjeksiyonları yöneticisine tutarlı başarı oranı, en deneyimli teknoloji kez misadministration hataları üstlenmeden ile ulaşmak için zor bir teknik vardır. Başarılı bir enjeksiyon onaylamak için güvenilir yolu yoktur. Bu iletişim kuralı bir fare kuyruğu ven enjeksiyon başarısı doğrulamak için bir nitel ve nicel yöntemi araştırmacılar vererek bu soruna bir çözüm sunmaktadır. Burada, NIRF etiketli nanoemulsion7,8,25 seçiminde (Bu durumda, bir ilaç) Aracısı içerir ve bir NIRF küçük-hayvan Imager enjeksiyon yerinde görüntüsü. Bir sigara nanoemulsion-tabanlı aracı geliştirmek ve piyasada bulunan kızıl ötesi boya dahil ederek NIRF görüntüleme aynı prensibi kullanın seçeneği vardır. Ayrıca, kullanıma hazır uygulamaları tümörü Imaging, metabolik gibi çeşitli görüntüleme ajanlarla görüntüleme, kaçakçılığı hücre ve Apoptozis da ticari olarak kullanılabilir. İğne steril bir iğne veya alternatif olarak, bir IV kateter kullanarak gerçekleştirilir; Bu araştırmacı tercihine bağlıdır. Buna ek olarak, otomatik kuyruk ven enjektörleri26 bu işleminde yardımcı olması için kullanılan ve bu metodoloji ile uyumludur. Ancak, bu teknoloji henüz piyasada bulunan olamamıştır.
Doğru aracı yönetim daha yüksek oranda sağlamak önemli adım kuyruk ven enjeksiyon yöntemi vardır. İlk olarak, kuyruk birisi kir ya da enkaz, araştırmacılar daha iyi damar görmek izin kaldırmak için etanol ile temizlenmelidir. Bu büyük yüzey alanı enjeksiyon için sıcak suda kuyruk batış tarafından damar genişletici Ayrıca yöntemde, çok önemli bir adım önemlidir. Birden çok deneme gereklidir olay bu kuyruk damar daha distal bir noktada enjekte bazı hata verir. Enjeksiyon hayvanın vücut Kaudal yönünü yaklaşırken kuyruk ven boyutu arttıkça bir daha proksimal konumda kuyruk denenmesi gerektiğini. Ayrıca, birden fazla üç-beş sitelerinde Ipsilateral kuyruk damar üzerinde iğne yerleştirme başarısız olursa kontralateral kuyruk ven kullanılabilir.
Bir test aracısı sonuçlarında az NIRF sinyal enjeksiyon noktasında başarılı bir yönetim. O zaman hiçbir direniş enjeksiyon yönetimi sırasında hissedilir ve hiçbir Floresans kuyruk, küçük ise, enjeksiyon başarılı olarak kaydedilebilir. Direnç enjeksiyon sırasında hissedilir ve kuyruk, bazı uzunluğu boyunca bir iz NIRF sinyal enjeksiyon başarısız olarak kaydedilir ve büyük olasılıkla daha sonra kısmen subkutan varsa. Floresans fotoğraf öncesi ve sonrası enjeksiyon alınır ve enjeksiyon kalitesini niteliksel gözlemleyerek veya kantitatif floresan sinyal enjeksiyon yerinde analiz tarafından değerlendirildi. NIR Floresans Imager eşlik eden yazılım kez bu çözümlemesi gerçekleştirme yeteneğine sahiptir.
Yöntem çeşitli şekillerde adapte edilebilir. Fare ve sıçanlar ven yerleştirmeye kuyruk için geçerlidir. En küçük hayvan NIR Floresans görüntüleme cihazları fare kemirgenler accomodating yeteneğine sahip olacak. Anestezi düzeyde araştırma laboratuvarı IACUC protokolü uyarınca hayvan ağırlığını bağlı olarak ayarlanması gerekir. Başka bir olası değişiklik nanoemulsion tabanlı olmayan bir sonda hazırlanması bir kızılötesi boya araştırmacı formüle Ajan birleşmeyle veya belirli bir biyolojik uygulama için özel olarak tasarlanmış bir kullanıma hazır görüntüleme aracı satın alma olduğunu.
Bir sıçan nispeten büyük ise, sık sık küçük hayvan Imager konumlandırmak zor olabilir. Böylece sınama yansıması enjekte önce çekmecede hayvanıyla alınır ve kuyruk görünür nerede görüş alanı tespit önerilir. Emin olmak için Görüntüleyici, çekmece kuyruk görüntüleme sırasında taşınmaz banda yardımcı olur.
Alternatif yöntemler enjeksiyonları küçük hayvanlarda değil aynı zamanda oluşan deneysel prosedürler ile müdahale ve hayvanlar postinjection ötenazi gerektiren reaktifler etiketleme kullanımı için sınırlıdır kuyruk ven kalitesini değerlendirmek isteyen 12,13. Bu yüzden bakım deneysel tasarım tavsiye bazı reaktifler çalışma sonuçları ve terapötik değerlendirmesi dahil, hayvanların etkileri olur.
Bu yöntem gelecekte, kızılötesi floresan problar gelişmeler yanı sıra küçük hayvan görüntüleme teknolojisi gelişmeler ile rafine olabilir. Çeşitli farklı uygulamalar için tasarlanmış bir anonim kızılötesi boya ile biyolojik probları bir çalışma tasarım aracı yönetim aşamada bir enjeksiyon kalitesini doğrulamak için bu yöntem2',3 konusunda kısaca açıklandığı gibi kullanılabilir ,27,28,29,30,31,32.
Disclosures
Yazarlar ifşa gerek yok.
Acknowledgments
J.A.P. ve J.M.J. ortaklaşa etkileri nöropatik ağrı kronik daralma yaralanma sıçan modelinde Nanoemulsions değerlendirmek için deneysel bir yaklaşım tasarlanmış. J.M.J. gebe ve nanoemulsions, nanoemulsion kompozisyon ve imalat işlemleri genel olarak makrofaj hedefli ilaç teslim yaklaşımla tasarlanmış. J.M.J. daha fazla L.L. tarafından J.M.J. rehberliğinde fabrikasyon nanoemulsion, üretilen Nanoemulsion kararlılığını değerlendirildi J.M.J., L.L. ve S.P. hayvan bakımı, cerrahi, davranış, kuyruk ven enjeksiyonları ve NIRF görüntüleme yürütülen ortak yüksek lisans ve H.K.S. tarafından J.A.P. rehberliğinde El yazması yazılı ve M.S. tarafından hazırlanan ve protokol H.K.S. tarafından yazılmıştır.
NIR optik görüntüleme küçük hayvan görüntüleme sistemi (Pittsburgh doku Mühendisliği girişimi tohum Grant tarafından desteklenen) Duquesne Üniversitesi'nde gerçekleştirildi. J.M.J. destek DOD Ödülü numarası FA8650-17-2-6836, NIDA Ödülü sayı 1R21DA039621-01, NIBIB Ödülü numarası R21EB023104-02 ve AFMSA Ödülü sayı FA8650-17-2-6836 kabul eder. J.A.P. ve J.M.J Pittsburgh doku Mühendisliği girişimi tohum hibe desteğinden kabul edersiniz. J.A.P. da Hunkele korkunç hastalığı Ödülü, Samuel ve Emma Winters Vakfı, Charles Henry Leach II Fonu ve Commonwealth evrensel araştırma geliştirme ödülü kabul eder. J.A.P. ve J.M.J. destek Duquesne Üniversitesi açılış Provost'ın disiplinler arası araştırma konsorsiyumlar kronik ağrı araştırma Konsorsiyumu destekleyen Grant, kabul ediyorum.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



