Summary
Hier presenteren we een methode voor het valideren van staart ader injecties in ratten met behulp van nabij-infrarood fluorescentie imaging gegevens uit kleurstoffen in agenten of biologische sondes opgenomen. De staart is beeld vóór en na de injectie, het fluorescent signaal wordt gekwantificeerd en een beoordeling van de kwaliteit van de injectie wordt gemaakt.
Abstract
Intraveneuze (IV) beheer van agenten in de ader van de staart van ratten kunnen zowel moeilijk als inconsistent zijn. Het optimaliseren van de staart ader injecties is een essentieel onderdeel van vele experimentele procedures waar reagentia moeten rechtstreeks in de bloedbaan worden ingevoerd. Onbewust, kunnen de injectie subcutane, eventueel wijzigen de wetenschappelijke resultaten. Gebruik makend van een nanoemulsion gebaseerde biologische sonde met een opgenomen nabij-infrarood fluorescente (NIRF) kleurstof, biedt deze methode de mogelijkheid om imaging een succesvolle staart veneuze injectie in vivo. Met het gebruik van een NIRF imager, zijn beelden genomen vóór en na de injectie van de agent. Een aanvaardbaar IV injectie wordt dan kwalitatief of kwantitatief opzicht bepaald op basis van de intensiteit van het signaal van de NIRF op de plaats van injectie.
Introduction
De wijze van toediening van agenten in kleine dieren dient als een kritiek punt van vele experimenten. Het bepaalt waar de agent is te leveren en, vervolgens, wat zal er gebeuren met de agent daarna. Hoewel andere routes kunnen worden gebruikt voor agent administratie1, is de intraveneuze route van levering een aangewezen route voor bepaalde agentia. IV injectie kunt agenten om rechtstreeks in de bloedbaan, het omzeilen van weefsel van de first-pass effect en de noodzaak van vreemde opgeloste absorption1 worden ingespoten. Dit zorgt ook voor targeting cellen in de bloedbaan2,3 en directe levering aan alle weefsels binnen de bloedsomloop. Bij knaagdieren, kunnen verschillende aders worden beschouwd, met inbegrip van de hals, de saphenous en de staart ader.
Bij deze methode wordt een NIRF kleurstof bevattende een biologische sonde — in dit geval, een nanoemulsion (figuur 1A)3,4,5,6— wordt geïnjecteerd in de ader van de laterale staart van ratten. Deze bijzondere NIRF-bevattende nanoemulsion nog eerder is gebruikt voor het beeld en het bijhouden van neuroinflammation in vivo en ex vivo7,8 in een rat model9 van neuropatische pijn2,3,4, 5,10,11. Beeldvorming is uitgevoerd vóór en na de injectie met een preklinische NIR fluorescentie imager (Zie Tabel van materialen). Dit dient als een instrument voor het valideren van de kwaliteit van het bestuur van de agent. Imaging voorafgaand aan de staart veneuze injectie dient als basis voor het verkrijgen van een beeld van de basislijn.
In dierstudies, worden intraveneus toegediend nanoemulsions steeds wordt gebruikt als biologische sondes en targeting agenten12,13,14,15. Het is een bewezen uitdaging voor het beheren van een agent via de staart ader16,17— zij het een drug, een virale vector of een ander sonde — en om ervoor te zorgen dat de gehele inhoud van de injectie de bloedbaan hebben ingevoerd en niet de omliggende weefsels17. Daarom is een methode van visualiseren en evalueren van de kwaliteit van een succesvolle injectie gunstig.
Meestal wordt een warmte lamp of warm water gebruikt voor het opwarmen van de staart, waardoor verwijding van de ader, waardoor de visualisatie vóór injectie. Terwijl hierdoor instap te vergemakkelijken in de ader, is er niet een kwantitatieve manier te onderscheiden of de compound de bloedbaan heeft ingevoerd in haar geheel18,19,20,21. Dit wordt nog moeilijker in stammen van dieren waar de ader flauw met de huid, zoals in zwarte muizen contrasteert. Meestal kan de onderzoeker een mislukte injectie meten door ervaren weerstand tijdens de injectie en, in sommige gevallen, een uitstulping op de staart, met vermelding van een subcutane lekkage van de agent22,23te visualiseren.
In deze studie NIRF beeldvorming van de nanoemulsion geïnjecteerd in de ader van de laterale staart van levende ratten wordt uitgevoerd op een NIRF van de kleine dieren imaging systeem (Zie Tabel van materialen). Ratten zijn gevoed een speciale gezuiverd dieet (Zie Tabel van materialen) ter vermindering van de niet-specifieke gut fluorescentie. Gelijktijdige Beeldacquisitie van wit licht en 800 nm fluorescentie is gevangen met behulp van de NIRF imager en bijbehorende software. De relatieve fluorescentie-intensiteit wordt gemeten op de staart bij de pre injectie en na injectie Staten. De intensiteit van de fluorescentie voor de regio van belang (ROI) op de plaats van injectie is opgenomen en gedeeld door het gebied van de ROI. Kwalitatieve evaluaties kunnen worden gemaakt die injecties aanvaardbaar zijn. Eventueel kan verdere kwantitatieve analyse worden uitgevoerd door de instelling van drempels voor aanvaardbaar injecties en het toewijzen van ROI metingen in groepen, op welk punt de statistische significantie kan worden berekend.
Door gebruik te maken van deze strategie van de validatie na staart ader injecties, verbetert de kwaliteit van een onderzoek als gevolg van verhoogde consistentie van agent administratie. Deze methode voor de beoordeling van de kwaliteit van de staart veneuze injectie kan gemakkelijk worden aangepast voor verschillende injecteerbare agenten op te nemen van de infra-rood fluorescerende sondes commercieel geboden door verschillende bedrijven.
Protocol
Alle protocollen werden uitgevoerd overeenkomstig de richtsnoeren in de gids voor de zorg en het gebruik van proefdieren van het National Institutes of Health en institutionele Animal Care en gebruik Comité (IACUC) aan de Duquesne University.
1. voorbereiding en anesthesie
Opmerking: Aseptische technieken worden gebruikt voor het geheel van de procedure. Alleen moeten nieuwe steriele materialen en gesteriliseerde met autoclaaf steriele instrumenten worden gebruikt. Persoonlijke beschermingsmiddelen (steriele handschoenen, haar motorkap, chirurgische masker, scrubs) moet gedragen worden om besmetting te voorkomen.
- Volwassen mannelijke Sprague-Dawley ratten met een gewicht van 250-300 g werden gebruikt in dit protocol. Acclimatiseren van de ratten aan standaard levensomstandigheden, houd ze op een 12 h licht/12 h donker cyclus, en verstrekken van voedsel en water ad libitum. Sociaal huis van het dier, houd ze op papier beddengoed en voorzien van een speciaal dieet (Zie Tabel van materialen) om te voorkomen dat autofluorescence tijdens de beeldvorming.
- Anesthetize met het gebruik van een goed geplaatste verwarming pad, het dier onder een eerste 5% Isofluraan in 20% zuurstof, gevolgd door een niveau van het onderhoud van niet minder dan 1,5% Isofluraan en niet meer dan 3%, tenzij het dier wakker of gevoel behoudt.
- Bevestigen goede verdoving via een gebrek aan respons tot staart snuifjes. Toezicht op de bloedstroom evenals via vital signs gedurende de hele procedure.
2. pre-injectie Image Aquisition
- Het imago van het dier in een preklinische NIR fluorescentie imager door plaatsing van het dier lateraal om de injectieplaats op de laterale staart om een basislijn van fluorescentie in de staart (Figuur 1C, E) bloot te stellen. Het uitvoeren van een gelijktijdige Beeldacquisitie van beide een wit licht (lichaam weergave) en in de buurt van infrarood kanalen met behulp van de NIRF imager en de bijbehorende software, met gekoppelde opzoektabellen (LUT).
- Na imaging, verplaatsen van het dier terug naar de chirurgische tabel en plaats deze onder verdoving voor de staart veneuze injectie.
Opmerking: Blijven volgen van het dier vital signs en gecontroleerd of er goede afstomping via staart snuifje.
3. staart veneuze injectie met NIRF-bevattende Agent
-
Oriënteren met het dier in de vatbaar positie, de staart met de dorsale zijde naar boven. Verwijden de staart therapieën in warm water gedurende ten minste 1 min. Orient de staart ader zodat de laterale zijde (rechts of links) is 30° gedraaid (met de klok mee of tegen de klok in) om de linker- of staart ader (Figuur 1B) bloot te stellen.
- Zodra een laterale staart ader gelegen is (die verschijnt donker gekleurde bij dilatatie), ontsmet de gehele staart met alcohol pads, 2 x te herhalen.
- Bij een passende dosering op basis van het ontwerp van de studie, door injecties in de regio van de distale coccygeal wervels van de staart en bewegen meer proximale te beginnen als goede naald plaatsing mislukt.
- Invoegen van een 25-27 G steriele naald, schuine rand, in de ader van de laterale staart, met de staart in een hoek van 180°, invoegen van de naald evenwijdig aan de opgeheven staart. Observeren bloed flashback in de rand van de naald om de juiste plaatsing. Als geen flashback herkenbaar is, langzaam de naald tip (zonder deze te verwijderen uit de staart) te vinden van ader inbrengen. Als subcutaan geplaatst, treedt er geen bloed flashback.
- Plaats de injectiespuit met de injecteerbare materialen in de rand van de naald. Wanneer de juiste plaatsing wordt bereikt, zal de injecteerbare vloeistof weerstand na injectie niet oplopen. De injectie zal vooraf soepel en gemakkelijk. Zodra geïnjecteerd, verwijder de naald en de spuit, toepassen van druk met een steriel gaas voor ten minste 1 min. om stolling en markeren de plek van de injectie met een pen op de staart, ervoor te zorgen het zichtbaar op de witte lichte afbeelding.
Opmerking: Geen hematoom en laesie zal worden zichtbaar op de site van injectie. - Als de naald tip tijdens het inbrengen van de spuit beweegt, de naald te verwijderen en probeer opnieuw de naald vermelding procedure meer proximale op de ader ipsilaterale staart. Opnieuw de dezelfde naald niet gebruiken als een punt verschillende reentry is geprobeerd.
Opmerking: Als alternatief, de injectie kan worden uitgevoerd met een IV-katheter met een bloed-flow indicator (Zie Tabel van materialen). Dit heeft het voordeel van visuele-bevestiging van de katheter tijdens Venapunctie. Leg de katheter, schuine kant naar boven, op de hoek die hierboven worden beschreven. Observeren snelle flashback in de gehele lengte van de bloedstroom indicator om de juiste plaatsing. Lichte tegendruk kan worden gebruikt voor het trekken van bloed in de spuit te bevestigen van juiste plaatsing in het schip vóór het injecteren van. Nogmaals, zullen geen weerstand gevoeld worden.
4. na injectie Beeldacquisitie
- Uitvoeren van kwaliteitsbeoordeling staart veneuze injectie in een preklinische NIR fluorescentie imager in dezelfde richting als de basislijn pre injectie afbeelding na. Zorgen dat het dier is nog steeds goed verdoofd — en zal blijven voor de duur van imaging — vóór het plaatsen van het in de imager.
Opmerking: Een imaging systeem met een lade housingwith anesthesie verbindingen en een masker voor het dier moet worden gebruikt, indien beschikbaar. - Het dier aan de laterale kant bloot van de injectieplaats (zoals vermeld) op de laterale staart te oriënteren. Controleer om te zien als een NIRF-signaal aanwezig alleen op de plaats van injectie is. Dit wijst op een succesvolle staart veneuze injectie (Figuur 1D).
Opmerking: Als het signaal is verspreid over de hele staart, het is beschouwd als subcutane en, vandaar mislukte (Figuur 1F). Figuur 2 ziet u extra voorbeelden van mislukte injecties.
5. image kwantificering
Opmerking: Kwantificering van de afbeelding kan worden uitgevoerd met de imaging software die bij de NIR imager, als deze functie beschikbaar is. Anderzijds kunnen andere commercieel beschikbare beeld analysesoftware gebruikte24.
- In de afbeelding na injectie, tekent u een regio-of-interest rond het gebied van de fluorescentie bij de injectie site2,6.
- Het meten van het gebied en de relatieve fluorescentie intensiteit en de record als gebied/intensiteit. Vergelijk na injectie- en basislijnraster vóór injectie beelden hetzij kwalitatief of quantitively met behulp van passende statistische analyse (afhankelijk van de studiegroepen en voorwaarden).
Opmerking: De onderzoeker kan beslissen over drempels die discrimineren goede van slechte injecties of een percentage van kwaliteit aan de injectie toewijzen.
Representative Results
Ratten werden ingespoten met NIRF-bevattende nanoemulsion in de ader van de laterale staart en pre-en post injectie beelden werden genomen met de kleine-dier imager (Tabel of Materials) zoals beschreven in het protocol. Na injectie beelden zijn kwalitatief voor injectie kwaliteit beoordeeld en geplaatst in de 'goede injectie' (n = 7) en 'slecht injectie' (n = 4) groepen. Kwalitatieve beoordeling werd uitgevoerd door het observeren van de intensiteit van de fluorescentie na injectie gebied. In een optimale injectie, is het NIRF signaal beperkt tot de plaats van injectie. Geen signaal zal worden gezien als de injectie succesvol, is omdat de agent volledig heeft verdreven in de bloedbaan. De injectie van een slechte kwaliteit geeft een NIRF-signaal dat is verspreid over de lengte van de staart.
Beelden werden geanalyseerd met de meegeleverde NIRF imager-software. Regio's-of-interest werden getrokken op de site van pre injectie beelden (Figuur 1C, E) en rond het gebied van fluorescentie in na injectie beelden (Figuur 1D, F). Beelden waar fluorescentie zichtbaar in de lengte van de staart was waren onaanvaardbaar geacht en verwijderd uit de analyse (Figuur 2). Metingen van de ruimte en fluorescentie-intensiteit werden geregistreerd. Waarden voor gebied/fluorescentie intensiteit werden berekend en uitgezet (Figuur 1G). Een significant verschil (ongepaarde t-test) in fluorescentie intensiteit tussen pre-en post injectie beelden werd waargenomen in de groep van de 'slechte injectie' (Figuur 1G) (p = 0,0024).
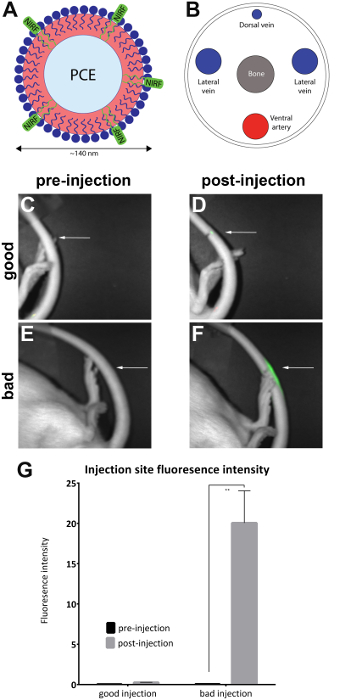
Figuur 1 : NIRF op basis nanoemulsion en beelden van staart ader. (A) A nanoemulsion gebaseerde biologische sonde met NIRF kleurstof was in (B) de laterale staart ader ingespoten en beeld in een NIRF imager. (C en D) pre- en postinjection beelden van een goede injectie. (E en F) pre- en postinjection beelden van een slechte injectie. Witte pijlen geven aan het punt van de injectie. Het is mogelijk om kwalitatief beoordelen het succes van een goede injectie in vergelijking met een slechte injectie door de beoordeling van de omvang van het signaal van de NIRF op de plaats van injectie. Onaanvaardbaar injecties weergeven fluorescentie door de lengte van de staart en werden verwijderd uit de analyse (Figuur 2). (G) de beelden kunnen ook worden geanalyseerd om te onthullen van een kwantitatieve maat voor de intensiteit van de fluorescentie, met drempels voor injectie kwaliteit toegewezen door de onderzoeker. De foutbalken in de grafiek weerspiegelen de SEM. Voor de 'goede injectie' groep, n = 7. Voor de 'slechte injectie' groep, n = 4. Er is een statistisch verschil in intensiteit van de fluorescentie in de groep 'slechte injectie' bij het vergelijken van pre- en postinjection beelden (ongepaarde t-test; p = 0,0024). Klik hier voor een grotere versie van dit cijfer.

Figuur 2 : Voorbeelden van slechte injecties. (A) Fluorescent signaal gezien in een deel van de staart. (B) Fluorescent signaal gezien over de volledige lengte van de staart. (C) Fluorescent signaal verspreid zwaar in de gehele staart en caudal gebied van lichaam van het dier. Klik hier voor een grotere versie van dit cijfer.
Discussion
Onderzoekslaboratoria zijn er aanzienlijke kosten als gevolg van het wanbeheer van testen agenten. Staart ader injecties zijn een moeilijke techniek om meester te bereiken consistente succestarief, met de meest ervaren van technologen vaak transmigratiebeleid fouten ontstaan. Er is geen betrouwbare manier om te bevestigen van een succesvolle injectie. Dit protocol biedt een oplossing voor dit probleem door onderzoekers een kwalitatieve en kwantitatieve methode voor het valideren van het succes van een lymfkliertest staart veneuze injectie te geven. Hier, een nanoemulsion NIRF gemerkt7,8,25 bevat de agent van keuze (in dit geval een drug) en op de plaats van injectie in een NIRF kleine-dier imager is beeld. Er is ook de optie voor het ontwikkelen van een niet-nanoemulsion-gebaseerde agent en hetzelfde principe voor NIRF imaging gebruiken door de integratie van verkrijgbare infra-rode kleurstoffen. Bovendien kant-en-klare imaging agenten met een verscheidenheid van toepassingen, zoals een tumor imaging, metabole beeldvorming, cel mensenhandel en apoptosis ook commercieel beschikbaar zijn. Een injectie wordt uitgevoerd ofwel met behulp van een steriele naald of, subsidiair, een IV-katheter; Dit hangt af van de voorkeur van de onderzoeker. Bovendien, geautomatiseerde staart ader injectoren26 zijn gebruikt om te helpen bij dit proces en compatibel zijn met deze methodiek. Echter, deze technologie is nog niet geworden commercieel beschikbaar.
Er zijn belangrijke stappen in de staart veneuze injectie methode die zorgen voor een hoger tarief van toediening van de juiste agent. Ten eerste, de staart moet worden gereinigd met ethanol te verwijderen elke modder of gruis bevatten, waardoor onderzoekers de ader beter te visualiseren. Leerstoornissen de ader door dompelen de staart in warm water is ook een zeer belangrijke stap in de methode, omdat het een grotere oppervlakte voor injectie zorgt. Injecteren op een meer distale punt op de staart ader zorgt voor enige fout, in het geval dat meerdere pogingen nodig zijn. Injectie moet worden geprobeerd op een meer proximale positie in de staart als de staart ader groter wordt als het caudal aspect van het lichaam van het dier wordt benaderd. Daarnaast kan de contralaterale staart ader worden gebruikt als naald plaatsing in meer dan drie tot vijf sites op de ader ipsilaterale staart mislukt.
Een succesvolle beheer van een agent testresultaten in weinig tot geen NIRF-signaal op de plaats van injectie. Als geen verzet wordt gevoeld tijdens het beheer van de injectie, maar er is weinig tot geen fluorescentie bij de staart, kan vervolgens de injectie worden opgenomen als succesvol. Als weerstand tijdens de injectie wordt gevoeld, maar er is een parcours van NIRF signaal langs enkele lengte van de staart, dan de injectie wordt geregistreerd als mislukt en waarschijnlijk is deels onderhuids. Fluorescentie afbeeldingen zijn genomen vóór en na injectie, en de kwaliteit van de injectie is beoordeeld door observeren kwalitatief of kwantitatief te analyseren van het signaal van de fluorescentie op de plaats van injectie. De software bij de NIR fluorescentie imager is vaak geschikt voor het uitvoeren van deze analyses.
De methode kan op verschillende manieren worden aangepast. Het is van toepassing op de staart van veneuze injectie in zowel muizen en ratten. De meeste kleine-dier NIR fluorescentie imagers zullen kunnen lymfkliertest knaagdieren opvang. Niveaus van verdoving moeten worden aangepast afhankelijk van het gewicht van het dier, overeenkomstig het onderzoekslaboratorium IACUC protocol. Een andere mogelijke wijziging is de voorbereiding van een sonde niet-gebaseerde nanoemulsion door het opnemen van een infrarood kleurstof in het researcher's geformuleerde agent of door de aankoop van een kant-en-klare imaging agent, op maat van een specifieke biologische toepassing.
Als een rat relatief groot is, kan het vaak moeilijk zijn om te plaatsen het in de kleine-dier imager. Het is dus raadzaam een test foto is genomen met het dier in de lade vóór het injecteren, en een gezichtsveld vastgesteld waar de staart zichtbaar is. Het is nuttig om tape de staart naar de lade van de imager, om ervoor te zorgen het niet tijdens imaging beweegt.
Alternatieve methoden ter beoordeling van de kwaliteit van de staart ader injecties in kleine dieren beperkt tot het gebruik zijn van labeling reagentia die niet interfereren met gelijktijdige experimentele procedures en eisen dat euthanasie van de dieren postinjection 12,,13. Sommige reagentia kunnen beïnvloeden studie resultaten en de therapeutische beoordeling van de betrokken dieren dus zorg in experimentele design is aanbevolen.
Deze methode kan in de toekomst worden verfijnd met de vooruitgang in kleine dieren imaging technologie, evenals verbeteringen in infrarood fluorescerende sondes. Biologische sondes met een ingebouwde infrarood kleurstof, ontworpen voor een verscheidenheid van verschillende toepassingen, kunnen worden gebruikt in het stadium van de administratie agent van een studie ontwerp voor het valideren van de kwaliteit van een injectie, zoals beschreven in deze methode2,3 ,27,28,29,30,31,32.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
J.A.P. en J.M.J. ontworpen gezamenlijk de experimentele aanpak voor de evaluatie van Nanoemulsions in de chronische vernauwing letsel rat model voor gevolgen voor neuropatische pijn. J.M.J. bedacht en ontworpen de algehele macrofaag-gerichte drug levering aanpak met nanoemulsions, de samenstelling van de nanoemulsion en de processen voor fabricage. J.M.J. geproduceerd de nanoemulsion, die verder werd vervaardigd door L.L. onder leiding van J.M.J. De stabiliteit van de nanoemulsion werd beoordeeld door J.M.J., L.L. en S.P. Animal care, chirurgie, gedrag, staart ader injecties en NIRF imaging werden uitgevoerd gezamenlijk door M.S. en A.M.S. onder leiding van J.A.P. Het manuscript werd geschreven en bereid door M.S., en het protocol werd geschreven door A.M.S.
NIR optische beeldvorming werd uitgevoerd op het kleine dieren Imaging systeem aan de Duquesne University (ondersteund door de Pittsburgh Tissue Engineering initiatief zaad subsidie). J.M.J. erkent steun van het DOD award nummer FA8650-17-2-6836, de NIDA award nummer 1R21DA039621-01, de NIBIB award nummer R21EB023104-02 en de AFMSA Award nummer FA8650-17-2-6836. J.A.P. en J.M.J erkentelijk voor steun uit de Pittsburgh Tissue Engineering initiatief zaad toekenning. J.A.P. erkent ook de Hunkele gevreesde ziekte Award, de Samuel en Emma Winters Foundation, het Charles Henry Leach II Fonds en de Commonwealth universele Research Enhancement Award. J.A.P. en J.M.J. erkentelijk voor steun uit de Duquesne University inaugurele Provost interdisciplinaire Consortia onderzoeksbeurs, die de chronische pijn Research Consortium ondersteunt.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



