Summary
Nous présentons ici une méthode pour valider des injections de veine de queue chez le rat en utilisant la fluorescence proche infrarouge des données d’imagerie de colorants incorporées des agents ou des sondes biologiques. La queue est imagée avant et après l’injection, le signal fluorescent est quantifié et une évaluation de la qualité de l’injection est faite.
Abstract
L’administration intraveineuse (IV) des agents dans la veine de queue de rat peut être difficile et incompatibles. Optimisation des injections de veine de queue est un élément clé de nombreuses procédures expérimentales où les réactifs doivent être introduits directement dans la circulation sanguine. Sans le vouloir, l’injection peut être sous-cutanée, éventuellement modifier les résultats scientifiques. Utilisant une sonde biologique basé sur nanoémulsion avec un colorant incorporé (NIRF) de fluorescent de proche infrarouge, cette méthode offre la possibilité de l’imagerie une queue réussie injection dans la veine in vivo. Avec l’utilisation d’un imageur NIRF, les images sont prises avant et après l’injection de l’agent. Intraveineux acceptable qualitativement ou quantitativement détermine alors basées sur l’intensité du signal NIRF au site d’injection.
Introduction
La voie d’administration d’agents en petits animaux sert un point critique de nombreuses expériences. Il détermine où l’agent doit être livrée et, par la suite, ce qui se passera à l’agent par la suite. Bien que les autres voies peuvent être utilisés pour l’agent d’administration1, la voie intraveineuse de livraison est une voie privilégiée pour certains agents. Injection intraveineuse permet aux agents d’être injecté directement dans la circulation sanguine, sans passer par des effets de premier passage tissulaire et la nécessité d’absorption1 soluté superflues. Cela permet aussi de ciblage de cellules dans le sang2,3 et l’injection directe dans tous les tissus au sein de l’appareil circulatoire. Chez les rongeurs, plusieurs veines peuvent être considérés, y compris la jugulaire, la saphène interne et la veine caudale.
Dans cette méthode, un NIRF teindre contenant une sonde biologique — dans ce cas, une nanoémulsion (Figure 1 a)3,4,5,6— est injecté dans la veine latérale queue de rats. Cette nanoémulsion NIRF contenant particulier a été utilisée précédemment pour l’image et suivre neuroinflammation in vivo et ex vivo,7, 8 , un modèle de rat9 de douleur neuropathique2,3,4, 5,10,11. L’imagerie est réalisée avant et après l’injection avec un pré-clinique de fluorescence de NIR (voir Table des matières). Cela sert d’outil pour valider la qualité de l’administration de l’agent. L’imagerie avant la queue veine injection sert comme base pour l’obtention d’une image de référence.
Plus en plus dans les études animales, nanoemulsions administrées par voie intraveineuse sont utilisées comme sondes biologiques et ciblage des agents12,13,14,15. C’est une faute prouvée à administrer un agent via la queue veine16,17— que ce soit un médicament, un vecteur viral ou une autre sonde — et pour s’assurer que l’intégralité du contenu de l’injection est entrées avec succès dans la circulation sanguine et pas la entourant les tissus17. Par conséquent, une méthode de visualisation et d’évaluer la qualité d’une injection réussie est bénéfique.
En règle générale, une lampe chauffante ou l’eau chaude est utilisée pour chauffer la queue, ce qui provoque une dilatation de la veine, permet la visualisation avant l’injection. Tandis que ce qui assure une entrée plus facile dans la veine, il n’y a pas une manière quantitative de discerner si le composé est entré dans la circulation sanguine dans sa totalité18,19,20,21. Cela devient encore plus difficile dans les souches d’animaux où la veine contraste faiblement avec la peau, comme chez la souris noires. En règle générale, l’enquêteur peut évaluer une injection défaillante en éprouvant la résistance pendant l’injection et, dans certains cas, en visualisant un renflement sur la queue, ce qui indique une fuite sous-cutanée de l’agent22,23.
Dans cette étude, l’imagerie de la nanoémulsion injectée dans la veine latérale queue de rats vivants NIRF est effectuée sur un NIRF de petits animaux, système d’imagerie (voir Table des matières). Rats sont nourris avec une spéciale purifiée de régime (voir Table des matières) pour réduire la fluorescence du tube digestif non spécifique. Acquisition d’images simultanées de lumière blanche et 800 nm fluorescence est capturée à l’aide de l’imageur NIRF et des logiciels associés. L’intensité de la fluorescence relative est mesurée sur la queue à l’États injection avant et après l’injection. L’intensité de fluorescence pour la région d’intérêt (ROI) sur le site d’injection est enregistrée et divisée par l’aire du ROI. Des évaluations qualitatives sont possibles sur lesquelles les injections sont acceptables. Éventuellement, outre l’analyse quantitative est possible en définissant des seuils pour les injections acceptables et en assignant des mesures de ROI en groupes, à quel point la signification statistique peut être calculée.
En utilisant cette stratégie de validation après des injections de veine de queue, la norme d’une étude de recherche s’améliore grâce à une cohérence accrue de l’administration de l’agent. Cette méthode d’évaluation de la qualité de l’injection dans la veine queue peut être facilement personnalisée pour différents agents injectables inclure des sondes fluorescentes infra-rouge fournis dans le commerce par plusieurs entreprises.
Protocol
Tous les protocoles ont été effectuées conformément aux directives du guide pour le soin et l’utilisation des animaux de laboratoire des National Institutes of Health et animalier institutionnel et utilisation Comité (IACUC) à l’Université Duquesne.
1. préparation et anesthésie
Remarque : Techniques d’asepsie sont utilisés pour l’intégralité de la procédure. Seulement les nouveaux matériaux stériles et autoclavés instruments stériles doivent être utilisées. Les équipements de protection individuelle (gants stériles, bonnet de cheveux, un masque chirurgical, scrubs) doivent être porté pour éviter toute contamination.
- Rats Sprague-Dawley mâles adultes pesant 250 – 300 g ont été utilisés dans le présent protocole. Acclimater les rats aux conditions de vie standard, gardez-les sur un cycle foncé h de lumière/12 h 12 et fournir des vivres et eau ad libitum. Loger l’animal socialement, gardez-les sur litière de papier et fournir un spécial régime (voir Table des matières) pour éviter l’autofluorescence en imagerie.
- Avec l’utilisation d’un coussin chauffant placé correctement, anesthésier l’animal sous un isoflurane initial de 5 % à 20 % d’oxygène, suivi d’un niveau d’entretien d’au moins 1,5 % isoflurane et pas plus de 3 %, à moins que l’animal se réveille ou conserve le sentiment.
- Confirmer une anesthésie appropriée par une absence de réponse à la queue pincées. Surveiller la circulation sanguine aussi bien par l’intermédiaire de signes vitaux tout au long de la procédure.
2. avant injection Image Aquisition
- L’image de l’animal dans un pré-clinique de fluorescence NIR en positionnant l’animal latéralement pour exposer le site d’injection sur la queue latéral pour établir une base de fluorescence dans la queue (Figure 1C, E). Effectuer une acquisition d’images simultanées d’un feu blanc (vue du corps) et à proximité des canaux infrarouges à l’aide de l’imageur NIRF et des logiciels associés, avec des tables de choix lié (LUT).
- Suite à l’imagerie, déplacer l’animal de retour à la table d’opération chirurgicale et placez-le sous anesthésie pour l’injection dans la veine queue.
Remarque : Continuer à surveiller les signes vitaux de l’animal et vérifiez à nouveau bonne anesthetization par l’intermédiaire de pincement de la queue.
3. queue Injection dans la veine avec Agent NIRF contenant
-
Avec l’animal en position couchée, orienter la queue avec la face dorsale vers le haut. Dilater les vaisseaux de la queue dans l’eau tiède pendant au moins 1 min. Orient la queue veineuse du côté latéral (droit ou gauche) est tourné à 30° (dans le sens horaire ou antihoraire) pour exposer la veine queue droite ou gauche (Figure 1B).
- Une fois la veine latérale arrière a été retrouvée (qui apparaît de couleur foncée à la dilatation), désinfecter la queue entière avec des tampons d’alcool, répéter 2 x.
- À une dose appropriée basée sur la conception de l’étude, commencer les injections dans la région des vertèbres coccygiennes distale de la queue et se déplaçant plus proximale cas d’échec de la mise en place correcte de l’aiguille.
- Insérer une aiguille stérile de 25 – 27 G, biseau vers le haut, dans la veine latérale arrière, avec la queue à un angle de 180°, insertion de l’aiguille parallèlement à la queue relevée. Observer les flashback de sang sur le bord de l’aiguille afin d’assurer la mise en place correcte. Si aucun flashback n’est apparent, déplacez doucement la pointe de l’aiguille (sans le supprimer de la queue) pour trouver l’insertion dans la veine. S’il est placé sous la peau, aucun retour de flamme de sang ne se produit.
- Insérer la seringue avec les matériaux injectables dans le rebord de l’aiguille. Lorsqu’un placement correct est atteint, le liquide injectable n’encourra pas de résistance à l’injection. L’injection fera progresser en douceur et facilement. Une fois injecté, retirer l’aiguille et la seringue, appliquer une pression avec des gazes stériles pendant au moins 1 min assurer la coagulation et marquer l’endroit de l’injection avec un stylo sur la queue, s’assurer que c’est visible sur l’image de lumière blanche.
Remarque : Aucun hématome ou lésion ne sera visible sur le site d’injection. - Si la pointe de l’aiguille se déplace lors de l’insertion de la seringue, retirer l’aiguille et recommencez la procédure de saisie des aiguilles plus proximale sur la veine caudale ipsilatéral. Ne pas réutiliser l’aiguille même si un point différent de rentrée est essayé.
Remarque : Par ailleurs, l’injection peut être réalisée avec un cathéter IV avec un indicateur de flux sanguin (voir Table des matières). Ceci a l’avantage d’une confirmation visuelle du cathéter pendant la ponction veineuse. Insérer le cathéter, côté biseau vers le haut, à l’angle décrit précédemment. Observer le prompt retour de flamme dans toute la longueur de l’indicateur de flux sanguin afin d’assurer la mise en place correcte. Légère pression arrière peut être utilisée pour tirer le sang dans la seringue pour confirmer l’emplacement approprié dans le bateau avant de l’injecter. Encore une fois, ne se fera sentir aucune résistance.
4. après l’injection Image Acquisition
- Effectuer l’évaluation de la qualité après injection dans la veine queue dans un pré-clinique de fluorescence NIR dans la même orientation que l’image de référence avant injection. S’assurer que l’animal est toujours correctement anesthésié — et sera ainsi pendant la durée de l’imagerie — avant de placer dans l’imageur.
Remarque : Un système d’imagerie contenant un tiroir housingwith anesthésie des connexions et un masque pour l’animal doit être utilisé s’il est disponible. - Orienter l’animal sur son côté latéral pour exposer le site d’injection (dans la mesure indiquée) sur la queue latéral. Vérifier si un signal NIRF est présent uniquement sur le site d’injection. Ceci indique une injection dans la veine réussie queue (Figure 1D).
Remarque : Si le signal est éparpillée dans toute la queue entière, elle est réputée être sous-cutanée et, par conséquent infructueux (Figure 1F). La figure 2 montre des exemples supplémentaires d’injections a échoué.
5. Quantification de l’image
Remarque : Quantification de l’image peut être effectuée avec le logiciel d’imagerie qui accompagne l’imageur NIR, si cette fonction n’est disponible. Sinon, autres logiciels d’analyse image disponible dans le commerce peut être utilisé24.
- Dans l’image après l’injection, dessiner une région d’intérêt autour de la zone de fluorescence à l’injection site2,6.
- Mesurer la zone et l’intensité de la fluorescence relative et l’enregistrement comme zone/intensité. Comparer les images avant injection après l’injection et la ligne de base soit qualitativement ou quantitativement à l’aide de l’analyse statistique appropriée (selon les groupes d’étude et les conditions).
Remarque : Le chercheur peut décider sur des seuils que distinguer bien des injections de mauvaises ou d’affecter un pourcentage de qualité à l’injection.
Representative Results
Des rats ont été injectés avec nanoémulsion NIRF contenant dans la veine latérale arrière et avant et après l’injection des images ont été prises avec l’imageur de petits animaux (Table des matières) tel que décrit dans le protocole. Après l’injection images sont qualitativement évalués pour la qualité de l’injection et placés dans la « bonne injection » (n = 7) et « mauvaise injection » (n = 4) groupes. Évaluation qualitative a été réalisée en observant l’intensité de fluorescence de zone après l’injection. Dans une injection optimale, le signal NIRF se limite au site d’injection. Aucun signal ne verra si l’injection est efficace parce que l’agent a été entièrement déplacée dans la circulation sanguine. Une injection de mauvaise qualité affiche un signal NIRF qui est dispersé sur toute la longueur de la queue.
Des images ont été analysées avec le logiciel NIRF imageur. Régions d’intérêt ont été dessinées sur le site d’images avant injection (Figure 1C, E) et autour de la zone de la fluorescence en images après l’injection (Figure 1D, F). Les images où la fluorescence était visible sur toute la longueur de la queue ont été jugés inacceptables et retirés de l’analyse (Figure 2). Mesures de l’intensité de la zone et fluorescence ont été enregistrés. Valeurs d’intensité de la zone/fluorescence ont été calculés et tracés (Figure 1G). Une différence significative (non appariés t-test) en fluorescence intensité entre les images avant et après l’injection a été observée dans le groupe « mauvaise injection » (Figure 1G) (p = 0,0024).
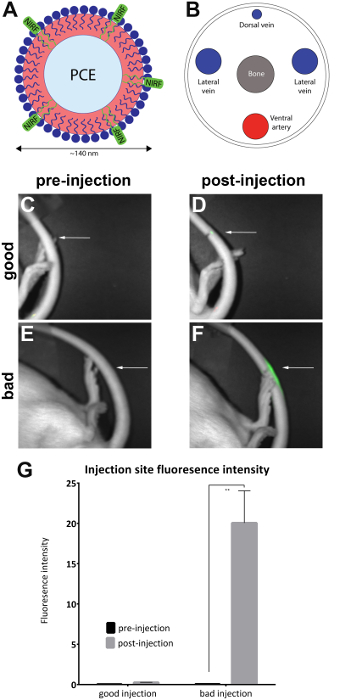
Figure 1 : NIRF basé nanoémulsion et des images de la veine caudale. (A) A basé sur nanoémulsion biologique sonde contenant un colorant NIRF a été injecté dans la veine caudale (B), le latéral et imagée dans un imageur NIRF. (C et D) images pré et post-injection d’une bonne injection. (E et F) pré et post-injection images d’une mauvaise injection. Flèches blanches indiquent le point d’injection. Il est possible d’évaluer qualitativement le succès d’une bonne injection par rapport à une mauvaise injection en évaluant la mesure du signal NIRF au site d’injection. Les injections inacceptables affichent fluorescence sur toute la longueur de la queue et ont été retirées de l’analyse (Figure 2). (G) les images peuvent également être analysés afin de révéler une mesure quantitative de l’intensité de fluorescence, avec seuils pour injection de qualité attribué par l’enquêteur. Les barres d’erreur sur le graphique reflètent le SEM. Pour le groupe « bonne injection », n = 7. Pour le groupe « mauvaise injection », n = 4. Il y a une différence statistique dans l’intensité de la fluorescence dans le groupe « mauvaise injection » lorsque l'on compare les images avant et post-injection (non appariés t-test ; p = 0,0024). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Exemples de mauvaises injections. (A) signal Fluorescent vu dans la partie de la queue. (B) signal Fluorescent vu sur toute la longueur de la queue. (C) signal Fluorescent dispersés lourdement dans la queue entière et de la région caudale du corps de l’animal. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Laboratoires de recherche engagent des coûts considérables à la suite de la transmigration des agents de contrôle. Les injections de veine de queue sont une technique difficile à maîtriser pour atteindre des taux de réussite cohérent, avec les plus expérimentés des technologues encourir souvent des erreurs de la transmigration. Il n’y a aucun moyen fiable pour confirmer une injection réussie. Ce protocole offre une solution à ce problème en donnant aux chercheurs une méthode qualitative et quantitative pour valider le succès d’une injection dans la veine queue murine. Ici, une nanoémulsion NIRF marqués7,8,25 intègre l’agent de choix (dans ce cas, un médicament) et est imagé au point d’injection dans un imageur de petits animaux NIRF. Il y a aussi la possibilité de développer un agent non dotés nanoémulsion et utiliser le même principe d’imagerie NIRF en incorporant des colorants d’infra-rouge disponibles dans le commerce. En outre, prêt-à-utiliser des agents d’imagerie avec une variété d’applications, telles que l’imagerie tumorale, métabolique, imagerie, cellule traite, et l’apoptose est également disponibles dans le commerce. L’injection est réalisée soit en utilisant une aiguille stérile ou un cathéter IV ; Cela dépend de la préférence du chercheur. En outre, automatisé queue veine injecteurs26 ont été utilisées pour faciliter ce processus et sont compatibles avec cette méthode. Cependant, cette technologie n’est pas encore disponible dans le commerce.
Il y a des étapes importantes dans la méthode d’injection de queue veine qui assurent un taux plus élevé de l’administration de l’agent correct. Tout d’abord, la queue doit être nettoyée avec de l’éthanol pour enlever toute saleté ou des débris, permettant ainsi aux chercheurs de mieux visualiser la veine. Dilatation de la veine en immergeant la queue dans l’eau chaude est également une étape très importante dans la méthode, car elle permet une plus grande surface pour injection. Injecter un point plus distale sur la veine caudale permet une erreur, dans le cas où plusieurs tentatives sont nécessaires. Injection devrait être tentée à une position plus proximale dans la queue car la veine caudale augmente à l’approche de l’aspect caudale du corps de l’animal. En outre, la veine caudale controlatérale peut être utilisée si le placement de l’aiguille ne parvient pas à plus de trois à cinq sites sur la veine caudale ipsilatéral.
Une administration réussie d’un agent de test entraîne peu ou aucun signal NIRF au point d’injection. Si aucune résistance lors de l’administration de l’injection et il y a peu ou aucune fluorescence à la queue, puis l’injection peut être enregistrée comme réussie. Si une résistance est ressentie pendant l’injection et il y a un signal de sentier de NIRF sur une longueur de la queue, puis l’injection est enregistrée comme infructueuse et est probablement en partie sous-cutanée. Images de fluorescence sont prises avant et après l’injection, et la qualité de l’injection est évaluée par observer qualitativement ou analyser quantitativement le signal de fluorescence au site d’injection. Le logiciel livré avec l’imagerie de fluorescence NIR est souvent capable d’effectuer cette analyse.
La méthode peut être adaptée à plusieurs égards. Elle s’applique à la queue d’injection dans la veine dans les souris et les rats. Imagerie de fluorescence plus petits animaux NIR sera capable d’accueillir des rongeurs murins. Niveaux d’anesthésie doivent être ajustés en fonction du poids de l’animal, conformément au protocole IACUC du laboratoire de la recherche. Une autre modification possible est la préparation d’une sonde non dotés nanoémulsion en intégrant un colorant infrarouge agent formulé du chercheur ou en achetant un agent d’imagerie prêtes à l’emploi, adapté à une application biologique spécifique.
Si un rat est relativement important, il peut souvent être difficile à placer en l’imageur de petits animaux. Il est donc recommandé qu’une image est prise avec l’animal dans le tiroir avant d’injecter, ou un champ de vision établie dont la queue est visible. Il est utile de bande la queue dans le tiroir de l’imageur, pour s’assurer qu’il ne bouge pas pendant la formation image.
Méthodes alternatives visant à évaluer la qualité de la veine caudale des injections chez les petits animaux sont limitées à l’utilisation de l’étiquetage des réactifs qui ne pas interférer avec les procédures expérimentales simultanées et exiger l’euthanasie de la post-injection animaux 12,,13. Certains réactifs peuvent avoir une incidence résultats de l’étude et l’évaluation thérapeutique des animaux concernés, les soins dans une conception expérimentale est donc recommandé.
Cette méthode peut, à l’avenir, être raffinée grâce aux progrès dans la technologie d’imagerie de petits animaux, ainsi que des améliorations dans l’infrarouges sondes fluorescentes. Sondes biologiques avec un colorant infrarouge intégré, conçu pour une variété de différentes applications, peuvent servir à l’étape d’administration agent d’une conception de l’étude afin de valider la qualité de l’injection, comme indiqué dans cette méthode2,3 ,27,28,29,30,31,32.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
J.A.P. et J.M.J. conçu conjointement l’approche expérimentale d’évaluation Nanoemulsions dans le modèle de rat des lésions chroniques de la Constriction des effets sur la douleur neuropathique. J.M.J. conçu et créé l’approche de livraison de drogue de macrophages ciblée dans l’ensemble avec nanoemulsions, la composition nanoémulsion et procédés de fabrication. J.M.J. produit la nanoémulsion, qui a été également fabriquée par L.L. sous la houlette des J.M.J. La stabilité de la nanoémulsion a été évaluée par J.M.J., L.L. et S.P. Animal les soins, comportement, chirurgie, injections de veine de queue, et imagerie NIRF menées conjointement par M.S. et a.m.S. sous la direction de J.A.P. Le manuscrit a été écrit et préparé par M.S., et le protocole a été rédigé par a.m.S.
Imagerie optique NIR a été effectuée sur le système d’imagerie petit Animal à l’Université Duquesne (pris en charge par la subvention de démarrage Pittsburgh Tissue Engineering Initiative). J.M.J. reconnaît le soutien du DOD attribution numéro FA8650-17-2-6836, NIDA prix numéro 1R21DA039621-01, ingénierie attribution numéro R21EB023104-02 et AFMSA prix FA8650-17-2-6836. J.A.P. et J.M.J souligner le soutien de la subvention de démarrage Pittsburgh Tissue Engineering Initiative. J.A.P. reconnaît également le Hunkele prix de maladie redoutée, le Samuel et Emma hivers Foundation, le fonds Charles Henry Leach II et le prix de valorisation recherche universelle du Commonwealth. J.A.P. et J.M.J. souligner le soutien de la Duquesne University inaugurale prévôté de la subvention du consortiums de la recherche interdisciplinaire, qui soutient le Consortium de recherche de douleur chronique.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



