Summary
Hier präsentieren wir eine Methode zur Validierung Schweif Vene Injektionen bei Ratten durch die Verwendung von Nah-Infrarot-Fluoreszenz Bilddaten von Farbstoffen in Agenten oder biologische Sonden eingearbeitet. Die Rute wird abgebildet, bevor nach der Injektion wird das Fluoreszenzsignal quantifiziert und eine Beurteilung der Qualität Injektion erfolgt.
Abstract
Intravenöse (IV) Verabreichung von Wirkstoffen in die Rute Vene von Ratten kann schwierig und widersprüchlich sein. Tail Vene Injektionen zu optimieren ist ein wichtiger Teil der vielen experimentellen Verfahren wo Reagenzien müssen direkt in den Blutstrom eingeführt werden. Unbewusst, kann die Injektion subkutan, vielleicht ändern die wissenschaftlichen Ergebnisse. Mit Hilfe einer Nanoemulsion-basierten biologischen Sonde mit einer eingearbeiteten Nahinfrarot-Fluoreszenzfarbstoff (NIRF), bietet diese Methode die Möglichkeit von imaging-eine erfolgreiche Schweif Vene Injektion in-vivo. Mit dem Einsatz einer NIRF Imager sind Bilder vor und nach der Injektion des mittels getroffen. Eine akzeptable IV-Injektion wird dann qualitativ oder quantitativ ermittelt anhand der Intensität des NIRF Signals an der Injektionsstelle.
Introduction
Die Art der Verabreichung von Agenten in Kleintiere dient als ein kritischer Punkt von vielen Experimenten. Es legt fest, wo der Agent soll geliefert werden und anschließend an den Agenten danach geschehen wird. Obwohl andere Routen für Agent-Verwaltung-1verwendet werden können, ist die intravenöse Route der Lieferung eine bevorzugte Route für bestimmte Wirkstoffe. IV-Injektion kann Agenten direkt in die Blutbahn, Umgehung First-Pass-Gewebe Auswirkungen und die Notwendigkeit für überflüssige gelösten absorption1 injiziert werden. Dies ermöglicht auch gezielt Zellen in die Blutbahn2,3 und direkte Lieferung an allen Geweben innerhalb des Herz-Kreislauf-Systems. Bei Nagetieren können mehrere Adern betrachtet werden, einschließlich die Halsschlagader, die saphena und die Rute Vene.
Bei dieser Methode wird eine NIRF färben mit einer biologischen Sonde – in diesem Fall eine Nanoemulsion (Abbildung 1A)3,4,5,6— in die seitlichen Schweif Vene von Ratten injiziert. Diese besondere NIRF-haltigen Nanoemulsion wurde zuvor verwendet, um Bild und Neuroinflammation in vivo und ex Vivo7,8 in einer Ratte Modell9 von neuropathischen Schmerzen2,3,4zu verfolgen, 5,10,11. Bildgebung ist vor und nach der Injektion mit einer präklinischen NIR-Fluoreszenz-Imager durchgeführt (siehe Tabelle der Materialien). Dies dient als Werkzeug, um die Qualität der Agent-Verwaltung zu validieren. Bildgebung vor der Rute Vene Injektion dient als Grundlage für den Erhalt ein Baseline-Abbild.
In tierexperimentellen Studien sind immer intravenös verabreichte Nanoemulsionen als biologische Sonden und targeting-Agenten12,13,14,15genutzt. Es ist eine bewährte Herausforderung, einen Agent über die Rute Vene16,17zu verwalten – sei es ein Medikament, viralen Vektoren oder einer anderen Sonde – und um sicherzustellen, dass der gesamte Inhalt der Injektion die Blutbahn erfolgreich eingegeben haben und nicht die umliegenden Gewebe17. Daher ist eine Methode zur Visualisierung und Bewertung der Qualität einer erfolgreichen Einspritzung vorteilhaft.
In der Regel wird eine Wärmelampe oder warmem Wasser zur Rute, wärmen die Dilatation der Vene, erlaubt die Visualisierung vor der Injektion verursacht. Während dadurch einfacher Einstieg in die Vene ist keine quantitative Art und Weise zu erkennen, ob die Verbindung in seiner Gesamtheit18,19,20,21den Blutkreislauf eingetreten ist. Dies wird noch schwieriger in Stämmen von Tieren, wo die Vene schwach mit der Haut, wie z. B. in schwarze Mäuse kontrastiert. In der Regel kann der Prüfer eine fehlerhafte Injektion durch erleben Widerstand während der Injektion und in einigen Fällen, visualisieren eine Ausbuchtung am Heck, Angabe einer subkutanen Lecks der Agent22,23messen.
In dieser Studie NIRF Bildgebung von der Nanoemulsion injiziert in die seitlichen Schweif Vene live Ratten erfolgt auf einem kleinen Tier NIRF imaging-System (siehe Tabelle der Materialien). Ratten sind eine spezielle gereinigt gefüttert Ernährung (siehe Tabelle der Materialien), um unspezifische Darm Fluoreszenz zu reduzieren. Gleichzeitige Bildaufnahme von weißem Licht und 800 nm Fluoreszenz ist mit der NIRF Imager und die dazugehörige Software erfasst. Die relative Fluoreszenzintensität wird auf das Heck auf die Voreinspritzung und nach der Injektion Staaten gemessen. Die Fluoreszenzintensität für die Region of Interest (ROI) an der Injektionsstelle aufgenommen und geteilt durch die Fläche des ROI. Qualitative Bewertungen erfolgen auf die Injektionen akzeptabel sind. Optional können weitere Quantitative Analyse durchgeführt werden, durch die Festlegung von Grenzwerten für akzeptable Injektionen und Zuweisen von ROI-Messungen in Gruppen, an welcher, die Stelle die statistische Signifikanz berechnet werden kann.
Durch die Nutzung dieser Validierungsstrategie nach Heck Vene spritzen, verbessert sich der Standard einer Forschungsstudie durch erhöhte Konsistenz der Agent-Administration. Diese Methode der Beurteilung der Qualität der Schweif Vene Injektion kann für verschiedene injizierbare Mittel zum Infrarot-fluoreszierende Sonden kommerziell von mehreren Unternehmen angeboten gehören leicht angepasst werden.
Protocol
Alle Protokolle wurden gemäß den Richtlinien in der Anleitung für die Pflege und Verwendung von Labortieren der National Institutes of Health und institutionellen Animal Care und Nutzung Committee (IACUC) an der Duquesne University durchgeführt.
1. Vorbereitung und Narkose
Hinweis: Aseptische Techniken werden für die Gesamtheit des Verfahrens verwendet. Sind nur neue Sterilgut und autoklaviert sterile Instrumente verwendet werden. Persönlicher Schutzausrüstung (sterile Handschuhe, Haar-Haube, Mundschutz, Scrubs – Die Anfänger) muss getragen werden, um Kontaminationen zu vermeiden.
- Erwachsene männlichen Sprague-Dawley Ratten mit einem Gewicht von 250 – 300 g wurden in diesem Protokoll verwendet. Akklimatisieren Sie die Ratten standard Lebensbedingungen zu, halten sie auf einem 12 h Licht/12 h-dunkel-Zyklus und bieten Sie Nahrung und Wasser ad libitum. Haus das Tier sozial, bewahren Sie sie auf Papier Betten und bieten eine spezielle Diät (siehe Tabelle der Materialien), um Autofluoreszenz während der Aufnahme zu vermeiden.
- Betäuben Sie mit dem Einsatz von einem richtig platzierten Heizkissen das Tier unter einem anfänglichen 5 % Isofluran in 20 % Sauerstoff, gefolgt von einer Wartungsniveau von nicht weniger als 1,5 % Isofluran und nicht mehr als 3 %, es sei denn, das Tier erwacht oder Gefühl behält.
- Ordnungsgemäße Betäubung über eine fehlende Reaktion auf Prisen tail zu bestätigen. Überwachen Sie den Blutfluss sowie über Vitalfunktionen während des Verfahrens.
(2) Voreinspritzung Bild Aquisition
- Bild-das Tier in einer präklinischen NIR-Fluoreszenz-Imager durch die Positionierung des Tieres seitlich um die Einstichstelle an der seitlichen Rute zum Einrichten einer Basislinie der Fluoreszenz im Heck (Abbildung 1C, E) verfügbar zu machen. Führen Sie eine gleichzeitige Bildaufnahme von beiden ein weißes Licht (Körper-Ansicht) und in der Nähe von Infrarot-Kanäle mit dem NIRF Imager und zugehörige Software mit verknüpften Lookup-Tabellen (LUT).
- Bildgebung, bewegen Sie das Tier zurück in den OP-Tisch und legen Sie sie unter Narkose für die Heck-Vene-Injektion.
Hinweis: Überwachen Sie des Tieres Vitalfunktionen und überprüfen Sie richtige Anesthetization über Heck Prise.
(3) Tail Vene Injektion mit NIRF-haltige Mittel
-
Orientieren Sie mit dem Tier in Bauchlage sich die Rute mit der dorsalen Seite nach oben. Erweitern Sie das Heck Gefäßsystem im warmen Wasser für ein Minimum von 1 min. Orient das Heck Vene, so dass die laterale Seite (rechts oder links) 30° (im Uhrzeigersinn oder gegen den Uhrzeigersinn) gedreht wird um die Rechte oder linke Rute Vene (Abbildung 1B) verfügbar zu machen.
- Sobald eine seitliche Schweif Ader gefunden wurde (die erscheint dunkel gefärbten nach Dilatation), desinfizieren Sie das gesamte Heck mit Alkohol-Pads, 2 X wiederholen.
- Eine geeignete Dosierung basierend auf das Studiendesign Beginn Injektionen in der distalen Steißbein Wirbel-Region den Schwanz und bewegt mehr proximalen korrekte Nadelplatzierung unterlässt.
- 25 – 27 G sterile Nadel, Abschrägung, in die Vene seitliche Rute, mit der Rute in einem 180° Winkel, parallel zu der angehobene Heck Nadel einsetzen. Beobachten Sie Blut Rückblende in der Felge der Nadel, um die korrekten Platzierung zu gewährleisten. Wenn keine Rückblenden hervorgeht, langsam bewegen die Nadelspitze (ohne Herausnahme aus dem Schweif) Vene einführen zu finden. Wenn subkutan platziert, wird kein Blut Flashback auftreten.
- Legen Sie die Spritze mit injizierbaren Materialien in der Felge der Nadel. Wenn die richtige Platzierung erreicht wird, entstehen die injizierbare Flüssigkeit Widerstand nach Einspritzung. Die Injektion wird glatt und leicht voraus. Einmal injiziert, entfernen Sie die Nadel und Spritze, Druck mit steriler Gaze für mindestens 1 min zu gewährleisten, Blutgerinnung, und markieren Sie die Stelle der Injektion mit einem Stift an der Rute, so dass es auf dem weißen Licht Bild sichtbar ist.
Hinweis: Kein Hämatom oder Läsion sichtbar an der Injektionsstelle. - Bewegt sich der Spitze der Nadel beim Spritze einsetzen, entfernen Sie die Nadel, und wiederholen Sie das Nadel-Anmeldeverfahren mehr proximalen auf der ipsilateralen Schweif Vene. Wiederverwenden Sie die gleiche Nadel nicht, wenn ein anderes Wiedereintritt Punkt versucht wird.
Hinweis: Alternativ kann die Injektion mit einer IV-Katheter mit einem Blut-Flow Indikator durchgeführt werden (siehe Tabelle der Materialien). Dies hat den Vorteil einer optischen Bestätigung des Katheters während der Blutentnahme. Setzen Sie den Katheter, schräge Seite, in der zuvor beschriebenen Winkel. Beobachten Sie schnellen Rückblende in der gesamten Länge des Indikators Durchblutung um korrekte Platzierung zu gewährleisten. Leichten Gegendruck kann verwendet werden, um Blut in die Spritze, die richtige Platzierung im Behälter vor der Injektion zu bestätigen zu ziehen. Wiederum wird kein Widerstand zu spüren.
(4) nach der Injektion Bildaufnahme
- Durchführen Sie Qualitätsbewertung nach Heck Vene Injektion in einer präklinischen NIR Fluoreszenz Imager in die gleiche Ausrichtung wie die Baseline Voreinspritzung-Abbild. Sicherstellen, das Tier ist noch richtig betäubt – und werden so für die Dauer der Bildgebung – vor in der Imager platzieren.
Hinweis: Ein bildgebendes System enthält eine Schublade Housingwith Anästhesie Verbindungen und eine Maske für das Tier sollte verwendet werden, falls vorhanden. - Richten Sie das Tier an der Querseite an die Injektionsstelle (wie gekennzeichnet) an der seitlichen Rute aussetzen. Überprüfen Sie, ob ein NIRF Signal nur an der Injektionsstelle vorhanden ist. Dies bedeutet eine erfolgreiche Schweif Vene Injektion (Abbildung 1D).
Hinweis: Wenn das Signal das gesamte Heck verteilt ist, wird es als subkutane und daher nicht erfolgreich sein (Abbildung 1F). Abbildung 2 zeigt Beispiele von gescheiterten Injektionen.
5. Bild Quantifizierung
Hinweis: Bild Quantifizierung kann mit der imaging-Software, die die NIR-Imager begleitet durchgeführt werden, wenn diese Funktion verfügbar ist. Alternativ kann andere handelsübliche Bildanalyse-Software verwendeten24sein.
- Zeichnen Sie im das Bild nach der Injektion eine Region of Interest rund um den Bereich der Fluoreszenz bei der Injektion Seite2,6.
- Und der relativen Fluoreszenzintensität und Datensatz als Bereich/Intensität zu messen. Vergleichen Sie nach der Injektion und die Basislinie Voreinspritzung Bilder entweder qualitativ oder quantitativ mit geeigneten statistischen Analyse (abhängig von Studiengruppen und Bedingungen).
Hinweis: Der Forscher kann Schwellen beschließen, die gut von schlecht Injektionen zu diskriminieren oder die Injektion einen Prozentsatz der Qualität zuweisen.
Representative Results
Ratten wurden mit NIRF-haltigen Nanoemulsion in die seitlichen Schweif Vene injiziert, und vor und nach der Injektion Bilder wurden mit der kleinen Tier-Imager (Table of Materials), wie im Protokoll beschrieben. Nach der Injektion Bilder qualitativ für Injektion Qualität bewertet und platziert in "gute Injektion" (n = 7) und "schlechte" (n = 4) Gruppen. Qualitative Beurteilung erfolgte durch die Beobachtung der Fluoreszenzintensität nach der Injektion Bereich. In einer optimalen Injektion beschränkt sich das NIRF Signal an der Injektionsstelle. Kein Signal wird gesehen werden, wenn die Injektion erfolgreich ist, weil der Agent voll in die Blutbahn verdrängt hat. Eine Injektion von schlechter Qualität zeigt ein NIRF Signal, die entlang der Länge der Rute verteilt ist.
Bilder wurden mit der begleitenden NIRF Imager Software analysiert. Regionen von Interesse waren auf dem Gelände der Voreinspritzung Bilder (Abbildung 1C, E) und rund um den Bereich der Fluoreszenz in Bildern nach der Injektion (Abbildung 1D, F) gezogen. Bilder wo Fluoreszenz sichtbar über die gesamte Länge der Rute war waren nicht annehmbar und entfernt aus der Analyse (Abbildung 2). Messungen der Gegend und Fluoreszenz Intensität wurden aufgezeichnet. Werte für Bereich/Fluoreszenzintensität wurden berechnet und dargestellt (Abbildung 1G). Ein signifikanter Unterschied (ungepaarten t-test) in Fluoreszenz Intensität zwischen vor-und nach der Injektion wurde in der "schlechten Injektion" Gruppe (Abbildung 1G) beobachtet (p = 0.0024).
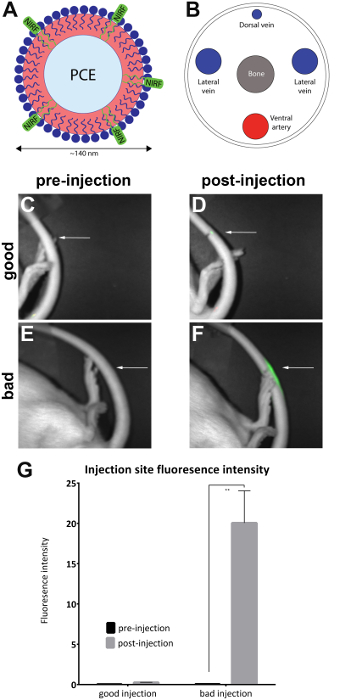
Abbildung 1 : NIRF basierte Nanoemulsion und Bilder der Schweif Vene. (A) A Nanoemulsion-basierten biologischen Sonde mit NIRF Farbstoff war in (B) die seitlichen Schweif Vene injiziert und abgebildet in einer NIRF Imager. (C und D) vor- und postinjection Bilder einer guten Einspritzung. (E und F) vor- und postinjection Bilder von einer schlechten Injektion. Weiße Pfeile zeigen den Punkt der Injektion. Es ist möglich, den Erfolg einer guten Einspritzung im Vergleich zu einer schlechten Injektion durch Bewertung des Ausmaßes des NIRF Signals an der Injektionsstelle qualitativ zu bewerten. Inakzeptable Injektionen zeigen Fluoreszenz über die gesamte Länge der Rute und wurden aus der Analyse (Abbildung 2) entfernt. (G) die Bilder können auch analysiert werden, um eine quantitative Messung der Fluoreszenzintensität, mit Schwellenwerten für Injektion Qualität zugewiesen durch den Prüfarzt zu offenbaren. Die Fehlerbalken im Diagramm widerspiegeln SEM Für die "gute Injektion" Gruppe, n = 7. Für die "schlechten Injektion" Gruppe, n = 4. Es gibt ein statistisch signifikanter Unterschied im Fluoreszenzintensität in der "schlechten Injektion" Gruppe beim Vergleich von vor-und postinjection (ungepaarten t-test; p = 0.0024). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Beispiele für schlechte Injektionen. (A) Fluoreszenzsignal gesehen Teil der Rute. (B) Fluoreszenzsignal gesehen über die gesamte Länge der Rute. (C) Fluoreszenzsignal verteilt stark in das gesamte Heck und kaudalen Bereich des Körpers des Tieres. Bitte klicken Sie hier für eine größere Version dieser Figur.
Discussion
Forschungslabors entstehen erhebliche Kosten durch die Misswirtschaft der Test-Agents. Tail Vene Injektionen sind eine schwierige Technik zu meistern, konsequente Erfolgsquote, mit den erfahrensten Technologen häufig anfallenden Misswirtschaft Fehler zu erreichen. Es gibt keine zuverlässige Möglichkeit, eine erfolgreiche Injektion zu bestätigen. Dieses Protokoll bietet eine Lösung für dieses Problem geben Forscher eine qualitative und quantitative Methode, um den Erfolg einer murinen Schweif Vene Einspritzung überprüfen. Hier eine NIRF gekennzeichnet Nanoemulsion7,8,25 enthält das Mittel der Wahl (in diesem Fall ein Medikament) und an der Injektionsstelle bei einer NIRF kleine Tier Imager abgebildet ist. Es gibt auch die Möglichkeit, einen nicht-Nanoemulsion-basierte Agent zu entwickeln und verwenden das gleiche Prinzip der NIRF Bildgebung durch den Einbau von handelsüblichen Infrarot-Farbstoffe. Darüber hinaus Ready-to-Use Image Agenten mit einer Vielzahl von Anwendungen, z. B. Tumor imaging, metabolische Bildgebung, Zelle, Menschenhandel und Apoptose sind auch im Handel erhältlich. Eine Injektion erfolgt entweder mit einer sterilen Nadel oder alternativ eine IV-Katheter; Dies hängt von den Vorlieben des Forschers. Darüber hinaus automatisierte Schweif Vene Injektoren26 wurden verwendet, um in diesem Prozess unterstützen und sind kompatibel mit dieser Methodik. Allerdings hat diese Technologie noch nicht kommerziell verfügbar geworden.
Es sind wichtige Schritte in die Rute Vene Injektion Methode, die eine höhere Rate von richtigen Agent Verwaltung sicherstellen. Zunächst sollte die Rute mit Ethanol, Schmutz und Ablagerungen, so dass Forscher besser visualisieren die Vene entfernen gereinigt werden. Dilatation der Vene durch Eintauchen der Schweif in warmem Wasser ist auch ein sehr wichtiger Schritt in der Methode, da es eine grössere Fläche für die Injektion ermöglicht. An einem mehr distalen Punkt auf der Rute Vene injizieren kann für einige Fehler, für den Fall, dass mehrere Versuche erforderlich sind. Injektion sollte versucht werden, an einer mehr proximalen Position im Heck wie die Schweif Ader an Größe zunimmt, wie der kaudalen Aspekt des Körpers des Tieres angesprochen wird. Darüber hinaus kann die kontralateralen Schweif Ader verwendet werden, wenn Nadelplatzierung in mehr als drei bis fünf Seiten auf der ipsilateralen Schweif Ader schlägt fehl.
Eine erfolgreiche Verwaltung eines Test-Agent führt zu wenig bis keine NIRF Signal zum Zeitpunkt der Injektion. Wenn kein Widerstand zu während der Verabreichung der Injektion spüren ist und es wenig bis keine Fluoreszenz am Heck gibt, kann die Injektion so erfolgreich aufgezeichnet werden. Wenn Widerstand zu beim Einspritzen spüren ist und es ein Trail NIRF Signal über einige Länge der Rute, gibt dann die Injektion ist als erfolglos und ist teilweise subkutane. Fluoreszenzbilder werden vor und nach der Injektion und die Qualität der Injektion wird anhand Beobachtung qualitativ oder quantitativ das Fluoreszenzsignal an der Injektionsstelle zu analysieren. Die Software begleitet den NIR-Fluoreszenz-Imager ist oft in der Lage, diese Analyse durchzuführen.
Die Methode kann auf verschiedene Weise angepasst werden. Es gilt zu Endstück Vene Injektion bei Mäusen und Ratten. Die meisten kleinen Tier NIR Fluoreszenz Imager werden kann murinen Nagetiere beherbergen. Ebenen der Anästhesie je nach Gewicht des Tieres, in Übereinstimmung mit dem Forschungslabor IACUC Protokoll angepasst werden müssen. Eine andere mögliche Änderung ist die Vorbereitung einer nicht-Nanoemulsion-basierten Sonde durch die Einbeziehung eines Infrarot-Farbstoff in der Forscher formulierten Agent oder durch den Kauf einer Ready-to-Use imaging-Agents, auf eine bestimmte biologische Anwendung zugeschnitten.
Wenn eine Ratte relativ groß ist, kann es oft schwierig, ihn in das kleine Tier-Imager positionieren sein. Es empfiehlt sich somit wird, ein Testbild vor der Injektion mit dem Tier in der Schublade genommen und eine Sichtfeld festgestellt, wo die Rute sichtbar ist. Es ist hilfreich, Band, die das Heck in die Schublade der Imager, um sicherzustellen, dass während der Aufnahme nicht bewegt.
Alternative Methoden zur Bewertung der Qualität der Schweif Vene, die Injektionen bei Kleintieren beschränken sich auf die Nutzung von Reagenzien, die nicht stören mit gleichzeitigen experimentelle Verfahren und erfordert Euthanasie der Tiere Steroidtherapie Kennzeichnung suchen 12,13. Einige Reagenzien können Ergebnisse der Studie und die therapeutische Beurteilung der Tiere beteiligt sind, auswirken, sodass Sorgfalt bei der Versuchsplanung empfohlen wird.
Diese Methode kann in Zukunft mit den Fortschritten in klein-Tier-imaging-Technologie, sowie Verbesserungen in der Infrarot-fluoreszierende Sonden verfeinert. Biologische Proben mit eine eingebaute Infrarot-Farbstoff, entwickelt für eine Vielzahl von verschiedenen Anwendungen, in der Agent-Verwaltung-Bühne ein Studiendesign lässt sich um die Qualität einer Injektion zu validieren gemäß dieser Methode2,3 ,27,28,29,30,31,32.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
J.A.P J.M.J. gestaltet gemeinsam die experimentellen Ansatz für die Bewertung von hochdosierter in die chronische Schädigung der Verengung Rattenmodell für Auswirkungen auf neuropathische Schmerzen. J.M.J. konzipiert und gestaltet den insgesamt Makrophagen-bezogene Droge Lieferung Ansatz mit hochdosierter, Nanoemulsion Zusammensetzung und Verfahren zur Herstellung. J.M.J. produziert die Nanoemulsion, die weiter von l.l. unter der Leitung des J.M.J. hergestellt wurde Die Stabilität der Nanoemulsion wurde durch J.M.J., l.l. und S.P. Tier Pflege, Chirurgie, Verhalten, Tail Vene spritzen beurteilt und NIRF Bildgebung wurden gemeinsam durchgeführt von M.S und A.M.S. unter der Leitung von J.A.P Das Manuskript wurde geschrieben und von M.S vorbereitet, und das Protokoll wurde geschrieben von A.M.S.
NIR optische Bildgebung wurde auf dem kleinen Tier-Imaging-System an der Duquesne University (unterstützt durch die Pittsburgh Tissue Engineering Initiative Seed Grant) durchgeführt. J.M.J. räumt Unterstützung vom DOD Prämiennummer FA8650-17-2-6836, NIDA Award Nr. 1R21DA039621-01, NIBIB-Prämien-Nummer R21EB023104-02 und AFMSA Award Nr. FA8650-17-2-6836. J.A.P und J.M.J anerkennen, Unterstützung von Pittsburgh Tissue Engineering Initiative Seed Grant. J.A.P erkennt auch Hunkele gefürchtete Krankheit Award, den Samuel und Emma Winter Stiftung, Charles Henry Leach II Fonds und universelle Enhancement-Forschungspreis Commonwealth. J.A.P und J.M.J. anerkennen, Unterstützung durch die Duquesne University Inaugural Provost interdisziplinäre Konsortien Forschungsstipendium, die chronischen Schmerz-Forschungs-Konsortium unterstützt.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



