Summary
Her presenterer vi en metode for å validere hale blodåre injeksjoner i rotter ved å benytte nær infrarød fluorescens bildebehandling data fra fargestoffer innlemmet i agenter eller biologiske sonder. Halen er fotografert før og etter injeksjon, fluorescerende signalet er kvantifisert, og en vurdering av injeksjon kvaliteten er laget.
Abstract
Intravenøs (IV) administrasjon av agenter i halen venen rotter kan være både vanskelig og inkonsekvent. Optimalisere hale blodåre injeksjoner er en viktig del av mange eksperimentelle prosedyrer der reagenser må innføres direkte inn i blodbanen. Ubevisst, kan injeksjon være subkutan, muligens endre vitenskapelige resultatene. Denne metoden bruker en nanoemulsion-baserte biologiske sonde med en innarbeidet nær infrarød fluorescerende (NIRF) fargestoff, og tilbyr evnen Imaging en vellykket hale blodåre injeksjon i vivo. Med bruk av en NIRF imager tas før og etter injeksjon av agenten. En akseptabel IV injeksjon bestemmes kvantitativt eller kvalitativt deretter basert på intensiteten av NIRF signalet på injeksjonsstedet.
Introduction
Ruten for administrasjon av agenter i små dyr fungerer som et kritisk punkt mange eksperimenter. Bestemmer hvor agent skal leveres og, senere, hva vil skje med agenten etterpå. Selv om andre ruter kan brukes for agent administrasjon1er intravenøs ruten levering en foretrukket rute for visse agenter. IV injeksjon lar agenter til å være direkte injiseres inn i blodet, omgåelsen første-pass vev effekter og behovet for overflødig stoff absorption1. Dette gjør også for målretting celler i blodet2,3 og direkte levering til alle vev i sirkulasjonssystemet. I Red, kan flere vener vurderes, og inkludert jugular, den saphenous og hale venen.
I denne metoden en NIRF fargestoff som inneholder en biologisk sonde – i dette tilfellet, en nanoemulsion (figur 1A)3,4,5,6-injiseres i laterale hale åre rotter. Dette bestemte NIRF inneholder nanoemulsion har vært brukt tidligere bilde og spore neuroinflammation in vivo og ex vivo7,8 i en rotte modell9 nevropatisk smerte2,3,4, 5,10,11. Bildebehandling utføres før og etter injeksjon med en prekliniske NIR fluorescens imager (se Tabell for materiale). Dette fungerer som et verktøy til å validere kvaliteten på agent administrasjonen. Bildebehandling før halen blodåre injeksjon tjener som grunnlag for å oppnå et opprinnelig bilde.
I animal studies, er stadig intravenøst administrert nanoemulsions brukes som biologiske sonder og målretting agenter12,13,14,15. Det er en bevist utfordring å administrere en agent via hale blodåre16,17– være det et legemiddel, en viral vektor eller en annen sonde, og sikre at hele innholdet i injeksjon har angitt blodet og ikke den omkringliggende vev17. En metode for å visualisere og vurdere kvaliteten på en vellykket injeksjon er derfor gunstig.
Vanligvis brukes en heten lampen eller varmt vann å varme halen, som fører til utvidelse av venen, tillater sine visualisering før injeksjon. Mens Dette sikrer enklere inntreden i venen, er det ikke en kvantitativ måte å skjelne om sammensatte er inn blodet i sin helhet18,19,20,21. Dette blir vanskeligere fortsatt i stammer av dyr der fotsporene kontrasterer svakt med hud, som i svart mus. Etterforskeren kan vanligvis måle en mislykket injeksjon av opplever motstand under injeksjon og, i noen tilfeller kan visualisere en kul på halen, som indikerer en subcutaneous lekkasje av agent22,23.
I denne studien NIRF avbildning av nanoemulsion injisert i laterale hale åre live rotter utføres på en liten-dyr NIRF tenkelig system (se Tabell for materiale). Rotter er matet en spesiell renset kosthold (se Tabell for materiale) for å redusere uspesifikke gut fluorescens. Samtidige bildeopptak hvitt lys og 800 nm fluorescens fanges opp ved hjelp av NIRF imager og tilhørende programvare. Relativ fluorescens intensiteten måles på halen pre injeksjon og etter injeksjon States. Fluorescens intensiteten for regionen rundt (ROI) på injeksjonsstedet registreres og delt området av Avkastningen. Kvalitative vurderinger kan gjøres som injeksjoner er akseptabelt. Eventuelt kan videre kvantitativ analyse utføres ved å angi grensene for akseptabel injeksjoner og tilordne avkastning mål i grupper, da statistiske betydning beregnes.
Ved å benytte denne godkjenningsstrategi etter halen blodåre injeksjoner, forbedrer standarden på et forskningsprosjekt på grunn av økt konsistensen av agent administrasjon. Denne metoden for å vurdere kvaliteten på halen blodåre injeksjon kan enkelt tilpasses for ulike injiserbare agenter med infrarød fluorescerende sonder kommersielt fra flere selskaper.
Protocol
Alle protokoller ble utført i samsvar med retningslinjene i guiden og bruk av forsøksdyr av National Institutes of Health og institusjonelle Animal Care og bruk Committee (IACUC) på Duquesne University.
1. forberedelse og anestesi
Merk: Aseptiske teknikker som brukes for helheten av prosedyren. Bare som nye sterilt materialer og autoklaveres sterilt instrumenter skal brukes. Personlig verneutstyr (sterilt hansker, hår panseret, kirurgiske maske, scrubs) må brukes for å unngå forurensning.
- Voksen Sprague-Dawley hannrotter veiing 250-300 g ble brukt i denne protokollen. Acclimate rottene å standard levekår, holde dem på en 12 h lys/12 h mørke syklus og gi mat og vann ad lib. Huset dyret sosialt, holde dem på papir bedding og gir en spesiell diett (se Tabell for materiale) for å unngå autofluorescence under bildebehandling.
- Med bruk av en riktig plassert varmeputen, bedøve dyret under en første 5% isoflurane i 20% oksygen, etterfulgt av en opprettholdelsen plan flate av ikke mindre enn 1,5% isoflurane og ikke mer enn 3%, med mindre dyret våkner eller beholder følelsen.
- Bekrefte riktig anestesi via manglende respons til hale pinches. Overvåke blodgjennomstrømningen samt via vitale i hele denne prosedyren.
2. før injeksjon bilde kjøp
- Bilde dyr i en prekliniske NIR fluorescens imager ved å plassere dyret sidelengs for å avsløre injeksjonsstedet på lateral halen å fastsette baseline av fluorescens i halen (figur 1C, E). Utføre en samtidige bildeopptak både et hvitt lys (body visning) og infrarøde kanaler med NIRF imager og tilhørende programvare, med koblede oppslagstabeller (LUT).
- Etter bildebehandling, flytte dyret tilbake til tabellen kirurgisk, og plassere den under anestesi for hale blodåre injeksjon.
Merk: Fortsette overvåking dyrets vitale og kontrollerer riktig anesthetization via hale knipe.
3. hale blodåre injeksjon med NIRF inneholder Agent
-
Med dyr i liggende stilling, orientere halen med dorsal side vendt oppover. Dilate er halen blodkar i varmt vann i minst 1 min. Orient halen vene slik den laterale siden (enten høyre eller venstre) er slått 30° (med eller mot klokken) for å avsløre den høyre eller venstre hale venen (figur 1B).
- Når en lateral hale blodåre funnet (som vises mørk på dilatasjon), desinfisere hele halen med alkohol pads, Gjenta 2 x.
- På en passende dose basert på studien design begynne injeksjoner i regionen distale coccygeal ryggrad av halen og flytte mer proksimale Hvis riktig p plassering mislykkes.
- Sett en 25-27 G steril nål, skråkant, i laterale hale venen, med halen i 180° vinkel, sette nålen parallelt løftet halen. Observere blod flashback i kanten av nålen å sikre riktig plassering. Hvis ingen flashback er tydelig, sakte flytte pinne-spissen (uten å fjerne den fra halen) å finne blodåre innsetting. Hvis plassert subcutaneously, oppstår ingen blod flashback.
- Sett inn sprøyten med injiserbare materialer i kanten av nålen. Når riktig plassering er oppnådd, vil injiserbare væsken ikke medføre motstand ved injeksjon. Injeksjon vil avansere glatt og enkelt. Når injiseres, fjerne nålen og sprøyten, presse med sterilt gasbind for minst 1 min å sikre clotting og merke stedet til injeksjon med en penn på halen, sikre den er synlig på det hvite lys bildet.
Merk: Ingen hematom eller lesjon vil være synlig på injeksjonsstedet. - Hvis pinne-spissen flyttes under sprøyte innsetting, fjerne nålen og prøv på nål oppføring prosedyren mer proksimale på ipsilateral halen venen. Du må ikke bruke p. Hvis en annen reentry punkt er forsøkt.
Merk: Alternativt injeksjon kan utføres med en IV kateter med en blodstrøm indikator (se Tabell for materiale). Dette har fordelen med visuell bekreftelse av kateter under venipuncture. Sett inn kateter, skråkant side opp, i vinkel beskrevet tidligere. Observere spør flashback i hele lengden av blodstrøm indikatoren for å sikre riktig plassering. Liten mottrykk kan brukes til å trekke blod i sprøyten å bekrefte riktig plassering i fartøyet før injisere. Igjen, ingen motstand vil bli følt.
4. etter injeksjon bildeopptak
- Utføre kvalitetsvurdering etter halen blodåre injeksjon i en prekliniske NIR fluorescens imager i samme retning som den opprinnelige pre injeksjon. Sikre dyret er fortsatt riktig anesthetized, og vil være så for varigheten av imaging-før plassering i imager.
Merk: En tenkelig system som inneholder en skuff housingwith anestesi tilkoblinger og en maske for dyret bør brukes hvis tilgjengelig. - Plasser dyret på lateralt å avsløre injeksjonsstedet (som merket) på den laterale halen. Kontroller om et NIRF signal finnes bare på injeksjonsstedet. Dette indikerer en vellykket hale blodåre injeksjon (figur 1D).
Merk: Hvis signalet er spredt i hele halen, er det anses subkutan og, derfor mislykket (figur 1F). Figur 2 viser flere eksempler på mislykkede injeksjoner.
5. bilde kvantifisering
Merk: Bildet kvantifisering kan utføres med bildebehandling programvare som følger med NIR imager, hvis denne funksjonen er tilgjengelig. Eventuelt kan andre tilsvarede analyseprogramvare være brukt24.
- Tegne en område-av-begrave rundt området av fluorescens på injeksjon område2,6i bildet, og etter injeksjon.
- Måle område og relativ fluorescens intensitet og posten som området/intensitet. Sammenligne etter injeksjon og planlagte pre injeksjon bilder enten kvalitativt eller quantitively ved hjelp av riktig statistisk analyse (avhengig kollokvier og betingelser).
Merk: Forskeren kan bestemme terskler som diskriminerer bra fra bad injeksjoner eller tilordne en prosent av kvalitet til injeksjon.
Representative Results
Rotter ble injisert med NIRF inneholder nanoemulsion i laterale hale venen, og før og etter injeksjon bilder ble tatt med liten-dyr imager (Tabell for materiale) som beskrevet i protokollen. Etter injeksjon bildene er kvalitativt vurdert for injeksjon kvalitet og plassert i 'god injeksjon' (n = 7) og 'dårlig injeksjon' (n = 4) grupper. Kvalitativ vurdering ble utført ved å observere etter injeksjonsstedet området fluorescens intensiteten. I en optimal injeksjon, er NIRF signalet begrenset til injeksjonsstedet. Ingen signal vises hvis injeksjon er vellykket fordi agent er fullt fortrenges i blodet. En dårlig kvalitet injeksjon viser et NIRF signal som er spredt langs halen.
Bildene ble analysert med tilhørende NIRF imager programvaren. Regioner steder ble trukket på stedet før injeksjon bilder (figur 1C, E) og rundt området av fluorescens etter injeksjon bilder (figur 1D, F). Bilder der fluorescens var synlig hele lengden på halen ble ansett som uakseptabelt og fjernet fra analysis (figur 2). Målinger av området og fluorescens intensiteten ble registrert. Verdier for området/fluorescens intensitet ble beregnet og plottet (figur 1G). En betydelig forskjell (unpaired t-test) i fluorescens intensitet mellom før og etter injeksjon bilder ble observert i gruppen 'dårlig injeksjon' (figur 1G) (p = 0.0024).
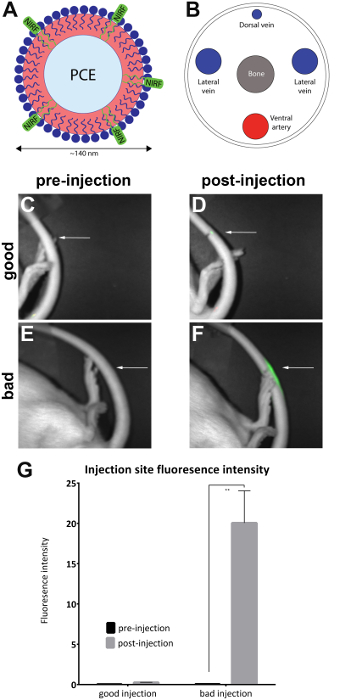
Figur 1 : NIRF basert nanoemulsion og bilder av halen blodåre. (A) A nanoemulsion-baserte biologiske sonde som inneholder NIRF fargestoff ble injisert i (B) sideveis hale venen og avbildet i en NIRF imager. (C og D) pre- og postinjection bilder av en god injeksjon. (E og F) pre- og postinjection bilder av en dårlig injeksjon. Hvite pilene angir poenget med injeksjon. Det er mulig å vurdere kvalitativt suksessen til en god injeksjon sammenlignet med en dårlig injeksjon ved å vurdere omfanget av NIRF signalet på injeksjonsstedet. Uakseptabel injeksjoner Vis fluorescens hele lengden på halen og ble fjernet fra analysis (figur 2). (G) bilder kan også analyseres for å vise et kvantitativt mål med fluorescens intensitet, terskler for injeksjon kvalitet av etterforskeren. Feilfelt i diagrammet gjenspeiler SEM. Den 'god injeksjon' gruppen n = 7. Den 'dårlig injeksjon' gruppen n = 4. Det er en statistisk forskjell fluorescens intensitet i gruppen "dårlig injeksjon" ved sammenligning av pre-og postinjection (unpaired t-test; p = 0.0024). Klikk her for å se en større versjon av dette tallet.

Figur 2 : Eksempler på dårlig injeksjoner. (A) fluorescerende signal sett i del av halen. (B) fluorescerende signal sett over hele lengden av halen. (C) fluorescerende signal spredt tungt i hele halen og caudal området av dyrets kroppen. Klikk her for å se en større versjon av dette tallet.
Discussion
Forskningslaboratorier medførte betydelige kostnader som følge av misadministration testing agenter. Hale blodåre injeksjoner er en vanskelig teknikk å mestre å oppnå konsistent suksessrate, med de mest erfarne av teknologer ofte pådra misadministration feil. Det er ingen pålitelig måte å bekrefte en vellykket injeksjon. Denne protokollen gir en løsning på dette problemet ved å gi forskerne en kvalitativ og kvantitativ metode for å validere suksessen til en murine hale blodåre injeksjon. Her en NIRF-merket nanoemulsion7,8,25 inkorporerer agent av valget (i dette tilfellet et stoff) og er avbildet på injeksjonsstedet i en NIRF liten-dyr imager. Det er også muligheten til å utvikle en ikke-nanoemulsion-baserte agent og bruke samme prinsippet om NIRF bildebehandling ved å innlemme kommersielt tilgjengelige infrarød fargestoffer. I tillegg klar-å-bruke tenkelig agenter med en rekke programmer, for eksempel svulst imaging, metabolske imaging celle menneskehandel, og apoptose er også kommersielt tilgjengelig. Injeksjon utføres enten ved å bruke en steril nål eller alternativt en IV kateter; Dette avhenger av fortrinnsretten forskeren. I tillegg automatisert hale blodåre sprøytebrukere26 har blitt brukt til å bistå i denne prosessen og er kompatible med denne metodikken. Imidlertid blitt denne teknologien ennå ikke kommersielt tilgjengelig.
Det er viktige skritt i halen blodåre injeksjon metoden som sikrer en høyere rate av riktig agent administrasjon. Først burde halen være renset med etanol å fjerne skitt eller rusk, slik at forskere bedre visualisere venen. Utvidelsen fotsporene av submerging halen i varmt vann er også et svært viktig skritt i metoden fordi det gir en større overflate område for injeksjon. Sprøytebruk på et mer distale punkt på halen venen tillater noen feil, at flere forsøk er nødvendig. Injeksjon bør forsøkes på en mer proksimale posisjon i halen som halen venen øker i størrelse da det caudal aspektet av dyrets kroppen er nærmet seg. Kontralateral halen venen kan i tillegg brukes hvis p plassering mislykkes i mer enn tre til fem nettsteder på ipsilateral halen venen.
En vellykket administrasjon av en agent testresultater i liten eller ingen NIRF signal ved injeksjon. Hvis ingen motstand er filt av injeksjon og det er liten eller ingen fluorescens på halen, kan deretter injeksjon registreres så vellykket. Hvis det er en sti av NIRF signalet langs noen lengde på halen, injeksjon registreres som mislykket og trolig delvis subkutan motstand er følte under injeksjon. Fluorescens bilder er tatt før og etter injeksjon, og kvaliteten på injeksjon vurderes ved å observere kvalitativt eller analysere kvantitativt fluorescens signalet på injeksjonsstedet. Programvaren følger NIR fluorescens imager er ofte mulig å utføre denne analysen.
Metoden kan tilpasses på flere måter. Det gjelder hale blodåre injeksjon i både mus og rotter. De fleste liten-dyr NIR fluorescens imagers vil være i stand til accomodating murine gnagere. Nivåer av anestesi må justeres avhengig av vekten av dyret, i samsvar med forskningslaboratoriets IACUC protokollen. En annen mulig endring er utarbeidelsen av en ikke-nanoemulsion-baserte sonde enten ved å innlemme en infrarød fargestoff i forskerens formulert agent eller kjøpe en klar-å-bruke tenkelig agent, skreddersydd for et bestemt biologiske program.
Hvis en rotten er relativt stort, kan det ofte være vanskelig å plassere det i liten-dyr imager. Det anbefales derfor at en testavbildning tas med dyr i skuffen før injisere, og en synsfelt konstatert der halen er synlig. Det er nyttig å tape halen til skuffen til imager, å sikre at det ikke flytte under bildebehandling.
Alternative metoder å vurdere kvaliteten på halen blodåre injeksjoner i små dyr er begrenset til utnyttelsen av merking reagenser som ikke forstyrre samtidige eksperimentelle prosedyrer og krever euthanasia av dyr postinjection 12,13. Noen reagenser kan påvirke studien resultater og terapeutiske vurdering av dyrene involvert, så forsiktighet i eksperimentell design anbefales.
Denne metoden kan i fremtiden, være forbedret med fremskritt i liten-dyr bildeteknologi, samt forbedringer i infrarød fluorescerende sonder. Biologiske sonder med en innarbeidet infrarød fargestoff, designet for en rekke forskjellige programmer, kan brukes på agent administrasjon scenen studie design for å validere kvaliteten på en injeksjon, som beskrevet i denne metoden2,3 ,27,28,29,30,31,32.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
J.A.P. og J.M.J. utviklet i fellesskap den eksperimentelle tilnærmingen for å vurdere Nanoemulsions i kronisk innsnevring skade rotte modell for effekter på nevropatisk smerte. J.M.J. utviklet og designet samlet macrophage målrettede stoffet levering tilnærming med nanoemulsions, nanoemulsion komposisjon, og prosesser for fabrikasjon. J.M.J. produsert av nanoemulsion, som ble ytterligere fabrikkert av ll under veiledning av J.M.J. Stabilitet i nanoemulsion ble vurdert av J.M.J., ll og S.P. dyr omsorg, kirurgi, atferd, hale blodåre injeksjoner og NIRF imaging ble utført i fellesskap av mastergrad og A.M.S under veiledning av J.A.P. Manuskriptet ble skrevet og utarbeidet av M.S., og protokollen ble skrevet av A.M.S.
NIR optisk tenkelig ble utført på små dyr tenkelig systemet på Duquesne University (støttet av Pittsburgh Tissue Engineering initiativ frø tilskuddet). J.M.J. anerkjenner støtte fra DOD prisen nummer FA8650-17-2-6836, NIDA prisen nummer 1R21DA039621-01, NIBIB prisen nummer R21EB023104-02 og AFMSA Award nummer FA8650-17-2-6836. J.A.P. og J.M.J anerkjenner støtte fra Pittsburgh Tissue Engineering initiativ frø stipendet. J.A.P. erkjenner også Hunkele fryktede sykdommen prisen, Samuel og Emma vintre Foundation, Charles Henry Leach II fondet og Commonwealth Universal forskning Enhancement Award. J.A.P. og J.M.J. anerkjenner støtte fra Duquesne University innvielses Provost tverrfaglig forskning konsortier Grant, som støtter kronisk smerte forskning konsortiet.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



