Summary
Aquí presentamos un método para validar las inyecciones de vena de la cola en ratas mediante la utilización de datos de imágenes de colorantes incorporados agentes o sondas biológicas la fluorescencia infrarroja. La cola es fotografiada antes y después de la inyección, se cuantifica la señal fluorescente y se hace una evaluación de la calidad de la inyección.
Abstract
La administración intravenosa (IV) de agentes en la vena de la cola de las ratas puede ser difícil e incoherente. Optimización de las inyecciones de vena de la cola es una parte clave de muchos procedimientos experimentales donde los reactivos necesitan ser introducidos directamente en el torrente sanguíneo. Sin quererlo, la inyección puede ser subcutánea, posiblemente alterando los resultados científicos. Utilizando una sonda biológica basada en la nanoemulsión con un tinte incorporado infrarroja fluorescente (NIRF), este método ofrece la capacidad de la imagen de una cola éxito inyección en la vena en vivo. Con el uso de un toner NIRF, imágenes son tomadas antes y después de la inyección del agente. Una inyección IV aceptable entonces cualitativo o cuantitativo se determina basado en la intensidad de la señal NIRF en el sitio de inyección.
Introduction
La vía de administración de agentes en pequeños animales sirve como un punto crítico de muchos experimentos. Determina que el agente debe ser entregado y, posteriormente, qué pasará con el agente después de eso. Aunque pueden utilizar otras rutas para el agente de administración1, la ruta intravenosa de entrega es una vía preferente de ciertos agentes. Inyección IV permite a los agentes que se inyecta directamente al torrente sanguíneo, evitando efectos de primer paso del tejido y la necesidad de absorption1 de solutos extraños. Esto permite también dirigida a las células en el torrente sanguíneo2,3 y entrega directa a todos los tejidos del sistema circulatorio. En roedores, pueden considerarse varias venas, incluyendo la yugular, la safena y la vena de la cola.
En este método, un NIRF tinte que contiene una sonda biológica — en este caso, una nanoemulsión (figura 1A)3,4,5,6, se inyecta en la vena lateral de la cola de las ratas. Este particular nanoemulsión que contiene NIRF se ha utilizado previamente la imagen y seguir neuroinflamación in vivo y ex vivo7,8 en un modelo de rata9 de dolor neuropático2,3,4, 5,10,11. La proyección de imagen se lleva a cabo antes y después de la inyección con un reproductor de imágenes de fluorescencia NIR preclínica (véase Tabla de materiales). Esto sirve como una herramienta para validar la calidad de la administración del agente. La proyección de imagen antes de la cola vena inyección sirve como base para la obtención de una imagen de línea de base.
Cada vez más en estudios con animales, nanoemulsiones intravenoso administrados se están utilizando como sondas biológicas y dirigida a agentes12,13,14,15. Es un desafío probado para administrar un agente a través de la vena de la cola16,17— ya sea una droga, un vector viral u otra sonda y para asegurar que todo el contenido de la inyección ha entrado con éxito en el torrente sanguíneo y no la de los tejidos circundantes17. Por lo tanto, un método para visualizar y evaluar la calidad de una inyección exitosa es beneficioso.
Normalmente, se utiliza una lámpara de calor o agua caliente para calentar la cola, que causa dilatación de la vena, permitiendo su visualización antes de la inyección. Mientras que esto asegura la fácil entrada en la vena, no es una forma cuantitativa de discernir si el compuesto ha entrado en el torrente sanguíneo en su totalidad18,19,20,21. Esto hace más difícil aún en cepas de animales donde la vena contrasta ligeramente con la piel, como en los ratones negros. Por lo general, el investigador puede medir una inyección experimentando resistencia durante la inyección y, en algunos casos, visualizar una protuberancia en la cola, lo que indica una fuga subcutánea del agente22,23.
En este estudio, proyección de imagen de NIRF de nanoemulsión inyectada en la vena lateral de la cola de ratas vivo se realiza en un NIRF animal pequeño sistema de imagen (véase Tabla de materiales). Las ratas se alimentan un especial purificado (véase Tabla de materiales) de la dieta para reducir la tripa no específico de fluorescencia. Adquisición simultánea de la imagen de luz blanca y 800 nm fluorescencia es capturada usando el toner NIRF y software asociado. Se mide la intensidad de fluorescencia relativa en la cola en los Estados antes de la inyección y después de la inyección. La intensidad de fluorescencia de la región de interés (ROI) en el sitio de inyección se graba y dividida por el área del retorno de la inversión. Evaluaciones cualitativas es posible que las inyecciones son aceptables. Opcionalmente, otros análisis cuantitativo se puede realizar estableciendo umbrales para inyecciones aceptables y asignar mediciones de ROI en grupos, en que punto se puede calcular la significación estadística.
Mediante la utilización de esta estrategia de validación después de inyecciones de vena de la cola, el estándar de un estudio de investigación mejora debido a la mayor consistencia de la administración del agente. Este método de evaluación de la calidad de la inyección en la vena cola puede personalizarse fácilmente para que diferentes agentes inyectables con sondas fluorescentes infrarrojos comercialmente suministradas por varias empresas.
Protocol
Se realizaron todos los protocolos de conformidad con las directrices de la guía para el cuidado y uso de animales de laboratorio de los institutos nacionales de salud institucional Animal atención y Comité uso (IACUC) en la Universidad de Duquesne.
1. preparación y anestesia
Nota: Se utilizan técnicas asépticas para la totalidad del procedimiento. Sólo nuevos materiales estériles y esterilizados instrumentos estériles deben usarse. Equipo de protección personal (guantes estériles, tapa de la pelo, mascarilla quirúrgica, scrubs) debe ser usado para evitar la contaminación.
- Adulto masculino ratas Sprague-Dawley con 250-300 g de peso se utilizaron en el presente Protocolo. Aclimatar las ratas a condiciones estándar, mantenerlos en un ciclo oscuro h 12 h luz/12 y proveer alimento y agua ad libitum. Casa el animal social, mantener el lecho de papel y proporcionan un especial (véase Tabla de materiales) de la dieta para evitar la autofluorescencia durante proyección de imagen.
- Con el uso de una almohadilla de calefacción correctamente colocado, anestesiar al animal bajo un isoflurano inicial del 5% en 20% de oxígeno, seguido por un nivel de mantenimiento de no menos de 1.5% de isoflurano y no más del 3%, a menos que el animal se despierta o conserva la sensación.
- Confirmar la anestesia adecuada a través de una falta de respuesta a la cola pinches. Controlar también el flujo de sangre a través de los signos vitales durante el procedimiento.
2. adquisición de la imagen de la inyección de
- La imagen del animal en un reproductor de imágenes de fluorescencia NIR preclínico colocando el animal lateralmente para exponer el sitio de la inyección en la cola lateral para establecer una línea base de fluorescencia en la cola (figura 1C, E). Realizar una adquisición simultánea de la imagen de una luz blanca (vista del cuerpo) y cerca de canales infrarrojos utilizando el toner NIRF y software asociado, con tablas de búsqueda enlazados (LUT).
- Tras la proyección de imagen, mover el animal de nuevo a la mesa quirúrgica y se coloca bajo anestesia para la inyección de la vena de la cola.
Nota: Continuar la vigilancia de los signos vitales del animal y repita la comprobación adecuada anestesia vía pizca de cola.
3. cola inyección en la vena con el agente que contiene NIRF
-
Con el animal en la posición propensa, Oriente la cola con la cara dorsal hacia arriba. Dilatar la vasculatura de la cola en agua caliente durante un mínimo de 1 minuto Oriente la cola de la vena para que la parte lateral (izquierda o derecha) se gira 30° (hacia la derecha o hacia la izquierda) para exponer la vena de la cola derecha o izquierda (figura 1B).
- Una vez localizada la vena lateral de la cola (que aparece de color oscuro sobre la dilatación), desinfectar la cola entera con almohadillas con alcohol, Repetir x 2.
- En una dosificación apropiada basada en el diseño del estudio, comienzan las inyecciones en la región de las vértebras coccígeas distal de la cola y mueve más proximal si no de la colocación de la aguja adecuada.
- Introduzca una aguja estéril 25 – 27 G, de bisel, en la vena lateral de la cola, con la cola en un ángulo de 180°, inserción de la aguja paralela a la cola levantada. Observar el retroceso de la sangre en el borde de la aguja para asegurar la correcta colocación. Si no hay retroceso es aparente, mueva lentamente la punta de la aguja (sin sacarlo de la cola) para buscar la inserción en la vena. Si se coloca por vía subcutánea, no se producirá ningún retroceso de la sangre.
- Inserte la jeringa con los materiales inyectables en el borde de la aguja. Cuando se logra la colocación correcta, el líquido inyectable no tendrán resistencia a la inyección. La inyección avanzará suavemente y fácilmente. Una vez inyectado, retire la aguja y la jeringa, aplique presión con una gasa estéril durante al menos 1 min para coagulación y marque el lugar de la inyección con un bolígrafo en la cola, asegurando que es visible en la imagen de luz blanca.
Nota: No hematoma o lesión sea visible en el sitio de inyección. - Si la punta de la aguja se mueve durante la inserción de la jeringa, retire la aguja y vuelva a intentar el procedimiento de entrada de la aguja más proximal de la vena de la cola ipsolateral. No reutilizar la misma aguja si se trató de un punto de reentrada diferente.
Nota: Alternativamente, la inyección puede realizarse con un catéter IV con un indicador de flujo de la sangre (véase Tabla de materiales). Esto tiene la ventaja de la confirmación visual del catéter durante la venopunción. Insertar el catéter, bisel lateral, en el ángulo descrito previamente. Observar el rápido retroceso en toda la longitud del indicador de flujo de sangre para garantizar la correcta colocación. Presión leve se puede utilizar para extraer sangre en la jeringa para confirmar la colocación correcta en el recipiente antes de inyectar. Una vez más, no se sentirá ninguna resistencia.
4. adquisición de la imagen después de la inyección
- Realizar evaluación de la calidad después de la inyección de la vena de cola en un sensor de fluorescencia NIR preclínico en la misma orientación que la imagen de la inyección inicial. Asegurar el animal es todavía adecuadamente anestesiado — y lo será para la duración de la proyección de imagen, antes de ser colocado en el reproductor de imágenes.
Nota: Si está disponible, puede usarse un sistema de imagen que contiene a las conexiones de cajón housingwith anestesia y una mascarilla para el animal. - Oriente el animal en su lado lateral para exponer el sitio de la inyección (como marca) en la cola lateral. Verifique si una señal NIRF está presente sólo en el sitio de inyección. Esto indica una inyección en la vena cola exitosa (figura 1D).
Nota: Si la señal está dispersa a lo largo de la cola entera, se considera ser subcutánea y, por lo tanto (figura 1F). La figura 2 muestra ejemplos adicionales de las inyecciones.
5. cuantificación de la imagen
Nota: Cuantificación de la imagen se puede realizar con el software de imágenes que acompaña al sensor NIR, si esta función está disponible. Alternativamente, otros programas de análisis de imagen comercialmente disponible pueden ser usado24.
- En la imagen después de la inyección, dibujar un región de interés alrededor de la zona de fluorescencia en el sitio de inyección2,6.
- Medir el área y la intensidad de fluorescencia relativa y registro como intensidad de zona. Comparar imágenes de la inyección después de la inyección y la línea de fondo ya sea cualitativamente o cuantitativamente mediante el uso de análisis estadístico apropiado (dependiente en grupos de estudio y condiciones).
Nota: El investigador puede decidir sobre los umbrales que diferenciar bien de inyecciones mal o asignan un porcentaje de calidad a la inyección.
Representative Results
Ratas fueron inyectadas con nanoemulsión que contiene NIRF en la vena lateral de la cola, y las imágenes antes y después de la inyección fueron tomadas con el reproductor de imágenes de pequeños animales (Tabla de materiales) como se describe en el protocolo. Imágenes después de la inyección cualitativamente se evaluó la calidad de la inyección y colocados en 'buena inyección' (n = 7) y la 'mala inyección' (n = 4) grupos. Evaluación cualitativa se realizó mediante la observación de la intensidad de fluorescencia de la zona después de la inyección. En una inyección óptima, la señal NIRF se limita al sitio de inyección. No hay señal se verá si la inyección es exitosa porque el agente ha sido totalmente desplazado hacia el torrente sanguíneo. Una inyección de mala calidad muestra una señal NIRF que se dispersa a lo largo de la longitud de la cola.
Imágenes se analizaron con el software que lo acompaña de imager NIRF. Regiones de interés fueron dibujados en el sitio de imágenes de pre-inyección (figura 1C, E) y alrededor de la zona de fluorescencia en imágenes después de la inyección (figura 1D, F). Imágenes donde la fluorescencia fue visible en toda la longitud de la cola se considera inaceptables y de análisis (figura 2). Se registraron las mediciones de la intensidad de la zona y de la fluorescencia. Valores de intensidad de fluorescencia/área se calcularon y grafica (figura 1G). Una diferencia significativa (desapareado t-test) en la fluorescencia intensidad entre las imágenes antes y después de la inyección se observó en el grupo 'mala inyección' (figura 1G) (p = 0.0024).
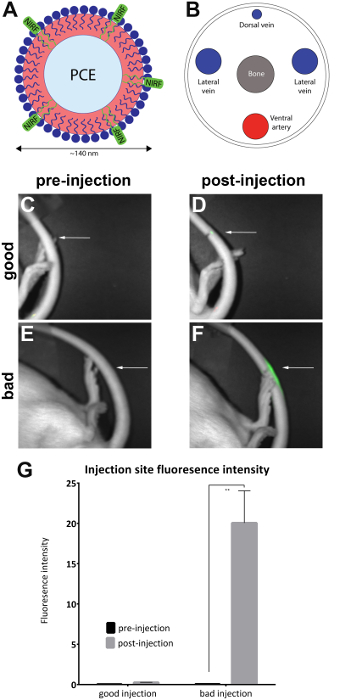
Figura 1 : NIRF basado en imágenes de la vena de la cola y nanoemulsión. (A) A base de nanoemulsión biológica sonda que contiene colorante NIRF fue inyectado en la vena de la cola (B) lateral y reflejada en un toner NIRF. (C y D) imágenes pre y postinjection de una buena inyección. (E y F) imágenes previo y postinjection de una inyección mal. Las flechas blancas indican el punto de inyección. Es posible evaluar cualitativamente el éxito de una buena inyección en comparación con una mala inyección mediante la evaluación de la amplitud de la señal NIRF en el sitio de inyección. Las inyecciones de inaceptables Mostrar fluorescencia a lo largo de la longitud de la cola y se eliminaron del análisis (figura 2). (G) las imágenes también pueden ser analizadas para revelar una medida cuantitativa de la intensidad de fluorescencia, con umbrales de calidad de inyección asignado por el investigador. Las barras de error en el gráfico reflejan el SEM. Para el grupo de 'buena inyección', n = 7. Para el grupo 'mala inyección', n = 4. Hay una diferencia estadística en la intensidad de fluorescencia en el grupo 'mala inyección' cuando se comparan imágenes previas y ClLi (desapareado t-prueba; p = 0.0024). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Ejemplos de inyecciones mal. Señal fluorescente (A) vista en la parte de la cola. (B) señal fluorescente sobre toda la longitud de la cola. (C) señal fluorescente muy dispersos en la cola entera y el área caudal del cuerpo del animal. Haga clic aquí para ver una versión más grande de esta figura.
Discussion
Laboratorios de investigación de incurran en costos significativos como resultado de la administraciones erróneas de los agentes de prueba. Inyecciones de vena de la cola son una técnica difícil de dominar para alcanzar la tasa de éxito constante, con el más experimentado de técnicos a menudo incurrir en errores de administraciones erróneas. No hay ninguna forma fiable de confirmar una inyección exitosa. Este protocolo ofrece una solución a este problema dando a los investigadores un método cualitativo y cuantitativo para validar el éxito de una inyección en la vena cola murino. Aquí, una nanoemulsión etiquetados NIRF7,8,25 incorpora el agente de elección (en este caso, un medicamento) y es reflejada en el sitio de la inyección en un sensor de pequeño animal NIRF. También existe la opción de desarrollar a un agente no basado en la nanoemulsión y utilizar el mismo principio de la proyección de imagen NIRF incorporando tintes de infrarrojos disponibles en el mercado. Además, agentes imagen Listo para su uso con una variedad de aplicaciones, como imágenes tumorales, metabólicos imaging, celulares tráfico, y apoptosis también están disponibles en el mercado. La inyección se realiza ya sea mediante el uso de una aguja estéril o, alternativamente, un catéter IV; Esto depende de la preferencia del investigador. Además, automatizado cola vena inyectores26 se han utilizado para ayudar en este proceso y son compatibles con esta metodología. Sin embargo, esta tecnología aún no es disponible en el mercado.
Hay pasos importantes en el método de inyección de la vena de la cola que garantizan una tasa de administración correcta del agente. En primer lugar, la cola se debe limpiar con etanol para eliminar cualquier suciedad o residuos, permitiendo a los investigadores visualizar mejor la vena. Dilatación de la vena sumergiendo la cola en agua caliente también es un paso muy importante en el método, ya que permite una mayor superficie para la inyección. Inyección en un punto más distal de la vena de la cola permite algún error, en caso de que se requieren múltiples intentos. La inyección debe realizarse en una posición más proximal de la cola como la vena de la cola aumenta de tamaño como se aborda el aspecto caudal del cuerpo del animal. Además, puede utilizarse la vena contralateral cola si no colocación de la aguja en más de tres a cinco sitios en la vena de la cola ipsolateral.
Una exitosa administración de un agente de prueba produce poca o ninguna señal NIRF en el punto de inyección. Si no hay resistencia se siente durante la administración de la inyección y hay poco a ninguna fluorescencia en la cola, entonces la inyección puede grabarse como exitosa. Si se siente resistencia durante la inyección y hay una señal de sendero de NIRF a lo largo de la longitud de la cola, entonces la inyección se registra como fracasada y es probable que en parte subcutánea. Imágenes de fluorescencia son tomadas antes y después de la inyección, y la calidad de la inyección se valora observando cualitativamente o cuantitativamente analizar la señal de fluorescencia en el sitio de inyección. El software que acompaña a las imágenes de fluorescencia de NIR es a menudo capaz de realizar este análisis.
El método se puede adaptar de diversas maneras. Es aplicable a la cola de la inyección en la vena en ratones y ratas. Más toner de fluorescencia de NIR pequeño animal será capaces de albergar roedores murinos. Niveles de anestesia deben ajustarse según el peso del animal, conforme al protocolo IACUC del laboratorio de investigación. Otra modificación posible es la preparación de una sonda no basado en la nanoemulsión mediante la incorporación de un colorante infrarrojo en agente formulado del investigador o por la compra de un agente de imagen Listo para su uso, a la medida de una aplicación biológica específica.
Si una rata es relativamente grande, a menudo puede ser difícil colocarlo en el reproductor de imágenes de pequeños animales. Por lo tanto se recomienda que una prueba de imagen se toma con el animal en el cajón antes de inyectar, y un campo de vista determinar donde es visible la cola. Es útil la cola al cajón del toner, para asegurarse de que no se mueve durante la proyección de imagen de la cinta.
Métodos alternativos que buscan evaluar la calidad de la vena de la cola las inyecciones en animales pequeños se limitan a la utilización de las etiquetas de los reactivos que no interfieren con los procedimientos experimentales concurrentes y requieren la eutanasia de la postinjection de animales 12,13. Algunos reactivos pueden afectar los resultados del estudio y la evaluación terapéutica de los animales implicados, por lo que se recomienda cuidado en el diseño experimental.
Este método en el futuro, puede, ser refinado con avances en tecnología de imágenes de pequeños animales, así como mejoras en sondas fluorescentes infrarrojos. Las sondas biológicas con un colorante infrarrojo incorporado, diseñado para una variedad de diferentes aplicaciones, pueden utilizarse en la fase de administración del agente de un diseño de estudio para validar la calidad de una inyección, como se describe en este método2,3 ,27,28,29,30,31,32.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
J.A.P. y J.M.J. diseñan conjuntamente el enfoque experimental para la evaluación de nanoemulsiones en el modelo de rata de lesión crónica de constricción para efectos en el dolor neuropático. J.M.J. había concebido y diseñado el enfoque de entrega de drogas general orientada a macrófagos nanoemulsiones la nanoemulsión composición y procesos de fabricación. J.M.J. produjo la nanoemulsión, que además fue fabricada por L.L. bajo la dirección de la J.M.J. La estabilidad de la nanoemulsión evaluaron la atención J.M.J., L.L. y S.P. animales, cirugía, comportamiento, inyecciones de vena de la cola, y la proyección de imagen NIRF se llevaron a cabo conjuntamente por M.S. y a.m.s. bajo dirección de J.A.P. El manuscrito fue escrito y preparado por M.S., y el protocolo fue escrito por A.M.S..
La proyección de imagen óptica NIR fue realizada en el pequeño sistema de proyección de imagen de Animal en la Universidad de Duquesne (apoyado por el Pittsburgh tejido ingeniería iniciativa semilla). J.M.J. reconoce apoyo del número de concesión de DOD FA8650-17-2-6836, NIDA Premio número 1R21DA039621-01, número del Premio NIBIB R21EB023104-02 y AFMSA Premio número FA8650-17-2-6836. J.A.P. y J.M.J reconocen apoyo de Pittsburgh tejido ingeniería iniciativa Seed Grant. J.A.P. reconoce también el Premio de la enfermedad temida Hunkele, el Samuel y Emma inviernos Fundación, el fondo Charles Henry Leach II y el Premio de mejora de investigación Universal Commonwealth. J.A.P. y J.M.J. reconocen apoyo de Duquesne University Inaugural Provost interdisciplinario consorcios beca de investigación, que soporta el consorcio de investigación de dolor crónico.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



